超高效液相色谱-串联质谱法检测鸡血浆中头孢噻肟及其主要代谢物
2017-11-13杨小体汤晓艳张小庆沈习习
杨小体,汤晓艳,*,张小庆,沈习习
(1.南京农业大学食品科技学院,肉品加工与质量控制教育部重点实验室,江苏 南京 210095;2.中国农业科学院农业质量标准与检测技术研究所,农业部农产品质量安全重点实验室,北京 100081)
超高效液相色谱-串联质谱法检测鸡血浆中头孢噻肟及其主要代谢物
杨小体1,2,汤晓艳1,2,*,张小庆2,沈习习1,2
(1.南京农业大学食品科技学院,肉品加工与质量控制教育部重点实验室,江苏 南京 210095;2.中国农业科学院农业质量标准与检测技术研究所,农业部农产品质量安全重点实验室,北京 100081)
研究头孢噻肟(cefotaxime,CTX)在鸡血浆中代谢规律,建立同时检测血浆中CTX及其主要代谢物去乙酰头孢噻肟(desacetylcefotaxime,DCTX)的超高效液相色谱-串联质谱方法,以10 mg/kg的体质量剂量给药实验蛋鸡,并对给药后不同时间点采集的血液样品,进行CTX及其主要代谢物DCTX含量的检测。结果表明,所建方法中CTX和DCTX的检出限分别为0.07、0.14 μg/L;定量限分别为0.23、0.99 μg/L。回收率分别为86.7%~95.2%、89.5%~112%,相对标准偏差不大于7.7%,满足残留分析方法的要求;CTX在蛋鸡体内分布迅速,给药后即刻达到峰值(56.34 mg/L),且代谢较快,给药24 h后检测值低于3.0 μg/L,而主要代谢物DCTX在给药45 m in后达到峰值(10.22 mg/L),消除相对缓慢,给药24 h时检测值仍可达到54.0 μg/L。
头孢噻肟(CTX);去乙酰头孢噻肟(DCTX);超高效液相色谱-串联质谱法(UPLC-MS/MS);血浆
头孢噻肟(cefotaxime,CTX)属于人用β-内酰胺类抗生素,具有广谱、高效、耐酶等特点。我国农业部第560号公告明确禁止该药用于畜禽养殖中[1],但由于其对流感杆菌、大肠杆菌、肺炎杆菌、淋球菌等[2-4]疗效显著,近年来发现CTX原药或其生产下脚料被违规用于家禽养殖中的现象非常严重。抗生素的违规违禁使用不仅会造成畜禽组织及其制品中的药物残留问题,威胁食品安全,而且会破坏生态环境平衡,促进细菌产生耐药性,影响人类疾病的预防与治疗[5]。
CTX在人体内药物代谢研究比较深入[6-7],在犬、鼠、羊、兔等动物体内也有相关研究[8-12],但是,目前鲜见该药在家禽体内的相关研究报道。CTX在机体内易代谢转化,主要活性代谢物为去乙酰头孢噻肟(desacetylcefotaxime,DCTX)。CTX及DCTX分子结构式如图1所示。目前CTX的残留检测方法基本只针对其原药,关于其代谢物的检测,仅有针对人、鼠血浆及脑脊液建立的高效液相色谱法报道[7,13-15],且方法灵敏度较低,检出限远不能满足生物样本微量残留检测的需要。因此,本实验建立超高效液相色谱-串联质谱(ultra performance liquid chromatography-tandem mass spectrometriy,UPLC-MS/MS)同时检测CTX及其主要代谢物的高灵敏度方法,并利用该方法对CTX在蛋鸡血浆中的代谢残留规律进行初步研究,为CTX在蛋鸡组织中的残留监控提供技术支撑和理论参考。
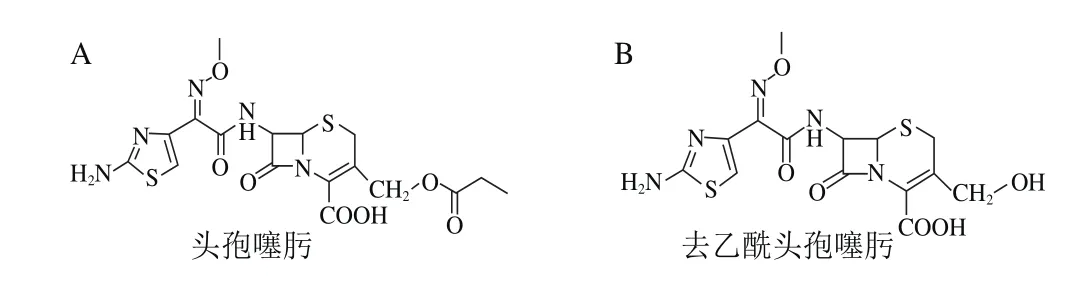
图1 CTX(A)和DCTX(B)分子结构式Fig. 1 M olecular structures of cefotaxime and desacetylcefotaxime
1 材料与方法
1.1 材料与试剂
健康海兰褐蛋鸡6 只,210 日龄,体质量1.5~2 kg,购自河北燕郊某养殖场。
CTX钠标准品(纯度≥98%;CAS:66485-93-4)上海源叶生物科技有限公司;DCTX标准品(纯度≥98%;CAS:66340-28-1) 加拿大TRC公司;乙腈(HPLC级) 美国J.T.Baker公司;甲醇(HPLC级) 德国Merck公司;甲酸(HPLC级) 美国M reda Tecnology公司;实验用水为M illi-Q超纯水。
1.2 仪器与设备
ACQUITY UPLC仪 美国Waters公司;TRIPLE QUADTM3500液相色谱-三重四极杆质谱联用仪 美国AB SCIEX质谱系统公司;XS105十万分之一分析天平瑞士Mettler Toledo公司;D2012 plus台式高速小型微量离心机 美国Scilogex公司;VORTEX-5涡旋振荡器海门市其林贝尔有限公司;超声波清洗机 宁波新艺超声设备有限公司;M illi-Q超纯水器 美国M illipore公司。
1.3 方法
1.3.1 标准溶液的配制
分别准确称取CTX钠和DCTX标准品,以甲醇-水(1∶1,V/V)为溶剂配制质量浓度为100 mg/L的标准储备液,于棕色容量瓶中低温避光保存(5 d以内),测定当天以甲醇-水梯度稀释,配成一系列的标准溶液,现配现用。
1.3.2 液相色谱-质谱条件
色谱柱:A g ilen t E c lip se P lu s C18色谱柱(2.1 mm×100 mm,3.5 μm);流动相:A相为0.2%甲酸溶液,B相为乙腈;柱平衡时间1 m in;梯度洗脱程序:0~1.0 m in,95% A;1.0~3.0 m in,95%~60% A;3.0~5.0 m in,60% A;5.0~7.0 m in,95% A;流速0.3 m L/m in;进样体积5 μL;外标法定量。
电喷雾离子源(electrospray ionization,ESI),正离子扫描,多重反应监测(multiple reaction monitoring,MRM),气帘气压力35 MPa;雾化气压力55 MPa;干燥气压力55 MPa;撞气压力8 MPa;离子源电压5 500 V;离子化温度550 ℃;MRM定量离子对、去簇电压及碰撞电压见表1。
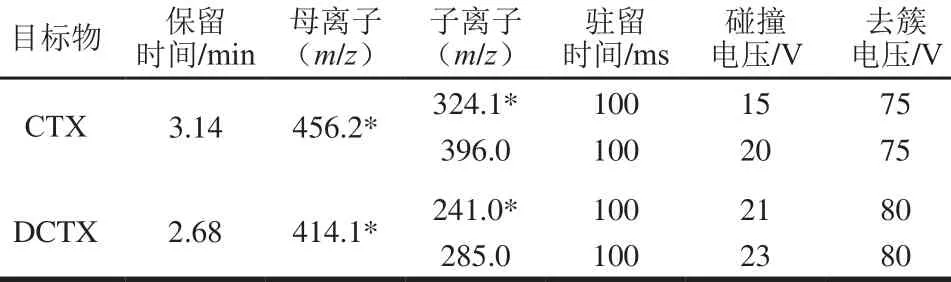
表1 CTX及DCTX质谱参数Table 1 Optimum parameters and selected fragment ions for cefotaxime and deacetylcefotaxime
1.3.3 蛋鸡给药与血液样品采样
健康海兰褐蛋鸡6 只,以全价饲料适应性饲养2 周,称质量后编号。给药前禁食12 h,自由饮水,以10 m g/kg的体质量剂量由一侧翼下静脉给药,准确记录给药时间。实验蛋鸡分别于给药后5、10、15、30、45 m in,1、1.5、2、4、6、8、10、12、24 h等时间点由另一侧翼下静脉采血0.6~0.8 m L,血样取出后立即移入含肝素钠的离心管,3 500 r/m in离心6 m in,分离血浆,-20 ℃保存备用。
1.3.4 血浆样品前处理
取血浆样品100 μL,加入400 μL甲醇沉淀蛋白,涡旋30 s,超声10 m in提取,12 000 r/m in离心5 m in,取上清液过0.22 μm滤膜,UPLC-MS/MS方法检测。
2 结果与分析
2.1 血浆样品前处理条件优化
本实验采用固相萃取法和有机溶剂沉淀法对前处理进行优化,实验发现用Oasis HLB等小柱净化后的CTX回收率仅有30%~40%,原因可能是CTX极性较大,在固相萃取小柱上保留性差所致[16]。有研究表明,4 倍体积的甲醇或3 倍体积的乙腈可完全沉淀生物样品中的蛋白质[17]。本实验比较了甲醇和乙腈沉淀蛋白的效果,发现用甲醇沉淀的血浆蛋白更易离心分离,且不会吸附目标物,目标物回收率大于75%。实验同时考察了血浆和甲醇不同比例(2∶5、1∶4、1∶5)时的沉淀效果,结果表明4 倍体积的甲醇可完全沉淀血浆蛋白,通过进一步优化实验条件,CTX和DCTX回收率均大于86.7%。目前,关于血浆前处理的研究中也多采用此方法[18-19]。此外,由于CTX在蛋鸡体内吸收迅速,血浆中药物质量浓度一般较高,不需氮吹浓缩的步骤,样品前处理简单快速、回收率高。
2.2 色谱-质谱条件的选择与优化
2.2.1 色谱条件选择与优化
由于头孢类抗生素在结构上都含有羧酸基团,故早期采用离子交换色谱(一般选用阴离子交换柱)来测定这类药物,但因所用的pH值往往低于其稳定的最佳pH值而不甚理想。近年来大都改用反向色谱法,最常用的分析柱填料为ODS C18,但对于CTX这种强极性的β-内酰胺类分离效果不好。因此实验选用Agilent ZORBAX SB-Aq(3.0 mm×100 mm,1.8 μm)色谱柱,ZorbaxXDB-C18(2.1 mm×150 mm,3 μm)色谱柱,Agilent Eclipse Plus C18(2.1 mm×100 mm,3.5 μm)色谱柱3 种对强极性化合物保留效果较好的色谱柱对分离效果进行了对比,结果表明Agilent Eclipse Plus C18色谱柱(2.1 mm×100 mm,3.5 μm)可将CTX和DCTX较好地分离,二者出峰时间分别为3.14 m in和2.68 m in,且峰形好、响应值高、重复性好。
头孢类抗生素常用的流动相为水、甲酸溶液、乙酸铵溶液与乙腈、甲醇[20-22]。本实验对流动相进行了考察,水相分别以纯水、甲酸溶液、乙酸铵溶液,有机相分别以乙腈、甲酸-乙腈、甲醇作为流动相在同一色谱条件下对目标物进行梯度洗脱分离。结果发现以甲酸溶液为流动相时,DCTX峰面积的响应值比纯水或乙酸铵溶液作为流动相时高10%左右,实验通过对甲酸溶液进一步优化,发现以0.2%甲酸溶液和乙腈作流动相时,CTX及DCTX的响应值和峰形均优于上述其他流动相,色谱图如图2所示。因此,选用0.2%甲酸溶液和乙腈作为本方法的流动相。
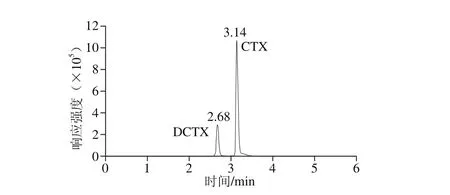
图2 CTX和DCTX标准溶液典型色谱图Fig. 2 Typical chromatograms of cefotaxime and desacetylcefotaxime in standard solution
2.2.2 质谱条件选择与优化
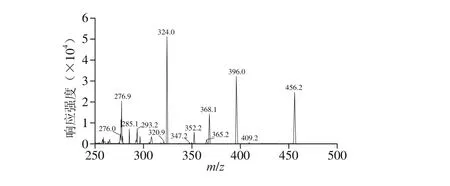
图3 CTX标准溶液在正离子模式下的二级质谱图Fig. 3 MS2 spectrum of cefotaxime standard solution under positive ion mode

图4 DCTX标准溶液在正离子模式下的二级质谱图Fig. 4 MS2 spectrum of desacetylcefotaximestandard solution under positive ion mode
在正负离子模式下,分别进行全扫描以选择适当的电离方式和母离子。结果表明,CTX和DCTX均在离子源ESI+电离方式下获得较高丰度的准分子离子峰[M+H]+,分别为m/z 456.1和m/z 414.1,再对分子离子采用子离子扫描方式进行二级质谱分析,并对子离子进行优化选择,确定定量离子和辅助定性离子。得到CTX的特征离子峰为m/z 396.1、m/z 324.1,即[M+H-CH3COOH]+和[M+H-CH3COOH-CO-CO2]+[23],与文献报道一致[24-26],DCTX的特征离子峰为m/z 241和m/z 285;其中m/z 241为β-内酰胺环主要裂解碎片,且丰度最高;m/z 285为β-内酰胺环较为特殊的开环方式[27]。CTX和DCTX的二级质谱图分别如图3和图4所示。
2.3 方法的线性范围、检出限和定量限
为了消除基质效应对测定结果的影响,本方法采用基质标准曲线对血浆中CTX及其主要代谢物进行分析。准确将一定量的CTX钠和DCTX混合标准溶液,分别加入按1.2.4节方法前处理过的空白血浆中,使二者最终上机质量浓度范围为2~1 000 µg/L。以化合物定量离子对的峰面积为纵坐标(Y),以基质标准液质量浓度为横坐标(X)进行线性回归计算。在优化实验条件下,分别以信噪比不小于3及10确定方法的检出限和定量限。结果如表2所示。CTX和DCTX在2~1 000 µg/L质量浓度范围内线性关系良好;检出限和定量限均满足残留分析要求。

表2 方法线性范围、检出限及定量限Table 2 Linear ranges, lim its of detection and lim its of quantification for cefotaxime and desacetylcefotaxime
2.4 加标回收率与相对标准偏差
在空白血浆中分别添加低、中、高3 个水平的CTX钠和DCTX混合标准溶液,每添加实验设6 个平行,按1.2.4节进行处理,以标准曲线定量,48 h内进样2 次,计算其回收率及批内、批间的相对标准偏差。如表3所示,CTX和DCTX的加标回收率分别为86.7%~95.2%、89.5%~112%;相对标准偏差均不大于7.7%,满足生物样品定量分析要求。
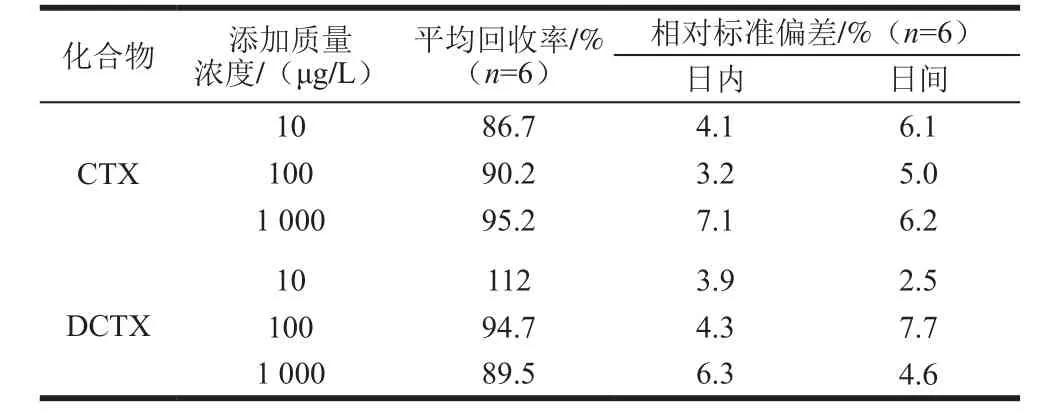
表3 鸡血浆中CTX和DCTX的回收率和相对标准偏差(n= 6)Table 3 Recoveries and relative standard deviations (RSD) of cefotaxime sodium and desacetylcefotaxime from spiked chicken p lasma sam p les (n= 6)
2.5 CTX和DCTX在血浆中的残留消除规律
用上述方法对血浆样品进行前处理并上机检测,外标法定量。如图5和图6所示,所有样品均检测到CTX和DCTX,质量浓度范围为3~56 342 μg/L,随着停药时间的延长,两者残留量都有明显下降趋势。
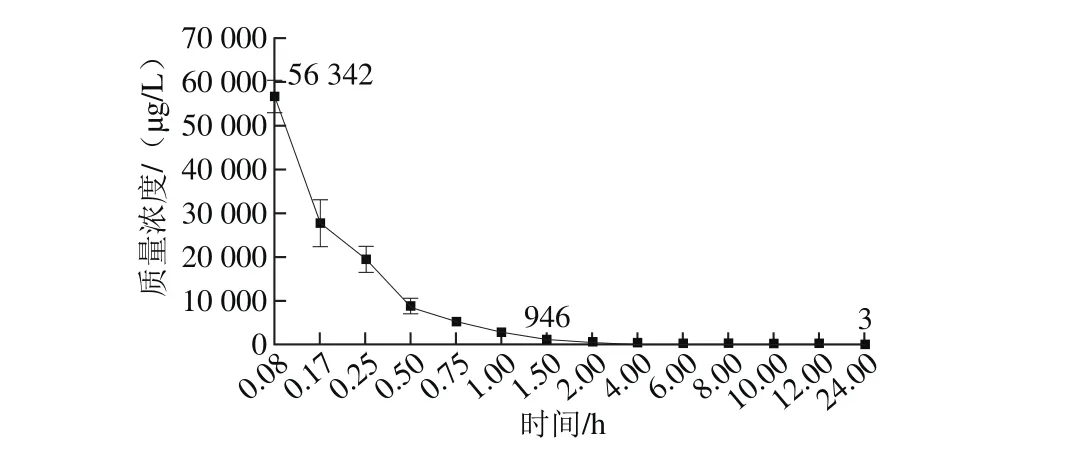
图5 鸡血浆中头孢噻肟残留质量浓度-时间曲线(n=6)Fig. 5 Concentration-time curve for cefotaxime in chicken plasma (n = 6)
由图5可以看出,CTX在给药后即刻达到峰值56 342 μg/L,随后呈明显下降趋势,1.5 h后质量浓度下降至946 μg/L,此后下降趋势平缓,24 h时已降至3.0 μg/L,说明CTX在鸡血浆中代谢消除迅速,与该药在其他动物体内研究结果一致[28-29]。

图6 血浆中DCTX残留质量浓度-时间曲线(n=6)Fig. 6 Concentration-time curve for desacetylcefotaxime in chicken p lasma (n = 6)
由图6可知,代谢物DCTX生成迅速,给药5 m in后质量浓度即可达到4 887 μg/L,由于CTX的代谢转化,质量浓度不断升高,并于给药45 m in后达到最高值10 215 μg/L,此后下降迅速。DCTX质量浓度于给药45 m in超过CTX,给药24 h后DCTX质量浓度仍为54.0 μg/L,说明DCTX消除相对缓慢,可延长CTX有效抗菌作用时间,这与文献报道一致[15,30]。据报道,CTX对鸡巴氏杆菌,鸡白痢沙门氏菌和鸡大肠杆菌等有较强的抗菌活性,最低抑菌质量浓度为0.012 5~0.1 μg/L[14]。本研究发现CTX在给药24 h后检测质量浓度为3.0 μg/L,仍可达到有效抑菌质量浓度。
3 结 论
本研究建立了超高效液相色谱串联质谱同时检测CTX及其主要代谢物DCTX的方法,该方法样品前处理简便快速,回收率高,定量限及精密度均能满足分析要求。应用本方法对CTX及其主要代谢物在蛋鸡血液中的残
留消除规律进行初步探究,结果表明CTX在蛋鸡体内代谢消除较快,而其代谢物DCTX消除相对缓慢,且残留量高,可作为残留监测的靶标物,本研究解决了该药在动物体内由于代谢转化而难于监测的问题,为CTX在畜禽养殖中违禁使用的监管监测提供理论依据和技术支撑。
[1] 农业部禁止在饲料和动物饮用水中使用的药物品种目录: 农业部公告第560号[S]. 2015.
[2] HERING J, FRÖMKE C, VON M C, et al. Cefotaxime-resistant Escherichia co li in broiler farms-a cross-sectional investigation in Germany[J]. Preventive Veterinary Medicine, 2016, 125: 154-157.DOI:10.1016/j.prevetmed.2016.01.003.
[3] BAI L, LAN R T, ZHANG X L, et al. Prevalence of Salmonella iso lates from chicken and pig slaughterhouses and emergence of ciprofloxacin and cefotaxime co-resistant S. enterica Serovar Indiana in Henan, China[J]. PLoS ONE, 2015, 10(12): e0144532.DOI:10.1371/journal.pone.0144532.
[4] MUHTADI F J, HASSAN M M A. Cefotaxime[J]. Analytical Profi les of Drug Substances, 1982, 11: 139-168. DOI:10.1016/S0099-5428(08)60262-2.
[5] 白莉, 张秀丽, 甘辛, 等. 肉鸡养殖场中环丙沙星和头孢噻肟双重耐药沙门菌耐药机制的研究[J]. 中国食品卫生杂志, 2015, 27(5):487-494. DOI:10.13590/j.cjfh.2015.05.001.
[6] KEARNS G L, YOUNG R A. Pharmacokinetics of cefotaxime and desacetylcefotaxime in the young[J]. Diagnostic M icrobiology &Infectious Disease, 1995, 22(1/2): 97-104. DOI:10.1016/0732-8893(95)00052-C.
[7] ROSSEEL M T, VANDEWOUDE K H. Liquid chromatographic determ ination o f the p lasma concentrations of cefotaxime and desacetylcefotaxime in plasma of critically ill patients[J]. Journal of Chromatography B Analytical Technologies in the Biomedical & Life Sciences, 2004, 811(2): 159-163. DOI:10.1016/j.jchromb.2004.08.040.[8] CHAMBERLAIN J, COOMBES J D, DELL D, et al. Metabolism o f cefotaxime in animals and man[J]. Journal of Antim icrobial Chemotherapy, 1980, 6(Suppl A): 69-78. DOI:10.1093/jac/6.suppl_A.69.
[9] GUERRIN I V H, ENGLISH P B, FIL IPPICH L J, et a l.Pharmacokinetics of cefotaxime in the dog[J]. Veterinary Record,1986, 119(4): 81-83. DOI:10.1136/vr.119.4.81.
[10] TSAI T H, CHEN Y F, CHEN K C, et al. Concurrent quantifi cation and pharmacokinetic analysis of cefotaxime in rat blood and brain by m icrodialysis and m icrobore liquid chromatography[J]. Journal of Chromatography B Biomedical Sciences & Applications, 2000,738(1): 75-81. DOI:10.1016/S0378-4347(99)00492-2.
[11] HAKIM L, BOURNE D W, TRIGGS E J. Disposition of cefotaxime and its metabolite, desacetylcefotaxime, in rat: application of a pharmacokinetic-protein binding model[J]. Xenobiotica, 1989, 19(7):743-754. DOI:10.3109/00498258909042312.
[12] 唐达. 注射用头孢噻肟钠丙磺舒钠在家兔体内的药代动力学研究[D].重庆: 西南大学, 2014.
[13] LING S S, YUEN K H, BARKER S A. Simple liquid chromatographic method for the determ ination of cefotaxime in human and rat p lasma[J]. Journal of Chromatography B, 2003, 783(1): 297-301.DOI:10.1016/S1570-0232(02)00657-8.
[14] HAKIM L, BOURNE D W, TRIGGS E J. High-performance liquid chromatographic assay of cefotaxime, desacetylcefotaxime and ceftriaxone in rat plasma[J]. Journal of chromatography, 1988, 424(1):111. DOI:10.1016/S0378-4347(00)81081-6.
[15] BAFELTOW SKA J J, BUSZM AN E, M ANDAT K, et a l.Determ ination of cefotaxime and desacetylcefotaxime in cerebrospinal fluid by so lid-phase extraction and high-performance liquid chromatography[J]. Journal of Chromatography A, 2002, 976(1/2):249-254. DOI:10.1016/S0021-9673(02)01234-7.
[16] 徐婧, 田亚平, 陈艳华, 等. 代谢组学血浆样品前处理及其快速高分辨液相色谱-质谱分析方法研究[J]. 分析化学, 2011, 39(12): 1793-1797. DOI:10.3724/SP.J.1096.2011.01793.
[17] 郑锌, 汤晓艳, 周剑, 等. 超高效液相色谱-串联质谱法测定鸡血浆中利巴韦林及其主要代谢物[J]. 分析测试学报, 2015, 34(7): 819-823.DOI:10.3969/j.issn.1004-4957.2015.07.011.
[18] 孙兆姝, 张卉卉, 包永睿, 等. 基于大鼠血浆中盐酸小檗碱药代动力学前处理方法研究[J]. 辽宁中医药大学学报, 2014(7): 5-7.DOI:10.13194/j.issn.1673-842x.2014.07.001
[19] M ICHOPOULOS F, LAI L, GIKA H, et al. UPLC-MS-based analysis of human plasma for metabonom ics using solvent precipitation or solid phase extraction[J]. Journal of Proteome Research, 2009, 8(4): 2114-2121. DOI:10.1021/pr801045q.
[20] CHEN D M, YU J, TAO Y F, et al. Qualitative screening of veterinary anti-m icrobial agents in tissues, m ilk, and eggs of foodproducing animals using liquid chromatography coupled w ith tandem mass spectrometry[J]. Journal of Chromatography B Analytical Technologies in the Biomedical & Life Sciences, 2016, 82:1017-1018. DOI:10.1016/j.jchromb.2016.02.037.
[21] 张秀尧, 蔡欣欣. 超高效液相色谱-三重四极杆质谱法快速同时测定牛奶中53 种β-内酰胺类抗生素及其代谢产物的残留[J]. 色谱,2014(7): 693-701. DOI:10.3724/SP.J.1123.2014.03019.
[22] 李欣南, 韩镌竹, 苏崴艺. 超高效液相色谱-串联质谱法同时测定生鲜乳中7 种β-内酰胺类抗生素残留[J]. 现代畜牧兽医, 2013(11): 40-46. DOI:10.3969/j.issn.1672-9692.2013.11.009.
[23] 李惠琳, 邢俊鹏, 刘志强, 等. 头孢菌素类抗生素的电喷雾多级串联质谱分析[J]. 质谱学报, 2005, 26(4): 198-202. DOI:10.3969/j.issn.1004-2997.2005.04.002.
[24] 汤薪瑶, 左剑恶, 余忻, 等. 制药废水中头孢类抗生素残留检测方法及环境风险评估[J]. 中国环境科学, 2014, 34(9): 2273-2278.
[25] 李晓晶, 于鸿, 甘平胜, 等. 土壤中β-内酰胺类抗生素的全自动固相萃取-超高效液相色谱-串联质谱测定法[J]. 环境与健康杂志,2016(5): 456-458. DOI:10.16437/j.cnki.1007-5038.2015.06.017.
[26] 张崇威, 班付国, 宋志超, 等. 超高效液相色谱-串联质谱法测定动物源食品中7 种药物残留[J]. 中国兽药杂志, 2014, 48(8): 51-54.
[27] 王威, 张宏森, 郭世恩. 去乙酰基头孢噻肟质谱裂解方式和化学稳定性[J]. 黑龙江大工程学报, 2012(4): 33-37. DOI:10.13524/j.2095-008x.2012.04.008.
[28] 徐俊, 曹芳元, 徐敏, 等. 头孢噻呋钠在成年麻鸭体内的药代动力学研究[J]. 中国兽药杂志, 2012, 46(9): 18-21.
[29] 赵曦, 张丹, 陈红. 注射用头孢噻肟钠/舒巴坦钠在犬体内的药物动力学研究[J]. 中国抗生素杂志, 2004, 29(10): 614-616.DOI:10.13461/j.cnki.cja.003598.
[30] ALEKSIĆ M M , KAPETANOV IĆ V, ATANACKOVIĆ J, et al.Simultaneous determ ination of cefotaxime and desacetylcefotaxime in real urine sample using voltammetric and high-performance liquid chromatographic methods[J]. Talanta, 2008, 77(1): 131-137.DOI:10.1016/j.talanta.2008.05.047.
Simultaneous Determ ination of Cefotaxime and Its Main Metabolite in Chicken Plasma by Ultra Performance Liquid Chromatography-Tandem Mass Spectrometry
YANG Xiaoti1,2, TANG Xiaoyan1,2,*, ZHANG Xiaoqing2, SHEN Xixi1,2
(1. Key Laboratory of Meat Processing and Quality Control, M inistry of Education, College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China; 2. Key Laboratory of Agri-Food Safety and Quality, M inistry of Agriculture,Institute of Quality Standards and Testing Technology for Agro-Products, Chinese Academy of Agricultural Sciences, Beijing 100081, China)
In order to study the pattern of cefotaxime metabolism in chicken plasma, an ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS) method was successfully developed for the simultaneous determ ination of cefotaxime and its metabolite desacetylcefotaxime. Cefotaxime at a dose of 10 mg/kg was adm inistered to laying hen, and chicken plasma was collected at diff erent time points to quantitate cefotaxime and desacetylcefotaxime by UPLC-MS/MS. The results showed that the lim its of detection (LOD) for cefotaxime and desacetylcefotaxime were 0.07 and 0.14 μg/L, respectively; the lim its of quantification (LOQ) were 0.23 and 0.99 μg/L, respectively. The recoveries of cefotaxime and desacetylcefotaxime ranged from 86.7%–95.2% and 89.5%–112%, respectively, w ith relative standard deviation (RSD) less than 7.7%, which met the requirements for quantitative analysis. Cefotaxime was rapidly distributed in laying hens and reached the peak (56.34 mg/L) immediately after adm inistration, and the rate of cefotaxime metabolism was fast, which was detected at a level lower than 3.0 μg/L after 24 hours. The main metabolite deacetylcefetaxime reached its peak (10.22 mg/L) after 45 m in, and it was elim inated at a relatively slow rate was and was still as high as 54.0 μg/L at 24 h after adm inistration.
cefotaxime (CTX); desacetylcefotaxime (DCTX); ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS); plasmaYANG Xiaoti, TANG Xiaoyan, ZHANG Xiaoqing, et al. Simultaneous determination of cefotaxime and its main metabolite in chicken plasma by ultra performance liquid chromatography-tandem mass spectrometry[J]. Food Science, 2017, 38(22):317-321. (in Chinese w ith English abstract)
10.7506/spkx1002-6630-201722047. http://www.spkx.net.cn
10.7506/spkx1002-6630-201722047
TS201.6
A
1002-6630(2017)22-0317-05
杨小体, 汤晓艳, 张小庆, 等. 超高效液相色谱-串联质谱法检测鸡血浆中头孢噻肟及其主要代谢物[J]. 食品科学, 2017,38(22): 317-321. DOI:10.7506/spkx1002-6630-201722047. http://www.spkx.net.cn
2017-04-08
中国农业科学院科技创新工程项目
杨小体(1989—),女,硕士研究生,研究方向为畜产品质量安全。E-mail:780525783@qq.com*通信作者:汤晓艳(1976—),女,研究员,博士,研究方向为畜产品质量安全。E-mail:txycaas@126.com
