8例输入性卵形疟不同亚型的鉴定
2017-11-13黄敏君李晶晶郑晓燕李小丽
王 磊,黄敏君,李晶晶,王 非,郑晓燕,李小丽,邹 洋
8例输入性卵形疟不同亚型的鉴定
王 磊,黄敏君,李晶晶,王 非,郑晓燕,李小丽,邹 洋
目的鉴定并分析境外输入性卵形疟的2种亚型及其感染的临床特点。方法 对在北京友谊医院2015年1月—2017年3月确诊的8例输入性卵形疟患者进行虫种亚型的鉴定,并分析比较不同亚型感染引起的实验室指标的差异。结果通过对8例患者进行巢氏PCR鉴定及序列分析,结果显示卵形疟curtisi及卵形疟wallikeri亚型各4例;与curtisi亚型感染相比,wallikeri亚型感染后引起血小板下降程度更低,乳酸脱氢酶及TBIL的上升程度更高。结论 输入性卵形疟的亚型鉴定须通过巢氏PCR鉴定完成,wallikeri亚型感染导致的器官损害更为严重。
输入性疟疾;卵形疟curtisi亚型;卵形疟wallikeri亚型;巢氏PCR;器官损害
疟疾是全球范围内最为严重的感染性疾病之一,截至2015年,全球仍有约43万人因感染疟疾而死亡[1]。卵形疟原虫是5种主要感染人体疟原虫中较为少见的疟原虫种[2]。其主要分布在非洲西部、东南亚和南亚等国家的热带地区,因其发病率低、临床症状较轻等特点一直未引起足够的重视[3]。
卵形疟原虫在形态学上和间日疟原虫相似,因而使用形态学方法较难鉴别,误诊率较高。目前专门针对卵形疟原虫的快速检测试剂还未上市,使用卵形疟抗原或其抗体制作的快速检测产品敏感性较低或检测效果极不稳定,因此目前众多实验室均使用PCR方法对卵形疟进行鉴定[3]。近期研究发现,卵形疟存在2个亚型,即卵形疟curtisi和卵形疟wallikeri[5]。此后又有研究表明不同卵形疟亚型感染后临床表现及实验室检查指标均存在明显差异[6]。因此,本研究对我院收治的8例输入性卵形疟患者的资料进行系统分析并进行巢氏PCR鉴定,明确不同卵形疟的感染亚型,总结不同卵形疟亚型感染的临床特点,为临床医师提供诊治思路,提高针对卵形疟感染的认知水平。
1 对象和方法
1.1 对象 研究对象为首都医科大学附属北京友谊医院 2015年1月—2017年3月收治的使用巢氏PCR确诊的8例输入性卵形疟感染患者。收集患者的性别、年龄、流行病学史(疫源地、发病至确诊时间),入院期间血常规、肝脏酶学功能等实验室资料。
1.2 仪器及试剂 Giemsa染液、BinaxNOW疟原虫乳酸脱氢酶检测试剂盒、全血DNA 提取试剂盒(QIAamp DNA Mini Kit),TaKaRa Ex Taq酶(DRR006A),5×Loading Buffer(GENEray,GR0205);蔡司Axio Scope A1显微镜及 PCR 仪(型号 PTC-200,Bio-Rad,美国)。
1.3 检测方法
1.3.1 Giemsa染色镜检 采集患者EDTA-Na2抗凝全血制作标准血涂片,将其干燥、固定后使用Giemsa染色,再用蔡司Axio Scope A1显微镜镜检疟原虫(放大倍数×1000)。
1.3.2 免疫学检测 使用疟原虫乳酸脱氢酶检测试剂盒对8例患者血样进行检测。取5 μl全血,垂直加入检测卡上加样孔A内,然后在样品孔B上垂直滴加4滴裂解液,15 min内判读结果。
1.3.3 巢氏PCR检测 按文献报道方法合成引物并进行扩增[7-8]。提取患者抗凝血DNA,针对疟原虫18S rRNA进行巢氏扩增,首轮扩增采用疟原虫属特异性引物(rPLU1/rPLU5),2轮扩增采用卵形疟引物(rOVA1WC/ rOVA2WC)、curtisi亚型引物(rOVA1/ rOVA2)及wallikeri 亚型引物(rOVA1v/ rOVA2v)(见表1)。扩增条件:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,共扩增35个循环;72 ℃延伸5 min。将阳性产物测序后再与GenBank中的相关序列进行BLAST比对和同源性分析。

表1 巢式PCR检测疟原虫种类的引物Table 1 Primers of nest PCR for Plasmodium spp.
1.4 统计学处理 患者临床症状、治疗和转归等数据和资料,用 Excel 2010 建立数据库,应用SPSS 19.0软件进行描述性分析。
2 结 果
2.1 一般资料 确诊为卵形疟的病例为8例,均为男性,年龄25~44岁,平均(32.9±7.4)岁。患者均有国外旅居史及蚊虫叮咬史。其中包括赤道几内亚5例,尼日利亚1例,科特迪瓦1例,乌干达1例。从发病到确诊疟疾的时间为7~210 d,平均为(85±84)d。在其他医院就诊时诊断肺部感染4例,恶性疟2例,间日疟2例。
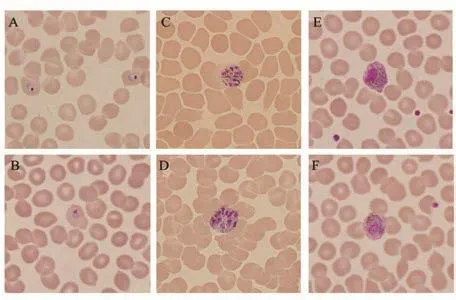
图1 8例卵形疟患者血涂片镜检结果(Giemsa染色,×1000倍)A~B. 滋养体;C. 未成熟裂殖体;D. 成熟裂殖体;E~F.配子体Figure 1 Morphology of Plasmodium ovale in blood smears from 8 malaria cases (Giemsa staining, ×1000)
2.2 镜检法及免疫学检测 8例患者外周血涂片在显微镜下检查疟原虫如图1所示,受感染的红细胞呈卵圆形,正常大小或稍胀大,均可见薛氏点;滋养体胞浆粗厚,胞浆坚实;裂殖子呈现玫瑰花样;配子体核居一侧,小配子体核较松散,大配子体核较致密。使用疟原虫乳酸脱氢酶检测试剂盒对8份标本进行检测,结果均为阴性,提示非恶性疟或间日疟感染。
2.3 巢氏PCR鉴定结果及测序分析 使用巢氏PCR检测结果显示,首轮扩增后以卵形疟引物rOVA1WC及rOVA2WC进行PCR扩增后发现8例患者均可见660 bp条带,提示所有患者均为卵形疟感染。然后分别以curtisi 和 wallikeri亚型引物rOVA1、rOVA2及rOVA1v、rOVA2v进行PCR扩增,curtisi亚型感染患者扩增片段长度为800 bp,如图2所示。wallikeri亚型感染患者扩增片段长度为780 bp,提示2种亚型感染患者各有4例,如图3所示。将上述患者2轮扩增的产物全部进行测序分析,并在NCBI数据库进行比对发现,curtisi亚型感染患者片段与数据库中卵形疟curtisi克隆DC-7的18S rRNA基因部分序列(GenBank编号为KF696375.1)的一致性为100%。wallikeri亚型感染患者片段与数据库中卵形疟wallikeri克隆RSH10的18S rRNA基因部分序列(GenBank 编号为KF219561.1)的一致性为100%。

图2 8例卵形疟患者全血DNA巢氏PCR扩增结果M. DNA标志物;N. 阴性对照;1~8. 病例1~8血样;pv. 间日疟原虫;pm. 三日疟原虫;pf . 恶性疟原虫Figure 2 Nest PCR amplification products of P. ovale DNA from 8 malaria cases
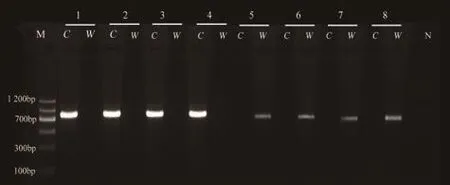
图3 8例卵形疟患者全血DNA不同亚型巢氏PCR扩增结果M. DNA标志物;N. 阴性对照; C. curtisi 亚型引物扩增;W. wallikeri亚型引物扩增;1~8. 病例1~8的血样Figure 3 Nest PCR amplification products of different subtypes of P. ovale DNA from 8 malaria cases
2.4 不同亚型感染与血小板、乳酸脱氢酶及TBIL之间的关系 卵形疟感染后均会引起不同程度血小板的下降,乳酸脱氢酶及TBIL的升高。与curtisi亚型感染相比,wallikeri亚型感染后引起血小板下降程度更低,乳酸脱氢酶及TBIL的上升程度更高。见表2。
2.5 治疗方法和预后 所有患者均采用蒿甲醚(昆明制药集团股份有限公司 H10900012 规格80 mg/支)80 mg/次,1次/12 h,首次加倍,深部肌肉注射进行抗疟治疗。此后分别口服双氢青蒿素哌喹片巩固及磷酸伯氨喹啉片治疗1个疗程,上述卵形疟患者均治愈,未见复发。
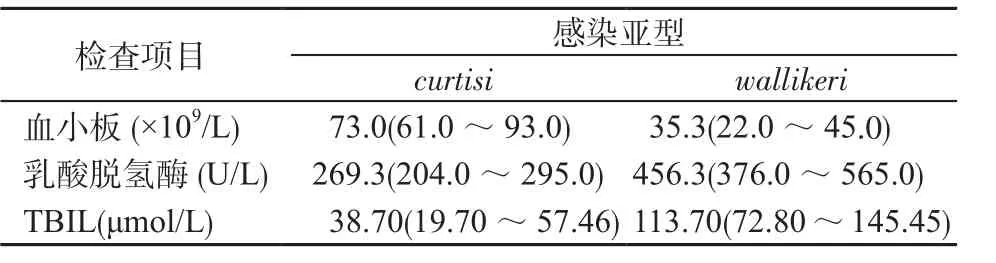
表2 不同卵形疟亚型感染与实验室指标之间的关系Table 2 Correlation of laboratory examination indexes and different subtypes of P. ovale infection
3 讨 论
Stephens[9]在1922年对感染患者红细胞中卵形疟原虫的形态学特点做了首次描述,但此后针对卵形疟的研究远远少于恶性疟及间日疟等,传统意义上认为,卵形疟发病率较低,传播较为局限,而且卵形疟的临床表现较轻,所以未引起重视。实际上由于卵形疟显微镜下形态与间日疟相似,以及其典型的疟疾隔日发作特点,常被误诊为间日疟或三日疟,从而导致其感染率被低估。直到2010年Sutherland[10]才发现卵形疟存在2个亚型,即经典型的卵形疟 curtisi 和变异型的卵形疟wallikeri。随着国内外交流的日益频繁,目前国内已有输入性卵形疟变异型(卵形疟wallikeri)感染的相关报道[8],但目前中国人感染这2种亚型的临床特点尚未见研究。
在疟疾诊断方法中,血涂片镜检作为病原学方法仍然被WHO认定为“金标准”。但卵形疟在形态上与间日疟仅有细微差别,极易出现漏诊或难以鉴别虫种。本组病例光镜下形态见红细胞呈卵圆形,环状体胞浆粗厚,且可见明显薛氏点,但也有些患者的血涂片并未见典型卵形疟的形态学特征。有文献显示,与卵形疟curtisi的形态相比,卵形疟wallikeri在感染红细胞表面出现薛氏点的可能性较小[11]。但在本组病例中2种卵形疟亚型均可见明显薛氏点,这可能与病例数较少相关。其次,商品化的免疫学检测试剂的靶标多针对于恶性疟原虫或泛疟原虫,尚无专门针对卵形疟原虫的快速检测试剂,检测敏感性也多表现为对恶性疟原虫敏感性高,而对非恶性疟原虫检测敏感性低,尤其对卵形疟原虫易出现假阴性或检测结果不稳定的情况。本组病例中使用疟原虫乳酸脱氢酶抗原检测结果均为阴性,提示在疟疾特别是卵形疟诊断过程中须要综合诊断。
目前的研究表明,卵形疟2种亚型从形态学上难以区分,因此分子生物学方法成为区分2种亚型的重要方法[4]。由于卵形疟2种亚型间多个基因存在多态性,先前对卵形疟原虫的多个基因诸如细胞色素b、 细胞色素c氧化酶、 乳酸脱氢酶及核糖体小亚基核糖核酸(SSU rRNA)等基因进行针对性设计以区分2种亚型,实验结果发现选择SSU rRNA基因较为可靠[12]。本组病例在疟原虫种属引物扩增后使用卵形疟通用引物(rOVA1WC/rOVA2WC)进行2轮扩增,结果均为阳性,提示8例患者均为卵形疟感染。此后分别使用卵形疟curtisi及wallikeri亚型引物扩增发现,各亚型均有4例患者,序列比对与NCBI数据库中2种亚型序列完全吻合,提示上述PCR的实验体系稳定准确,可以用于卵形疟与其他类型疟原虫的鉴别,以及卵形疟2种感染亚型间的区分,弥补了疟原虫血涂片镜检和抗原检测造成的误诊和漏诊,可以为临床提供更为精准的诊断信息。
新近研究发现,2种亚型卵形疟感染患者的实验室检查结果均有所不同。Rojo-Marcos等[13]分别对21例curtisi及14例wallikeri亚型感染者的实验室指标研究发现,血小板的下降程度在wallikeri亚型感染者中更为明显,2组患者比较差异具有统计学意义。在本组病例中,卵形疟感染均能引起血小板的下降,且与curtisi亚型感染相比,wallikeri亚型感染导致血小板下降更为明显,与上述文献报道相一致。此外本组病例中wallikeri亚型感染后导致乳酸脱氢酶及TBIL明显升高,提示wallikeri亚型感染造成更为严重的机体器官功能损伤,这可能与这一亚型的毒力、传播效率及患者易感性有关。但值得注意的是,由于本组病例数较少,2种亚型感染患者的临床指标进行统计学分析可能会产生偏倚,因此须要收集更多患者信息进行进一步评估。
综上所述,综合采用病原学、免疫学和分子生物学方法可以明确输入性卵形疟的诊断和分型,了解不同亚型间可能存在的差异及与实验室数据的不同特点的相关性;注重分型鉴定和实验室指标的综合分析,可进一步提高临床医师对不同疟原虫及其亚型感染的临床诊断并指导规范治疗。
[1]李硕,张云辉,王永怡,等. 2016年全球传染病热点回顾[J].传染病信息,2017,30(1):1-7.
[2]王磊,王非,齐志群,等. 62例输入性疟疾病原学特点分析[J].传染病信息,2016,29(3):170-172.
[3]Groger M, Fischer HS, Veletzky L, et al. A systematic review of the clinical presentation, treatment and relapse characteristics of human Plasmodium ovale malaria[J]. Malar J, 2017, 16:112.
[4]李美,夏志贵,汤林华. 卵形疟原虫wallikeri亚种及其基因检测体系的研究进展[J]. 中国寄生虫学与寄生虫病杂志,2014,32(1):64-67.
[5]Fuehrer HP, Noedl H. Recent advances in detection of Plasmodium ovale: implications of separation into the two species Plasmodium ovale wallikeri and Plasmodium ovale curtisi[J]. J Clin Microbiol, 2014, 52(2):387-391.
[6]Nolder D, Oguike MC, Maxwell-Scott H, et al. An observational study of malaria in British travellers: Plasmodium ovale wallikeri and Plasmodium ovale curtisi differ significantly in the duration of latency[J]. BMJ Open, 2013, 3(5):e2711.
[7]林耀莹,张山鹰,谢汉国,等. 罕见输入性卵形疟原虫wallikeri亚种的PCR鉴定和测序分析[J]. 中国病原生物学杂志,2014,(10):905-907.
[8]张玲玲,阮卫,陈华良,等. 浙江省5例输入性卵形疟原虫wallikeri亚种感染病例的鉴定[J]. 中国寄生虫学与寄生虫病杂志,2014,32(5):361-365.
[9]Stephens JWW. A new malaria parasite of man[J]. Ann Trop Med Parasitol, 2016, 87(4):375-377.
[10]Sutherland CJ,Tanomsing N,Nolder D,et al. Two nonrecombining sympatric forms of the human malaria parasite Plasmodium ovale occur globally[J]. J Infect Dis, 2010, 201(10):1544-1550.
[11]Phuong MS, Lau R, Ralevski F, et al. Parasitological correlates of Plasmodium ovale curtisi and Plasmodium ovale wallikeri infection[J]. Malar J, 2016, 15:550.
[12]Bauffe F, Desplans J, Fraisier C, et al. Real-time PCR assay for discrimination of Plasmodium ovale curtisi and Plasmodium ovale wallikeri in the Ivory Coast and in the Comoros Islands[J]. Malar J,2012, 11:307.
[13]Rojo-Marcos G, Rubio-Muñoz JM, Ramírez-Olivencia G, et al.Comparison of imported Plasmodium ovale curtisi and P. ovale wallikeri infections among patients in Spain, 2005-2011[J].Emerging Infectious Diseases, 2014, 20(3):409-416.
Identification of 8 imported malaria cases with different subtypes of Plasmodium ovale infection
WANG Lei, HUANG Min-jun, LI Jing-jing, WANG Fei, ZHENG Xiao-yan, LI Xiao-li, ZOU Yang*
Beijing Tropical Medicine Research Institute, Beijing Friendship Hospital, Capital Medical University,Beijing Key Laboratory for Research on Prevention and Treatment of Tropical Diseases, 100050, China WANG Lei and HUANG Min-jun are the first authors who contributed equally to the article
ObjectiveTo identify and analyze clinical features of 8 imported malaria cases with 2 subtypes of Plasmodium ovale(P. ovale) infection.MethodsThe subtype identification of 8 imported malaria patients from January 2015 to March 2017 in Capital Medical University was conducted. Laboratory examination indexes were compared and analyzed in different P. ovale subtype infection.ResultsNest PCR identification and sequence alignment results showed that 8 patients determined as P. ovale infection.Four cases were identified as P. ovale curtisi and 4 cases were P. ovale wallikeri infection, respectively. Furthermore, compared to the P.ovale curtisi infection, there were significant levels of laboratory examination indexes, including lower thrombocytopenia, higher lactic dehydrogenase and increased total bilirubin with P. ovale wallikeri infection.ConclusionsThe nest PCR amplification is necessary for identification of P. ovale subtype infection. Severe organ damages are observed with P. ovale wallikeri infection.
imported malaria; P. ovale curtisi; P. ovale wallikeri; nest PCR; organ dysfunction
R531.3
A
1007-8134(2017)05-0290-04
10.3969/j.issn.1007-8134.2017.05.011
国家自然科学基金项目(81702018);北京市卫生系统高层次卫生技术人才培养计划(2015-3-010);北京市医院管理局临床技术创新项目(XMLX201502);北京市重点实验室开放课题项目(2017-3-3)
100050,首都医科大学附属北京友谊医院北京热带医学研究所热带病防治研究北京市重点实验室(王磊、黄敏君、李晶晶、王非、郑晓燕、李小丽、邹洋)
前两位作者对本文有同等贡献,均为第一作者
邹洋,E-mail: zouyang1027@163.com
*Corresponding author, E-mail: zouyang1027@163.com
(2017-07-20收稿 2017-09-15修回)
(本文编辑 胡 玫)
