蒸三七皂苷类活性组分在大鼠体内代谢产物鉴定的研究
2017-11-11申文雯张银仇守蓓朱粉霞贾晓斌汤道权陈斌
申文雯 张银 仇守蓓 朱粉霞 贾晓斌 汤道权 陈斌


[摘要]采用超高效液相色谱与串联四极杆飞行时间质谱仪联用技术(UPLCQTOFMS/MS)分析大鼠灌胃蒸三七正丁醇部位后所得血液、尿液和粪便样品,获取正负离子模式下样品中化学成分的分析数据。样品数据经PeakView软件处理后,根据原型化合物的结构特征以及体内常见代谢方式的准确质量数变化,对代谢产物进行解析。最终利用代谢物的MS/MS信息鉴定了蒸三七正丁醇部位中的4个皂苷代谢原型,即人参皂苷Rh4,Rk3,Rk1,Rg5及其15个代谢产物。蒸三七正丁醇部位中4个人参皂苷的代谢途径包括葡萄糖醛酸化、脱糖、硫酸化、脱羟甲基化、支链丢失等。该文从定性角度对蒸三七主要活性皂苷类组分在体内的代谢开展了研究,进一步阐明蒸三七在体内发挥药效的物质基础。
[关键词]蒸三七正丁醇部位; 代谢产物鉴定; UPLCQTOFMS/MS; 人参皂苷Rh4,Rk3,Rk1,Rg5; 转化方式
[Abstract]UPLCQTOFMS/MS was used to identify metabolites in rat blood, urine and feces after the administration of nbutanol extract derived from steamed notoginseng The metabolic process of saponins came from steamed notoginseng was analyzed The metabolites were processed by PeakView software, and identified according to the structural characteristics of prototype compounds and the accurate qualitative and quantitative changes of common metabolic pathways Four saponins metabolites were identified based on MS/MS information of metabolites, namely ginsenoside Rh4, Rk3, Rk1, Rg5,and their 15 metabolites were verified The metabolic pathways of the four ginsenosides in nbutanol extract included glucuronidation, desugar, sulfation, dehydromethylation, and branch loss The metabolites of main active saponin components derived from steamed Panax notoginseng were analyzed from the perspective of qualitative analysis And the material basis for the efficacy of steamed notoginseng was further clarified.
[Key words]nbutanol extract derived from Panax notoginseng; identification of metabolites; UPLCQTOFMS/MS; ginsenoside Rh4, Rk3, Rk1, Rg5; transformation mode
三七為五加科植物三七Panax notoginseng (Burk.)F.H.Chen的干燥根。蒸三七作为三七中的一种炮制品,应用广泛,具有滋养血液、增强免疫功能、抑制肿瘤、增强健壮性、促进组织再生等功效,古人朴素认识为“熟补”。现代研究表明,三七炮制前后成分变化差异较大[1]。课题组前期研究发现,蒸三七中含有大量的不同于生三七的皂苷类化合物,各皂苷成分是其发挥补血功效的真正物质基础[2],药理试验表明以人参皂苷Rg3,Rg6,F4,Rh4,Rk3,Rk1,Rg5等为代表的皂苷类化合物具有增强免疫功能、抑制肿瘤等多种生物活性[37]。对蒸三七主要活性皂苷组分在体内过程的定性研究,有利于揭示蒸三七主要活性部位在体内发挥药效的物质基础及作用机制。蒸三七主要皂苷部位的提取,采用经典皂苷提取方法,醇提后经正丁醇萃取。经文献查阅,有关生三七的总人参皂苷及各主要人参皂苷单体如人参皂苷Rg1,Rb1等的体内代谢产物鉴定研究较多,而有关于蒸三七的相关内容尚未报道。
本研究通过收集灌胃给予蒸三七正丁醇部位后的大鼠血浆样品、尿液和粪便样品,利用UPLCQTOFMS/MS联用技术,将QTOFMS/MS测定的准确质量用于鉴定蒸三七正丁醇部位在大鼠体内的代谢物,根据质谱裂解规律,推测代谢物的化学结构,总结代谢途径,为探讨蒸三七的体内过程提供依据。
1材料
11仪器与试剂1260高效液相色谱仪(配有色谱泵,二级管阵列检测器,美国Agilent公司);Waters AcquityTM UHPLC超高效液相色谱质谱联用仪(美国Waters公司);MilliQ水纯化系统(美国Millipore公司);Mettler Toledo分析天平(瑞士Mettler Toledo分析仪器有限公司);AnkeTGL16G离心机(上海安亭科学仪器厂)。蒸三七正丁醇萃取部位(实验室自制);人参皂苷Rk1对照品(成都曼斯特生物科技有限公司中国科学院成都生物研究所,纯度>9504%);人参皂苷Rk3,Rh4,Rg5对照品(上海永恒生物科技有限公司,纯度>98%);甲醇、乙腈(色谱级,德国Merck公司);水为超纯水,其他试剂均为分析纯。endprint
12动物SD大鼠,雌雄各半,体质量(250±20) g,由江苏省中医药研究院动物中心提供,实验动物使用许可证号SYXK(苏)20162017。
2方法
21药材及样品的制备三七为五加科植物三七的干燥根,来源于安徽亳州中药饮片厂,并经南京中医药大学黄一平研究员鉴定。蒸三七的正丁醇部位的制备:取适量的蒸三七粉末,加入10倍量的70%乙醇,搅拌均匀,于75 ℃水浴加热回流提取3次,再抽滤,合并滤液,得粗提液,取所得粗提液,控温50 ℃于旋转蒸发仪浓缩至浸膏状,再加少量水减压浓缩至原体积的1/5。提取液回收乙醇后,用适量水混悬,正丁醇萃取3次,合并萃取液,挥去正丁醇,干燥备用。
22动物分组及给药健康SD大鼠12只,按体质量随机分成2组,雌雄各半。试验开始前各组动物自由饲养1周,然后置代谢笼中自由饲养适应3 d。试验采用单次灌胃给药方式,给药组大鼠按6 g·kg-1的剂量(相当于成人高剂量的40倍)给予配制好的蒸三七正丁醇部位1% CMCNa溶液;空白组给予等体积1% CMCNa灌胃。
23样品采集与处理血浆样品:于给药前和给药后05,1,2,4,6,8,12,24,36,48 h,由大鼠眼眶取血于预先涂有1%肝素钠生理盐水的EP管中,3 000 r·min-1离心10 min,取上清液,得到血浆样品。于-80 ℃条件下保存备用。分析前将血浆样品于37 ℃解冻,解冻后精密吸取血浆200 μL,加入3倍量的甲醇600 μL,涡旋1 min,13 000 r·min-1离心5 min,取600 μL上清液于EP管中,4 ℃条件下氮气吹干,最后以甲醇150 μL复溶,涡旋30 s,13 000 r·min-1离心10 min,取上清液进样检测。
分别采集给药前-12~0 h及给药后0~12,12~24 h的尿液和粪便样品,13 000 r·min-1离心10 min后,-80 ℃冷冻保存至上机检测。分析前将尿液样品于37 ℃解冻,解冻后分别取大鼠各时间段尿液2 mL,加3倍量甲醇,涡旋混匀3 min。13 000 r·min-1离心5 min后取上清液,氮气吹干,残渣加1 mL甲醇溶解,13 000 r·min-1离心10 min后取上清液,进样分析。
将各时间段大鼠粪便混合,烘箱50 ℃烘干备用。分析前将粪便样品用研钵研碎,称取2 g,加10倍量甲醇浸泡并超声30 min,13 000 r·min-1离心10 min后取上清液,氮气吹干,残渣加2 mL甲醇溶解,13 000 r·min-1离心15 min后取上清液,进样分析。
24色谱条件流动相A为01%甲酸水,B为乙腈溶液。样品的洗脱条件:0~25 min,20%~28% B;25~3 min,28%~36% B;3~55 min,36%~43% B;55~95 min,43%~50% B;95~10 min,50%~64% B;10~135 min,64%~100% B;135~145 min,100%~20% B。柱温40 ℃,流速04 mL·min-1,进样量2 μL。
25质谱条件采用TOF MSIDAMS/MS 模式,电喷雾离子源(ESI),采用正负离子模式扫描,掃描范围m/z 50~1 500。正负离子检测方式:气帘气(CUR)40 psi(1 psi=6895 kpa),雾化气(GS1)55 psi,辅助气(GS2)55 psi,电喷雾电压(ISVF)4 500 eV,离子源温度(TEM)550 ℃,去簇电压(DP)±100 eV;TOF MS 模式下设置碰撞电压±10 eV,IDAMS/MS条件下设置碰撞电压±40 eV,碰撞电压差20 eV。
3结果
31人参皂苷原型成分的结构鉴定前期研究已明确蒸三七正丁醇部位中的主要成分为皂苷,因此本试验将蒸三七中各人参皂苷作为提取对象进行分析。母体化合物及其代谢物在负模式下表现为其准分子离子[M-H]-或[M+HCOO]-,并通过MS和MS/MS碎裂行为和保留时间来研究确定其结构。根据可能的代谢途径及代谢产物的总结分析,推断出多数相关代谢物的结构。通过网络数据库或文献检索,如PubMed,SciFinder,CNKI等,利用Analyst TF 16软件的PeakView和Formulafinder等数据处理功能,经过峰提取和解析,并与对照品进行比对,在大鼠血浆、尿液及粪便中有4种个人参皂苷被初步鉴定出来,分别是人参皂苷Rk3,Rh4,Rk1,Rg5,其化学结构见图1。
人参皂苷Rk1 R1=glc(21)glc人参皂苷Rg5 R1=glc(21)glc
R2=HR2=H
人参皂苷Rk3 R1=H人参皂苷Rh4R1=H
R2=OglcR2=Oglc
3,Rh4,Rk1,Rg5
蒸三七中的主要有效成分各人参皂苷具有相同母核,即达玛烷型三萜,因此它们质谱信息很相似,在相同质谱条件下存在类似裂解规律,可能出现相似的碎片离子。如m/z 504这个碎片离子均出现在4种人参皂苷的主要碎片离子中,因各皂苷成分均脱去1分子葡萄糖所致。以人参皂苷Rg5的鉴定为例,其提取相对分子质量为766488 5,二级质谱提供的主要碎片离子m/z 613332 9,589333 8,571288 6,161049 6根据人参皂苷元素组成、相关裂解规律[910]和数据库在线比对,推测其分子式为C42H70O12,从而进一步推断该成分为人参皂苷Rk1或Rg5。采用上述相同方法一一解析鉴定并与对照品进行比对,最终确定4种人参皂苷,分别为人参皂苷Rk3,Rh4 ,Rk1,Rg5,见表1。
32 代谢产物的解析代谢物和母体药物一般都有类似的核心结构,根据核心结构的性质和一般代谢物的生物转化方法,预先收集整理了各人参皂苷可能代谢物的相关信息。各人参皂苷在体内主要发生的代谢转化有:葡萄糖醛酸化,脱糖,硫酸化,脱羟甲基化,支链丢失等。通过MarkerView软件,经过峰提取及相关处理后,使用PeakView中提取离子流色谱 (extract ion chromatogram,XIC)等功能,筛选精确的分子质量和碎片离子质量可较为容易地预测代谢产物的元素组成。最后,在准确相对分子质量、相关的药物的生物转化知识以及母体药物的碎片裂解模式的基础上,鉴定代谢物结构。endprint
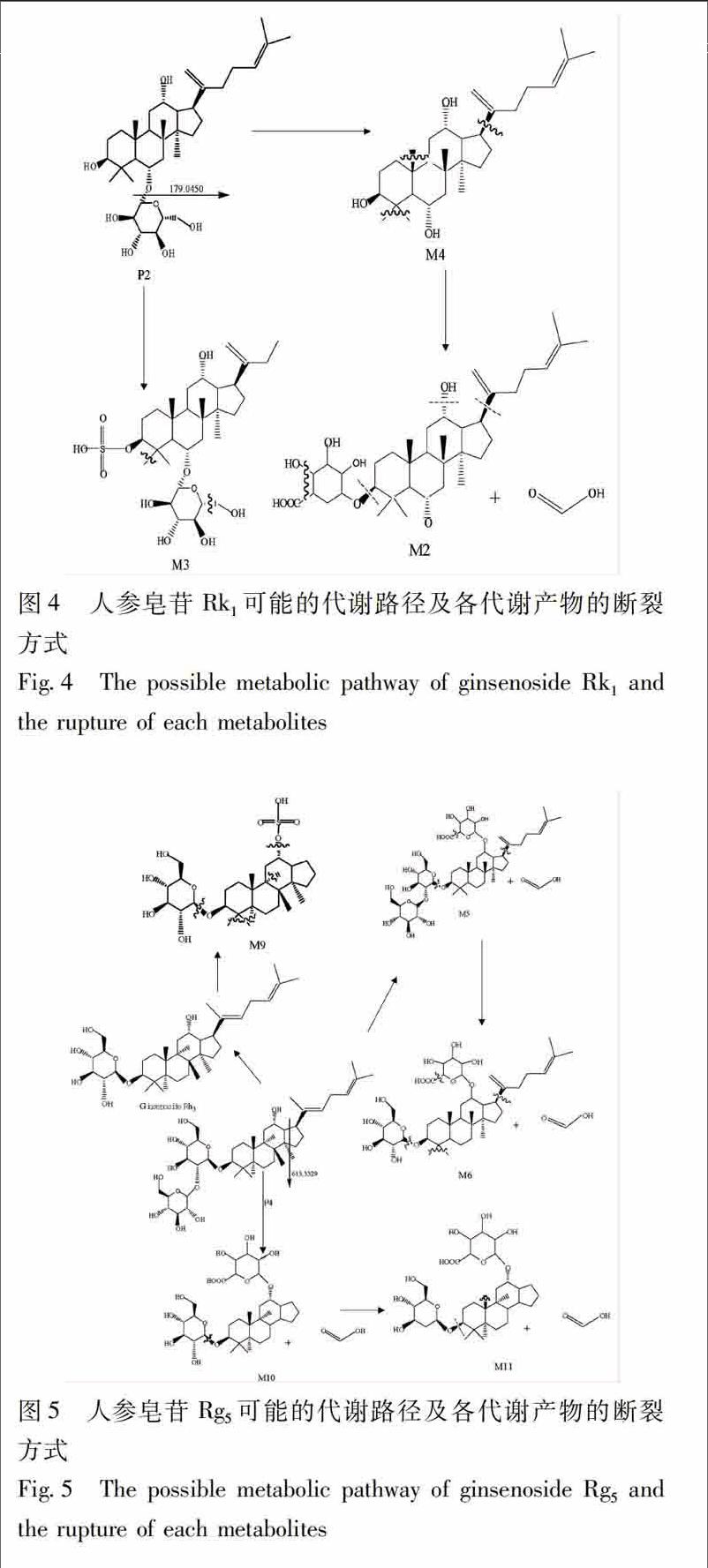
人参皂苷Rk3,Rh4 ,Rk1,Rg5的结构中取代基主要是甲基、糖基或者羟基,所以甲基、糖基和羟基的损失是其主要的碰撞诱导解离途径,另还可能存在葡萄糖醛酸化及硫酸化反应。综合相关文献调研及前期斑马鱼代谢研究结果,将可能的代谢产物断裂方式及代谢途径列出后分析比对,见图2~5。在大鼠血浆、尿液和粪便样本中最终确定了15个可能的代谢产物,主要的11个代谢产物相关信息见表2。
来自母体化合物Rk3的葡萄糖醛酸化缀合176,产生m/z 841591 9(M1)的甲酸缔合分子离子和其m/z 449293 5的产物离子。综上可认为M1是由于C3位葡萄糖醛酸化而产生的人参皂苷Rk3的葡萄糖醛酸化产物。根据人参皂苷Rk3的结构,M1为人参皂苷Rk33O葡萄糖醛酸盐。
NotR/min相对分子质量误差/×10-6m/z来源分子式名称
M1605841591 938449293 5粪便,血浆C42H68O14人参皂苷Rk33O葡萄糖醛酸盐
M21126679181 738571253 3,303136 6粪便C36H58O9脱水Δ20,21原人参三醇3O葡萄糖醛酸盐
M31130645468 828599351 1粪便,尿液C32H54O11S23脱2甲基丙烯基人参皂苷Rk33O硫酸酯
M41270457239 9-22303233 9粪便,血浆C30H50O3脱水Δ20,21原人参三醇
M51221987708 315464312 7粪便,血浆和尿液C48H78O18人参皂苷Rk112O葡萄糖醛酸盐
M61168825615 625433294 9粪便,尿液C42H68O13人参皂苷Rk212O葡萄糖醛酸盐
M7450957502 3-32436230 6,157221 4粪便,血浆C47H76O175″脱羟甲基人参皂苷Rk112O葡萄糖醛酸盐
M81148683420 036615230 1,479293 3粪便,血浆和尿液C36H60O10S人参皂苷Rk212O硫酸盐
M9432559380 3-30297244 3粪便,尿液C28H48O9S2′脱羟基,17脱1,5二甲基1,4己二烯基人参皂苷Rh312O硫酸盐
M101080717451 5030671443 4,509385 4粪便,血浆C34H56O1317脱1,5二甲基1,4己二烯基人参皂苷Rh312O葡萄糖醛酸盐
M111267701206 4-43641205 2,180902 4粪便,血浆和尿液C34H56O122′脱羟基,17脱1,5二甲基1,4己二烯基人参皂苷Rh312O葡萄糖醛酸盐
m/z 679181 7(M2)的甲酸缔合分子离子和其m/z 517253 3,303136 6的产物离子比m/z 841591 9(M1)的甲酸缔合分子离子,在m/z 449293 5处的产物离子小162。因此,M2被鉴定为M1失去1分子葡萄糖的产物,并且葡萄糖的损失位置被认为在C6位。根据M1的结构,M2为脱水Δ20,21原人参三醇3O葡萄糖醛酸盐。
在m/z 645468 8(M3)处的分子离子和其在m/z 599351 1处的产物离子,比人参皂苷Rk3在m/z 665431 8处甲酸缔合的分子离子多26。因此,M3被鉴定为人参皂苷Rk3丢失2甲基丙烯基和硫酸化的产物,硫酸化和丢失2甲基丙烯基的位置分别被认为是在C3位和C23位。根据人参皂苷Rk3的结构,M3为23脱2甲基丙烯基人参皂苷Rk33O硫酸盐。
通过162的中性损失产生对应于来自母体人参皂苷Rh4的葡萄糖损失的M4,其分子离子为m/z 457239 9,其产物离子在m/z 303233 9处。综上可认为M4是由于C6位处的葡萄糖损失,即人参皂苷Rh4失去1分子葡萄糖所得产物。根据人参皂苷Rh4的结构,M4为脱水Δ20,21原人参三醇。
M5来自母体化合物Rk1的葡萄糖醛酸化,人参皂苷Rk1通过176的葡萄糖醛酸化缀合产生m/z 987708 3(M5)处甲酸缔合的分子离子。因此,M5被认为是由于在C12位的葡萄糖醛酸化而引起的人参皂苷Rk1的葡糖醛酸化产物。根据人参皂苷Rk1的结构,M5为人参皂苷Rk112O葡萄糖醛酸盐。
在m/z 825615 6(M6)处甲酸缔合的分子离子和其在m/z 433294 9的产物离子比m/z 987708 3(M5)处甲酸缔合的分子离子小162,M5的产物离子在m/z 464312 7。因此M6被鉴定为M5脱1分子葡萄糖产物,并且其葡萄糖损失位置被认为是在C1″位。根据M5的结构,M6为人参皂苷Rk212O葡萄糖醛酸盐。
m/z 957502 3(M7)的甲酸缔合的分子离子及其在m/z 436230 6,157221 4的产物离子比m/z 987708 3(M5)处甲酸缔合的分子离子小30,其产物离子在m/z 464312 7处。因此,M7被鉴定为M5失去1分子羟甲基产物,羟甲基损失位置被认为是在葡萄糖的C5′位。根据M5的结构,M7为5″脱羟甲基人参皂苷Rk112O葡萄糖醛酸盐。
m/z 683420 0(M8)的分子离子和m/z 615230 1,479293 3的产物离子比人参皂苷Rk2的分子离子多80。因此,M8被鉴定为人参皂苷Rk2的硫酸化产物,硫酸化位置被认为是在C12位。根据人参皂苷Rk2的结构,M8为人参皂苷Rk212O硫酸盐。
加入206,产生M9的分子离子m/z 559380 3,对应于母体化合物人参皂苷Rg5的脱糖,硫酸化,去1,5二甲基1,4己二烯基,脱羟基化反应。结果表明,母体化合物的离子首先在C3位置处脱糖,随后人参皂苷Rh3的离子硫酸化,脱1,5二甲基1,4己二烯基支链,脱羟基。因此,M9被认为是人参皂苷Rh3的硫酸化,失去1,5二甲基1,4己二烯基支鏈的脱羟基产物。硫酸化,脱1,5二甲基1,4己二烯基和脱羟基化的位置分别是C12,C17和葡萄糖的C2′位。根据人参皂苷Rh3的结构,M9为2′脱羟基,17脱1,5二甲基1,4己二烯基人参皂苷Rh312O硫酸盐。endprint
在m/z 717451 5(M10)处甲酸缔合的分子离子和m/z 671443 4,509385 4处的产物离子比母体化合物Rg5 m/z 766488 5处甲酸缔合的分子离子少95。因此,M10被鉴定为人参皂苷Rg5在C17位失去1,5二甲基1,4己二烯基,C12位置处葡萄糖醛酸化和葡萄糖C1″位置处葡萄糖损失的产物,M10为17脱1,5二甲基1,4己二烯基人参皂苷Rh312O葡萄糖醛酸盐。
在m/z 701206 4(M11)处甲酸缔合的分子离子和m/z 641205 2,180908 4处的产物离子比m/z 717451 5(M10)处甲酸缔合的分子离子小16,其产物离子在m/z 671443 4,509385 4处。因此,M11被鉴定为M10的脱羟基产物,并且脱羟基位置被认为是在葡萄糖的C2′位。根据M10的结构,M11为2′脱羟基,17脱1,5二甲基1,4己二烯基人参皂苷Rh312O葡萄糖醛酸盐。
4讨论
本研究利用UPLCQTOFMS/MS技术发现了蒸三七正丁醇部位中的4种人参皂苷Rk3,Rh4,Rk1,Rg5和其在大鼠体内的11个主要的代谢产物,并根据MS/MS准确质量信息对代谢物的结构进行了初步鉴定。结果表明,蒸三七正丁醇部位中4种人参皂苷的代谢途径包括葡萄糖醛酸化、脱糖、硫酸化、脱羟甲基化、支链丢失等。其中,葡萄糖醛酸化的产物有M1,M2,M5,M6,M7,M10;脱糖反应的产物有M2,M4,M6,M7,M9,M10;硫酸化的产物有M3,M8,M9;脱羟甲基化的产物有M9,M11;支链丢失的产物有M3,M9,M10。因11个代谢产物均存在于粪便中,故粪便中各人参皂苷的主要代谢产物均发生了上述代谢转化;血中人参皂苷的代谢转化以Ⅰ相代谢的脱糖反应为主;尿中人参皂苷的代谢转化以Ⅱ相代谢的葡萄酸醛酸化及硫酸化为主。
本文仅考虑蒸三七活性部位在体内的药动学及代谢产物的鉴定分析,有关蒸三七醇提物(更能代表蒸三七)的体内代谢状况,可展开后续研究,有利于更深刻的认识蒸三七中外源性物质在体内的代谢状况及可能的转化途径。该研究对蒸三七主要活性皂苷类组分即人参皂苷Rk3,Rh4,Rk1,Rg5在体内的代谢,从定性角度得到阐释,进一步明确蒸三七在体内发挥药效的物质基础,亦为蒸三七的临床应用提供了参考。
[参考文献]
[1]Dong T X, Cui X M, Song Z H, et al Chemical assessment of roots of Panax notoginseng in China regional and seasonal variations in its active constituents [J]. J Agric Food Chem, 2003, 51 (16): 4617.
[2]Chan E C Y, Yap S L, Lau A J, et al Ultraperformance liquid chromatography/timeofflight mass spectrometry based metabolomics of raw and steamed Panax notoginseng [J]. Rapid Commun Mass Sp, 2007, 21 (4): 519.
[3]Chen B, Shen Y P, Zhang D F, et al The apoptosisinducing effect of ginsenoside F4 from steamed notoginseng on human lymphocytoma JK cells[J]. Nat Prod Res, 2013, 27 (24): 2351.
[4]Chen B, Jia X B Apoptosisinducing effect of ginsenoside Rg6 on human lymphocytoma JK cells [J]. Molecules, 2013, 18 (7): 8109.
[5]Toh D F, Patel D N, Chen Eric C Y, et al Antiproliferative effects of raw and steamed extracts of Panax notoginseng and its ginsenoside constituents on human liver cancer cells [J]. Chin Med, 2011, 6 (1): 4.
[6]Sun S, Wang C Z, Tong R, et al Effects of steaming the root of Panax notoginseng on chemical composition and anticancer activities [J]. Food Chem, 2010, 118 (2): 307.
[7]Sun S, Qi L W, Du G J, et al Red notoginseng: higher ginsenoside content and stronger anticancer potential than Asian and American ginseng [J]. Food Chem, 2011, 125 (4): 1299.
[8]Jin Y B, Luan X D, Liu H X, et al Pharmacokinetics and metabolite identification of a novel VEGFR2 and Srcdual inhibitor 6chloro2methoxyN(2methoxybenzyl) acridin9amine in rats by liquid chromatography tandem mass spectrometry [J]. Talanta, 2012,89 (2): 70.
[9]Chen B, Wei Y J, Wang D D, et al Metabolism of ginsenosides Rk3 and Rh4 from steamed notoginseng in zebrafish by ultraperformance liquid chromatography/quadrupoletimeofflight mass spectrometry[J]. Arch Pharm Res, 2015, 38 (8):1468.
[10]Shen W W, Wei Y J, Tang D Q, et al Metabolite profiles of ginsenosides Rk1 and Rg5 in zebrafish using ultraperformance liquid chromatography/quadrupoleetimeofflight MS[J]. J Gins Res, 2016,41(1):78.
[責任编辑张燕]endprint
