壁虎对肝细胞癌干细胞特性的影响及其机制
2017-11-11张雅兰陈文发吴春玲
张雅兰 陈文发 吴春玲

[摘要]研究壁虎对肝癌干细胞特性的影响,并探讨其分子机制。采用MTT法检测肝癌细胞增殖;肿瘤球培养和流式细胞术检测肝癌干性;Western blot检测Wnt通路及干性相关蛋白的表达;免疫共沉淀检测相互作用蛋白;皮下移植瘤模型检测肝癌细胞的干性。结果显示,壁虎对Huh7细胞的IC50为(0750±0112) g·mL-1,其对Hep3B细胞的IC50为(0454±0039) g·mL-1。壁虎处理的肝癌细胞培养形成的肿瘤球的数目和大小均缩小(P<005),CD44,CD133阳性的肝癌细胞比例减少(P<005)。守宫处理肝癌细胞后,βcatenin,CD44,cMyc,CCND1,Sox2,Oct4,Nanog,ABCG2等表达均下调。免疫共沉淀结果显示,壁虎能抑制LRP6与Frizzled6的相互作用。表明,壁虎能够抑制肝癌细胞的增殖、肿瘤球的形成及肿瘤干细胞的比例,其通过靶向LRP6,阻止LRP6与Frizzled6复合物的形成而抑制Wnt信号通路。
[关键词]壁虎; 肝细胞癌; 干细胞特性; Wnt
[Abstract]To explore the effects and mechanism of aqueous extracts of gecko on cancer stem cells properties of hepatocellular carcinoma In vitro, MTT assay was used to detect the cells growth in Huh7 and Hep3B Spheroidforming assay and flow cytometry were performed to observe the the stemness of Huh7 and Hep3B cells The protein expressions of βcatenin, CD44, cMyc, CCND1, Sox2, Oct4, Nanog and ABCG2 were detected by Western blot Interacting proteins were detected by coimmunoprecipitation; and a subcutaneous xenograft model was used to detect the stemness of hepatoma carcinoma cells The results indicated that aqueous extracts of gecko induced cell growth inhibition in a dose and timedependent manner, with the IC50 of (0750±0112) g·mL-1 for Huh7 and (0454±0039) g·mL-1for Hep3B, respectively The number and size of tumor spheres formed by hepatoma carcinoma cells were decreased after treatment by aqueous extracts of gecko(P<005); the proportions of cells staining with putative markers for cancer stem cells, such as CD133 and CD44, were decreased(P<005) After treatment with aqueous extracts of gecko, the expression levels of βcatenin, CD44, cMyc, CCND1, Sox2, Oct4, Nanog and ABCG2 were decreased Coimmunoprecipitation results showed that the aqueous extracts of gecko could inhibit the interaction between LRP6 and Frizzled6, indicating that the aqueous extracts of gecko could inhibit the proliferation of hepatoma cells, the formation of tumor spheres and the proportion of tumor stem cells, and inhibit the Wnt signaling pathway by targeting LRP6 to prevent the formation of LRP6 and Frizzled6 complexes.
[Key words]gecko; hepatocellular carcinoma; stemness; Wnt
肝細胞癌(hepatocellular carcinoma,HCC)是全球发病率居第5位的恶性肿瘤,也是我国最常见的恶性肿瘤之一。近年来,尽管多种HCC的治疗模式不断进展,但HCC的远期效果仍不理想,其中癌症的复发转移是导致远期效果不理想的重要原因。肿瘤干细胞(CSC)对放化疗的敏感性差,被认为是造成癌症转移、肿瘤化疗和放疗抵抗的主要原因之一。最初在《本草纲目》中记载,壁虎,亦称守宫或天龙,是一种传统的中药材。在现代医学中,壁虎被证实在肝癌中具有抗肿瘤作用[15],但其对肿瘤干性的影响未见相关报道。本研究探讨壁虎对肝癌干性的影响,并阐述其作用机制,以望为其临床治疗肝癌提供新的依据。
1材料
11药材鲜壁虎Gekko swinhonis Gunther购自河北祁奥中药饮片有限公司,经由作者鉴定后使用。经冷冻、研磨、溶解、过滤等步骤后制成鲜壁虎水提取物,经BCA法定量后,制成质量浓度100 g·L-1的溶液。endprint
12动物BALB/c裸小鼠45只,雄性,4周龄,购自上海斯莱克实验动物有限责任公司,许可证号SCXK(沪)20120002。裸鼠饲养环境稳定,实验动物相关操作符合动物伦理学要求。
13试剂βcatenin(510672AP),CD133(184701AP),cMyc(108281AP),CCND1(601861Ig),Sox2(110641AP),Oct4(112631AP),Nanog(142951AP),ABCG2(100511AP),GAPDH(600041Ig)均購自中国Proteintech公司;LRP6(2560),Frizzled6(5158),CD44(3570)均购自美国CST公司;细胞裂解液(S3090)购自碧云天生物技术公司;COIP试剂盒(Thermo公司,美国);LowInput QuickAmp Labeling Kit,Gene Expression Hybridization Kit 及基因芯片均购自德国Agilent公司。
14仪器移液器(GeneTex公司,美国);化学发光酶标仪(BIOTEK公司,美国);超速离心机(Eppendorf公司,德国);Agilent Scanner G2505C(Agilent 公司,德国);垂直电泳仪(BioRad公司,美国);转膜仪(BioRad公司,美国)。
2方法
21细胞培养人肝癌细胞Huh7和Hep3B购自上海中国科学院细胞库。细胞培养基为含10%胎牛血清,100 kU·L-1青霉素,100 kU·L-1链霉素的DMEM培基,在37 ℃,5%CO2饱和湿度恒温培养箱中培养细胞。
22细胞药物敏感度实验(MTT法)取对数生长期细胞,1万个细胞/孔种于96孔板中,细胞贴壁后加入含不同浓度(0,005,01,025,05,1,25,5 g·mL-1)壁虎水提取物的培基培养一定时间,每孔加入MTT溶液(5 g·L-1)20 μg,37 ℃孵箱中继续孵育4 h,再加入DMSO,选择570 nm波长,在酶联免疫检测仪上测定各孔吸光度。
23肿瘤球培养细胞用含不同浓度壁虎水提取物的培基培养一定时间(0,01,025 g·mL-1)处理48 h后,取对数生长期细胞,消化后充分洗涤弃去培养液中残留的血清,接种于低黏附性6孔板中,每孔5 000个细胞,4 mL肿瘤球培基(DMEM/F12+B27+bFGF+EGF)培养2~3周后观察肿瘤球的形成情况。
24流式检测细胞表面标记细胞用含不同浓度壁虎水提取物的培基培养一定时间(0,01,025 g·mL-1)处理48 h后,取对数生长期细胞约1×106个细胞,洗涤细胞后,用含一抗的PBS重悬细胞,冰上孵育20~45 min,离心后用PBS洗涤2次,重悬于含荧光二抗的PBS中,冰上孵育20~45 min,离心后用PBS洗涤2次,上机检测。
25动物造模取对数生长期细胞,以1×105,2×105,5×105 个/100 μL的梯度接种于裸鼠皮下,每个梯度15只裸鼠。壁虎水提取物0,1,3 mg·g-13个梯度每周灌胃给药2次,2个月后,观察裸鼠皮下瘤的形成情况。
26基因表达谱检测细胞用含不同浓度壁虎水提取物的培基培养一定时间(0,025 g·mL-1)处理48 h后,提取细胞总RNA,经定量后,用荧光染料标记RNA,再将标记的RNA与基因芯片进行杂交反应,反应结束后用Agilent Scanner G2505C 扫描芯片荧光信号,筛选出差异基因后,进行KEGG通路分析。
27Western blot检测相关基因蛋白的表达细胞用含不同浓度壁虎水提取物的培基培养一定时间(0,025 g·mL-1)处理48 h后,加入蛋白裂解液冰上裂解30 min,4 ℃ 12 000 r·min-1离心20 min取上清测蛋白浓度。经8%~10%SDS PAGE电泳,湿转至PVDF膜上,在3%BSA中封闭1 h,一抗(1∶1 000)4 ℃孵育过夜,洗膜后再用HRP耦联的二抗室温孵育15 h,洗膜后加ECL发光液进行曝光。
28免疫共沉淀将壁虎水提取物与磁珠孵育固定化后,提取细胞总蛋白,与上述的磁珠在4 ℃中共孵育过夜进行免疫共沉淀反应,后洗脱共沉淀的蛋白,对获取的蛋白进行质谱分析,筛选出差异蛋白或是对获取的蛋白进行Western blot检测验证质谱的结果。具体操作步骤按照免疫共沉淀试剂盒的说明书进行。
29统计学分析采用SPSS 210进行统计学分析。计量资料以±s表示;计量资料采用单因素方差分析(OneWay ANOVA)用于多组间的比较,采用t检验用于2组间比较。P<005为差异有统计学意义。
3结果
31抑制肝癌细胞的增殖肝癌细胞经壁虎处理后,壁虎对肝癌细胞的影响呈现出剂量和时间依赖性,随着壁虎浓度的增加及处理时间的延长(IC50的药物浓度处理细胞),其对肝癌细胞的增殖抑制作用越显著。壁虎作用于肝癌细胞48 h,其对Huh7细胞的IC50是(0750±0112) g·mL-1,其对Hep3B细胞的IC50是(0454±0039) g·mL-1。而当壁虎质量浓度小于025 g·mL-1时,对肝癌细胞增殖无明显影响,见图1。
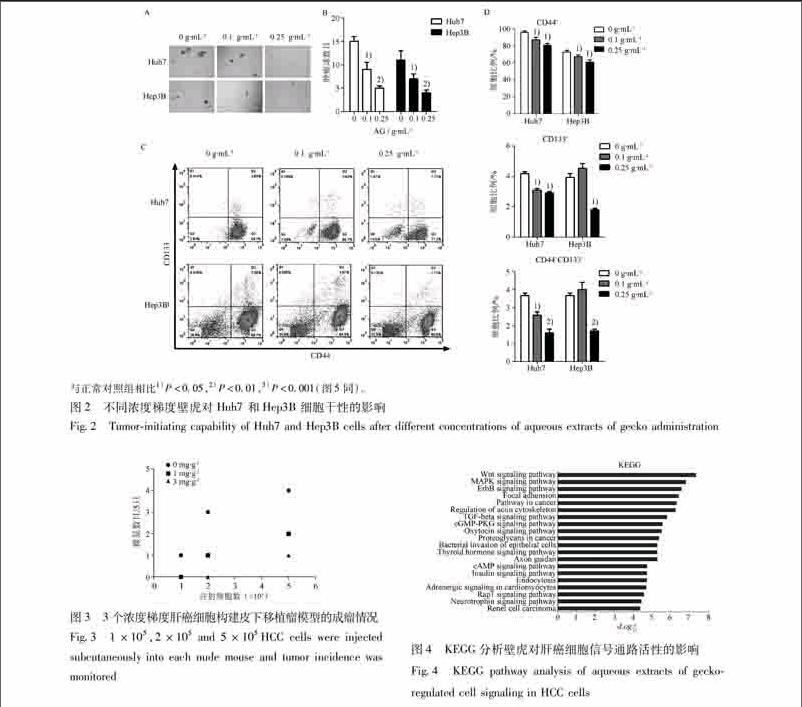
32壁虎抑制肝癌的干细胞特性肝癌细胞增殖受抑制可能会影响其干细胞特性,为排除增殖对干细胞特性的影响,选取01 g·mL-1和025 g·mL-12个浓度梯度的壁虎处理肝癌细胞。经处理后的肝癌细胞培养形成的肿瘤球的数目和大小均较对照组(0 g·mL-1)明显缩小(P<005),并且呈现出剂量依赖效应,见图2。同时,经不同浓度壁虎处理的肝癌细胞,其干细胞标志物CD44,CD133的比例也明显减少(P<005),也呈现出剂量依赖效应,见图2。
进一步在动物体内证实壁虎对肝癌细胞干细胞特性的影响,结果显示,壁虎能够抑制肝癌在体内的成瘤能力,且壁虎的浓度越大其对肝癌细胞成瘤能力的抑制越显著,见图3。endprint
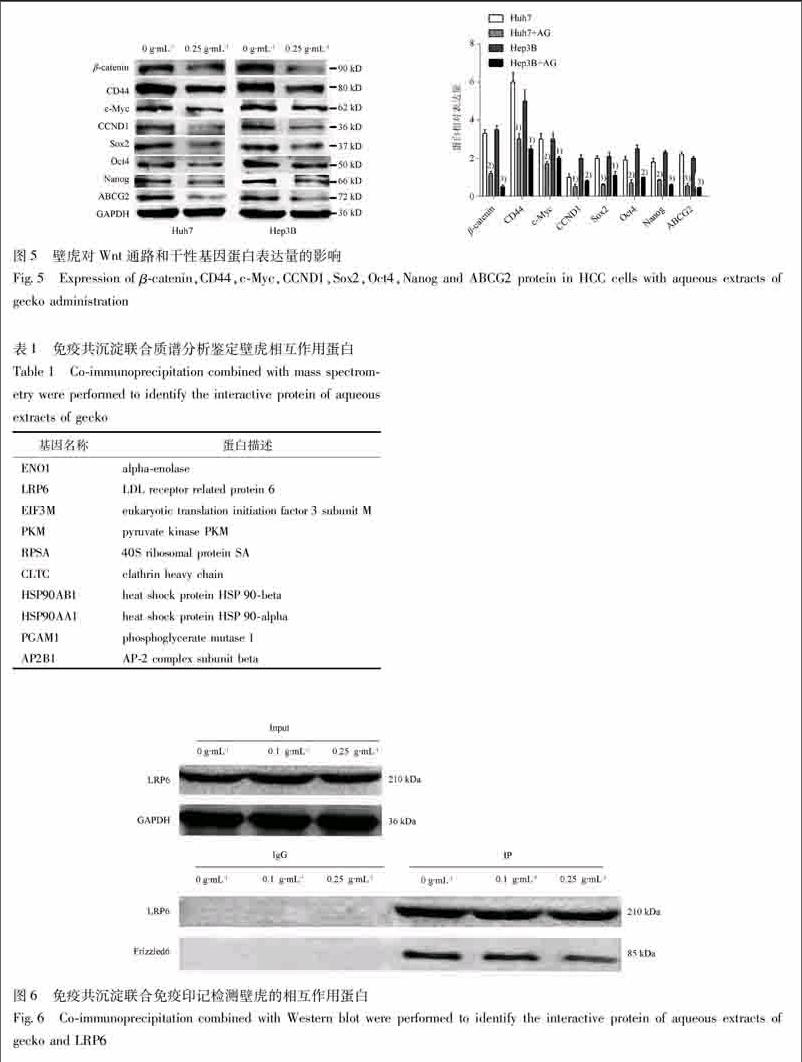
33壁虎通过抑制Wnt通路进而影响肝癌的干细胞特性为进一步阐明壁虎影响肝癌干细胞特性的具体机制,将肝癌细胞经壁虎处理后与未经壁虎处理的肝癌细胞进行基因表达谱分析。筛选出差异基因(倍数改变≥2倍),经KEGG通路分析表明,壁虎在肝癌细胞中主要影响Wnt通路,见图4。
进一步检测Wnt通路关键转录因子βcatenin及其经典靶基因CD44,cMyc,CCND1的表达,结果表明在肝癌细胞中经壁虎处理后Wnt通路的活性发生下调。Wnt通路与肝癌的干细胞特性密切相关,进一步检测干细胞特性的相关指标Sox2,Oct4,Nanog,ABCG2等表达,发现经壁虎处理的肝癌细胞的干细胞标志物蛋白发生下调,见图5。
34壁虎靶向LRP6后影响肝癌细胞Wnt通路活性通过免疫共沉淀联合质谱分析,筛选出与壁虎可能存在相互作用的蛋白,见表1。为筛选出的評分最高的10个相互作用蛋白。其中LRP6为Wnt通路的关键膜受体分子,进一步通过免疫共沉淀检测壁虎对LRP6的影响,结果显示,壁虎对LRP6的表达量并无影响,而是影响了LRP6与另一关键Wnt通路信号分子Frizzled6的结合,随着壁虎浓度的增加,LRP6与Frizzled6的结合量逐渐减少,见图6。
4讨论
壁虎已被证实能够发挥抑制肿瘤增殖及侵袭转移、促肿瘤凋亡、抗血管生成及免疫调节等多种功能[23,6],其在肝癌中能够促进肝癌的分化从而发挥抗肿瘤作用[1,5]。可见,壁虎可能影响肝癌的干细胞特性。本研究表明,壁虎可以抑制肝癌的干细胞特性在体内外呈现出抗肿瘤效应,其对肝癌干性的影响是通过抑制Wnt通路的活性而实现的。
细胞的增殖会对侵袭转移、干性等多种功能的检测产生影响。与前期相关报道一致,在本研究中证实了壁虎能够抑制肝癌细胞的增殖,后续实验选取了对肝癌细胞增殖无明显影响的壁虎浓度梯度对细胞进行处理。
肿瘤的干细胞特性已经被证实与肿瘤复发转移
与正常对照组相比1)P<005,2)P<001,3)P<0001(图5同)。
密切相关,直接影响肿瘤患者的预后。其中各种肿瘤标记物的检测常被用于反应干细胞比例,在肝癌中,CD44及CD133是肝癌干细胞标志物,通过检测CD44,CD133的细胞比例能够反映肝癌的干细胞比例[7]。检测肿瘤细胞的干细胞特性的“金标准”是通过检测其成瘤的能力。在相同细胞浓度的移植瘤中,成瘤能力越强则表明肿瘤的干性越强。在本研究中,壁虎能够在体内外抑制肝癌细胞的干细胞特性。
Wnt通路已被证实在维持干细胞特性中发挥重要作用[8]。Wnt通路的信号分子通过结合于细胞膜表面的Frizzled受体后,进一步与LRP5/6形成细胞表面的膜分子复合物,该复合物抑制βcatenin的降解复合物APC/AXIN1/GSK3β对βcatenin的泛素化降解,从而使得βcatenin能够入核促进包括cMyc,CCND1,CD44等多个靶基因的转录,激活Wnt信号通路发挥促进侵袭转移、干性等作用[911]。
本研究表明,壁虎能通过下调Wnt通路的活性从而抑制Sox2,Oct4,Nanog,ABCG2等多个肿瘤干细胞关键蛋白的表达,实现对肝癌干性的抑制。研究表明壁虎可能是通过其提取物中的蛋白成分发挥作用[23],这为采用研究蛋白相互作用的方法,探索壁虎可能的相互作用靶点提供了可能[12]。本研究通过免疫共沉淀联合质谱分析的方法研究壁虎的相互作用靶点,壁虎起作用成分为蛋白大分子,首先考虑其作用靶点位于细胞膜表面。对筛选出的可能作用靶点进行免疫共沉淀联合Western blot验证分析,证实了LRP6为壁虎的作用靶点,壁虎通过与LPR6相互作用后,阻止了LRP6与Frizzled的结合,从而抑制了Wnt信号通路的活性。本研究首次通过蛋白互相作用的研究方法寻找出了壁虎的具体作用靶
点,进一步阐明了其在肝癌中发挥抗肿瘤作用的分子机制。
综上可知,在肝癌中,壁虎通过作用于LPR6膜受体,阻止了LRP6与Frizzled复合物的形成,下调了Wnt信号通路活性,从而抑制肝癌的干细胞特性,发挥壁虎的抗肝癌作用。该研究着眼于肝癌干细胞特性相关的分子机制及生物学事件,将可能有利于改善肝癌患者的预后情况以及总体生存率,为壁虎临床运用于肝癌的治疗提供了理论依据。
[参考文献]
[1]Wang Y X, Gu X X, Geng D, et al Differentiation of bel7402 human hepatocarcinoma cells induced by aqueous extracts of fresh gecko (AG) and its antitumor activity in vivo[J]. J Ethnopharmacol, 2014, 155(3): 1583.
[2]Song Y, Wang J G, Li R F, et al Gecko crude peptides induce apoptosis in human liver carcinoma cells in vitro and exert antitumor activity in a mouse ascites H22 xenograft model[J]. J Biomed Biotechnol, 2012, 2012: 743573.
[3]Chen D, Yao W J, Zhang X L, et al Effects of gekko sulfated polysaccharideprotein complex on human hepatoma SMMC7721 cells: inhibition of proliferation and migration[J]. J Ethnopharmacol, 2010, 127(3): 702.endprint
[4]Yan Z C, Chen D, Wu X Z, et al Effects of aqueous extracts of Aconitum carmichaeli, Rhizoma Bolbostemmatis, Phytolacca acinosa, Panax notoginseng and Gekko swinhonis Guenther on Bel7402 cells[J]. World J Gastroenterol, 2007, 13(19): 2743.
[5]Wu X, Chen D, Xie G R Effects of gekko sulfated polysaccharide on the proliferation and differentiation of hepatic cancer cell line[J]. Cell Biol Int, 2006, 30(8): 659.
[6]Liu F, Wang J G, Wang S Y, et al Antitumor effect and mechanism of gecko on human esophageal carcinoma cell lines in vitro and xenografted sarcoma 180 in Kunming mice[J]. World J Gastroenterol, 2008, 14(25): 3990.
[7]Zhu M, Yin F, Fan X, et al Decreased TIP30 promotes Snailmediated epithelialmesenchymal transition and tumorinitiating properties in hepatocellular carcinoma[J]. Oncogene, 2015, 34(11): 1420.
[8]Miki T, Yasuda S Y, Kahn M, et al Wnt/betacatenin signaling in embryonic stem cell selfrenewal and somatic cell reprogramming[J]. Stem Cell Rev, 2011, 7(4): 836.
[9]Clevers H, Nusse R Wnt/betacatenin signaling and disease[J]. Cell, 2012, 149(6):1192.
[10]MacDonald B T, Tamai K, He X Wnt/betacatenin signaling: components, mechanisms, and diseases[J]. Dev Cell, 2009, 17(1): 9.
[11]Niehrs C The complex world of WNT receptor signalling[J]. Nat Rev Mol Cell Biol, 2012, 13(12): 767.
[12]Iizumi Y, Oishi M, Taniguchi T, et al The flavonoid apigenin downregulates CDK1 by directly targeting ribosomal protein S9[J]. PLoS ONE, 2013, 8(8): e73219
[責任编辑张宁宁]endprint
