红阳猕猴桃多糖组分的分离纯化、单糖组成及其抑制癌细胞活性
2017-11-11张盈娇朱永清李华佳邓俊琳
夏 陈,陈 建*,张盈娇,朱永清,李华佳,邓俊琳
(四川省农业科学院农产品加工研究所,四川 成都 610066)
红阳猕猴桃多糖组分的分离纯化、单糖组成及其抑制癌细胞活性
夏 陈,陈 建*,张盈娇,朱永清,李华佳,邓俊琳
(四川省农业科学院农产品加工研究所,四川 成都 610066)
研究红阳猕猴桃果实多糖组分的分离纯化、单糖组成及其对癌细胞增殖的抑制作用。用水提取总多糖,层析法分离纯化多糖组分;高效凝胶渗透色谱测定组分的纯度和分子质量;高效液相色谱法测定多糖纯组分的单糖组成;傅里叶变换红外(Fourier transform-infrared,FT-IR)光谱鉴定多糖纯组分的特征官能团;用3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐法测定多糖纯组分对肺癌、乳腺癌、肝癌、胃癌和结肠癌这5 种癌细胞的体外抑制活性。总多糖分离出ACP-1、ACP-2、ACP-3、ACP-4这4 种单组分多糖;其中ACP-3纯度最高,分子质量为2 663 kD,主要含有L-鼠李糖(17.78%,物质的量分数,后同)、D-半乳糖醛酸(25.25%)、D-半乳糖(25.45%)、L-阿拉伯糖(20.51%)、D-葡萄糖(6.14%)、D-甘露糖(2.13%)、D-木糖(1.03%)、D-葡萄糖醛酸(0.97%)及少量D-岩藻糖(0.74%);其FT-IR光谱图有多糖特征官能团的吸收峰。ACP-3对5 种癌细胞增殖的半数最大抑制浓度依次为0.646、0.310、0.642、0.281、0.575 µmol/L,对癌细胞增殖有抑制活性。
红阳猕猴桃果;多糖组分;提取分离;单糖组成;抑癌活性
红阳猕猴桃(Actinidia chinensis)属中华系猕猴桃品种,是1989年从四川省苍溪县的中华猕猴桃实生苗中选出的大果红肉新品种,富含多种维生素、氨基酸、微量元素等营养成分且总糖含量高,其口感及品质佳且售价高,被列入国家保护资源,并形成一种世界性产业[1-5]。目前已有关于红阳猕猴桃种植及果实贮藏保鲜的研究[6-8],也有关于红阳猕猴桃果实中活性物质总黄酮[9]、氨基酸[10]、花青素及多酚类等的研究[11-14]。猕猴桃果实多糖具有抗癌[15-16]、降血糖降血脂[17]、刺激皮肤胶原蛋白合成[18]、抗衰老[19]等生物活性。通常经提取纯化的总多糖中包括各种组分,其中仅部分组分是活性多糖,因此有必要把总多糖分级纯化并做活性筛选得到活性多糖。目前鲜见对红阳猕猴桃果实多糖的研究报道。
本实验研究红阳猕猴桃果实总多糖的提取,通过二乙氨基乙基纤维素52(diethylaminoethyl cellulose 52,DEAE-52)和葡聚糖凝胶G200层析分离纯化多糖组分,高效凝胶渗透色谱(high performance gel permeation chromatography,HPGPC)法测定多糖组分的纯度和分子质量,1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP)柱前衍生-高效液相色谱(high performance liquid chromatography,HPLC)法[20]测定多糖纯组分的单糖组成,傅里叶变换红外(Fourier transform infrared,FT-IR)光谱测定特征官能团吸收峰,以及用3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT)法[21]测定纯组分的抑制癌细胞活性,为红阳猕猴桃营养健康价值的利用提供科学依据。
1 材料与方法
1.1 材料与试剂
红阳猕猴桃果产于成都市都江堰。
胃癌细胞SGC7901、结肠癌细胞HT29、乳腺癌细胞MCF-7、肺癌细胞NCI-H460、肝癌细胞HepG2南京科佰公司;胎牛血清、胰蛋白酶 美国HyClone公司。
DEAE-52、葡聚糖凝胶G200、D-甘露糖、L-鼠李糖、D-葡萄糖醛酸、D-半乳糖醛酸、D-葡萄糖、D-木糖、D-半乳糖、L-阿拉伯糖、D-岩藻糖对照品、葡聚糖标准品 国药集团化学试剂有限公司。甲醇、乙腈(均为色谱纯) 美国Sigma公司;透析袋(截留分子质量大于3 000 D) 华美生物工程公司。
1.2 仪器与设备
UV-1750分光光度计 日本岛津公司;Hei-VAP Advantage ML旋转蒸发仪 德国Heidolph公司;FD-1A-50冷冻干燥机 北京比朗有限公司;H2050R-1高速离心机 湖南湘仪离心机仪器有限公司;1260型HPLC仪 美国安捷伦公司;MILLI-Q超纯水仪 美国Millipore公司;IGO150二氧化碳培养箱、ST-360酶标仪上海科华生物工程股份有限公司;EclipseTS100倒置式生物显微镜 日本Nikon公司。
1.3 方法
1.3.1 红阳猕猴桃总多糖的提取
称取2.0 kg成熟的红阳猕猴桃果,打浆,加入6 000 mL蒸馏水,于40 ℃搅拌提取2 h;然后6 000 r/min离心8 min,后续离心条件相同,取上清液, 60 ℃减压浓缩至3 00 mL溶液,加入9 mL 2 mol/L三氯乙酸溶液沉降蛋白质;然后离心除蛋白质,取上清液加入2 倍体积无水乙醇,醇沉12 h;离心,取沉淀复溶于水,再加入2 倍体积无水乙醇,醇沉12 h;再离心,取沉降物经冷冻干燥得略带色固体,称质量。将所得固体物取样配制成1 mg/mL水溶液,分别于280 nm和260 nm波长处做紫外扫描,检测其蛋白质和核酸含量情况;用碘-碘化钾试剂检测其是否含有淀粉;咔唑-硫酸试剂检测是否含有糖醛酸。用苯酚-硫酸法[22]检测该固体的总多糖含量。根据公式(1)计算总多糖得率。

式中:m1为总多糖质量/g;m2为鲜果质量/g。
1.3.2 红阳猕猴桃总多糖的分离纯化
1.3.2.1 DEAE-52离子交换层析
将红阳猕猴桃粗多糖配制成质量浓度3.8 mg/mL的溶液,用蒸馏水平衡DEAE-52(中等碱性阴离子交换剂)层析柱后,上样10 mL溶液,控制洗脱流速为0.8 mL/min,先用60 mL超纯水洗脱,再依次以0.1、0.2、0.3、1.0 mol/L的NaCl溶液各100 mL洗脱,每10 mL收集一管,并用苯酚-硫酸法[22]测定多糖含量,绘制曲线图,合并同一洗脱峰的收集液,浓缩、透析、冻干。多次上样分离粗多糖,用前述层析条件制备各单组分多糖样品。以苯酚-硫酸法测定各单组分多糖含量。根据公式(2)计算各单组分多糖的得率。

式中:m1为各单组分多糖质量/g;m2为总多糖质量/g。
1.3.2.2 葡聚糖凝胶G200二次分离纯化
取DEAE-52离子交换层析分离纯化得到的单组分多糖各20 mg,分别配制成质量浓度5.0 mg/mL的溶液样品,用蒸馏水平衡葡聚糖凝胶G200层析柱,上样1 mL,用0.1 mol/L NaCl溶液洗脱,控制洗脱流速为0.8 mL/min,每3 mL收集于一管并测定单组分多糖含量,绘制曲线图,并收集单一峰洗脱液。
1.3.3 单组分多糖纯度及分子质量测定
采用HPGPC法,精确称量葡聚糖标准品0.5 g,其分子质量分别为6、10、40、100、200、500、2 000、5 000 kD,用纯净水溶解并定容至100 mL,配制成5 mg/mL的葡聚糖标准溶液。色谱柱为PL aquagel-OH不锈钢柱(300 mm×7.5 mm,8 µm);柱温30 ℃;流动相为纯净水;流速为1.0 mL/min;检测器为示差折光检测器,柱温40 ℃;进样量为10 μL。用标准葡聚糖分子质量的对数值(lg M)对洗脱时间做洗脱曲线,得到葡聚糖分子质量分布的标准曲线。用同样操作方法和色谱条件测定猕猴桃果单组分多糖的洗脱曲线,测定其纯度,并用标准曲线计算得到单组分多糖的分子质量。
1.3.4 单组分多糖的组成分析
1.3.4.1 单组分多糖的水解
取红阳猕猴桃单组分多糖约20 mg,加入到5.0 mL的安瓿瓶中,向瓶中加入4.0 mL 2 mol/L H2SO4溶液,用酒精喷灯封管,然后将瓶置于烘箱中于l05 ℃水解8 h。冷却后取反应瓶,用BaCO3调整H2SO4溶液至pH 7,然后于6 000 r/min离心6 min,取上清液;沉淀再用5 mL蒸馏水超声洗涤,6 000 r/min离心,取上清液;将2 次的上清液合并,用0.25 μm微孔滤膜过滤后,于80 ℃浓缩至0.5 mL备用。
1.3.4.2 PMP柱前衍生-HPLC法分析单糖组成
单糖衍生:分别取1.3.4.1节的水解浓缩液和D-甘露糖、L-鼠李糖、D-葡萄糖醛酸、D-半乳糖醛酸、D-葡萄糖、D-木糖、D-半乳糖、L-阿拉伯糖、D-岩藻糖9 种单糖对照品溶液(3.0 mmol/L)各400 μL,依次加入200 μL 0.5 mol/L PMP甲醇溶液和400 μL 0.3 mol/L NaOH溶液,混匀;于70 ℃水浴反应40 min,取出,冷却10 min后,用400 μL 0.3 mol/L HCl溶液中和;然后以2 mL氯仿萃取(漩涡振荡,6 000 r/min离心8 min),细针头吸弃下层氯仿相,重复萃取3 次。取上层水相,过滤,以10 μL进样。
色谱条件:色谱柱ZORBAX SB-C18柱(150 mm×4.6 mm,5.0 µm);检测波长为250 nm;柱温为室温;流速为1.0 mL/min;进样体积为10 µL;流动相分别为:(A)0.05 mol/L磷酸盐溶液(pH 6.9)-15%乙腈、(B)0.05 mol/L磷酸盐溶液(pH 6.9)-40%乙腈,线性洗脱为0~10 min,0%~8% B,10~30 min,8%~20% B。
采用面积归一化法按公式(3)计算各单糖组分的物质的量分数。

式中:S1为各单糖组分峰面积/(mAU·s);S2为各单糖组分峰面积之和/(mAU·s)。
1.3.5 单组分多糖的FT-IR光谱检测
取5.0 mg单组分多糖组分样品,用溴化钾(KBr)压片法,以FT-IR光谱仪于4 000~600 cm-1扫描测试。
1.3.6 单组分多糖的癌细胞毒性实验
1.3.6.1 癌细胞培养
分别取胃癌细胞SGC7901、结肠癌细胞HT29、乳腺癌细胞MCF-7、肺癌细胞NCI-H460、肝癌细胞HepG25 种癌细胞株,吸出旧培养液,再加入500 µL的新鲜胰酶,消化3~4 min。用显微镜观察至细胞被完全消化,脱壁后,加入3 mL培养液终止消化,反复吹打混匀。将液体转移到15 mL离心管中,于8 000 r/min离心4 min。取出离心管,吸出管内液体,加入新培养液1 mL,用无菌枪头反复吹打使细胞充分混匀,然后将细胞放于37 ℃及含5% CO2的细胞培养箱中培养。
1.3.6.2 对癌细胞增殖的抑制作用
采用MTT法进行测定。收集对数期的这5 种癌细胞,调节细胞悬液至密度约为5×104个/mL,每孔100 µL加入到96 孔板,置于37 ℃、5% CO2的细胞培养箱孵育24 h,倒置显微镜下观察并加入红阳猕猴桃单组分多糖样品溶液。样品溶液加入结束后,每孔加入100 µL质量浓度为5 mg/mL的MTT溶液,继续培养4 h,在每孔加入150 µL二甲基亚砜,置摇床上低速振荡10 min,使结晶物充分溶解。用酶联免疫检测仪于492 nm波长处测定吸光度,求抑制率和半数最大抑制浓度(half maximal inhibitory concentration,IC50)。
2 结果与分析
2.1 红阳猕猴桃总多糖的提取
得到略带色固体状产物10.5 g,相对于鲜果质量得率为0.525%。该固体物溶液经紫外扫描,在280 nm和260 nm波长处吸收信号极低,表明其几乎不含蛋白质和核酸。碘-碘化钾试剂检测结果显示不含淀粉。咔唑-硫酸试剂检测结果表明含有糖醛酸。该固体物经苯酚-硫酸法定性鉴定为多糖,定量计算得其质量分数为73%。通常不同的提取方法对多糖的纯度、理化性质及生物活性会产生影响。文献报道过不同提取方法对软枣猕猴桃果多糖单糖组成及抗氧化活性的影响,有高温、低温、微波助提3 种方法[23],其中采用100 ℃高温水提多糖溶入了大量淀粉,而采用与本实验相同的低温(40 ℃)水提方法则不含淀粉。本实验采用低温水提法有利于保持总多糖的天然性状及纯度,也避免了高温或微波助提方法导致多糖分子断裂和理化性质的改变。
2.2 总多糖的分离纯化及单组分多糖分子质量
2.2.1 DEAE-52离子交换层析分析

图1 总多糖的DEAE-52离子交换层析Fig. 1 Chromatography of crude polysaccharides on DEAE-52 column
由图1可知,红阳猕猴桃总多糖经DEAE-52柱层析梯度洗脱分离后得到4 个洗脱峰:ACP-1、ACP-2、ACP-3和ACP-4。其中60~120 mL洗脱液为0.1 mol/L NaCl,洗脱得到第一个组分ACP-1;140~220 mL洗脱液为0.1、0.2 mol/L NaCl,洗脱得到组分ACP-2;230~290 mL洗脱液为0.2、0.3 mol/L NaCl,洗脱得到组分ACP-3;300~370 mL洗脱液为0.3 mol/L NaCl,洗脱得到组分ACP-4。色谱柱多次上样分离,合并同一洗脱峰的收集液经处理后得到红阳猕猴桃4 个组分多糖固体:ACP-1 250.2 mg,相对总多糖固体的得率(后同)为11.56%,多糖含量(后同)为82.5%;ACP-2 854.3 mg,得率39.50%,多糖含量83.7%;ACP-3 588.1 mg,得率27.20%,多糖含量84.3%;ACP-4 308.6 mg,得率14.25%,多糖含量87.2%;4 个组分的总得率为92.51%。为了确认这4 个组分为单组分多糖,以利于对其进行深入的理化和活性特性研究,又对这4 个组分分别用葡聚糖凝胶G200进行第二次分离实验。
2.2.2 单组分多糖的葡聚糖凝胶G200二次分离
ACP-1、ACP-2、ACP-3、ACP-4经葡聚糖凝胶G200柱层析,结果如图2所示。ACP-1经二次层析分离得4 个洗脱峰,表明该组分含有4 种分子质量范围的多糖。由于在葡聚糖凝胶G200层析柱中,这4 个洗脱峰分离度低,不易收集,因此本研究不再对该组分进一步探讨。而单组分多糖ACP-2、ACP-3、ACP-4经过葡聚糖凝胶G200柱层析时仍然得到单一洗脱峰,表明这3 种组分为均匀多糖组分,并以HPGPC测定其纯度并计算分子质量。

图2 4 种单组分多糖的葡聚糖凝胶G200层析Fig. 2 Chromatography of four polysaccharide fractions on Sephadex G200 column
2.2.3 单组分多糖的纯度和分子质量

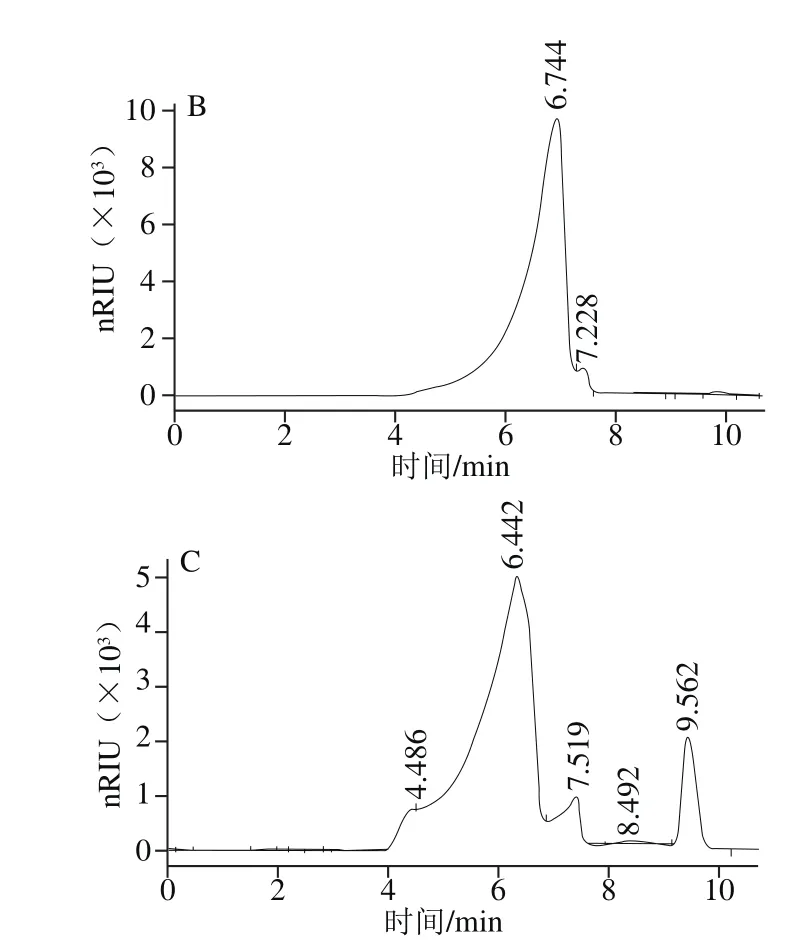
图3 ACP-2(A)、ACP-3(B)和ACP-4(C)的HPGCP图Fig. 3 HPGCP chromatograms of ACP-2 (A), ACP-3 (B) and ACP-4 (C)
HPGCP测定结果如图3所示,ACP-2和ACP-4仍非纯组分,DEAE-52离子交换层析和葡聚糖凝胶G200层析对单组分多糖的分离效率都不如HPGCP。HPGCP结果证明ACP-3是纯度最高的一个单组分多糖,在6.744 min有峰型很好的主峰,仅在7.228 min有一小的洗脱峰。根据制备的葡聚糖分子质量分布标准曲线计算得ACP-3的分子质量为2 663 kD。鉴于ACP-3的纯度最高,故采用ACP-3进一步研究其单糖组成和FT-IR光谱特征,及其抑制癌细胞增殖的生物活性。
2.3 ACP-3的单糖组成及结构分析
2.3.1 PMP柱前衍生-HPLC法分析单糖组成

图4 ACP-3单糖组成的HPLC图Fig. 4 HPLC chromatograms of monosaccharides from ACP-3
由图4可知,ACP-3含有全部对照的9 种单糖;各种单糖的物质的量分数分别为:L-鼠李糖17.78%、D-半乳糖醛酸25.25%、D-半乳糖25.45%、L-阿拉伯糖20.51%、D-葡萄糖6.14%、D-甘露糖2.13%、D-木糖1.03%、D-葡萄糖醛酸0.97%、及少量D-岩藻糖0.74%;另外可能还有少量未被标识的单糖。与文献报道的软枣猕猴桃果多糖单糖组成[23]相比,同是低温水提取方法,红阳猕猴桃单组分多糖ACP-3的D-半乳糖醛酸和L-鼠李糖含量远高于软枣猕猴桃对应单糖含量(6.64%、4.16%);而其含有的D-甘露糖和L-阿拉伯糖则远低于软枣猕猴桃多糖的这2种单糖(14.35%、38.37%);红阳猕猴桃ACP-3的D-半乳糖含量与软枣猕猴桃的D-半乳糖含量(24.75%)接近。结果也说明红阳猕猴桃果多糖与其他猕猴桃品种的多糖存在差异,有其自身特点。
2.3.2 FT-IR光谱分析

图5 多糖组分ACP-3的FT-IR光谱图Fig. 5 FT-IR spectrum of ACP-3
红阳猕猴桃ACP-3的FT-IR光谱分析由图5可知,ACP-3具有多糖的结构特征吸收[24-26]:在波数3 426 cm-1左右处出现的宽而强的吸收峰是羟基的O—H伸缩振动吸收峰;在波数2 940 cm-1处左右出现的弱的吸收峰是烷基的C—H伸缩振动吸收峰;1 614 cm-1和1 416 cm-1处的吸收峰正是含有的糖醛酸羰基(C=O)伸缩振动峰,且糖醛酸可能以钠盐的形式存在,该红外吸收特征峰印证了糖醛酸单糖成分的存在;1 200~1 000 cm-1是C—O—C和C—O—H伸缩振动。
2.4 ACP-3对癌细胞毒性的影响

图6 ACP-3对5 种癌细胞抑制率的影响Fig. 6 Inhibitory effect of ACP-3 on the proliferation of five cancer cells
ACP-3含有多种成分的单糖,推测其生物活性可能具有多样性,用MTT法体外实验测定其对5 种癌细胞的生长抑制率及其IC50,结果如图6所示。当ACP-3浓度小于等于0.375 5 µmol/L时,其对5 种癌细胞的抑制率均随ACP-C浓度的增大而显著增加(P<0.05);但超过0.375 5 µmol/L后,对不同癌细胞的抑制率有所不同,对肺癌细胞NCI-H460的抑制率呈显著性增加(P<0.05),对其余癌细胞的抑制率均未因浓度增大而产生显著性差异;当ACP-3浓度从1.502 1 µmol/L上升至3.004 2 µmol/L时,对肺癌细胞NCI-H460和乳腺癌细胞MCF-7细胞的抑制率无显著增加,但对其余癌细胞的抑制率均有显著性增加(P<0.05)。ACP-3对肺癌细胞NCI-H460、乳腺癌细胞MCF-7、肝癌细胞HepG2、胃癌细胞SGC7901、结肠癌细胞HT29的IC50,由计算得到分别为0.646、0.310、0.642、0.281、0.575 µmol/L。ACP-3对胃癌细胞SGC7901的IC50最小,因而对其抑制活性最大;其次是对乳腺癌细胞MCF-7的抑制作用;对其他3 种癌细胞的作用相对较弱。多糖的抗癌作用包括间接(免疫刺激)和直接(抑制细胞增殖和/或诱导细胞凋亡)两种途径[27-30]。ACP-3对胃癌和乳腺癌细胞的抑制活性相对强,值得探讨其对癌细胞的抑制机制,并可作为合适的化学结构修饰以期显著提高其抑癌活性。
3 结 论
红阳猕猴桃果经提取的总多糖分离得ACP-1、ACP-2、ACP-3、ACP-4 4 种单组分多糖,其中纯度最高的组分是ACP-3,其分子质量为2 663 kD;其含有的单糖种类多样,包括L-鼠李糖、D-半乳糖醛酸、D-半乳糖、L-阿拉伯糖、D-葡萄糖、D-甘露糖、D-木糖、D-葡萄糖醛酸及少量D-岩藻糖等;单糖组成的多样性是多糖组分生物活性的分子结构基础;ACP-3组分的FT-IR光谱分析也确认有源于单糖结构中的C=O、O—H、C—H、C—O—C官能团的特征吸收。ACP-3对体外实验的肺癌细胞NCI-H460、乳腺癌细胞MCF-7、肝癌细胞HepG2、胃癌细胞SGC7901、结肠癌细胞HT29这5 种癌细胞增殖都有一定抑制活性,且对胃癌细胞增殖的抑制活性最大。研究结果提示了红阳猕猴桃果多糖的保健功能,也为红阳猕猴桃(特别是其残次果)的精深加工及增值利用提供了理论依据。
[1] 李军德. 红阳猕猴桃[J]. 湖北林业科技, 2003(4): 39-40.
[2] 叶国盛. 世界稀优红肉猕猴桃新品种: “红阳”[J]. 中国果菜, 2004(1):35. DOI:10.3969/j.issn.1008-1038.2004.01.043.
[3] WANG M, LI M, MENG A. Selection of a new red-fleshed kiwifruit cultivar “HongYang”[J]. Acta Horticulturae, 2003, 610(610): 115-117.DOI:10.17660/ActaHortic.2003.610.13.
[4] 应云祥. 红阳猕猴桃的特点及栽培技术[J]. 农业科技通讯, 2014(1):234-236. DOI:10.3969/j.issn.1000-6400.2014.01.093.
[5] 科学技术部. 习近平主席为中国-新西兰猕猴桃联合实验室揭牌[EB/OL]. (2014-12-19) [2015-11-20]. http://www.most.gov.cn/yw/201412/t20141219_117030.htm.
[6] LI H J, ZHU Y Q, LUO F Y, et al. Use of controlled atmospheres to maintain postharvest quality and improve storage stability of a novel redfleshed kiwifruit (Actinidiachinensis Planch. var. rufopulpa [CF Liang et RH Huang] CF Liang et AR Ferguson)[J]. Journal of Food Processing and Preservation, 2015, 39(6): 907-914. DOI:10.1111/jfpp.12303.
[7] 何靖柳, 段钰, 杜小琴, 等. 几种保鲜处理对红阳猕猴桃活性氧代谢的影响[J]. 食品与发酵工业, 2016, 42(1): 225-231. DOI:10.13995/j.cnki.11-1802/ts.201601041.
[8] 何靖柳, 刘继, 秦文, 等. 贮藏处理后红阳猕猴桃的品质变化[J]. 食品工业科技, 2014, 35(8): 318-322. DOI:10.13386/j.issn1002-0306.2014.08.064.
[9] 陈雪梅, 甄汉深, 王雯慧, 等. 红阳猕猴桃总黄酮的含量测定[J]. 广西中医药大学学报, 2013, 16(2): 82-84. DOI:10.3969/j.issn.1008-7486.2013.02.042.
[10] 叶发荣, 韩秀梅, 肖钧, 等. ‘红阳’猕猴桃果实氨基酸含量及组成分析[J]. 中国园艺文摘, 2015, 31(8): 1-3; 25. DOI:10.3969/j.issn.1672-0873.2015.08.001.
[11] 杨俊, 姜正旺, 王彦昌. 红肉猕猴桃DFR基因的克隆及表达分析[J]. 武汉植物学研究, 2010, 28(6): 673-681. DOI:10.3724/SP.J.1142.2010.60673.
[12] 刘仁道, 黄仁华, 吴世权, 等. “红阳”猕猴桃果实花青素含量变化及环剥和ABA对其形成的影响[J]. 园艺学报, 2009, 36(6): 793-798.DOI:10.3321/j.issn:0513-353X.2009.06.003.
[13] 李文彬, 刘义飞, 彭明. 温度对猕猴桃花青素含量及其合成基因AdANS的影响[J]. 湖北农业科学, 2014, 53(9): 2070-2074.DOI:10.3969/j.issn.0439-8114.2014.09.026.
[14] COMESKEY D J, MONTEFIORI M, EDWARDS P J B, et al.Isolation and structural identification of the anthocyanin components of red kiwifruit[J]. Journal of Agricultural and Food Chemistry, 2009,57(5): 2035-2039. DOI:10.1021/jf803287d.
[15] 史彩虹, 李大伟, 赵余庆. 软枣猕猴桃的化学成分和药理活性研究进展[J]. 现代药物与临床, 2011, 26(3): 203-207.
[16] ZONG A, CAO H, WANG F. Anticancer polysaccharides from natural resources: a review of recent research[J]. Carbohydrate Polymers,2012, 90(4): 1395-1410. DOI:10.1016/j.carbpol.2012.07.026.
[17] 刘延吉, 刘金凤, 田晓艳, 等. 软枣猕猴桃多糖降血糖降血脂活性研究[J]. 食品与生物技术学报, 2012, 31(1): 86-89. DOI:10.3969/j.issn.1673-1689.2012.01.013.
[18] DETERS A M, SCHRÖDER K R, HENSEL A. Kiwi fruit (Actinidia chinensis L.) polysaccharides exert stimulating effects on cell proliferation via enhanced growth factor receptors, energy production,and collagen synthesis of human keratinocytes, fibroblasts, and skin equivalents[J]. Journal of Cellular Physiology, 2005, 202(3): 717-722.DOI:10.1002/jcp.20161.
[19] FENG S L, CHENG H R, XU Z, et al. Thermal stress resistance and aging effects of Panax notoginseng polysaccharides on Caenorhabditis elegans[J]. International Journal of Biological Macromolecules, 2015,81: 188-194. DOI:10.1016/j.ijbiomac.2015.07.057.
[20] CHENG B H, CHAN J Y, CHAN B C, et al. Structural characterization and immunomodulatory effect of a polysaccharide HCP-2 from Houttuynia cordata[J]. Carbohydrate Polymers, 2014, 103(4): 244-249. DOI:10.1016/j.carbpol.2013.12.048.
[21] RISS T L, MORAVEC R A, NILES A L, et al. Cell viability assaysassay guidance manual[EB/OL]. (2013-05-01) [2015-11-20]. http://www.ncbi.nlm.nih.gov/books/NBK144065/.
[22] CUESTA G, SUARE N, BESSIO M I, et al. Quantitative determination of pneumococcal capsular polysaccharide serotype 14 using a modification of phenol-sulfuric acid method[J]. Journal of Microbiological Methods, 2003, 52(1): 69-73. DOI:10.1016/S0167-7012(02)00151-3.
[23] 宣丽, 刘长江. 不同提取方法对软枣猕猴桃多糖单糖组成及抗氧化活性的影响[J]. 天然产物研究与开发, 2013, 25(9): 1260-1265.DOI:10.3969/j.issn.1001-6880.2013.09.022.
[24] CHENG H, FENG S, SHEN S, et al. Extraction, antioxidant and antimicrobial activities of Epimedium acuminatum Franch.polysaccharide[J]. Carbohydrate Polymers, 2013, 96(1): 101-108.DOI:10.1016/j.carbpol.2013.03.072.
[25] GAN D, MA L P, JIANG C X, et al. Production, preliminary characterization and antitumor activity in vitro of polysaccharides from the mycelium of Pholiota dinghuensis Bi[J]. Carbohydrate Polymers,2011, 84(3): 997-1003. DOI:10.1016/j.carbpol.2010.12.058.
[26] 马素云, 姚丽芬, 叶长文, 等. 1 种银耳多糖的分离纯化及结构分析[J].中国食品学报, 2013, 13(1): 172-177.
[27] LEMIESZEK M, RZESKI W. Anticancer properties of polysaccharides isolated from fungi of the Basidiomycetes class[J]. Contemporary Oncology, 2012, 16(4): 285-289. DOI:10.5114/wo.2012.30055.
[28] 王金辉, 黄健, 巩平, 等. 阿魏侧耳多糖抗癌作用机理研究[J]. 中国现代中药, 2011, 13(1): 39-43.
[29] JAYAKUMAR T, CHIU C C, WANG S H, et al. Anti-cancer effects of CME-1, a novel polysaccharide, purified from the mycelia of Cordyceps sinensis against B16-F10 melanoma cells[J].Journal of Cancer Research and Therapeutics, 2014, 10(1): 43-49.DOI:10.4103/0973-1482.131365.
[30] FAN L P, DING S D, AI L Z, et al. Antitumor and immunomodulatory activity of water-soluble polysaccharide from Inonotus obliquus[J].Carbohydrate Polymers, 2012, 90(2): 870-874. DOI:10.1016/j.carbpol.2012.06.013.
Isolation, Purification, Monosaccharide Composition and Anticancer Proliferation Activity of Polysaccharide Fraction from Hongyang Kiwi Fruits (Actinidia chinensis)
XIA Chen, CHEN Jian*, ZHANG Yingjiao, ZHU Yongqing, LI Huajia, DENG Junlin
(Institute of Agro-Products Processing Science and Technology, Sichuan Academy of Agricultural Sciences, Chengdu 610066, China)
The aim of this study was the isolation, purification, monosaccharide composition and anticancer activity of polysaccharide fractions from Hongyang kiwi fruits. Crude polysaccharides were obtained through water extraction.Column chromatography was applied to isolate and purify polysaccharide fractions. High performance gel permeation chromatography (HPGPC) was carried out to test the purity and molecular masses of the fractions. Monosaccharide composition of the purest polysaccharide fraction was tested by high performance liquid chromatography (HPLC), and its characteristic functional groups were identified by Fourier transform infrared (FT-IR) spectroscopy. The in vitro growth inhibitory effect of the pure polysaccharide fraction on lung cancer cell NCI-H460, breast cancer cell MCF-7, liver cancer cell HepG2, gastric cancer cell SGC7901, and colorectal cancer cell HT29 were determined by the 3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide (MTT) assay. Four fractions (ACP-1, ACP-2, ACP-3 and ACP-4)were isolated from the crude polysaccharides. ACP-3 was the purest fraction with a molecular mass of 2 663 kD. The monosaccharide composition analysis indicated that ACP-3 consisted of L-rhamnose (17.78%), D-galacturonic acid (25.25%),D-galactose (25.45%), L-arabinose (20.51%), D-glucose (6.14%), D-mannose (2.13%), D-xylose (1.03%), D-glucuronic acid(0.97%) and D-fucose (0.74%). The characteristic absorbance of functional groups was observed in the FT-IR spectrum of ACP-3 fraction. The half maximal inhibitory concentrations (IC50) of ACP-3 against NCI-H460, MCF-7, HepG2, SGC7901 and HT29 cell lines were 0.646, 0.310, 0.642, 0.281 and 0.575 µmol/L, respectively. ACP-3 showed a significant inhibitory effect on the proliferation of all tested cancer cell lines.
Hongyang kiwi fruit; polysaccharide fraction; extraction and isolation; monosaccharide composition; anticancer activity
10.7506/spkx1002-6630-201721020
TS255.1
A
1002-6630(2017)21-0126-06
2016-07-19
四川省财政创新能力提升工程优秀论文基金专项(2014LWJJ-008);四川省农科院条件建设专项-院人才项目
夏陈(1983—),男,助理研究员,硕士,研究方向为功能食(药)品。E-mail:xiachen3722496@163.com
*通信作者:陈建(1969—),男,研究员,博士,研究方向为功能食(药)品。E-mail:jc_saas@yahoo.com
夏陈, 陈建, 张盈娇, 等. 红阳猕猴桃多糖组分的分离纯化、单糖组成及其抑制癌细胞活性[J]. 食品科学, 2017, 38(21):126-131.
10.7506/spkx1002-6630-201721020. http://www.spkx.net.cn
XIA Chen, CHEN Jian, ZHANG Yingjiao, et al. Isolation, purification, monosaccharide composition and anticancer proliferation activity of polysaccharide fraction from Hongyang kiwi fruits (Actinidia chinensis)[J]. Food Science, 2017,38(21): 126-131. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201721020. http://www.spkx.net.cn
