宫颈癌高危患者对宫颈癌筛查的认知度和依从性
2017-11-11杜欣欣付晓宇李立安孟元光
杜欣欣,张 云,付晓宇,李立安,孟元光
宫颈癌高危患者对宫颈癌筛查的认知度和依从性
杜欣欣,张 云,付晓宇,李立安,孟元光
目的探讨宫颈癌高危患者对疾病危险因素的认知程度和筛查依从性的水平并分析影响因素。方法收集2014-10至2015-06间连续宫颈癌高危患者资料450例,年龄21~65岁,按长期居住地及有无医疗保险分为4组:(第1组)北京市居民有医疗保险组;(第2组)北京市居民无医疗保险组;(第3组)周边地区居民有医疗保险组;(第4组) 周边地区居民无医疗保险组。设计封闭式调查问卷进行研究。采用单因素ANOVA及多因素二元回归分析等统计学方法。结果6项主要危险因素包括高危型人乳头瘤病毒感染、既往多个性伴侣、过早初次性行为、性伴侣为阴茎癌患者、吸烟及多次阴道分娩史。研究对象的认知程度分别为71.1%、38.9%、18.7%、22.0%、13.6%和18.2%。北京地区高于周边地区,医保患者高于无医保患者。研究对象中,90.2%定期筛查宫颈癌,96.7%认同定期筛查宫颈癌,87.1%愿意接受医师的建议。文化程度、有无医疗保险以及长期居住地与宫颈癌筛查的依从性存在相关性(P<0.05)。结论宫颈癌高危患者对HPV感染的认知度较好,而对其他多种危险因素认知度不高。患者筛查依从性较好,独立影响因素包括文化程度、有无医疗保险和长期居住地。
宫颈癌;危险因素;认知度;依从性
宫颈癌是全世界女性第三大常见恶性肿瘤,发病率仅次于乳腺癌和肺癌,也是第二大女性生殖系统肿瘤[1]。宫颈癌的发病率和病死率在发达国家中已经显著降低,全国健康教育普及和疾病筛查是主要控制措施之一[2, 3]。然而在发展中国家,尤其是中低收入国家,宫颈癌仍然是女性发病率和病死率最高的疾病[4, 5]。国际癌症研究机构2012年的数据报道,全世界宫颈癌新发病例和死亡病例分别有85%和87%来自于发展中国家[6]。我国宫颈癌的发病率和病死率农村地区高于城市,在低收入地区开展宫颈癌防治工作困难重重[7]。提高疾病的认知程度有助于提高参与宫颈癌筛查的依从性,随着认知程度的提高,宫颈癌Ⅰ期和Ⅱ期的发现比例从38%提高到51%[8,9]。本研究一方面分析宫颈癌高危患者对疾病危险因素的认知程度和筛查依从性的水平;另一方面,将研究对象按长期居住地和是否持有医疗保险分组进行对照研究,分析认知度与依从性的影响因素。既往此类研究多以农村人群作为研究对象,而对城市人口关注不足,本研究首次提供了城市人口的研究数据,为相关医疗部门提供参考。
1 对象与方法
1.1 对象 2014-10至2015-06间连续收集解放军总医院接诊的宫颈癌高危患者的临床资料并采用问卷调查形式开展横断面研究。问卷结构为封闭式,调查方法为访问,内容经过预测试,包含人口学特征、对宫颈癌危险因素的认知程度及参与疾病筛查的依从性三个方面。人口学特征包括年龄、文化程度、职业、户口所在地、长期居住地、家庭人均月收入及是否持有医疗保险。患者为北京市及周边地区的长期居住人口。医疗保险指能够覆盖门诊宫颈癌筛查检查项目的医疗保险,商业医疗保险不负担此项费用的视为无医保。按长期居住地及是否持有医疗保险将患者分成4组:(第1组, G1)北京市居民有医疗保险组;(第2组, G2)北京市居民无医疗保险组;(第3组, G3)周边地区居民有医疗保险组;(第4组, G4) 周边地区居民无医疗保险组。
1.2 样本量 使用软件OpenEpi Version 3.03a计算样本量。基于普遍应用的50%到95%的可信区间,实际发生率45%~55%,检验效能1.0,最小样本量384例,考虑15%的脱落率,总体患者样本量为442例,共收集450例连续病例。
1.3 病例选择标准 入组标准:(1)宫颈癌高危患者(遵照指南标准,经过宫颈癌联合筛查,满足阴道镜检查指征的患者);(2)自愿入组;(3)年龄21~65岁;(4)智力正常无需监护人陪同。排除标准:(1)不能或拒绝配合调查;(2)既往任何时间点有过宫颈病变或宫颈癌病史及治疗史;(3)全子宫切除术后;(4)朋友或家属有宫颈癌病史者;(5)情绪激动或焦虑者。
1.4 方法 研究人员包括3名临床医师及2名护士,参与研究前接受统一培训。研究场所为固定位置的诊室,环境安静舒适、相对封闭。研究过程中,无关人员均不能进入该诊室。12位代码替代患者姓名并记录于调查问卷和知情同意书。原始数据为纸质问卷,存留于专用封闭的文件柜中。本研究符合解放军总医院伦理委员会相关规定。研究实施前患者签署知情同意书,一式两份。
1.5 统计学处理 使用软件SPSS 23.0进行数据分析。ANOVA分析研究因素和结果变量之间的关系。多因素Logistic回归分析确定独立影响因素之间的关联强度,包含优势比及95%置信区间,P<0.05为差异有统计学意义。
2 结 果
2.1 样本特征 30~49岁患者为宫颈癌筛查的主体人群,占69.8%。居住北京的患者 (G1+G2) 中,30~39岁组人数多于40~49岁组(40.5%vs27.8%)。居住外地的患者 (G3+G4) 中, 40~49岁组人数多于30~39岁组(46.1%vs63.4%)。53.3% (240/450) 的患者具有大学及以上学历。居住北京的患者中该项数据显著高于居住外地患者 (66.0%vs36.1%)。持有医保的患者人数明显高于没有医保的患者(65.6%vs34.4%)。52.2%(235/450)研究对象家庭人均月收入在3000~8000元。总体相比,第4组患者的文化程度和经济条件明显低于其他3组 (P<0.05,表1)。
2.2 宫颈癌危险因素的认知程度 本研究包含6项宫颈癌主要危险因素,即高危型人乳头瘤病毒(high risk human papilloma virus, HR-HPV)感染、既往多个性伴侣、过早初次性行为、性伴侣为阴茎癌患者、吸烟及多次阴道分娩史。研究对象被要求从中指出个人认可的与宫颈癌发病有关的所有因素。 如表2所示,6项危险因素的正确认知度分别为71.1%(320/450),38.9%(175/450),18.7%(84/450),22.0%(99/450),13.6%(61/450)和18.2%(82/450)。
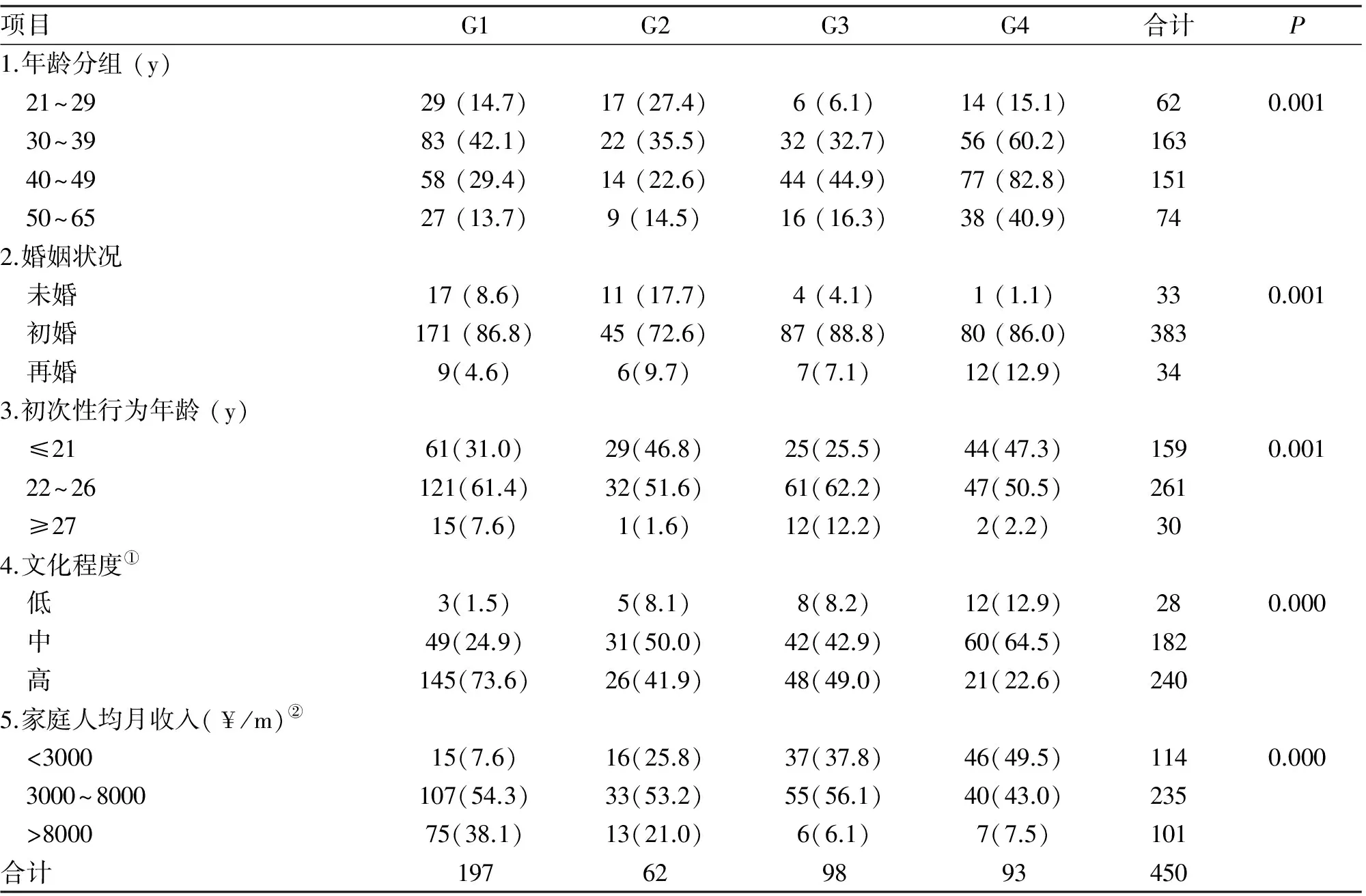
表1 4组宫颈癌高危患者的人口学特征 (n; %)
G1:北京市居民有医疗保险组;G2:北京市居民无医疗保险组;G3:周边地区居民有医疗保险组;G4:周边地区居民无医疗保险组;①低:文盲或小学学历;中:初、高中、中专学历;高:大学及以上学历;②计算汇率(2016.05.04) 1美元=6.499元
2.2.1 HR-HPV感染 不同地区和是否持有医保的患者之间认知程度存在显著性差异,北京地区高于周边地区(χ2= 21.09,P= 0.000),医保患者高于无医保患者(χ2=19.59,P=0.000)。
2.2.2 既往多个性伴侣 认知程度存在地区性显著差异,北京地区高于周边地区(χ2= 11.43,P=0.001),医保患者高于无医保患者(χ2=10.97,P=0.001)。第4组的认知程度与其他3组相比差异呈显著性(G1vsG4,χ2= 20.07,P=0.000;G2vsG4,χ2= 9.33,P=0.002;G3vsG4,χ2=9.52,P=0.002)。
2.2.3 过早初次性行为 北京地区高于周边地区(χ2=5.58,P=0.018),医保患者高于无医保患者(χ2=9.23,P= 0.002)。第4组的认知程度与其他3组相比较差异呈显著性(G1vsG4,χ2=11.66,P=0.001; G2vsG4,χ2=3.82,P=0.093; G3vsG4,χ2=5.71,P=0.017)。
2.2.4 性伴侣为阴茎癌患者 对于此项危险因素的认知程度,4组之间比较差异无统计学意义(P>0.05)。北京地区患者高于周边地区患者(χ2=2.61,P=0.106),医保患者高于无医保患者(χ2=2.89,P=0.089),差异无统计学意义。
2.2.5 吸烟 86.5%的研究对象不认为吸烟与患宫颈癌有关。各组之间比较,认知程度无统计学差异(P>0.05)。来自不同地区和有无医保的患者之间比较差异无统计学意义,但是认知度仍然北京地区患者高于周边地区患者(χ2=1.86,P=0.173),医保患者高于无医保患者(χ2=0.76,P=0.383)。
2.2.6 多次阴道分娩史 4组研究对象组间总体比较,对该项危险因素的认知程度存在显著性差异(P<0.05)。北京地区患者有23.2%认为多产是宫颈癌危险因素,周边地区仅为11.5%,二者比较差异有统计学意义(χ2=10.01,P=0.002);18.3%的医保患者认为多产是宫颈癌危险因素,无医保的患者比例为18.1%,二者比较差异无统计学意义(χ2=0.00,P=0.950)。
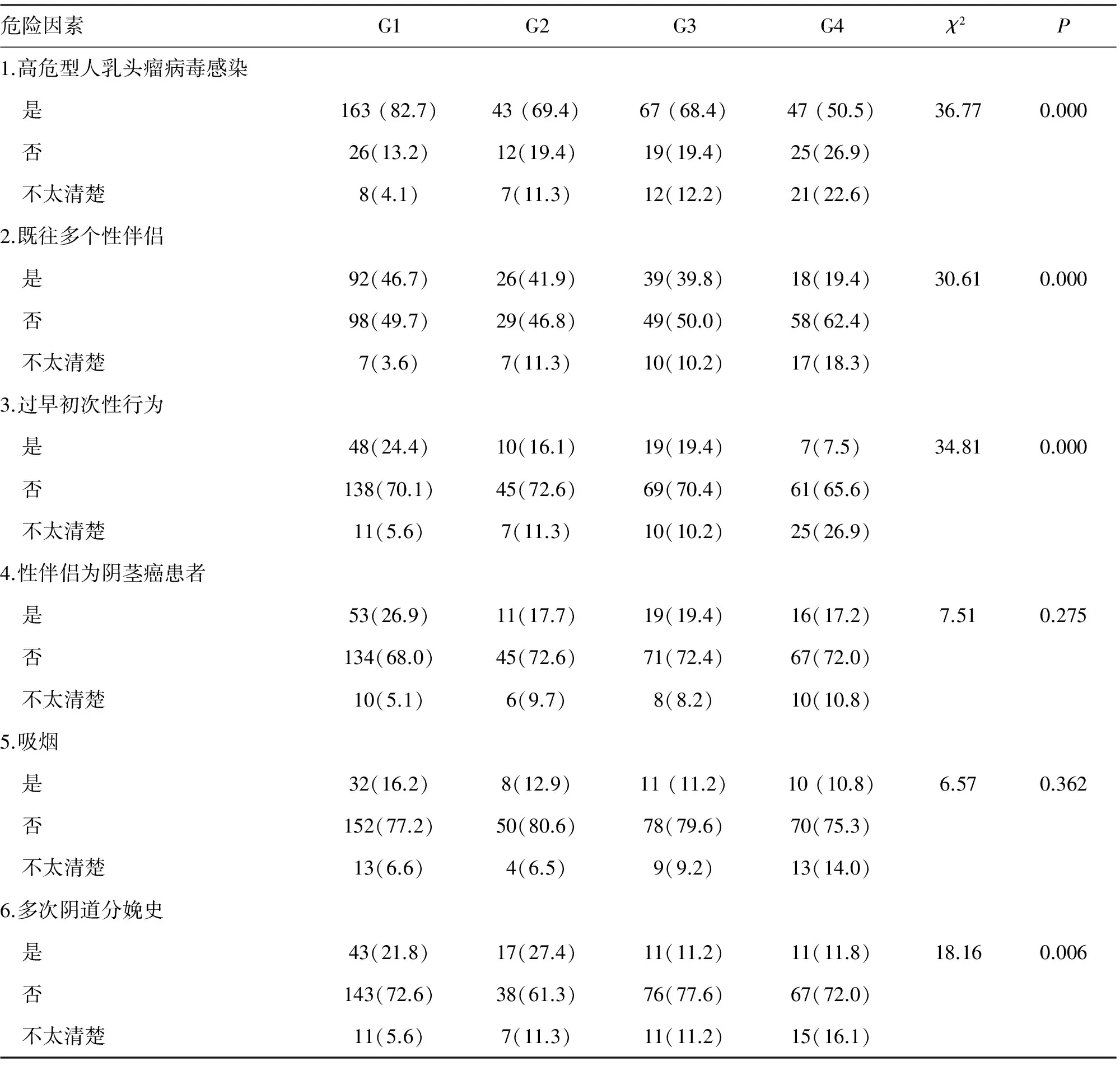
表2 宫颈癌危险因素的认知程度分析 (n;%)
G1:北京市居民有医疗保险组;G2:北京市居民无医疗保险组;G3:周边地区居民有医疗保险组;G4:周边地区居民无医疗保险组
2.3 参与宫颈癌筛查的依从性 采用4道封闭式选择题反映研究对象关于宫颈癌筛查的态度,以此评估参与疾病筛查的依从性(表3、4)。研究对象中90.2%定期筛查宫颈癌,96.7%认同定期筛查宫颈癌,87.1%愿意接受医师的建议。单因素分析显示有医保的患者更加认同育龄期女性定期筛查宫颈癌(CrudeOR=8.17,95%CI:2.27~29.40) 并且更加主动地获取宫颈癌相关的健康知识,如上网搜索(CrudeOR=1.73,95%CI:1.06~2.83)。来自北京地区的患者 (CrudeOR=3.24,95%CI:1.81~5.82) 和持有医保的患者(CrudeOR=2.29,95%CI:1.31~4.00) 更加愿意听从和采纳医师防治宫颈癌的建议。
多因素二元回归分析显示,研究对象接受宫颈癌筛查的依从性除了受到长期居住地和是否持有医疗保险的影响,还与年龄和文化程度有关,其中文化程度的影响甚至高于长期居住地和有无医疗保险。患者对医师建议的接受度随着年龄组的增加而提高(P<0.05);文化程度越高的患者,越倾向定期筛查宫颈癌、越能够主动获取相关科普知识和越遵医嘱防止疾病(P<0.05)。依从性与家庭人均月收入、婚姻状况和初次性生活年龄没有相关性。
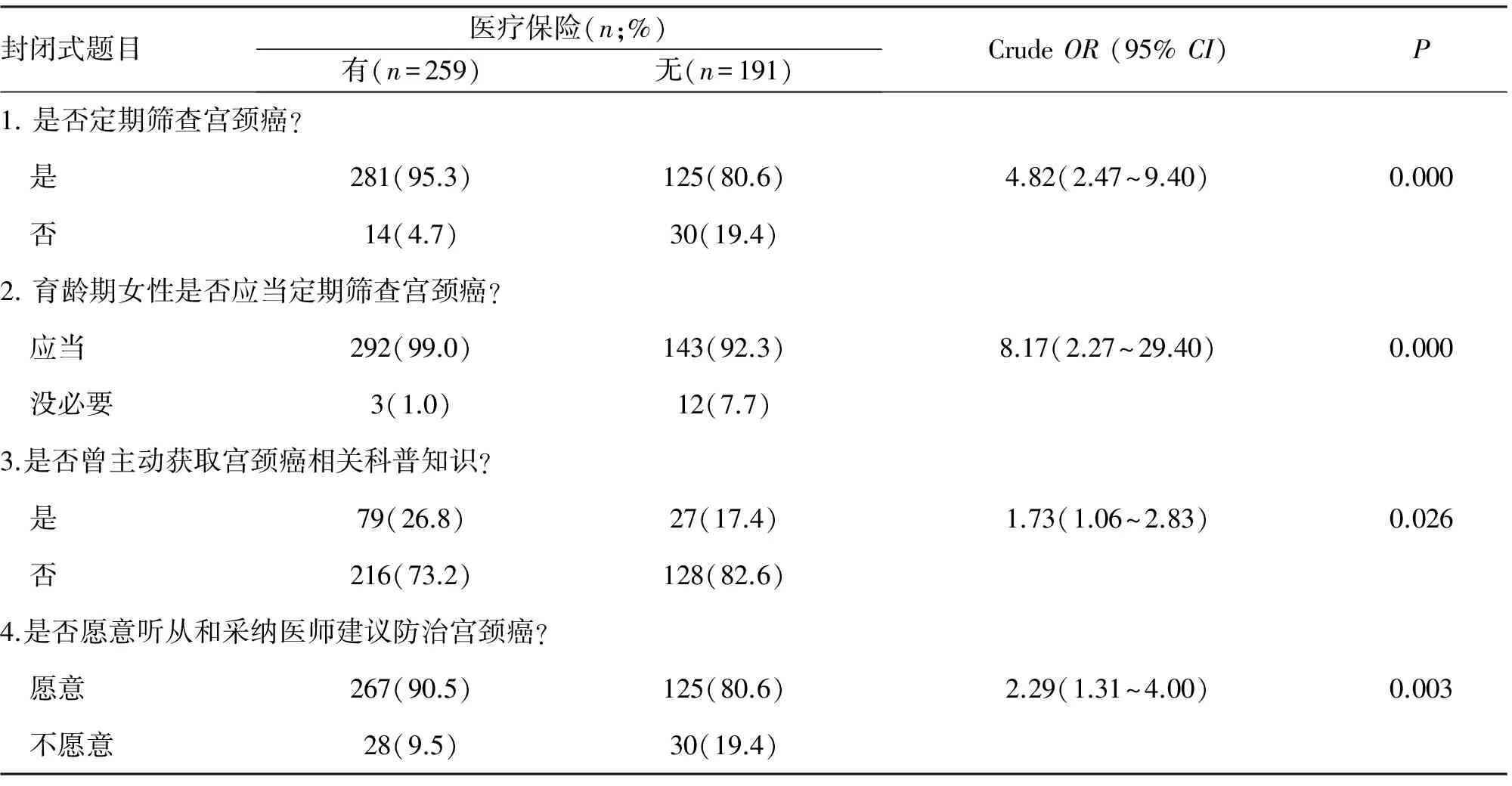
表3 医疗保险与患者筛查宫颈癌依从性的相关性分析
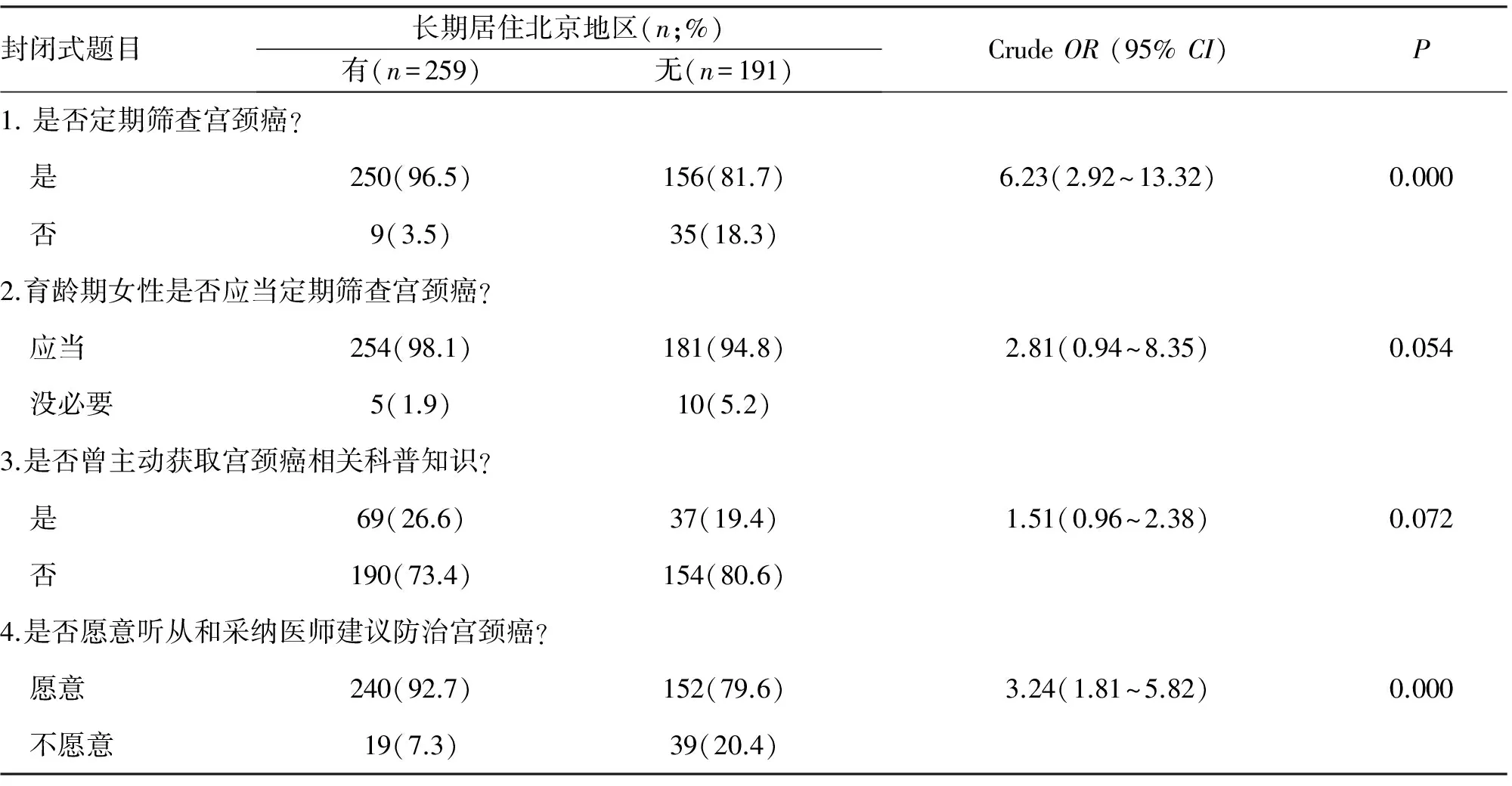
表4 长期居住地与患者筛查宫颈癌依从性的相关性分析
3 讨 论
3.1 提高危险因素认知程度,降低宫颈癌发病率和病死率 健康人群缺乏对宫颈疾病的了解和对筛查必要性的认知,被认为是妨碍宫颈癌筛查项目实施最主要的因素[10, 11],并在某种程度上导致疾病发展到晚期阶段[12, 13]。因此,有理由相信通过提高患者对宫颈癌的认知程度,降低危险因素的影响,能够控制HPV感染的流行,从而降低宫颈癌的发病率和病死率。
HPV感染是宫颈癌患病最主要的危险因素,超过90%的宫颈癌患者曾经感染HPV[14],但大部分感染为一过性,不会进展成癌症[15, 16]。不同国家和地区人群对HPV导致宫颈癌的认知程度差异较大。研究报道乌干达82%的研究对象[17]、摩洛哥4.2%[18]、印度6.5%[19]及76.4%的美国西班牙裔或拉丁美洲人[20]对HPV的致癌性有所了解。本研究数据为71.1%,忽略地区差异认知度总体较高。其他多种危险因素包括个人不良卫生习惯、吸烟、多个性伴侣及过早初次性行为等[21-23]。研究报道显示中低收入国家人群对于这些危险因素的认知程度并不乐观。在一项印度的研究中,仅有26.9%的研究对象认为多个性伴侣是宫颈癌危险因素[24]。关于多次阴道分娩,其危险性普遍被低估,撒哈拉以南的非洲地区,仅48.6%的研究对象认同多产是宫颈癌的危险因素[17]。而在肯尼亚地区,多产及过早初次性行为不被视为危险因素[25]。吸烟增加HPV感染风险,宫颈病变的发病风险也随之升高。Mzarico等[26]报道,每日吸烟的数量越大,疾病发生的风险越高。本研究中,研究对象对吸烟增加宫颈癌患病风险的认同比例最低。由此可见,无论在北京地区还是周边地区,研究对象对于除HPV之外的危险因素认知程度均不足。过度关注HPV感染可能会导致不必要的恐慌和过度治疗[27],对其他危险因素认知不足可能会影响预防HPV感染措施的实际效果。
分组研究发现,患者的认知程度北京地区高于周边地区,并受到有无医疗保险的影响。其客观方面原因为北京地区教育水平较高,医保覆盖面广,因此健康教育和体检普及率高。主观原因可能存在自我服务偏倚,如多产在周边地区较为常见,其危险性被主观否定,而北京地区以独生子女为主,自我服务偏倚较小,因此出现认知程度的地区差异。
3.2 改善依从性影响因素,促进宫颈癌预防 在做依从性多因素分析时,研究对象呈现整体依从性较好。独立影响因素包括文化程度、有无医疗保险和长期居住地,文化程度是最主要的影响因素。既往研究发现,良好的教育程度和职业对宫颈癌筛查的认知程度具有重要影响[7,19],与本研究结果一致。患者文化程度越高,越会主动地获取疾病相关知识,从而提高自身对疾病的认知程度,进而更加主动地接受宫颈癌筛查。有医保的患者个人医疗负担较轻,同时具备较好的健康意识,参与筛查的主动性高,表现在赞同定期接受疾病筛查和愿意遵循医嘱。北京地区患者的文化程度和医保覆盖率高于周边地区,因此依从性显示出地区差异。
本研究中,非京地区患者高级别宫颈病变和宫颈癌的患病率显著高于北京地区(48.7%vs35.2%,χ2=8.22,P=0.004,OR=1.75,95%CI:1.20~2.57)。从不同地区患者的年龄构成进一步分析,北京地区30~39岁年龄组比例最高,并且随年龄增加,人数比例逐渐下降;周边地区比例最高的年龄段为40~49岁组。宫颈上皮内瘤变的好发年龄为25~35岁,也有报道为30~34岁,而我国宫颈癌好发年龄为40~50岁,越晚开始筛查,发生高级别宫颈上皮内瘤变和宫颈癌的风险越大。因此更加说明普及宫颈健康知识和宫颈癌筛查服务,对于疾病防控至关重要。
综上所述,宫颈癌高危患者对HPV感染的认知度较好,而对其他多种危险因素认知度不足。认知度存在地区差异并受到有无医疗保险的影响。研究对象对宫颈癌筛查的依从性较好。文化程度是依从性最主要的独立影响因素。普及宫颈健康知识,扩大医保覆盖面,推广宫颈癌筛查服务,有助于提高对疾病的认知程度,减低致病因素的危险性,促进接受筛查的主动性与依从性,从而达到防控疾病的目的。
本研究尚存在一定局限性。首先,研究对象为经过初筛的宫颈癌高危人群,分析结果不能反映健康人群的认知程度;第二,封闭式结构的问卷内容和访问式调查方法可能有提示作用而高估认知程度。有待扩大样本量进一步研究。
[1] Sogukpinar N, Saydam B K, Can H O,etal. Assessment of cervical cancer risk in women between 15 and 49 years of age: case of Izmir[J]. Asian Pac J Cancer Prev, 2013, 14(3):2119-2125.
[2] Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012[J]. CA:Cancer J. Clin, 2012, 62(1):10-29.
[3] Feldman S. Making sense of the new cervical-cancer screening guidelines[J]. N Engl J Med, 2011, 365(23):2145-2147.
[4] Alhamany Z, El Mzibri M, Kharbach A,etal. Prevalence of human papillomavirus genotype among Moroccan women during a local screening program[J]. J Infect Dev Ctries, 2010, 4(11):732-739.
[5] Ferlay J, Shin HR, Bray F,etal. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. Int J Cancer, 2010, 127(12):2893-2917.
[6] Arbyn M, Castellsague X, de Sanjose S,etal. Worldwide burden of cervical cancer in 2008[J]. Ann Oncol, 2011, 22(12):2675-2686.
[7] Simayi D, Yang L, Li F,etal. Implementing a cervical cancer awareness program in low- income settings in Western China: a community-based locally affordable intervention for risk reduction[J]. Asian Pac J Cancer Prev, 2013, 14(12):7459-7466.
[8] Kahesa C, Kjaer S, Mwaiselage J,etal. Determinants of acceptance of cervical cancer screening in Dar es Salaam, Tanzania[J]. BMC PUBLIC HEALTH, 2012, 12:1093.
[9] Jayant K, Rao R S, Nene B M,etal. Improved stage at diagnosis of cervical cancer with increased cancer awareness in a rural Indian population[J]. Int J Cancer, 1995, 63(2):161-163.
[10] Hyacinth H I, Adekeye O A, Ibeh J N,etal. Cervical cancer and pap smear awareness and utilization of pap smear test among Federal civil servants in North Central Nigeria[J]. PLoS One, 2012, 7(10):e46583.
[11] Basu P, Hassan S, Fileeshia F,etal. Knowledge, attitude and practices of women in maldives related to the risk factors, prevention and early detection of cervical cancer[J]. Asian Pac J Cancer Prev, 2014, 15(16):6691-6695.
[12] Nwankwo K C, Aniebue U U, Aguwa E N,etal. Knowledge attitudes and practices of cervical cancer screening among urban and rural Nigerian women: a call for education and mass screening[J]. Eur J Cancer Care, 2011, 20(3):362-367.
[13] World Health Organization. Comprehensive Cervical Cancer Control: A Guide to Essential Practice[M]. 2nd edition. Geneva: World Health Organization, 2014:77-95.
[14] Elmi A A, Bansal D, Acharya A,etal. Human Papillomavirus (HPV) Infection: Molecular Epidemiology, Genotyping, Seroprevalence and Associated Risk Factors among Arab Women in Qatar[J]. PLoS One, 2017, 12(1):e0169197.
[15] McGuire S. World Cancer Report 2014. Geneva, Switzerland: World Health Organization, International Agency for Research on Cancer, WHO Press, 2015[J]. Adv Nutr, 2016, 7(2):418-419.
[16] Dunne E F, Park I U.HPV and HPV-associated diseases[J].Infect Dis Clin North Am, 2013, 27(4):765-778.
[17] Mwaka A D, Orach C G, Were E M,etal. Awareness of cervical cancer risk factors and symptoms: cross-sectional community survey in post-conflict northern Uganda[J].Health Expect,2016, 19(4):854-867.
[18] Mouallif M, Bowyer H L, Festali S,etal. Cervical cancer and HPV: Awareness and vaccine acceptability among parents in Morocco[J]. Vaccine, 2014, 32(3):409-416.
[19] Siddharthar J, Rajkumar B, Deivasigamani K. Knowledge, Awareness and Prevention of Cervical Cancer among Women Attending a Tertiary Care Hospital in Puducherry, India[J]. J Clin Diagn Res, 2014, 8(6):OC01-03.
[20] Bodson J, Warner E L, Kepka D. Moderate Awareness and Limited Knowledge Relating to Cervical Cancer, HPV, and the HPV Vaccine Among Hispanics/Latinos in Utah[J]. Health Promot Pract, 2016, 17(4):548-556.
[21] Zhang Q, Xie W, Wang F,etal. Epidemiological Investigation and Risk Factors for Cervical Lesions: Cervical Cancer Screening Among Women in Rural Areas of Henan Province China[J]. Med Sci Monit, 2016, 22:1858-1865.
[22] Liu Z C, Liu W D, Liu Y H,etal. Multiple Sexual Partners as a Potential Independent Risk Factor for Cervical Cancer: a Meta-analysis of Epidemiological Studies[J].Asian Pac J Cancer Prev,2015, 16(9):3893-3900.
[23] Edelstein Z R, Madeleine M M, Hughes J P,etal. Age of diagnosis of squamous cell cervical carcinoma and early sexual experience[J]. Cancer Epidemiol Biomarkers Prev, 2009, 18(4):1070-1076.
[24] Shankar A, Rath G K, Roy S,etal. Level of Awareness of Cervical and Breast Cancer Risk Factors and Safe Practices among College Teachers of Different States in India: Do Awareness Programmes Have an Impact on Adoption of Safe Practices?[J].Asian Pac J Cancer Prev, 2015, 16(3):927-932.
[25] Gatune J W, Nyamongo I K. An ethnographic study of cervical cancer among women in rural Kenya: is there a folk causal model?[J].Int J Gynecol Cancer, 2005, 15(6):1049-1059.
[26] Mzarico E, Gomez-Roig M D, Guirado L,etal. Relationship between smoking, HPV infection, and risk of Cervical cancer[J]. Eur J of Gynaecol Oncol, 2015, 36(6):677-680.
[27] U.S. Preventive Services Task Force. Screening for cervical cancer: recommendation statement[J]. Am Fam Physician, 2012, 86(6):555-559.
Levelsofknowledgeofandcompliancewithcervicalcancerscreening:across-sectionalstudyofhigh-riskpatients
DU Xinxin, ZHANG Yun, FU Xiaoyu, LI li’an,and MENG Yuanguang.
Department of Obstetrics and Gynecology, Chinese PLA General Hospital, Beijing 100853, China
ObjectiveTo assess the amount of knowledge of risk factors for cervical cancer, compliance with screening and influencing factors among high-risk patients.MethodsFour hundred and fifty consecutive patients aged 21 to 65 were involved. Data collection took place between October 2014 and June 2015. Participants were divided into four groups: those living in Beijing with health care insurance(group 1), those living in Beijing without health care insurance(group 2), those living in peripheral areas of Beijing with health care insurance(group 3), and those living in peripheral areas without health care insurance(group 4). Enclosed questionnaires were adopted. ANOVA and multivariate logistic regression were used for data analysis.ResultsSix risk factors of cervical cancer were identified: HR-HPV infection, multiple sexual partners, early-onset of sexual activity, partners with penis carcinoma, cigarette smoking and multiple vaginal deliveries. The awareness rate of the six risk factors was 71.1%, 38.9%, 18.7%, 22.0%,13.6% and 18.2%, respectively. 90.2% of the participants were regularly screened for cervical carcinoma, 96.7% agreed to regular cervical carcinoma screening, and 87.1% would like to follow the professional advice about cervical cancer prevention. Education levels, health care insurance and places of residence were correlated with compliance with cervical cancer screening (P<0.05).ConclusionsThe awareness of HPV infections is satisfactory while the rate of awareness of other risk factors is generally low in this study. Participants have good compliance with cervical cancer screening. Education levels, health insurance and places of residence are the main influencing factors. Knowledge of the disease should be popularized and health insurance coverage expanded.
cervical cancer; risk factors; awareness; compliance
解放军总医院临床科研扶持基金(2013FC-ZHCG-1005)
杜欣欣,博士,主治医师。
100853 北京,解放军总医院妇产科
孟元光,E-mail:meng6512@vip.sina.com
R711.74
(2017-06-10收稿 2017-07-15修回)
(责任编辑 岳建华)
