借助有机溶剂的铜与硝酸反应实验创新设计
2017-11-11浙江省台州市路桥中学318050
浙江省台州市路桥中学(318050)
王宇浩
借助有机溶剂的铜与硝酸反应实验创新设计
浙江省台州市路桥中学(318050)
王宇浩
1 实验仪器
具支试管、玻璃导管、橡胶管、试管。
2 实验药品
螺旋状铜丝、浓硝酸(15 mol/L)、稀硝酸(6 mol/L)、苯、40%NaOH溶液。
3 演示实验
3.1 演示铜与浓硝酸反应
实验步骤:在如图1所示的具支试管中加入2 mL浓硝酸和2 mL苯,塞上插有螺旋状铜丝的橡皮塞,并使铜丝与浓硝酸充分接触。
实验现象:铜丝与浓硝酸剧烈反应,溶液变为蓝色,产生大量气泡往上冒,无色的苯很快变为红棕色。当液面上方的空气开始变红时,立即将铜丝往上拉,使之脱离浓硝酸,右侧试管中的NaOH溶液被倒吸入具支试管中。
优点:铜与浓硝酸反应剧烈,产生的NO2气体很容易外逸到大气中造成污染。本实验先用苯吸收NO2气体,减少了NO2气体的外逸,又不影响实验效果。
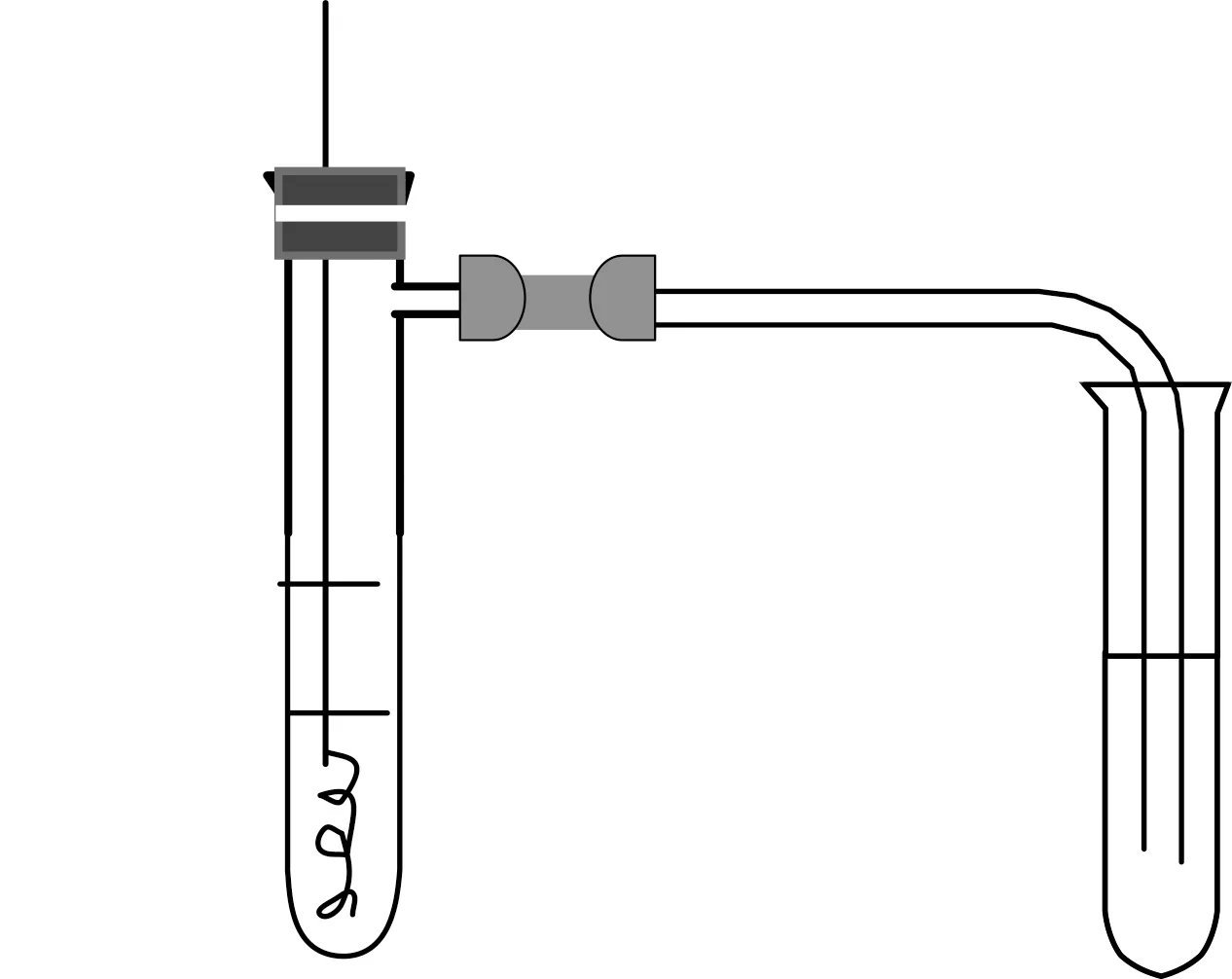
图1 实验装置图
3.2 演示铜与稀硝酸反应
实验步骤:在如图1所示的具支试管中加入2 mL稀硝酸和2 mL苯,塞上插有螺旋状铜丝的橡皮塞,使铜丝与稀硝酸充分接触。
实验现象:铜丝与稀硝酸缓慢反应,溶液变为蓝色,产生气泡往上冒,苯一直为无色,慢慢地液面上方的空气开始变红,此时将铜丝往上拉,使之脱离稀硝酸,右侧试管中的NaOH溶液被倒吸入具支试管中。
优点:铜与稀硝酸反应产生的NO接触空气很容易变为红棕色,本实验让产生的气体先经过苯,从苯一直保持无色证明无NO2生成,而生成的气体接触氧气变红棕色证明产生的气体为NO。
4 创新设计的意义
前人在铜与硝酸反应的实验设计已经作了大量的研究。铜与浓硝酸反应现象明显,对于产生的气体的处理基本上是通入氢氧化钠溶液进行吸收。但当产生的气体较多时,往往来不及充分吸收而导致气体外逸。本实验采用有机溶剂先溶解部分的NO2和NO,当观察到实验现象后,拉出铜丝,让NaOH溶液倒吸入反应装置中实现对尾气的吸收处理。对铜与对稀硝酸的反应不需要赶走装置中的空气即可实现对产物的观察和检验,操作简单,现象明显。
实验改进
2017-07-30
