氢氧化亚铁制备的简单化改进
2017-11-11湖北省应城市第一高级中学432400
湖北省应城市第一高级中学(432400)
邢泰宇
实验改进
氢氧化亚铁制备的简单化改进
湖北省应城市第一高级中学(432400)
邢泰宇
1 问题的提出
人教版高中化学必修1教材中将FeSO4溶液加入到NaOH溶液中制备氢氧化亚铁,观察到生成的白色絮状沉淀迅速变成灰绿色,最后变成红褐色。实验中通常都会出现灰绿色,很难观察到白色沉淀,不少学者对该过程开展了研究,提出了如下几种观点:①FeSO4溶液中含有Fe3+对实验有影响;②溶液中溶解氧使得形成的沉淀是Fe(OH)2、Fe(OH)3等的混合物及其水合物;③Fe(OH)2沉淀吸附了过量的Fe2+而使沉淀变成灰绿色。
鉴于以上观点,有如图1所示的几种常见实验改进装置。(a)图采用油封及长滴管滴加液体法,(b)图采用在还原性氛围中制备法,(c)图采用油封及铁做阳极电解法等。但实验时(a)图观察到白色沉淀的时间较短,甚至有时观察不到白色沉淀,(b)图对装置气密性的要求较高,(b)(c)图装置略显复杂,课堂演示时间较长,学生分组实验操作较难。
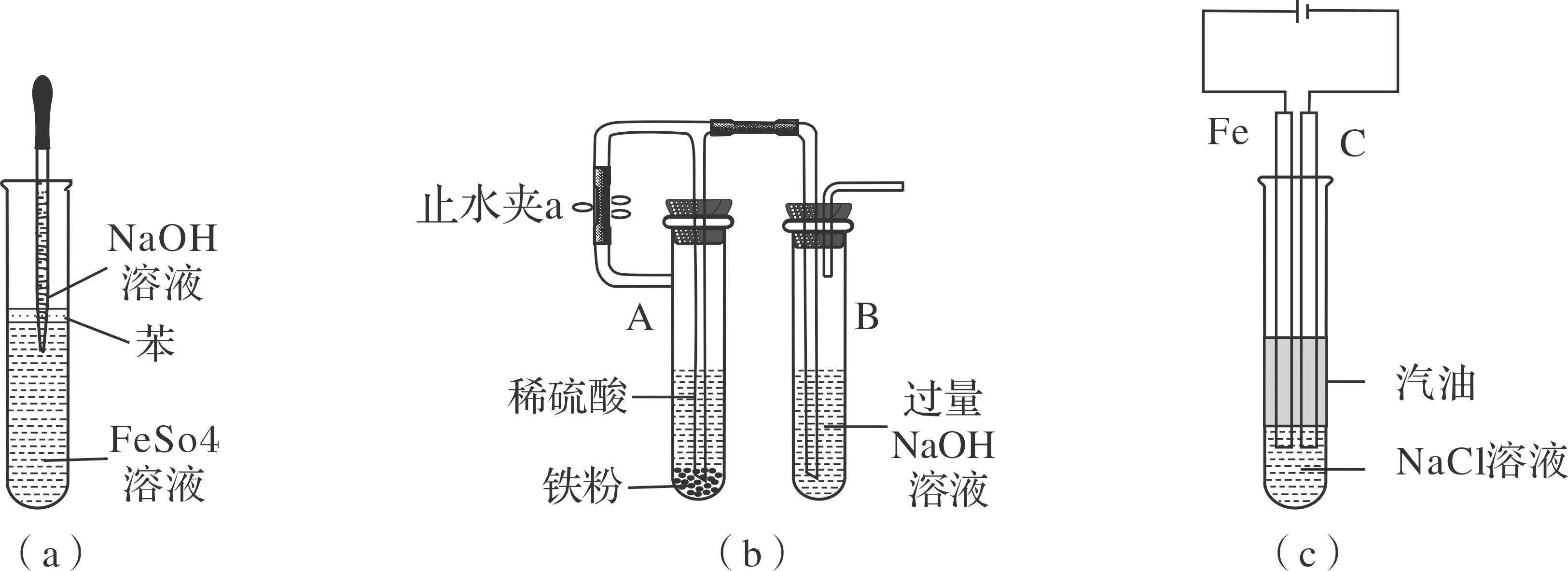
图1 各种氢氧化亚铁制备改进装置
如上种种,亟待寻找一种满足中学化学课堂教学现状的实验方案。
2 氢氧化亚铁制备的简单化改进
2.1 实验用品
药品:还原铁粉(分析纯)、硫酸(分析纯)、氢氧化钠(分析纯)。
仪器:锥形瓶、试管、长胶头滴管、扎有小孔的气球。
2.2 实验过程
(1)新制FeSO4溶液:在洁净的锥形瓶中加入足量还原铁粉(分析纯),再加入适量用硫酸(分析纯度)配制的稀溶液,将锥形瓶口用扎有小孔的气球套紧,也可以不使用气球,如图2(a)(b)所示,静置5~12 h待用(可在实验前一天配制)。

图2 氢氧化亚铁制备的简单化改进装置
(2)配制较浓的NaOH溶液:将氢氧化钠(分析纯度)溶于蒸馏水配制较浓的NaOH溶液待用,蒸馏水和较浓NaOH溶液可不用加热煮沸处理。
(3)实验操作:捏紧长胶头滴管的胶头,赶出其中空气,用其吸取一定量的新制FeSO4溶液中的清液,然后将滴管插入过量较浓的NaOH溶液的液面下,如图2(c)所示,挤压胶头滴管,滴加FeSO4溶液即可。
2.3 实验现象
产生白色沉淀,白色沉淀持续时间为5~10 min左右。振荡试管,可观察到白色沉淀变成灰绿色,最后变成红褐色。
3 实验设计意图
(1)药品、仪器的使用符合中学化学实验室的要求。还原铁粉、硫酸、氢氧化钠、锥形瓶、长胶头滴管等器材中学实验室中都有,不需要特殊药品和仪器,并且试剂用量较少,节约药品,尤其是FeSO4溶液每次实验只需要几滴,便于开展学生分组实验。
(2)FeSO4溶液可在实验课前5~12 h配制,NaOH溶液可在实验课前几分钟配制,二者反应时灵敏迅速,可节约教师课堂演示实验或学生分组实验的时间。
(3)锥形瓶口径小,与空气接触面积小,加之里面有氢气不断溢出,减少了空气的进入,使得体系内的溶解氧达到最小程度。锥形瓶瓶口用扎有小孔的气球套紧,也可进一步减少空气的进入。另外,将长胶头滴管插入较浓的NaOH溶液的液面下滴加FeSO4溶液,这样操作可减少滴加试剂过程中氧气的再溶入。
(4)采用过量还原铁粉与稀硫酸新制备FeSO4溶液,保证体系内几乎无Fe3+存在,排除其对实验的干扰。
(5)将少量新制FeSO4溶液滴加到过量的较浓的NaOH溶液中(与人教版高中化学必修1教材实验顺序相反),保证Fe2+充分反应,避免Fe(OH)2沉淀吸附Fe2+等有色离子,排除其对实验现象的干扰。
2017-08-02
