顶空气相色谱- 质谱联用法分析两种玉兰花挥发性成分
2017-11-10李晓颍曹翠玲武军凯刘建珍潘玉霞井立军王子华
李晓颍, 曹翠玲, 武军凯, 刘建珍, 潘玉霞, 井立军, 王子华
(1.河北科技师范学院 园艺科技学院, 河北 秦皇岛 066600;2.秦皇岛出入境检验检疫局, 河北 秦皇岛 066004)

顶空气相色谱-质谱联用法分析两种玉兰花挥发性成分
李晓颍1, 曹翠玲2, 武军凯1, 刘建珍1, 潘玉霞1, 井立军1, 王子华1
(1.河北科技师范学院 园艺科技学院, 河北 秦皇岛 066600;2.秦皇岛出入境检验检疫局, 河北 秦皇岛 066004)
采用顶空/气相色谱- 质谱法分析了白玉兰花和紫玉兰花挥发性成分,结合自动解卷积鉴定系统软件和NIST11质谱数据库,分别鉴定出71种和56种挥发物。其中,41种挥发物为两者共有,分别占挥发物总量的99.25%和96.45%,表明2种玉兰挥发性成分具有明显的一致性,而特有挥发性化合物分别为30种和15种。两种玉兰花挥发性成分均以萜类为主,分别为59种和43种,分别占93.28%和89.19%,属单萜、倍半萜及其含氧衍生物,其中质量分数大于2%且为两种玉兰所共有的9种挥发物分别为β-月桂烯(7.45%,19.04%)、β-蒎烯(18.07%,16.50%)、α-蒎烯(11.38%,16.01%)、桉叶油素(18.09%,14.58%)、邻伞花烃(5.08%,6.55%)、d-柠檬烯(5.14%,5.71%)、γ-松油烯(6.83%,3.19%)、香桧烯(14.06%,2.57%)、α-松油烯(5.10%,2.50%),含量差别较为明显。从挥发物总量来看,白玉兰花接近紫玉兰花的8倍,具有显著差别。
玉兰花; 挥发性成分; 顶空进样; 气质联用技术
玉兰属YulaniaSpach为木兰科Magnolia重要的分类群之一[1],此树种在我国有2000多年的栽培与药用历史。常见的玉兰有白玉兰、紫玉兰和广玉兰等,其树种花蕾入药,通称辛夷,是我国传统出口中药材之一。此外,玉兰也是重要的园林观赏植物和食材。玉兰花朵硕大,资源丰富,近年来对其化学成分及药理等方面的研究者渐多[2-9]。
了解玉兰花特征挥发性成分有利于保持其相应开发产品的固有特征香味及品质,提高玉兰属植物的经济附加值,充分利用玉兰属丰富的植物资源。
顶空/气相色谱- 质谱联用(headspace sampling-gas chromatography-mass spectrometry, HS/GC-MS)具有样品前处理简单、准确完整保持样品信息和不受非挥发性物质干扰的优点[10-13]。本文采用静态顶空进样/气相色谱- 质谱联用技术结合自动解卷积鉴定系统(automatic mass spectral deconvolution and identification system, AMDIS)软件和NIST11质谱数据库分别对白玉兰花和紫玉兰花挥发性成分进行了鉴定,并采用面积归一化法对挥发性化合物的相对含量进行了测定。
1 材料与方法
1.1 实验材料
白玉兰花和紫玉兰花均采自河北科技师范学院校园绿化带,为避免玉兰花香气成分变化,采摘时间为玉兰花盛花期3~5 d。
1.2 仪器与设备
7890A- 5975C型气质联用仪,配有7697A型顶空进样器、自动质谱解卷积鉴定系统(AMDIS)、NIST11谱库检索系统,安捷伦科技有限公司(美国)。
1.3 分析方法
1.3.1顶空条件
平衡温度90 ℃,定量环温度100 ℃,传输线温度110 ℃,样品瓶平衡时间20 min,压力平衡时间0.1 min,进样时间0.5 min,进样体积1 mL。
1.3.2色谱条件
HP- 225石英弹性毛细管柱(30.0 m×250 μm×0.25 μm),载气为He(99.999%),分流比为20∶1,流量1.0 mL/min,进样口温度230 ℃,起始温度为40 ℃,保持3 min,以10 ℃/min升至180 ℃,保持3 min,再以10 ℃/min升至200 ℃,保持2 min。
1.3.3质谱条件
EI源电压70 eV,离子源温度为230 ℃,接口温度250 ℃,四级杆温度150 ℃,质量扫描范围为m/z 30~500 u。
1.4 样品处理
取新鲜玉兰花朵2 g剪碎后置于20 mL顶空进样瓶中,硅胶垫密封,铝盖封口,放入自动顶空进样仪中进行测定,两种玉兰花均在相同条件下平行测定3次。
零件特征实际加工尺寸偏离理想尺寸,使零件在使用时对使用者产生不利影响,这种影响用质量损失量化、用质量损失成本进行成本度量。质量损失成本是质量损失函数的数学期望,质量损失函数分为望大、望目和望小3种情况。本文讨论零件特征的尺寸特性,采用望目质量损失函数L(x)和望目质量损失函数下的质量损失成本函数。
1.5 数据处理
玉兰花样品经顶空进样器平衡后,在最佳分离条件下进行GC-MS分离检测,采用自动质谱解卷积鉴定系统、NIST11谱库检索系统进行数据分析,并对扣除背景干扰后所得的谱图进行人工核对和补充检索,该分析过程提高了化合物鉴定准确度,增加了化合物鉴定数量。实验采用面积归一化法计算各组分的相对含量。
2 结果与分析
2.1 2种玉兰花挥发性成分组成与含量
2种玉兰花香气成分总离子流色谱图如图1和图2,经由化学工作站MSD Chemstation数据处理系统,按峰面积归一化法确定了各组分相对质量分数,定性定量分析结果列于表 1。
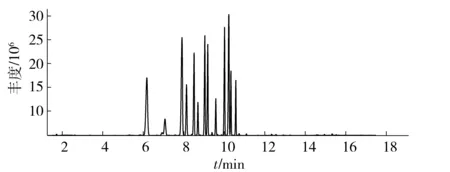
图1 白玉兰花挥发性成分总离子流色谱图Fig.1 Total ion chromatogram of volatile components of Michelia alba DC. by HS/GC-MS

图2 紫玉兰花挥发性成分总离子流色谱图Fig.2 Total ion chromatogram of volatile components of Magnolia liliiflora Desr. by HS/GC-MS

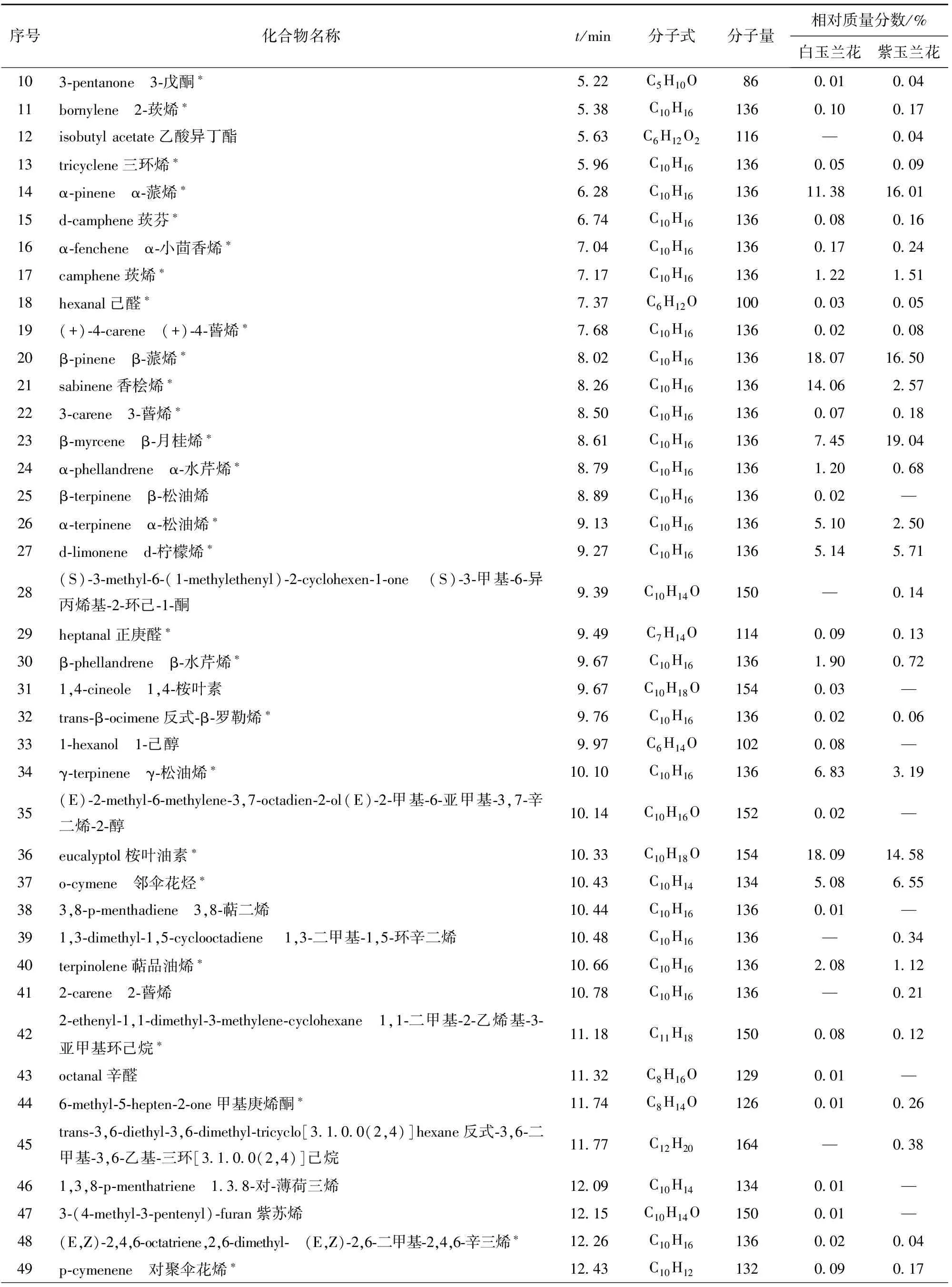
表1 2种玉兰花主要挥发性成分及相对含量
续表1

续表1
* 表示2种玉兰花所共有;— 表示未检出。
2种玉兰花通过GC-MS分析,从总离子流图可以看出,样品挥发性成分得到了很好分离。所有化合物的质谱图均采用AMDIS解卷积处理及NIST11质谱库匹配分析,质谱匹配度大于等于80的化合物被列入分析范围内,且匹配度最高的化合物被用于研究。按照上述方法,实验从白玉兰花和紫玉兰花中分别鉴定出71种和56种挥发性成分,占挥发性物质总量的99.88%和99.74%,其中有41种物质均存在于2种玉兰花挥发性成分中,占挥发物总量的99.25%和96.45%,说明2种玉兰花的挥发性成分具有明显的一致性,详见表1。检出的挥发性成分主要包含烃类、醇类、 酮类、 醛类,还有少量的酯类、氧化物和杂环类化合物,表2为2种玉兰花挥发性物质种类、数量及相对含量。
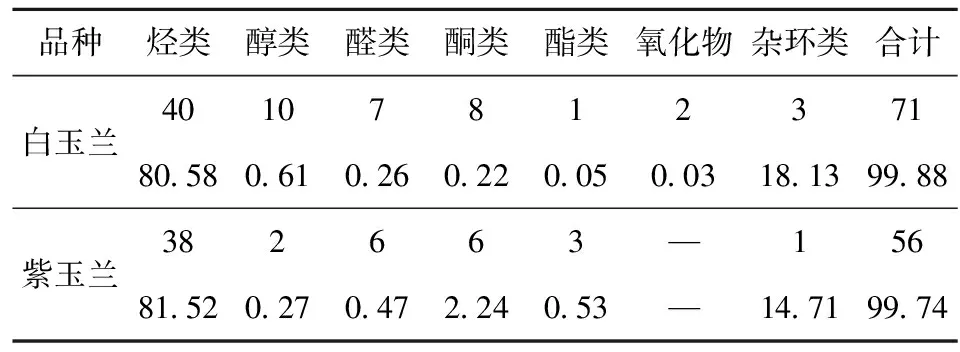
表2 2种玉兰花挥发性成分类型及含量
—表示未检测到。
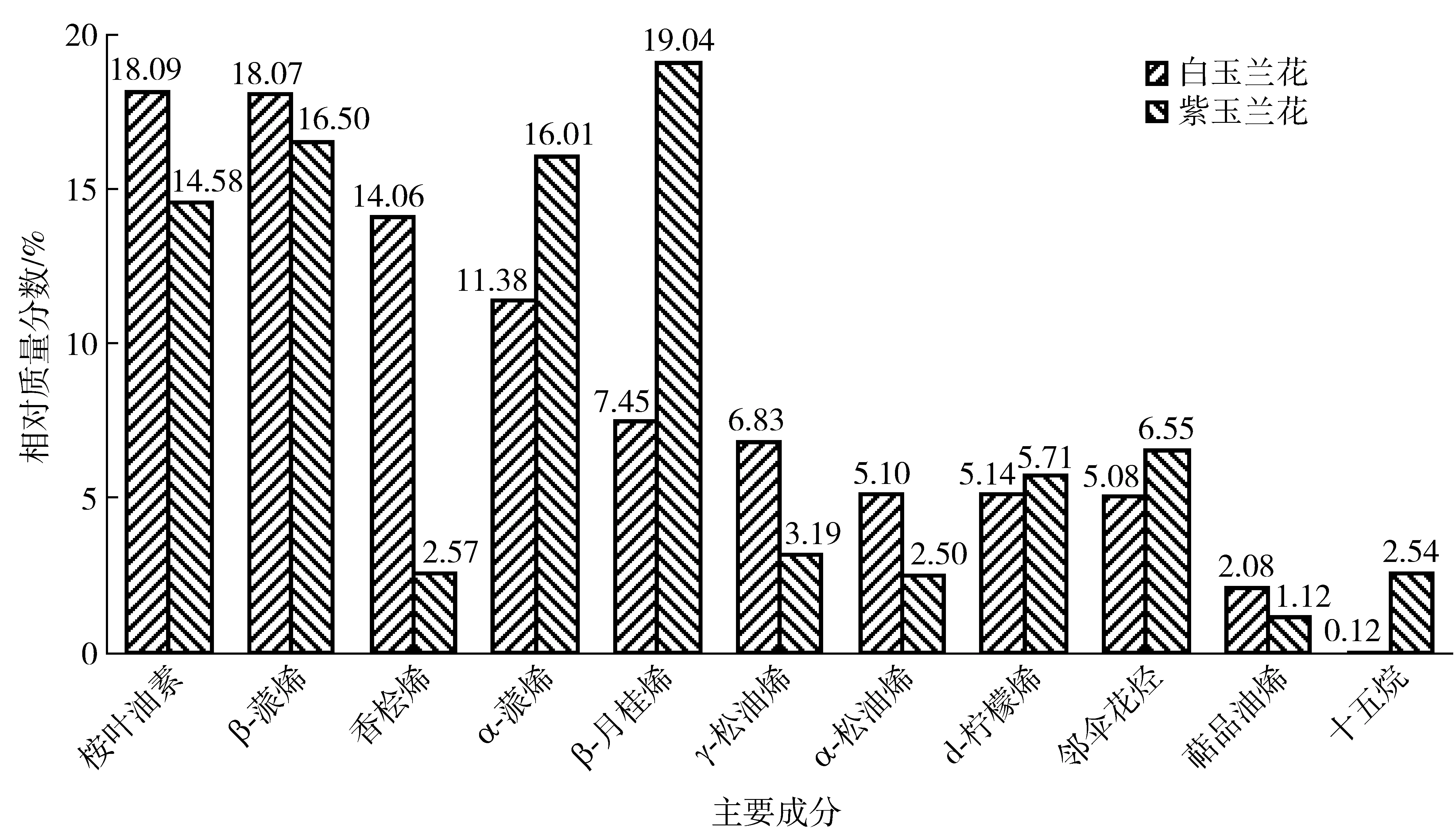
图3 2种玉兰花10种主要成分相对含量比较Fig.3 Contents difference of 10 volatile components in two kinds of Magnolia
2.2 2种玉兰花主要挥发性成分分析
从白玉兰花挥发性成分中鉴定出的71种物质主要是烃类、醇类、酮类和醛类, 氧化物、酯类和杂环化合物的种类数较少。相对质量分数大于2%的10种物质由高到低分别是桉叶油素(18.09%)、β-蒎烯(18.07%)、香桧烯(14.06%)、α-蒎烯(11.38%)、β-月桂烯(7.45%)、γ-松油烯(6.83%)、α-松油烯(5.10%)、d-柠檬烯(5.14%)、邻伞花烃(5.08%)、萜品油烯(2.08%),占挥发物总量的93.28%。在紫玉兰花挥发性成分中鉴定出的56种物质主要是烃类、酮类和醛类,醇类、酯类和杂环化合物的种类数较少。相对质量分数大于2%的物质也是10种,由高到低分别是β-月桂烯(19.04%)、β-蒎烯(16.50%)、α-蒎烯(16.01%)、桉叶油素(14.58%)、邻伞花烃(6.55%)、d-柠檬烯(5.71%)、γ-松油烯(3.19%)、香桧烯(2.57%)、α-松油烯(2.50%)、十五烷(2.54%),占挥发物总量的89.19%。
2种玉兰花挥发性成分均以萜类化合物为主,主要包括单萜、倍半萜及其含氧衍生物,还有少量脂肪族化合物,与之前有关玉兰挥发物的报道一致[14-18]。本次实验,白玉兰花检出59种萜类化合物,紫玉兰检出43种萜类化合物,分别占检出挥发物种类的83.10%和76.79%,而相对质量分数则分别占到99.39%和94.53%,见表3。
萜类化合物是植物中广泛存在的一类代谢产物,在植物生长、发育过程中起重要作用,而且具有重要的商业价值,被广泛用于工业、医药卫生等领域[19-20]。近年来,随着分子生物学的发展,萜类化合物成为植物次生代谢研究领域的热点之一。
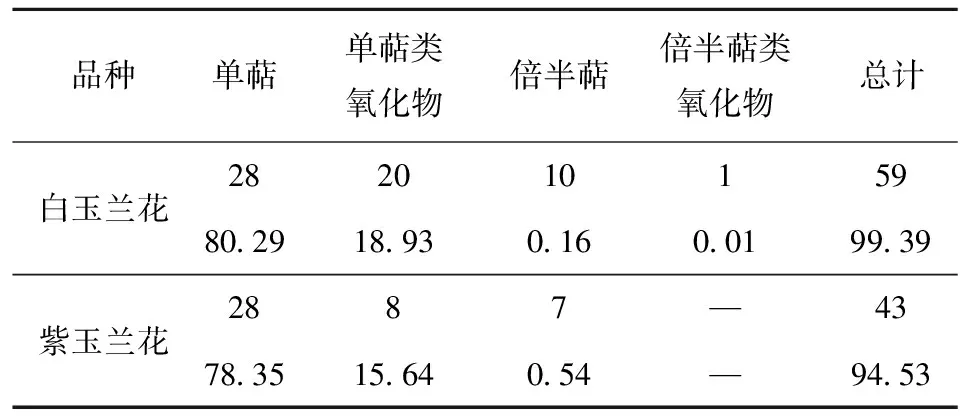
表3 萜类化合物种类及相对质量分数
—表示未检测到。
2.3 主要挥发物作用及相关应用
本次实验在两种玉兰花中检出的相对质量分数大于2%且同时存在的9种挥发物均为萜类化合物。其中,β-月桂烯、β-蒎烯、α-蒎烯、邻伞花烃、d-柠檬烯、γ-松油烯、香桧烯、α-松油烯为单萜类化合物,桉叶油素为单萜类氧化物。
参考相关文献,β-月桂烯是一种化学性质活泼的天然产物[21],也是合成萜烯类合成香料如香叶醇、芳樟醇、新铃兰醛、柑青醛等香料的重要原料。α-蒎烯和β-蒎烯是松节油的主要化学成分[22],α-蒎烯有松木、针叶及树脂样的气息,香气透发,用于合成松油醇、芳樟醇以及一些檀香型香料,具有明显的镇咳和祛痰功能及抗真菌效应。β-蒎烯主要用作各种萜烯类合成香料的起始原料,用于制造柠檬醛、香茅醇、羟基香茅醛、香叶醇、芳樟醇、紫罗兰酮、甲基紫罗兰酮、薄荷醇等合成香料,是合成β-蒎烯树脂和生产维生素E等的重要原料之一。伞花烃是重要的有机合成中间体,广泛用于制造魔香、药物、消毒剂、有机溶剂和食品添加剂等。柠檬烯是一种天然的功能单萜, 在食品中作为香精香料添加剂被广泛使用,具有多种生理作用,抗癌活性明显[23]。松油烯一般作为香料合成的中间体使用,α-松油烯可用于调配柠檬、薄荷香精。γ-松油烯可用于调配白柠檬、圆柚、柑橘、药草、芒果等食用香精。桉叶油素为常见挥发油有效成分,主要分布在桃金娘科、樟科、姜科等植物中,富含在桉叶、樟叶、豆蔻等药材挥发油中,临床具有抗菌消炎、平喘、镇咳祛痰等药理作用,也常用作香料和防腐剂[24]。
其他萜类化合物虽在玉兰花中含量较低,但在植物生命活动中同样起重要作用,在食品工业、药用等方面也具有重要的应用价值。水芹烯可用于食用香料,主要用于配制柑橘类和香辛料类人造精油,还可以直接用于生物活性杀虫剂,在精细化学领域也有独特的应用前景。芳樟醇是家用产品香精和皂用香精配方中使用频率最高的香料品种,也用于配制食用香精,同时芳樟醇有医疗保健的功效,民间自古以来就将含有芳樟醇的挥发油或植物作为催眠和镇静剂加以使用的报道[25]。石竹烯具有局部麻醉、治疗结肠炎、镇咳等作用。苏紫烯主要作为花香型香精的修饰剂,可用于香皂、洗涤剂等日用香精中,也可微量应用于食品香精中。
除萜类化合物外,本实验在两种玉兰花挥发性成分中均检出少量低级脂肪族化合物,包括部分醛、酮和直链烷烃,它们多数具有特征性气味,广泛存在于植物体。以上成分共同构成了两种玉兰花挥发性成分,使其具有浓郁的玉兰花香,并且具有一定的药用和商业价值。
3 结 论
实验通过顶空进样结合气质联用技术,测定了白玉兰花和紫玉兰花的特征性挥发性成分,分别鉴定出71种和56种挥发物,包含烃类、醇类、 酮类、 醛类,还有少量的酯类、氧化物和杂环类化合物,这些挥发性成分共同构成了玉兰花芬芳浓郁的花香。同时存在于两种玉兰花挥发性成分中的物质为41种,占挥发物总量的99.25%和96.45%,这也表明两种玉兰挥发性成分具有明显的一直性,而特有挥发性化合物分别为30种和15种。两种玉兰花挥发性成分均以萜类为主,分别为59种和43种,属单萜、倍半萜及其含氧衍生物,其中质量分数大于2%的9种挥发物均为两种玉兰花所共有,但在含量上仍有明显差别。此外,从挥发物总量来看,白玉兰花接近紫玉兰花的8倍,具有显著差别,这也是两种玉兰花的不同之处的重要体现。从主要萜类成分来看,与相关文献报道一致,多数具有明显的特征性香气,在植物生长、发育过程中起重要作用,被广泛用于工业、医药卫生等领域。通过本次实验对两种玉兰花挥发性成分有了深入了解,也对比了两种玉兰花挥发物之间的差别,对玉兰花进一步开发和利用具有一定指导意义。
[1] 傅大立. 玉兰属的研究[J]. 武汉植物学研究, 2001, 19(3): 191-198.
FU D L. Notes onYulaniaSpach[J]. Journal of Wuhan Botanical Research, 2001, 19(3): 191-198.
[2] 王琪, 李洪玲. 中药辛夷质量标准研究- 比色法测定辛夷中总黄酮的含量[J]. 中草药, 2003, 34(5): 424-425.
[3] 李云贵, 徐望龙, 刘奕训, 等. 玉兰的化学成分及药理活性研究进展[J]. 广州化工, 2013, 41(3): 28-29.
LI Y G, XU W L, LIU Y X, et al. Research advance of chemical constituents and pharmacological activities ofMagnoliadenudataDesr.[J]. Guangzhou Chemical Industry, 2013, 41(3): 28-29.
[4] 赵利琴. 望春玉兰萜类成分及其生物活性研究进展[J]. 时珍国医国药, 2005, 16(4): 298-300.
[5] 刘艳清. 紫玉兰花挥发油化学成分的气相色谱- 质谱分析[J]. 时珍国医国药, 2008, 19(8): 1911-1912.
[6] 陈华国, 杨占南, 赵超, 等. SPME/GC/MS分析荷花玉兰挥发性成分[J]. 光谱实验室, 2010, 27(4): 1440-1442.
CHEN H G, YANG Z N, ZHAO C, et al. Analysis of volatile oil from the flower ofMagnoliagrandifloraby SPME/GC/MS[J]. Chinese Journal of Spectroscopy Laboratory, 2010, 27(4): 1440-1442.
[7] 杜广钊, 白冰, 李慧, 等. 广玉兰叶精油化学成分的GC-MS分析[J]. 湖北农业科学, 2010, 49(7): 1707-1708.
DU G Z,BAI B,LI H, et al. GC-MS analysis of essential oil inMagnoliagrandifloraL.[J]. Hubei Agricultural Sciences, 2010, 49(7): 1707-1708.
[8] FAN Z Q, WANG S B, MU R M, et al. A simple, fast, solvent-free method for the determination of volatile compounds inMagnoliagrandifloraLinn.[J]. Journal of Analytical Chemistry, 2009, 64(3): 289-294.
[9] 张倩, 唐娜娜, 于海林, 等. 广玉兰果实脂肪酸成分的GC-MS分析[J]. 河南大学学报(医学版), 2009, 28(2): 101-103.
ZHANG Q, TANG N N, YU H L, et al. Analysis of fatty acids from fruit ofMagnoliagrandiforeby GC-MS[J]. Journal of Henan University (Medical Science), 2009, 28(2): 101-103.
[10] 张金海. 顶空气相色谱法测定咸鱼中正己醛含量样品前处理条件的优化[J]. 大连海洋大学学报, 2015, 30(2): 216-220.
ZHANG J H. Optimization of pretreatment condition in analysis of hexanal content in salted fish by headspace gas chromatography (GC)[J]. Journal of Dalian Ocean University, 2015, 30(2): 216-220.
[11] 洪华, 王莉, 武中平, 等. 静态顶空气相色谱- 质谱联用法同时测定食品添加剂中9种有机溶剂残留[J]. 食品科学, 2014, 35(18): 167-171.
HONG H , WANG L, WU Z P, et al. Simultaneous determination of 9 residual organic solvents in food additives by static headspace gas chromatography-mass spectrometry[J]. Food Science, 2014, 35(18): 167-171.
[12] FAN W, ALMIRALL J. High-efficiency headspace sampling of volatile organic compounds in explosives using capillary microextraction of volatiles (CMV) coupled to gas chromatography-mass spectrometry (GC-MS)[J]. Analytical and Bioanalytical Chemistry, 2014, 406(8): 2189-2195.
[13] 刘海学, 刘秋娟, 杨志岩. 顶空固相微萃取- 气相色谱法测定黑液中甲醇含量的研究[J]. 中国造纸学报, 2009, 24(1): 104-107.
LIU H X, LIU Q J, YANG Z Y. The application of headspace solid phase-microextraction gas chromatograph for determination of methanol contentin[J]. Black Liquor Transactions of China Pulp and Paper, 2009, 24(1): 104-107.
[14] 汪洪武, 鲁湘鄂, 彭艳霞. 不同季节玉兰花及叶挥发油化学成分的GC-MS分析[J]. 精细化工, 2007, 24(3): 257-260.
WANG H W, LU X E, PENG Y X. Analysis of the essential oils from the flowers and leaves ofMagnoliadenudataDesr. in different seasons by gas chromatography-mass spectrometry[J]. Fine Chemicals, 2007, 24(3): 257-260.
[15] 孙印石, 王建华, 程秀珍, 等. 静态顶空进样气质联用法测定白玉兰花和紫玉兰花的头香成分[J]. 时珍国医国药, 2010, 21(6): 1386-1387.
[16] 许柏球, 栾崇林, 刘莉萍, 等. 顶空固相微萃取- 气相色谱- 质谱法分析玉兰花的挥发性成分[J]. 香料香精化妆品, 2014(3): 1-7.
XU B Q, LUAN C L, LIU L P, et al. Analysis of volatile components inMagnoliaby HS-SPME/GC/MS[J]. Flavour Fragrance Cosmetics, 2014(3): 1-7.
[17] 石磊, 王金梅, 康文艺. HS-SPME-GC-MS分析2种木兰属植物的挥发性成分[J]. 中国中药杂志, 2008, 33(12): 1429-1433.
[18] 赵武, 赵芸玉, 李建霞, 等. 玉兰肉质外种皮挥发性成分与功能的初步研究[J]. 西北植物学报, 2015, 35(6): 1254-1261.
ZHAO W, ZHAO Y Y, LI J X, et al. Preliminary study of volatile components and function of sarcotesta inMagnoliadenudateDesr.[J]. Acta Botanica Boreali-Occidentalia Sinica, 2015, 35(6): 1254-1261.
[19] 占爱瑶, 由香玲, 詹亚光. 植物萜类化合物的生物合成及应用[J]. 生物技术通讯, 2010, 21(1): 131-135.
ZHAN A Y, YOU X L, ZHAN Y G. Biosynthetic pathway and applications of plant terpenoid isoprenoid[J]. Letters in Biotechnology, 2010, 21(1): 131-135.
[20] 张秋菊, 张爱华, 孙晶波, 等. 植物体中萜类物质化感作用的研究进展[J]. 生态环境学报, 2012, 21(1): 187-193.
ZHANG Q J, ZHANG A H, SUN J B, et al. Advances of research on allelopathic potencial of terpenoids in plants[J]. Ecology and Environmental Sciences, 2012, 21(1): 187-193.
[21] 连建伟, 夏建陵, 黄坤, 等. β-月桂烯在有机反应中的应用研究进展[J]. 化工进展, 2011(8): 1826-1831.
LIAN J W, XIA J L, HUANG K, et al. Research progress of application of β-myrcene in organic reactions[J]. Chemical Industry and Engineering Progress, 2011(8): 1826-1831.
[22] 金建忠, 沈敏敏. β-蒎烯氧化反应研究进展[J]. 广州化学, 2006, 31(3): 51-56.
JIN J Z, SHEN M M. Progress in oxidation of β-pinene[J]. Guangzhou Chemistry, 2006, 31(3): 51-56.
[23] 王伟江. 天然活性单萜——柠檬烯的研究进展[J]. 中国食品添加剂, 2005(1): 33-37.
WANG W J. Recent advances on limonene, a natural and active monoterpene[J]. China Food Additives, 2005(1): 33-37.
[24] 王文元, 顾丽莉, 吴志民. 1, 8-桉叶油素的研究进展[J]. 食品与药品, 2007, 9(02A): 56-59.
WANG W Y, GU L L, WU Z M. Research progress on 1,8-cineol[J]. Food and Drug, 2007, 9(02A): 56-59.
[25] 陈尚钘, 赵玲华, 徐小军. 天然芳樟醇资源及其开发利用[J]. 林业科技开发, 2013, 27(2): 13-17.
AnalysisonVolatileComponentsofTwoKindsofMagnoliaFlowersbyHeadspaceGasChromatography-MassSpectrometry
LI Xiaoying1, CAO Cuiling2, WU Junkai1, LIU Jianzhen1, PAN Yuxia1, JING Lijun1, WANG Zihua1
(1.CollegeofHorticultureScience&Technology,HebeiNormalUniversityofScienceandTechnology,Qinhuangdao066600,China;2.QinhuangdaoEntry-ExitInspectionandQuarantineBureau,Qinhuangdao066004,China)
In this study, the volatile components ofMicheliaalbaDC. andMagnolialiliifloraDesr. were analyzed by headspace sampling-gas chromatography-mass spectrometry (HS/GC-MS). With the help of automatic mass spectral deconvolution and identification system (AMDIS) and NIST11 mass spectrum database, 71 and 56 kinds of volatile components were identified, and 41 volatile components were shared by the two kinds ofMagnoliawith the total relative content of 99.25% and 96.45%. Besides, the numbers of special volatile compounds were 30 and 15. As more as 59 and 43 volatile components were terpenoids hold of 93.28% and 89.19%, which belonged to monoterpenes, sesquiterpenes and their oxo-derivatives. The 9 shared volatile components which contented more than 2% were β-myrcene (7.45%, 19.04%), β-pinene (18.07%, 16.50%), α-pinene (11.38%, 16.01%), eucalyptol (18.09%, 14.58%), o-cymene (5.08%, 6.55%), d-limonene (5.14%, 5.71%),γ-terpinene (6.83%, 3.19%), sabinene (14.06%, 2.57%), and α-terpinene (5.10%, 2.50%). From the point of total volatile components content,MicheliaalbaDC was close to eight times higher thanMagnolialilifloraDesr..
Magnolia; volatile components; headspace sampling; gas chromatography-mass spectrometry
10.3969/j.issn.2095-6002.2017.05.009
2095-6002(2017)05-0053-08
李晓颍,曹翠玲,武军凯,等. 顶空气相色谱- 质谱联用法分析两种玉兰花挥发性成分[J]. 食品科学技术学报,2017,35(5):53-60.
LI Xiaoying, CAO Cuiling, WU Junkai,et al. Analysis on volatile components of two kinds ofMagnoliaflowers by headspace gas chromatography-mass spectrometry[J]. Journal of Food Science and Technology, 2017,35(5):53-60.
TS201.2; O657.7
A
2016-11-12
秦皇岛市农科院项目(2014-19)。
李晓颍,男,助理实验师,硕士,主要从事色谱技术方面的研究。
(责任编辑:檀彩莲)
