MOF-5吸附姜黄素及在胃肠中的消化研究
2017-11-10陈莹莹徐春明
刘 亚, 王 雨, 陈莹莹, 田 征, 徐春明
(北京工商大学 食品学院/食品添加剂与配料北京高校工程研究中心/北京市食品风味化学重点实验室, 北京 100048)

MOF-5吸附姜黄素及在胃肠中的消化研究
刘 亚, 王 雨, 陈莹莹, 田 征, 徐春明*
(北京工商大学 食品学院/食品添加剂与配料北京高校工程研究中心/北京市食品风味化学重点实验室, 北京 100048)
采用直接合成法制备MOF-5,正交试验法优化MOF-5吸附姜黄素的条件,以MOF-5用量、姜黄素浓度、吸附温度、吸附时间为影响因素得出优化吸附率。对优化吸附率的复合物进行了体外模拟消化,通过复合物在胃肠消化的释放率进行生物有效性的初步探索。得到优化吸附条件为:MOF-5用量0.4 g,姜黄素质量浓度0.20 mg/mL,吸附温度30 ℃,吸附时间36 min,优化吸附率为94.57%。在模拟人体胃肠消化时,姜黄素在胃液中的平均释放率为48.93%,经过肠道消化后姜黄素平均含量为10.32%。MOF-5吸附姜黄素后主要在胃部被释放,肠道被吸收,起到了很好的控释作用。
MOF-5; 姜黄素; 胃肠消化; 体外模拟消化
姜黄为姜科姜黄属植物姜黄的干燥根茎[1]。姜黄素是姜黄的主要活性成分之一,作为香料和色素广泛应用于食品等行业[2]。姜黄素具有广泛的药理学活性[3],包括抗病毒、抗炎、抗氧化、抗肿瘤和改善肠道功能[4-8]等,但由于姜黄素具有难溶于水,见光易分解,半衰期短等缺点,在体内生物有效性很低,限制了其药理活性的发挥[9]。目前常用的提高姜黄素生物有效性的方法有脂质体技术、微乳化技术、环糊精包合技术、纳米技术、固体分散技术[10-11]等,但这些方法仍存在着制备工艺复杂、操作繁琐等问题。
金属- 有机骨架材料(metal organic frameworks,MOFs)具备比表面积大、孔隙率高等特点,在吸附分离[12-13]、催化[14]等方面表现出优良的性能。以金属元素Zn为单元框架合成的金属有机框架材料MOF-5应用较为广泛,而且在低剂量时,金属骨架材料对人体无毒。Vlasova 等[15]将MOF-5用于吸附未提炼的植物油的游离脂肪酸和过氧化物,这是MOF-5在食品应用方面的一次探索。此外,MOF-5具有很好的生物相容性[16],作为药物载体不仅可以靶向给药,还可以控释并提高药物的生物有效性[17]。杨宝春等[18]以辣椒素和5-氟尿嘧啶为目标药物,发现MOF-5作为运输载体可以有效提高药物的有效性。
生物有效性是物质经口服后由胃肠道吸收,经肝脏到达体循环血液中发挥作用的含量占摄入量的百分比。根据活性成分在胃肠道中的溶出和消化吸收情况来推测生物有效性是一种简单可行的方法[19]。本研究以直接合成法制备的MOF-5吸附姜黄素,随后对其进行体外胃肠消化实验,分析复合物在胃肠中的释放情况,对姜黄素在体内生物有效性的提高以及控制姜黄素的释放等方面研究进行探索。
1 材料与方法
1.1 材料与试剂
姜黄素,西安赛邦医药科技有限公司;胃蛋白酶、胰酶,北京迪朗生化科技有限公司;牛胆盐,国药集团化学试剂有限公司;其他化学试剂,北京化工厂。
1.2 仪器与设备
JJ200型电子天平,常熟市双杰测试仪器厂;DK- 98- ⅡA型电热恒温水浴锅,天津泰斯特仪器有限公司;KQ- 50E型超声波清洗器,昆山超声仪器有限公司;TDL- 5- A型高速离心机,上海安亭科学仪器厂;Multiskan FC型酶标仪,赛默飞世尔仪器有限公司;DHG- 9426A型电热恒温鼓风干燥箱,上海精宏实验设备有限公司;恒温振荡培养箱,上海太仓实验设备厂;VEGA3 SB- EASYProbe型扫描电子显微镜,捷克Tescan公司;pH计,上海三信仪器厂。
1.3 实验方法
1.3.1姜黄素标准曲线的建立
配制适量浓度的姜黄素溶液,扫描全波谱,确定姜黄素最大吸收波长为426 nm。以无水乙醇为空白建立姜黄素标准曲线,以吸光度为纵坐标,质量浓度为横坐标,进行线性回归,得到回归方程。
1.3.2MOF-5的制备与表征
采用直接合成法制备MOF-5[20]。将干燥的MOF-5置于扫描电镜(scanning electron microscope,SEM)的样品室中进行扫描分析,以观察MOF-5的表面形貌。将干燥的MOF-5样品在4 000~400 cm-1进行傅里叶红外光谱(Fourier transform infrared spectrometer,FT-IR spectrometer)扫描,对样品进行表征。
1.3.3MOF-5吸附姜黄素单因素实验
选取不同的吸附时间、吸附温度、MOF-5用量、姜黄素质量浓度进行MOF-5吸附姜黄素的单因素实验,离心,测定上清液在426 nm下的吸光度,根据标准曲线计算出吸附率。
1.3.4正交试验设计
以MOF-5质量(因素A),姜黄素质量浓度(因素B),吸附温度(因素C)以及吸附时间(因素D)为4个主要因素,根据单因素实验的吸附率,每个因素设3水平,设计正交试验,见表1。
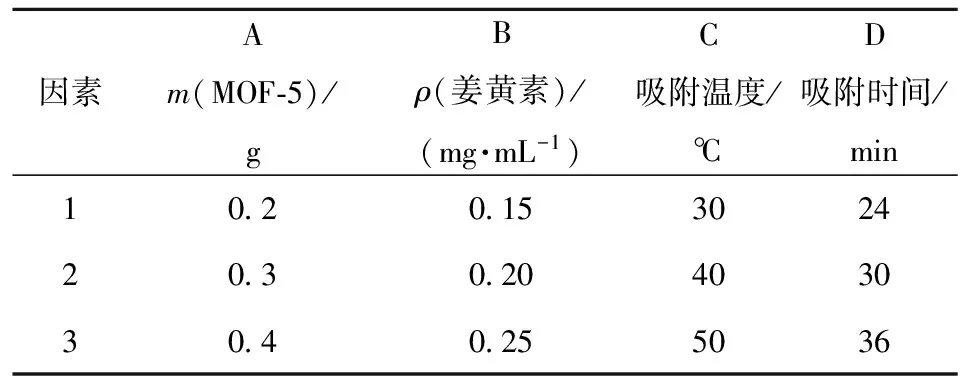
表1 因素水平表
1.3.5MOF-5吸附姜黄素后体外消化实验
根据中国药典配制模拟胃液和模拟肠液,参照Zou等[21]的胃- 十二指肠模型进行体外消化实验,略有改动。
1.4 吸附率计算
吸附率计算公式见式(1)。
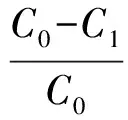
(1)
式(1)中:C0为吸附前姜黄素溶液的质量浓度,mg/mL;C1为吸附后离心上清液的姜黄素质量浓度,mg/mL;C0、C1均通过姜黄素的标准曲线计算。
2 结果与分析
2.1 姜黄素标准曲线分析
根据实验操作绘制标准曲线,如图1。回归方程为A=160.7C+0.004 4,R2=0.998 8。结果表明,姜黄素在0~4.0 μg/mL的质量浓度范围内与吸光度呈良好的线性关系。
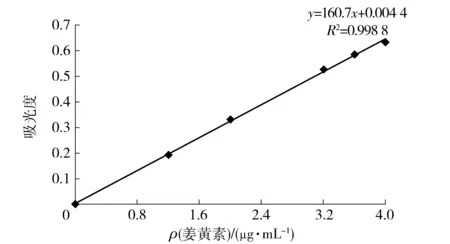
图1 姜黄素标准曲线Fig.1 Standard curve of curcumin
2.2 MOF-5的制备与表征结果分析

图2 MOF-5扫描电镜图Fig.2 SEM micrographs of MOF-5
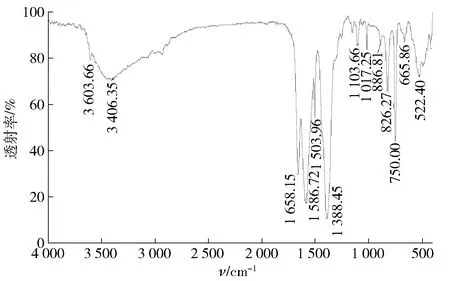
图3 MOF-5红外光谱Fig.3 FT-IR patterns of MOF-5
直接合成法制备的MOF-5为白色粉末。SEM表征如图2,FT-IR表征如图3。用扫描电镜对制备的MOF-5样品进行微观结构观察。由图2可以观察到,合成的MOF-5呈单独的颗粒状,有些粒子之间出现了相互堆积,粒子大小也不相同,有蜂窝结构,与文献报道的基本一致[22]。
由图3可见,波数出现在1 621,1 587,1 458 cm-1附近的吸收峰为苯环的骨架振动峰;在764 cm-1附近处的吸收峰为苯环的C—H弯曲振动峰,在波数1 103 cm-1附近的吸收峰是羧基C—O的伸缩振动峰,位于3 406 cm-1附近的宽峰为水分子中O—H的振动峰。MOF-5的红外表征图谱与张民召等[23]的文献中的峰形一致,确证制备的样品为MOF-5。
2.3 MOF-5吸附姜黄素单因素实验结果
2.3.1MOF-5用量对吸附率的影响
30 ℃水浴,分别称取0.1,0.2,0.3,0.4 g的MOF-5吸附5 mL质量浓度为0.2 mg/mL的姜黄素30 min,离心后取上清液,测定其在426 nm下的吸光度,根据标准曲线计算吸附率。MOF-5用量对吸附率的影响见图4。由图4可知,吸附率随着MOF-5的用量逐渐增长,但是采用0.5 g MOF-5吸附姜黄素时由于MOF-5质量过高造成了离心效率差,无法准确测出MOF-5的吸附效率。通过对比,MOF-5用量为0.3~0.4 g时吸附率出现了增长缓慢的趋势,0.4 g MOF-5吸附姜黄素的吸附率可达到95%左右,已经接近吸附的饱和点,故选用0.2,0.3,0.4 g进行正交试验。

图4 MOF-5用量与吸附率的关系Fig.4 Effect of MOF-5 dosages on adsorption rate
2.3.2姜黄素质量浓度对吸附率的影响
称取0.4 g的MOF-5在30 ℃水浴中吸附不同质量浓度的姜黄素溶液30 min,离心后,检测上清液吸光度并计算吸附率。姜黄素质量浓度对吸附率的影响见图5。
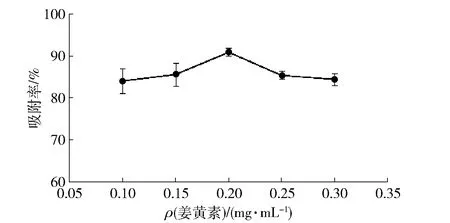
图5 姜黄素质量浓度与吸附率的关系Fig.5 Effect of curcumin concentrations on adsorption rate
由图5可知,在姜黄素质量浓度为0.20 mg/mL时,吸附率达到最高,随后降低,故在正交试验中选取姜黄素质量浓度为0.15,0.20,0.25 mg/mL。
2.3.3吸附温度对吸附率的影响
称取0.4 g的MOF-5,加入5 mL质量浓度为0.20 mg/mL的姜黄素置于30,40,50,60 ℃下吸附30 min后离心,取上清液检测吸光度并计算吸附率。吸附温度对吸附率的影响见图6。由图6可知,吸附率随着温度的升高先增大后减小,在40 ℃时吸附率最高,选择30,40,50 ℃进行正交试验。
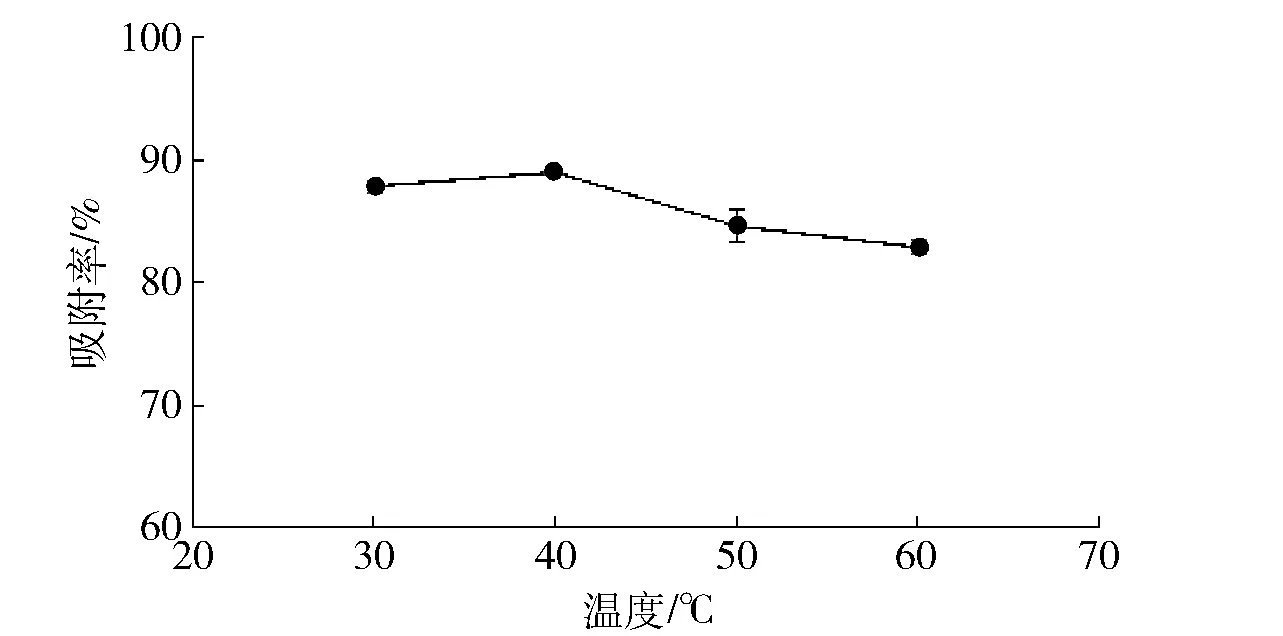
图6 吸附温度与吸附率的关系Fig.6 Effect of temperatures on adsorption rate
2.3.4吸附时间对吸附率的影响
在40 ℃水浴下,称取0.4 g MOF-5,分别加入5 mL的0.20 mg/mL的姜黄素吸附不同时间,离心后测其上清液的吸光度得出吸附率。吸附时间对吸附率的影响见图7。
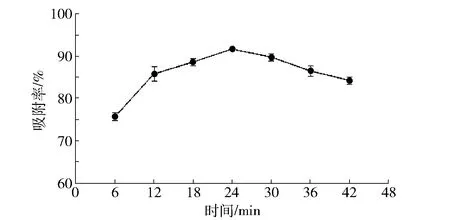
图7 吸附时间与吸附率的关系Fig.7 Effect of time on adsorption rate
由图7可知,吸附率随时间的延长先增大后减小,随着时间的增大MOF-5有轻微的解吸现象。选取24,30,36 min进行正交试验。
2.4 MOF-5吸附姜黄素正交试验结果
以吸附率为指标,按表1进行正交试验,试验结果如表2。由表2可见,4因素中,MOF-5用量和姜黄素质量浓度对吸附率的影响较为显著,其中,MOF-5用量对吸附的影响最为显著,吸附温度对吸附率的影响最不显著。在试验设计范围内,正交优化得到MOF-5吸附姜黄素的较佳吸附条件为A3B2C1D3,即MOF-5用量为0.4 g、姜黄素质量浓度为0.20 mg/mL、温度为30 ℃、吸附时间为36 min。对较佳吸附条件设置3组平行实验进行验证,得到吸附率分别为94.63%,94.08%,92.31%。平均包合率为93.67%,相对标准偏差为1.29%,较佳条件稳定可靠。若从实际生产考虑,可选择室温接近的温度并且适当延长或缩短吸附时间,从而获得较佳效益比。
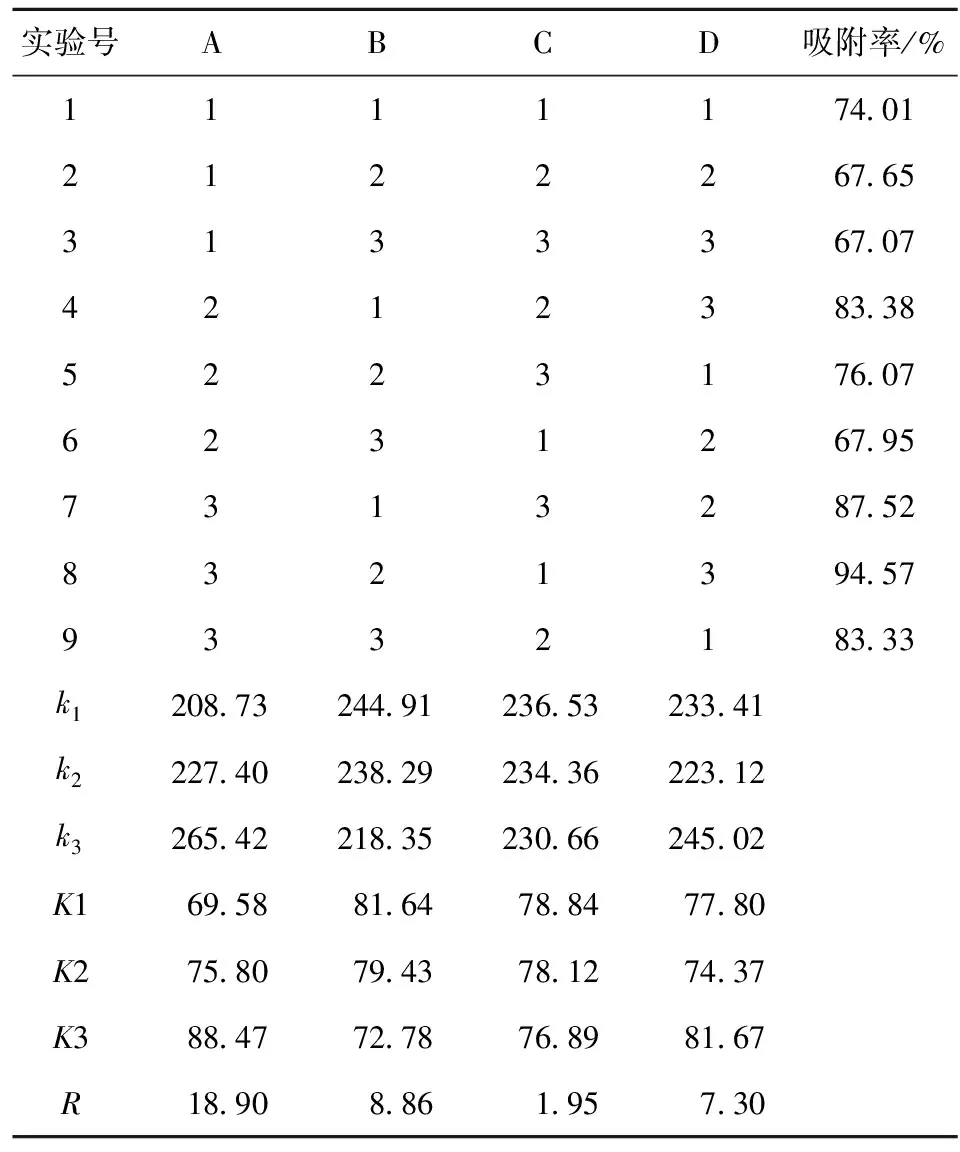
表2 正交试验设计表及结果
2.5 MOF-5-姜黄素的胃肠消化结果分析
模拟胃部及胃肠消化后,检测离心后的上清液吸光度。根据标准曲线计算姜黄素分别在模拟胃液和模拟胃肠液中的释放率,结果见图8、图9。

图8 姜黄素的体外胃肠消化情况Fig.8 In vitro gastrointestinal digestion of curcumin
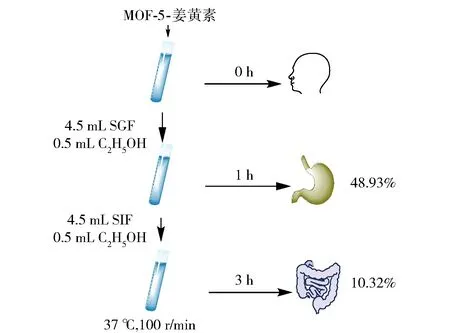
图9 MOF-5-姜黄素复合物的体外胃肠消化情况Fig.9 In vitro gastrointestinal digestion of MOF-5-curcumin complex
由图8得出,姜黄素经口服后,在胃中的释放极少,进入肠道后释放逐渐增多,但是终止消化时仅为7.402%,这和文献[24]中姜黄素在酸性条件下不溶,在肠道的吸收率低一致,所以提高姜黄素在水中的溶解度,从而提高姜黄素在人体肠道中的吸收率,是提高其生物利用度的主要方法。经过MOF-5吸附的姜黄素,从其在体外胃肠消化实验数据可看出,其在水中的溶解度大大增加,在胃液中释放率提高到48.93%,经过肠液消化后姜黄素在肠道的含量变为10.32%。经MOF-5吸附后,姜黄素在胃肠道内的消化过程发生改变,吸附在MOF-5上的姜黄素首先需要释放出来,进而被胃肠道吸收。数据表明,吸附的姜黄素主要在胃液中释放,在肠液中消化吸收。经MOF-5吸附的姜黄素在肠道中吸收量较单体姜黄素大,可能是MOF-5-姜黄素复合物发挥其控释作用[17],使姜黄素缓慢释放增加了其在肠道的吸收。同时,姜黄素在模拟胃肠环境中存在有微量的分解,发生生物转化过程且产生较多种类的代谢产物[25]。姜黄素在中性及碱性条件下不稳定,会降解为以阿魏酸、香草醛和丙酮为主的降解物。除了部分姜黄素通过胃肠进入人体循环外,剩余的10.32%的姜黄素会避免胃肠黏膜的消化而发挥生理效应,提高了姜黄素的生物有效性。
人体肠道系统具有丰富的微生物[26],在体外模拟胃肠消化时并没有考虑到微生物的存在,所以MOF-5能否成为姜黄素的运载载体,人体的生物有效性与体外胃肠模拟方法得到的数据一致性成为其发展的关键因素。
3 结 论
采用直接加入合成法制备了金属有机骨架材料MOF-5,利用溶剂扩散法将姜黄素吸附到金属有机骨架化合物MOF-5中,得到主- 客体金属有机骨架复合材料MOF-5-姜黄素,并通过单因素实验和正交试验考察温度、吸附时间、姜黄素质量浓度和MOF-5用量对吸附的影响。研究结果表明:MOF-5用量为0.4 g,姜黄素质量浓度0.20 mg/mL,吸附温度30 ℃,吸附时间36 min为较佳吸附条件,此时吸附率为94.57%。在模拟人体胃肠消化时,姜黄素在胃液中的平均释放率为48.93%,经肠道消化后姜黄素的含量变为10.32%,MOF-5吸附姜黄素后主要在胃部被释放,肠道被吸收,具有很好的控释作用。
MOF-5吸附姜黄素后其控释效果增大了姜黄素在水中的溶解度,是提高姜黄素生物利用度的一次积极探索,为提高姜黄素的生物利用度增添了一种新的途径。尽管已经验证MOFs与人体具有良好的生物相容性,但人体摄入MOF-5-姜黄素复合物后的具体代谢过程还需要进一步探究。MOFs尚处于早期发展阶段,但其运载载体的潜力已经得到充分肯定。积极发挥MOFs在控释吸收方面的优势,将会使其在食品营养物质的高效利用,药物的控释、药理活性的发挥等方面发挥更大的作用。
[1] 崔语涵, 安潇, 王海峰, 等. 姜黄化学成分研究[J]. 中草药, 2016, 47(7): 1074-1078.
CUI Y H, AN X, WANG H F, et al. Chemical constituents from rhizomes of curcuma longa[J]. Chinese Traditional and Herbal Drugs, 2016, 47(7): 1074-1078.
[2] 袁鹏, 陈莹, 肖发,等. 姜黄素的生物活性及在食品中的应用[J]. 食品工业科技, 2012, 33(14):371-375.
YUAN P, CHEN Y, XIAO F, et al. The bioactivities of curcumin and its application in foods[J]. Science and Technology of Food Industry, 2012, 33(14):371-375.
[3] SHISHODIA S. Molecular mechanisms of curcumin action: gene expression[J]. Biofactors, 2013, 39(1):37-55.
[4] 孙京芳, 吉美芳, 徐正行,等. 姜黄素- 汉防己碱共递送抗病毒复方脂质体的构建[J]. 药学研究, 2016, 35(3):157-160.
SUN J F, JI M F, XU Z X, et al. Preparation of curcumin-tetrandrine co-delivery antiviral compound recipe liposome[J]. Journal of Pharmaceutical Research, 2016, 35(3):157-160.
[5] SHEHZAD A, REHMAN G, LEE Y S. Curcumin in inflammatory diseases[J]. Biofactors, 2013, 39(1):69-77.
[6] AK T, GÜLÇIN I. Antioxidant and radical scavenging properties of curcumin[J]. Chemico-Biological Interactions, 2008, 174(1):27-37.
[7] WILKEN R, VEENA M S, WANG M B, et al. Curcumin: a review of anti-cancer properties and therapeutic activity in head and neck squamous cell carcinoma[J]. Molecular Cancer, 2011, 12(5): 12.
[8] 李云, 周明眉, 苟小军,等. 姜黄素对间歇性睡眠剥夺大鼠特定肠道菌的影响[J]. 中草药, 2016, 47(5):794-798.
LI Y, ZHOU M M, GOU X J, et al. Effects of curcumin on gut microbiota of interval sleep deprivation rats[J]. Chinese Traditional and Herbal Drugs, 2016, 47(5):794-798.
[9] SELVAM C, JACHAK S M, THILAGAVATHI R, et al. Design, synthesis, biological evaluation and molecular docking of curcumin analogues as antioxidant, cyclooxygenase inhibitory and antiinflammatory agents[J]. Bioorganic & Medicinal Chemistry Letters, 2005, 15(7):1793-1797.
[10] 徐春明, 刘亚, 陈莹莹,等. 姜黄素生理活性、代谢以及生物利用度的研究进展[J]. 中国食品添加剂, 2016(9):203-210.
XU C M, LIU Y, CHEN Y Y, et al. Research progress on physiological activity,metabolism and bioavailability of curcumin[J]. China Food Additives, 2016(9):203-210.
[11] MANGOLIM C S, MORIWAKI C, NOGUEIRA A C, et al. Curcumin-β-cyclodextrin inclusion complex: stability, solubility, characterisation by FT-IR, FT-Raman, X-ray diffraction and photoacoustic spectroscopy, and food application[J]. Food Chemistry, 2014, 153:361-370.
[12] MAES M, TREKELS M, BOULHOUT M, et al. Selective removal of N-heterocyclic aromatic contaminants from fuels by lewis acidic metal-organic frameworks[J]. Angewandte Chemie International Edition, 2011, 50(18):4210-4214.
[13] 代伟, 庄海堂, 卢信清,等. 金属有机骨架材料MOF-5上噻吩硫化物的吸附分离[J]. 燃料化学学报, 2010, 38(5):626-630.
DAI W, ZHUANG H T, LU X Q, et al. Adsorptive separation of thiophene derivatives via metal organic framework material MOF-5[J]. Journal of Fuel Chemistry and Technology, 2010, 38(5):626-630.
[14] SONG G, WANG Z, WANG L, et al. Preparation of MOF(Fe) and its catalytic activity for oxygen reduction reaction in an alkaline electrolyte[J]. Chinese Journal of Catalysis, 2014, 35(2):185-195.
[15] VLASOVA E A, YAKIMOV S A, NAIDENKO E V, et al. Application of metal-organic frameworks for purification of vegetable oils[J]. Food Chemistry, 2016, 190(1):103-109.
[16] 乔智威, 李理波, 周健. 生物相容性金属- 有机骨架材料负载药物的分子模拟[J]. 高等学校化学学报, 2014(12):2638-2644.
QIAO Z W, LI L B, ZHOU J. Molecular simulations of bio-compatible metal-organic frameworks for drug carrier application[J]. Chemical Journal of Chinese Universities, 2014(12):2638-2644.
[17] PATRICIA H, CHRISTIAN S, MARA V, et al. Metal-organic frameworks as efficient materials for drug delivery[J]. Angewandte Chemie, 2006, 118(36):6120-6124.
[18] 杨宝春, 姜耀东, 秦雪娟,等. 抗肿瘤药物在金属有机骨架中的装载及体外释放[J]. 高等学校化学学报, 2012, 33(1):26-31.
YANG B C, JIANG Y D, QIN X J, et al. Loaded andinvitrodrug release of anticancer drugs in porous metal-organic frameworks[J]. Chemical Journal of Chinese Universities, 2012, 33(1):26-31.
[19] CARINO S R,SPERRY D C,HAWLEY M. Relative bioavailability estimation of carbamazepine crystal forms using an artificial stomach-duodenum model[J]. Journal of Pharmaceutical Sciences,2006,95(1):116-125.
[20] 徐娜, 李菁, 冯占恒,等. 金属- 有机框架MOF-5的制备与表征[J]. 实验技术与管理, 2012, 29(1):49-50.
XU N, LI J, FENG Z H, et al. Systhesis and characterization of porous metal-organic framework MOF-5[J]. Experimental Technology and Management, 2012, 29(1):49-50.
[21] ZOU L, ZHENG B, LIU W, et al. Enhancing nutraceutical bioavailability using excipient emulsions: influence of lipid droplet size on solubility and bioaccessibility of powdered curcumin[J]. Journal of Functional Foods, 2015, 15:72-83.
[22] PANELLA B, HIRSCHER M. Hydrogen physisorption in metal-organic porous crystals[J]. Advanced Materials, 2005, 17(5):538-541.
[23] 张民召, 孙洋, 魏海英. 两种方法合成的MOFs材料表征及吸附性能研究[J]. 广州化工, 2016(4):53-55.
ZHANG M Z, SUN Y, WEI H Y. Characterization and sorption performance of metal organic frameworks synthesized by two different methods[J]. Guangzhou Chemical Industry, 2016(4):53-55.
[24] VAREED S K, KAKARALA M, RUFFIN M T, et al. Pharmacokinetics of curcumin conjugate metabolites in healthy human subjects[J]. Cancer Epidemiology Biomarkers & Prevention, 2008, 17(6):1411-1417.
[25] DEMPE J S,SCHEERLE R K,PFEIFFER E,et al. Metabolism and permeability of curcumin in cultured caco-2 cells[J].Molecular Nutrition & Food Research,2013,57(9):1543-1549.
[26] 陈卫. 肠道菌群:膳食与健康研究的新视角[J]. 食品科学技术学报, 2015, 33(6):1-6.
CHEN W. Gut microbiota—a new concern on health regulation[J]. Journal of Food Science and Technology,2015,33(6):1-6.
StudyonMOF-5AdsorptionCurcuminandDigestioninGastrointestinalTract
LIU Ya, WANG Yu, CHEN Yingying, TIAN Zheng, XU Chunming*
(SchoolofFoodandChemicalEngineering/BeijingHigherInstitutionEngineeringResearchCenterofFoodAdditivesandIngredients/BeijingKeyLaboratoryofFlavorChemistry,BeijingTechnologyandBusinessUniversity,Beijing100048,China)
MOF-5 was prepared by a direct synthesis method. Effects of MOF-5 mass, curcumin concentration, adsorption temperature and and adsorption time were investigated by the single-factor experiment. Based on the results, the orthogonal test method was used to optimize the adsorption conditions. The optimal adsorption rate of the complex was simulatedinvitro, and the bioavailability of the complex was studied. The best adsorption conditions were as follows: MOF-5 quality 0.4 g, curcumin concentration 0.20 mg/mL, adsorption temperature 30 ℃, and adsorption time 36 min. Under the optimal conditions, the best adsorption rate was 94.57%. After the simulated gastrointestinal digestion, the average release rate of curcumin in gastric juice was 48.93%. After passing through the digestive tract, the average content of curcumin was 10.32%. Curcumin absorbed by MOF-5 was released in stomach and absorbed in intestine.
MOF-5; curcumin; gastrointestinal digestion;invitrosimulated digestion
10.3969/j.issn.2095-6002.2017.05.008
2095-6002(2017)05-0046-07
刘亚,王雨,陈莹莹, 等. MOF-5吸附姜黄素及在胃肠中的消化研究[J]. 食品科学技术学报,2017,35(5):46-52.
LIU Ya, WANG Yu, CHEN Yingying, et al. Study on MOF-5 adsorption curcumin and digestion in gastrointestinal tract[J]. Journal of Food Science and Technology, 2017,35(5):46-52.
TS202.3; TS201.4; R459.3
A
2016-12-17
北京工商大学“本科人才培养质量建设”项目(19005656025);北京工商大学学位与研究生教育研究项目(2016XWYJS013)。
刘 亚,女,硕士研究生,研究方向为生物化工;
*徐春明,男,副教授,博士,主要从事生物化工方面的研究,通信作者。
(责任编辑:叶红波)
