草鱼鱼鳞抗氧化肽的酶法制备及其抗氧化稳定性研究
2017-11-10柯勤勤罗洋洋何林凌饶承冬叶浪李树红李美良
柯勤勤,罗洋洋,何林凌,胡 强,饶承冬,叶浪,李树红,李美良
(四川农业大学食品学院,四川雅安 625014)
草鱼鱼鳞抗氧化肽的酶法制备及其抗氧化稳定性研究
柯勤勤,罗洋洋,何林凌,胡 强,饶承冬,叶浪,李树红,李美良*
(四川农业大学食品学院,四川雅安 625014)
【目的】采用碱性蛋白酶水解草鱼鱼鳞制备抗氧化肽,并探讨其稳定性。【方法】运用单因素及正交试验对酶解条件进行优化,并进行体外抗氧化活性的测定,对酶解得到的抗氧化肽进行体外模拟胃肠消化实验。【结果】在优化工艺条件下,鱼鳞酶解液中羟自由基清除率为88.71%;其体外抗氧化能力随肽质量浓度增大而增大,在浓度为0.5 mg/mL时,鱼鳞抗氧化肽清除DPPH自由基能力达到Vc的81.1%;对超氧阴离子自由基清除率为98.97%。在胃肠消化前4 h内抗氧化活性较稳定,之后随时间延长抗氧化稳定性显著下降。【结论】在酶解草鱼鱼鳞的较佳工艺条件:温度60℃、料液比1∶15、加酶量800 U/g、时间3 h下,碱性蛋白酶水解草鱼鱼鳞制备的抗氧化肽具有良好的抗氧化活性及稳定性。
草鱼鱼鳞;酶解;多肽;抗氧化性;胃肠消化
据统计,2015年我国草鱼年产量已达到全国淡水鱼总产量的18.54%,居淡水养殖产量首位,约为567.62万t。而鱼鳞约占鱼体质量3.0%~5.0%[1],在实际生产中草鱼鱼鳞大多以磨成鱼粉的形式作为饲料处理[2],产品附加值极低,大部分被丢弃处理,只有少部分加工成鱼饲料再次利用。目前对鱼鳞的深加工研究主要有提取胶原蛋白、鱼银、明胶和有机酸钙[2-4]等,而关于草鱼鱼鳞蛋白抗氧化肽及其胃肠消化稳定性方面的研究报道较少。因此将草鱼鱼鳞制备出抗氧化肽能提高草鱼的附加值,有利于充分利用我国的渔业资源,具有极为广阔的市场前景。
有研究证明鱼鳞中含有丰富的蛋白质、各种矿物质、鸟嘌呤和卵磷脂,其中蛋白质占鱼鳞干重的70%[5]。目前国内外对于鱼鳞蛋白的研究主要集中在提取工艺上,鱼鳞蛋白中含大量疏水性氨基酸,经过酶解后,小分子量的肽释放出来,使酶解物具有较强的抗氧化作用。近些年来,从水产品中制取抗氧化活性肽的研究引起了越来越多的学者的关注,国内外学者已从秋刀鱼、泥鳅、罗非鱼、沙丁鱼,鲢鱼等鱼鳞、鱼内脏、鱼皮及鱼骨架等下脚料蛋白酶解液中制备出具有显著抗氧化活性的肽段[7-11]。目前,国外对各种鱼类,比如阿拉斯加青鳕骨架、亚洲银鲤、黄鳍牛舌鱼等来酶解鱼肉制备胶原蛋白肽的研究相对于鱼鳞等下脚料较多[12-14],国内部分学者对鱼鳞酶解有一定的研究[15-17]。但是对于鱼鳞抗氧化肽在人体内消化吸收及稳定性的研究较少,抗氧化肽在消化过程中胃肠稳定性是否遭到破坏,其活性是否下降,是需要解决的问题。而用碱性蛋白酶对草鱼鱼鳞进行水解制取低分子量抗氧化肽并研究体外抗氧化活性及其稳定性的研究还鲜有报道[18]。
本研究旨在探讨碱性蛋白酶酶解制备鱼鳞抗氧化肽的工艺研究,确定鱼鳞抗氧化肽酶法制备的最佳工艺条件。并进行体外抗氧化活性的测定及其胃肠消化实验对其稳定性的影响。为其在今后的研究和实际应用中提供理论依据和参考。
1 材料和方法
1.1 材料、试剂与仪器
1.1.1 主要实验材料及试剂
草鱼鱼鳞:采购于四川省雅安市雨城区农贸市场,清水洗净,烘干并捣碎备用;碱性蛋白酶(酶活力≥200 U/mg)上海瑞永生物科技有限公司。
福林酚、氢氧化钠、三氯乙酸、水杨酸、无水乙酸、过氧化氢、盐酸、脱氧胆酸钠、酒石酸钾、抗坏血酸等均为国产分析纯。
1.1.2 主要仪器
可见分光光度计:V-1100D型,上海美谱达仪器有限公司;电子天平:FA1204B型,上海越平科学仪器有限公司;数显恒温水浴锅:HH-8型,天津泰斯特仪器有限公司;pH计:PHS-3E型,上海佑科仪器仪表有限公司;优普系列超纯水机:ULUP-IV-10T型,成都超纯科技有限公司;高速冷冻离心机:SORVALL Legend MICRO17型),德国ThermoFisher公司;离心机:SORVALLST16R型,德国ThermoFisher公司。
1.2 方法
1.2.1 草鱼鱼鳞抗氧化肽的制备
草鱼鱼鳞→清洗、烘干、捣碎→用超纯水溶解,并调pH值→碱性蛋白酶酶解,在酶解过程中维持pH的稳定,酶解结束后调至pH=7→灭酶→离心→取上清液备用。
1.2.2 酶解液中的多肽含量的测定
以牛血清白蛋白(BSA)为标准,作标准曲线,用Lowry 法测定[19]。
1.2.3 碱性蛋白酶酶解条件的单因素试验设计
1.2.3.1 不同料液比对酶解液的羟自由基清除率和多肽含量的影响
料液比即质量体积比(g/mL)可分别设为1∶10、1∶15、1∶20、1∶30,在加酶量为 800 U/g,pH 值为 9.0,酶解温度为55℃的条件下恒温反应3 h,灭酶后离心取上清液测多肽含量和羟自由基清除率。
1.2.3.2 不同加酶量对酶解液的羟自由基清除率和多肽含量的影响
加酶量分别设为 200 U/g、400 U/g、800 U/g、1600 U/g、3200 U/g,在料液比为 1∶30 g/mL,pH 值为 9.0,酶解温度为55℃的条件下恒温反应3 h,灭酶后离心取上清液测多肽含量和羟自由基清除率。
1.2.3.3 不同酶解时间对酶解液的羟自由基清除率和多肽含量的影响
酶解时间分别设为 2、3、4、5、6 h,在料液比为1∶30 g/mL,pH 值为 9.0,加酶量为 400 U/g,酶解温度为55℃的条件下恒温反应,灭酶后离心取上清液测多肽含量和羟自由基清除率。
1.2.3.4 不同酶解温度对酶解液的羟自由基清除率和多肽含量的影响
酶解温度分别设为 30、40、50、55、60 ℃,在料液比为1∶30 g/mL,pH值为9.0,加酶量为 400 U/g的条件下恒温反应3 h,灭酶后离心取上清液测多肽含量和羟自由基清除率。
1.2.4 正交试验设计
影响酶解反应的重要因素有加酶量、料液比、温度、时间及pH值等。根据单因素试验的结果,选取料液之比(A)、酶解时间(B)、酶解温度(C)、加酶量(D)各因素的3个水平,以鱼鳞酶解液的羟自由基清除率为指标,设计L9(34)正交试验确定各因素的较佳条件,正交试验设计如表1所示。
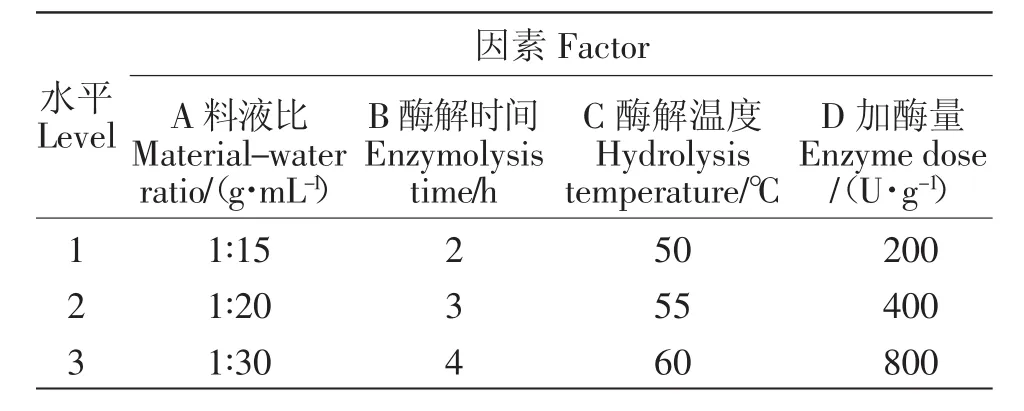
表1 碱性蛋白酶制备鱼鳞抗氧化肽的正交试验设计Table 1 Scales antioxidant peptides prepared by alkaline proteasein the orthogonal array design
1.2.5 羟自由基清除能力的测定
参考徐怀德等[19]方法并适当改进。在试管中分别加入0.3mL 1.8mmol/L水杨酸-乙酸溶液、0.2mL已知浓度的酶解液、0.4mL 1.8mmol/L FeSO4溶液,最后加入0.02mL含量为0.03%的H2O2,振荡混合均匀,37℃水浴反应30min,于510 nm处测定吸光值As;取0.2mL超纯水代替酶解液,测得的吸光度为A0。羟自由基的清除率D表示为:。
1.2.6 超氧阴离子自由基清除能力的测定
参照PanX.[20]等方法并适当改进。取0.0252mol/L NBT(氯化硝基四氮唑蓝)溶液1mL,6.24 mol/L NADH(还原型辅酶)溶液1mL与1mL不同浓度样品溶液混合均匀,并加入1mL浓度为0.12mmol/L的PMS(吩嗉硫酸甲酯)溶液启动反应,混合均匀后于25℃恒温水浴准确反应5min,用超纯水作参比,同时以相同浓度的Vc代替酶解液作为对照,于560 nm处测定吸光值。超氧阴离子清除率按下式计算:

式(1)中:A0为不含酶解液的吸光值;A1为含有酶解液的吸光值。
1.2.7 DPPH·自由基清除能力的测定
参考张尊听等[21]方法并适当改进。将已知浓度的酶解液0.5mL及0.5mL 1×10-4mol/L DPPH·溶液(用无水乙醇配制)加入同一具塞试管中摇匀,室温下避光静置20min,然后4000 r/min离心10min,用95%乙醇调零于517 nm波长下测定吸光度。同时以相同浓度的Vc代替酶解液,作为对照。
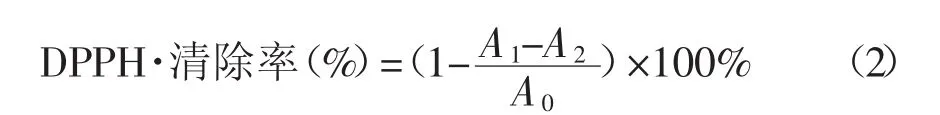
式(2)中:A1为含有酶解液和DPPH·溶液的吸光值;A2为含有酶解液和95%乙醇溶液的吸光值;A0为含有DPPH·溶液和超纯水的吸光值。
1.2.8 体外模拟胃肠连续消化实验
参照刘珊珊等方法[22-23]并适当改进。取250mL(mg/mL)鱼鳞抗氧化肽冻干物溶于0.01 mol/L盐酸溶液中(pH=2.0),取0.005 g胃蛋白酶加入0.01 mol/L盐酸溶液中,配置胃蛋白酶溶液1mL(pH=2.0)。将9mL的鱼鳞小肽溶液与1mL的胃蛋白酶溶液分别置于37℃保温10min后,将其混合均匀,置于37℃恒温水浴振荡器中模拟胃消化2 h。待胃消化结束后,将消化液pH值调至7.5。添加0.4 g的胰蛋白酶和糜蛋白酶并混合均匀,于37℃恒温水浴振荡器中模拟肠消化4 h。在胃肠消化反应阶段每隔1 h(即0、1、2、3、4、5、6 h)取 1 次消化液。每次取出的消化液样品,置于沸水浴中灭酶10min,冷却至室温,并将其pH值调至7.0,冷冻保存于-20℃,备用。
1.2.9 抗氧化性测定
取上一步中的消化液用Lorry法测蛋白浓度,并配成相同浓度的消化液,测定其羟基自由基清除率、超氧阴离子清除率,方法同1.2.5、1.2.6。
1.2.10 数据统计分析方法
采用Excel 2010对试验数据进行最小显著极差(LSR)分析,结果取3次试验的平均值。
2 结果与分析
2.1 料液比对鱼鳞蛋白酶解液清除羟基自由基效果的影响
如图1所示,随着料液比的增大,酶解液中的多肽含量及羟自由基清除率呈先下降再上升,多肽含量最后又呈上升趋势,其含量最高时,羟自由基清除率却非最高。当料液比为1∶30时,酶解液对羟自由基清除能力最强,清除率达到91.71%。实验表明,料液比并非越小越好,料液比过小,单位体积内分子过大,难以与酶充分接触,因此从经济角度考虑,取料液比为 1∶15、1∶20、1∶30 作为正交试验考察水平。
2.2 加酶量对鱼鳞蛋白酶解效果的影响

图1 料液比对酶解液清除羟基自由基的影响Figure 1 The effect of ratio of solid to liquid onelimination ratio of hydroxyl radicals by enzymatic hydrolysate
由图2可知,随着加酶量的增大,多肽含量与羟自由基清除率均呈先上升再下降再上升再下降的趋势,当加酶量为400 U/g时,酶解液对羟自由基清除能力最强,达到94.51%。在加酶量为800 U/g时多肽含量较低,而在1600 U/g时多肽含量达到了最高值,但随着加酶量的增加多肽含量呈下降趋势,可能是部分肽段被水解成氨基酸所致。因此,随着加酶量的增加,酶解液中的多肽含量和羟自由基清除率的变化趋势基本相同,说明对羟自由基的清除作用主要来源于鱼鳞酶解液中的多肽。根据结果分析,取加酶量为 200 U/g、400 U/g、800 U/g作为正交试验考察水平。
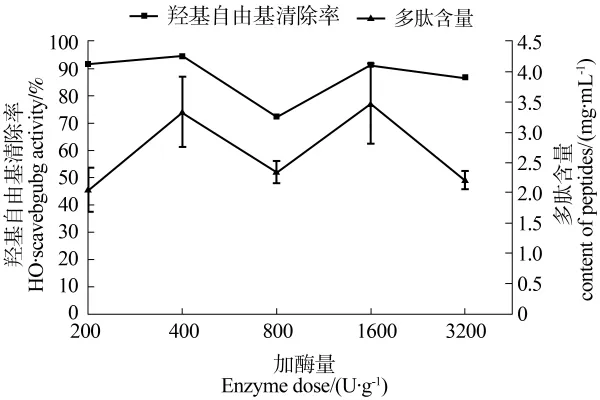
图2 加酶量对酶解液清除羟基自由基的影响Figure 2 The effect of enzyme additionon elimination ratio of hydroxyl radicals by enzymatic hydrolysate
2.3 酶解时间对鱼鳞蛋白酶解效果的影响
由图3可知,随着酶解时间的延长,多肽含量呈先下降再上升再下降的趋势,羟自由基清除率呈先上升再下降的趋势。当酶解时间为2 h时,酶解液对羟自由基清除能力最强,达到99.18%。实验表明,在前4 h,羟自由基清除率、酶解液中多肽含量都随着酶解的进行变化幅度较大,但酶解时间超过4 h后,酶解液中多肽含量随着酶解时间延长而逐渐下降,对羟自由基的清除作用也随之下降。可能是因为在反应的开始阶段,酶活力高,酶切位点多,水解效率高,水解度显著增大,随着酶解时间的延长,反应产物浓度增加,底物浓度减少,反应速率降低,水解趋于平缓,多肽被继续水解成氨基酸,此时羟基自由基的清除率逐渐降低,说明鱼鳞抗氧化活性主要来源于小分子肽,与前面的结论一致。因此,取酶解时间为2、3、4 h作为正交试验考察水平。
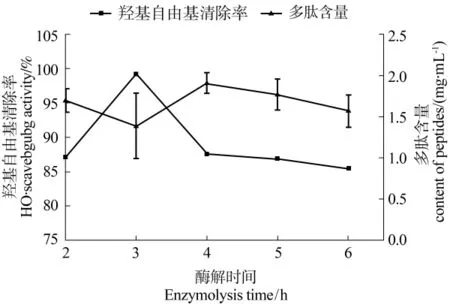
图3 酶解时间对酶解液清除羟基自由基的影响Figure 3 The effect of enzymolysis timeon elimination ratio of hydroxyl radicals by enzymatic hydrolysate
2.4 酶解温度对鱼鳞蛋白酶解效果的影响
酶解温度对鱼鳞蛋白酶解效果见图4,随着温度的升高,酶解液中的多肽含量呈先下降再上升再下降的趋势,羟自由基清除率呈先下降再上升再下降的趋势。当酶解温度为55℃时,酶解液对羟自由基清除能力最强,达到97.19%。由于本实验中所选用的碱性蛋白酶,其最适酶解温度范围为50~60℃。因此在一定的温度范围内,酶的活性会随着温度升高而增加,多肽含量也会随之增加,但超过酶的最适温度范围时,酶将逐渐失去活性,多肽含量也会随之降低,对羟基自由基的清除率也会下降。说明温度间接影响着酶解液对羟基自由的清除能力。根据如上结果,取温度为50、55、60℃作为正交试验考察水平。

图4 酶解温度对酶解液清除羟基自由基的影响Figure 4 The effect of enzymatic hydrolysis temperature on elimination ratio of hydroxyl radicals by enzymatic hydrolysate
2.5 正交试验设计确定最佳工艺
在初步单因素实验的基础上,筛选出酶解温度、酶解时间、加酶量以及料液比为主要影响因素,pH设定为9.0。通过L9(34)正交实验,确定鱼鳞蛋白酶解最佳工艺条件。具体影响因素和实验水平见表2。
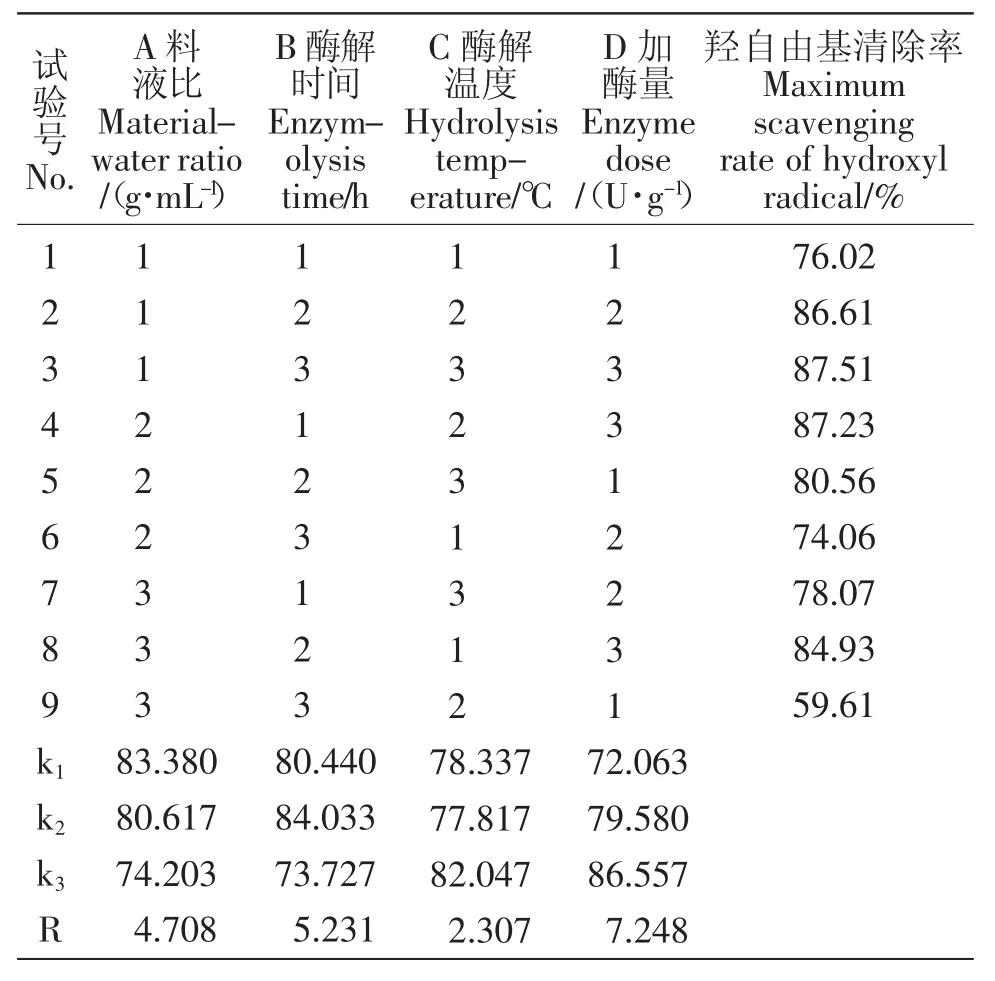
表2 工艺条件确定正交试验设计及结果Table 2 Orthogonal array design matrix and corresponding experimental results
由表2实验结果可知,对酶解效果的影响程度大小顺序为:D>B>A>C,即:加酶量>酶解时间>料液比>酶解温度。故根据正交试验结果,在pH值一定条件下,最终确定碱性蛋白酶水解草鱼鱼鳞制取抗氧化肽的最佳酶解工艺条件为A1B2C3D3,即温度60℃、加酶量800 U/g、时间3 h、料液比1∶15。在此酶解条件下测得鱼鳞抗氧化肽的浓度为0.1 mg/mL,此时羟自由基的清除率最高为88.71%。
2.5.1 超氧阴离子自由基清除能力
根据正交试验得出的最佳提取条件,酶解得到草鱼鱼鳞抗氧化肽。考察鱼鳞抗氧化肽在不同质量浓度时对邻苯三酚自氧化产生的超氧阴离子自由基的清除能力,并与阳性对照Vc进行比较,结果如图5所示。
超氧阴离子在生物体系中是细胞氧化反应的第一步产物,随后被分解为羟基自由基、过氧化氢及氧分子。而且超氧阴离子自由基是引起脂肪过氧化反应的重要因素,因此从生物体系中或者脂质含量丰富的食品中清除超氧阴离子自由基是非常重要的。由图5可知,当质量浓度小于0.2 mg/mL时,鱼鳞抗氧化肽对超氧阴离子自由基的清除能力与质量浓度呈一定的量效关系,清除率随着鱼鳞抗氧化肽的质量浓度的增加而逐渐增大。当鱼鳞抗氧化肽的质量浓度达到0.2 mg/mL时,清除率达到98%以上,接近于同质量浓度的Vc的清除率。与Vc相比,鱼鳞抗氧化肽呈现出较好的抗氧化活性。说明草鱼鱼鳞抗氧化肽在清除超氧阴离子自由基方面有着潜在的应用价值。
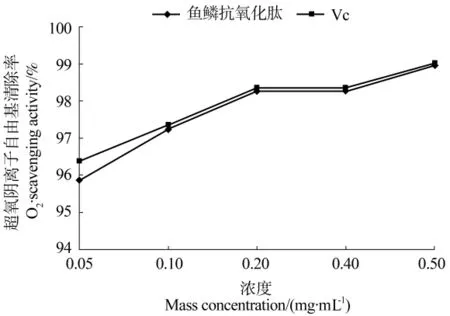
图5 鱼鳞抗氧化肽的超氧阴离子自由基清除能力Figure 5 The superoxide anion radical scavenging capacity of antioxidant peptides from fish scale
2.5.2 DPPH·自由基清除能力
根据正交试验得出的最佳提取条件,酶解得到草鱼鱼鳞抗氧化肽。考察鱼鳞抗氧化肽在不同质量浓度时对DPPH·自由基的清除能力,并与阳性对照Vc进行比较,结果如图6所示。

图6 鱼鳞抗氧化肽的DPPH·自由基清除能力Figure 6 The DPPH radical scavenging capacity of antioxidant peptides from fish scale
在评价化合物抗氧化性指标中,DPPH·自由基清除实验是一种传统、受欢迎的方法,其溶液呈现紫红色,在波长517 nm处有特征吸收峰。当在DPPH·溶液中加入抗氧化剂时,其颜色会变成淡黄色或者无色,在517 nm处的吸收峰就会减弱。由图6可知,对DPPH·自由基的清除率随鱼鳞抗氧化肽的浓度的增加而增大,说明鱼鳞抗氧化肽对DPPH·自由基的清除能力与质量浓度呈良好的线性关系。当浓度从0.05 mg/mL增加到0.5 mg/mL时,鱼鳞抗氧化肽对DPPH·自由基的清除率迅速上升到78.34%,而在相同浓度范围内,Vc对DPPH·自由基的清除率则基本保持在96%以上。在相同浓度水平下,鱼鳞抗氧化肽有一定的DPPH·自由基清除能力,但相对于Vc来说还有一定的差距。说明鱼鳞抗氧化肽的抗氧化活性小于Vc。有研究表明DPPH·清除能力与蛋白质水解程度和具有高疏水性氨基酸的小肽有关[24],因此,草鱼鱼鳞酶解液中所含的小肽物质能作为很好的质子供体,与自由基发生反应,使其生成稳定的物质;同时可以终止自由基连锁反应,达到抗氧化的作用。
2.6 抗氧化肽的活性在胃肠连续消化过程中的变化
由图7可知,经胃蛋白酶消化后,超氧阴离子清除率在前2 h内,随着消化时间延长而增大,加入糜蛋白酶和胰蛋白酶进行肠消化后,清除率先增大后缓慢下降,消化6 h后超氧阴离子清除率急剧下降;产生这种结果可能是因为在前4 h内,经胃肠消化,部分多肽降解为小分子肽,暴露出较多的活性基团,与自由基发生反应的机会增多,有利于其抗氧化活性的提高,同时小肽的进一步释放也有利于人体的吸收,在这个过程中,胃肠消化是对超氧阴离子清除能力是有益的,此时超氧阴离子清除率达到100%,增加了1.29%。消化4 h后,超氧阴离子清除率显著下降,可能是因为在蛋白酶的作用下,小肽继续分解为氨基酸,导致其抗氧化活性减弱。
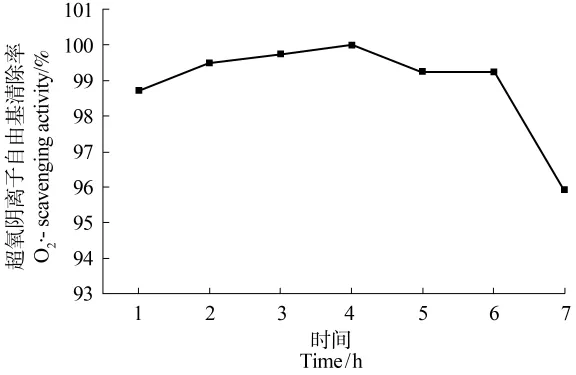
图7 鱼鳞抗氧化肽超氧阴离子自由基清除能力随胃肠消化时间变化的曲线Figure 7 Changes of scavenging reactiveoxygen radical scavenging activity of grass carp fish scales peptide during gastrointestinal digestion
在图8中,鱼鳞抗氧化肽经过胃肠消化后,羟基自由基清除率随着消化时间延长显著降低,此时羟基自由基清除率降低了13.57%,说明胃肠消化对羟基自由基清除能力是不利的。在这个过程中肠消化作用比胃消化作用更强,对分子的降解作用更显著,且对抗氧化活性影响更显著,这与顾敏[25]等研究结果相符。
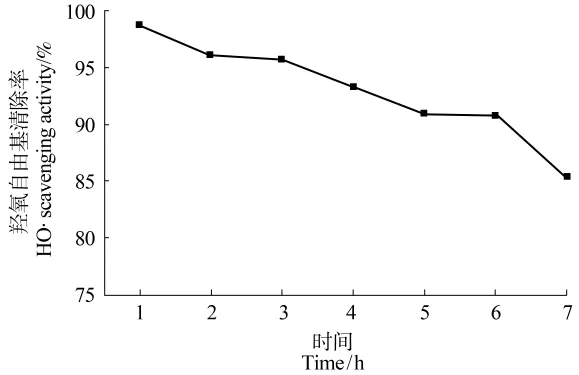
图8 鱼鳞抗氧化肽羟基自由基清除能力随胃肠消化时间变化的曲线Figure 8 Changes of hydroxyl radical scavenging activity of grass carp fish scales peptide during gastrointestinal digestion
3 结论
通过单因素试验、正交实验优化鱼鳞多肽含量及羟基自由基清除率,得出草鱼鱼鳞酶解最佳工艺条件为温度60℃、加酶量800 U/g、时间3 h、料液比1∶15。此时草鱼鱼鳞抗氧化肽的浓度为0.1 mg/mL,羟基自由基的清除率效果最好,达到88.71%。
随着抗氧化肽浓度的增加其DPPH自由基清除能力和超氧阴离子清除能力增大,在浓度为0.5 mg/mL时,鱼鳞抗氧化肽清除DPPH自由基能力达到Vc的81.1%;对超氧阴离子自由基清除率为98.97%。在体外模拟胃肠连续消化前4 h过程中,胃肠消化是对超氧阴离子清除能力是有益的,其抗氧化稳定性较好;消化4 h后,随时间延长活性显著下降,而在整个消化过程中胃肠消化对羟基自由基清除能力是不利的。
[1]农业部渔业渔政管理局.中国渔业统计年鉴[Z].北京:中国农业出版社,2014.
[2]杜云建,赵玉巧,李念念.酶解法制备草鱼鱼鳞多肽及其清除羟自由基的研究[J].食品科学,2010,31(7):168-172.
[3]王希搏.鱼鳞有机酸钙、胶原蛋白及胶原多肽联产工艺与工厂设计[D].武汉:华中农业大学,2013.
[4]卢昭.草鱼鱼鳞胶原蛋白提取分离工艺的研究[D].合肥:安徽农业大学,2013.
[5]张俊杰,曾庆孝.鱼鳞的开发利用前景[J].中国水产,2004(5):74-75.
[6]刘丹.秋刀鱼蛋白抗氧化肽的分离纯化及其抗疲劳功效研究[D].广州:华南理工大学,2015.
[7]游丽君.泥鳅蛋白抗氧化肽的分离纯化及抗疲劳、抗癌功效研究[D].广州:华南理工大学,2010.
[8]郭瑶.罗非鱼皮胶原肽的制备及其抗氧化活性的研究[D].青岛:中国海洋大学,2006.
[9]MORALES-MEDINA R,TAMM F,GUADIX A M,et al.Functional and antioxidant properties of hydrolysates of sardine(S.pilchardus) and horse mackerel(T.mediterraneus) for the microencapsulation of fish oil by spray-drying[J].Food Chemistry,2016,194:1208-1216.
[10]何娟,程晓凤,罗永康,等.鲢鱼皮抗氧化肽水解用酶的筛选研究[J].食品科技,2017(3):135-140.
[11]JE J Y,PARK P J,KIM S K.Antioxidant activity of a peptide isolated from Alaska pollack (Theragra chalcogramma)frame protein hydrolysat[eJ].BmjClinicalResearch,1993,307(6909):45-50.
[12]MENDIS E,RAJAPAKSE N,KIM S K.Antioxidant properties of a radical-scavenging peptide purified from enzymatically prepared fish skin gelatin hydrolysate.[J].Journal of Agricultural&Food Chemistry,2005,53(3):581-587.
[13]GIMÉNEZ B,ALEMÁN A,MONTERO P,et al.Antioxidant and functional properties of gelatin hydrolysates obtained from skin of sole and squid[J].Food Chemistry,2009,114(3):976-983.
[14]刘庆慧,王采理,张培新,等.鱼鳞酶解工艺的研究[J].渔业科学进展,1998(2):76-80.
[15]陈季旺,夏文水,黄爱妮,等.鱼降压肽的酶法制备工艺及其理化性质[J].水产学报,2007,31(4):512-517.
[16]涂宗财,郑明,陈钢,等.酶解鱼鳞蛋白制备抗氧化肽的研究[J].食品工业科技,2009(7):202-203.
[17]杨立,邹波,李玓瓅,等.鱼鳞抗氧化肽的酶法制备工艺及特性[J].食品科学,2011,32(12):115-119.
[18]付玉梅,许锦珍,廖群,等.Lowry法测定寡肽的研究[J].药物分析杂志,2011,31(4):739-741.
[19]徐怀德,殷金莲,陈沁.甲鱼酶解产物抗氧化功能的研究[J].中国食品学报,2007,7(4):25-32.
[20]PAN X,ZHAO Y,HU F,et al.Preparation and identification of antioxidant peptides from protein hydrolysate of skate(Raja porosa) cartilage[J].Journal of Functional Foods,2016,25:220-230.
[21]张尊听,杨伯伦,刘谦光,等.野葛根异黄酮成分的超声萃取及抗氧化作用[J].食品科学,2002,23(5):31-33.
[22]刘珊珊,敖静,谢宁宁,等.酪蛋白抗氧化肽的胃肠消化稳定性研究[J].中国食品学报,2014,14(2):47-54.
[23]刘萍.休闲鱼肉粒的体外消化模拟及其产物抗氧化效果评价[J].食品与机械,2014,30(6):135-138.
[24]KTARI N,JRIDI M,BKHAIRIA I,et al.Functionalities and antioxidant properties of protein hydrolysates from muscle of zebra blenny(Salaria basilisca)obtained with different crude protease extract[sJ].Food Research International,2012,49(2):747-756.
[25]顾敏.青养蛋白抗氧化肽的分离纯化及胃肠道消化特性研究[D].广州:华南理工大学,2014.
Enzymatic Preparation and Antioxidant Stability of the Peptide Extracted from Scales of Grass Carp
KE Qin-qin,LUO Yang-yang,HU Qiang,RAO Cheng-dong,YE Lang,LI Shu-hong,LI Mei-liang*
(College of Food Science,Sichuan Agricultural University,Ya'an 625014,Sichuan,China)
【Objective】In this paper,antioxidant peptides was hydrolyzed from grass carp fish scale by the alkaline protease,and its stability was discussed.【Methods】Optimum hydrolysis condition of alcalase enzyme was investigated with single factor experiment and orthogonal experiment and antioxidant peptides obtained by enzymatic hydrolysis were tested in vitro antioxidant and gastrointestinal digestion experiment.【Results】The polypeptide content's scavenging rates against hydroxyl free radicals was 88.71%under the optimal conditions.The antioxidant capacity decreased with the increasing of peptide mass concentration.When the concentration was 0.5 mg/mL,scale antioxidant peptide on DPPH radical scavenging capacity reached 81.1%of Vc and its clearance rates against superoxideanion free radicals was 98.97%.In the gastrointestinal digestion process,the antioxidant activity was stable in the first 4 hours;after 4 hours,anti oxidative stability declined significantly with the time increasing.【Conclusion】The results showed that the optimum values of temperature,enzyme dosage,solidto-water ratio and reaction time were 60 ℃,1∶15(g/mL),800 U/g and 3 hours;under these conditions,antioxidant peptides preparaed by alkaline protease hydrolysis of grass carp fish scales have good antioxidant activity and stability.
grass carp fish scales;hydrolysis;polypeptide;antioxidant activity;gastrointestinal digestion
TS254.9
A
1000-2650(2017)03-0433-06
10.16036/j.issn.1000-2650.2017.03.023
2017-05-18
四川省教育厅项目“鲢、草下脚料中活性肽的纯化及其铁螯合物的制备研究”(项目编号:14ZB0010)。
柯勤勤,在读研究生。*责任作者:李美良,博士,副教授,主要从事水产品加工理论与技术研究,E-mail:liml@sicau.edu.cn。
(本文审稿:张云松;责任编辑:秦碧雯;英文编辑:刘益平)
