拟南芥RING E3连接酶AtASSR1在盐胁迫响应中的功能初探
2017-11-10苗明军李跃建刘志斌李旭锋
杨 亮,常 伟*,李 志,苗明军,李跃建,刘志斌,李旭锋,杨 毅
(1.四川省农业科学院园艺研究所,蔬菜种质与品种创新四川省重点实验室,成都 610066;2.四川大学生命科学学院生物资源与生态环境教育部重点实验室,成都 610064)
拟南芥RING E3连接酶AtASSR1在盐胁迫响应中的功能初探
杨 亮1,常 伟1*,李 志1,苗明军1,李跃建1,刘志斌2,李旭锋2,杨 毅2
(1.四川省农业科学院园艺研究所,蔬菜种质与品种创新四川省重点实验室,成都 610066;2.四川大学生命科学学院生物资源与生态环境教育部重点实验室,成都 610064)
【目的】构建拟南芥AtASSR1转基因株系,研究并初步揭示RING E3连接酶AtASSR1在盐胁迫应答中的作用。【方法】利用农杆菌介导的花序浸染法,成功获得AtASSR1基因插入的纯合转基因株系,并通过检测盐胁迫处理前后,转基因株系及野生型、atassr1突变体植株中生理生化指标来初步揭示AtASSR1的功能。【结果】通过检测盐胁迫处理前后,不同基因型株系的H2O2、过氧化氢酶活性、丙二醛的含量,发现转基因株系中的过氧化氢酶活性最低,而积累的H2O2与丙二醛含量最多;分析脯氨酸含量发现,盐胁迫处理后突变体株系的脯氨酸含量积累最多。【结论】E3连接酶AtASSR1可能在介导植物响应盐胁迫等非生物胁迫的应答中发挥重要生理功能。
拟南芥;AtASSR1;E3连接酶;盐胁迫
盐胁迫是影响植物生长发育最重要的非生物胁迫之一,土壤盐渍化造成可耕地面积减少及农作物减产[1]。据统计,中国土地盐渍化面积达3.7×105km2,其中耕地面积达7×104km2[2]。不断扩大的盐渍化土地面积已对农业生产造成了重大损失。盐胁迫能够诱导植物体内活性氧的积累,使植物产生氧化胁迫应答。为避免过量产生的活性氧对自身的伤害,植物在进化过程中形成了一套去除及中和活性氧的防御体系,包括抗氧化酶系统和非酶系统的抗氧化剂类[3]。
泛素化作用是一种蛋白质的翻译后修饰过程,几乎存在于所有的真核生物当中[4]。泛素分子能通过底物蛋白的赖氨酸残基与其形成共价键而结合。通过泛素化作用,不仅能使底物蛋白发生稳定性及活性上的改变,而且其亚细胞定位也会相应得到调整[5]。对拟南芥基因组序列进行分析发现,超过6%的编码蛋白基因都直接或间接地参与到泛素介导的26S蛋白酶体降解途径(ubiquitin-mediaed 26S proteasome system,UPS)中[6]。UPS 主要由泛素、泛素激活酶 E1、泛素结合酶E2、泛素连接酶E3,以及26S蛋白酶体组成,不同组分之间通过连续的酶促反应,可将泛素分子连接至底物蛋白[7]。其中,泛素连接酶E3在此途径中起到识别底物与呈递泛素分子的作用,是泛素化过程最为关键的成员[8]。
根据结构域的差异,E3泛素连接酶可分为两大类:含有 HETC(homology to E6-AP C-terminus)结构域的E3连接酶和含有RING(really interesting new gene)finger结构域的E3连接酶。RING finger型E3连接酶包含一个锌指结构域(zinc finger motif),由半胱氨酸和组氨酸组成的8个氨基酸残基,与两个锌离子发生螯合作用,形成该类蛋白的催化活性中心。其中,以C3H2C3(RING-H2)构型和C3HC4(RINGHC)构型最为常见,约占RING finger E3总数的90%。在模式植物拟南芥中,分别包含241个C3H2C3型E3连接酶和186个C3HC4型E3连接酶,它们的主要差异是第5配基是否为组氨酸[9]。
单亚基RING E3连接酶在植物中呈现高度的多样化,仅在拟南芥中,包含的单亚基RING E3连接酶就多达469种[10]。最近几年的研究揭示出这一类E3连接酶在植物生长发育中具有相当重要的作用,直接或间接参与多种非生物胁迫响应。例如,RING E3连接酶CHYR1能够被SnRK2.6蛋白激酶磷酸化,从而作为正调控因子参与到脱落酸(abscisic acid,ABA)与干旱胁迫的响应中[11];KEG通过降解ABI5而对ABA信号通路起负调控的作用[12-13];SDIR1能够与SDIRIP1相互作用发生降解,后者能够调节ABA信号通路中的关键基因ABI5的表达,从而对ABA信号通路进行调控[14];AtAIRP1/2/3/4,及 RHA2a/2b都是ABA信号通路的正调控因子,同时,在植物中过表达上述蛋白的基因,都能够通过减少ABA介导的气孔开度,达到增强植物抗旱的表型[15-21]。
AtASSR1是本实验室经过对拟南芥基因组的生物信息学分析获得的一个具有体外活性的E3连接酶,运用RT-PCR的方法克隆出AtASSR1的编码区序列,并将其构建到植物表达载体pZh01中,通过农杆菌介导的花序浸染法对该基因的拟南芥TDNA插入突变体进行遗传转化,筛选后,成功得到纯合的转基因阳性株系,并对得到的转基因株系连同野生型与突变体一起,进行了盐胁迫处理前及处理后的生理生化指标检测,为进一步研究AtASSR1在植物盐胁迫应答中的功能奠定了基础。
1 材料和方法
1.1 实验材料
本研究所用拟南芥(Arabidopsis thaliana)的生态型背景均为哥伦比亚型(Columbia)拟南芥;野生型拟南芥(Col-0)为本实验室保存;突变体atassr1(Salk_115341)购于拟南芥生物资源中心(Arabidopsis Biological Resource Center,ABRC)。
植物总RNA提取试剂盒购自天根生化科技有限公司;反转录试剂盒、各种限制性内切酶、T4 DNA连接酶、反转录试剂盒购自大连宝生物公司;MDA、CAT试剂盒购自南京建成生物工程研究所;DAB购自AMRSCO公司;潮霉素(hygromycin)购自Roche公司;SYBGreen购自Bio-Rad公司;引物合成与测序均交由成都擎科梓熙生物技术有限公司;植物表达载体pZh01由本实验室保存。
1.2 实验方法
1.2.1 植物培养
将拟南芥种子浸泡于30%的漂白溶剂(包含1.5%V/V的次氯酸钠与0.1%V/V的Triton X-100)中灭菌15min,随后用无菌的ddH2O清洗4次,均匀平铺在1/2 MS固体培养基(0.8%W/V琼脂,1%W/V蔗糖)中,4℃避光春化2 d,转移到22℃温室培养5~7 d后移植至培养土中,光周期为16 h光照/8 h黑暗,温度22℃,湿度70%,光照强度120 mol/m2·s。
1.2.2 植物表达载体的构建
利用 TAIR(http://www.arabidopsis.org/)上已公布的AtASSR1的编码区序列设计全长引物,序列为AtASSR1-CDS-F:5’-CGC GGA TCCATG GCT AAA TTA TCT TTC AAG G-3’和AtASSR1-CDS-R:5’-CGA GCT CTC TCA CAT GGA AAT CGT AAG GAG-3’,分别包含BamHI与Ecl136II酶切位点。提取生长10d后的野生型拟南芥幼苗总RNA,反转录成cDNA后,以此为模板,利用上述全长引物进行PCR扩增。对PCR产物进行回收后,利用BamHI与Ecl136II内切酶将片段连入植物表达载体pZh01中,转化大肠杆菌感受态细胞JM109,选取部分单克隆进行PCR及酶切验证后,进行测序,经验证正确后即构建成植物表达载体pZh01-AtASSR1。
1.2.3 转基因株系的获得及鉴定
将pZh01-AtASSR1质粒转入农杆菌EHA105感受态细胞,验证筛选出正确克隆后,挑取单菌落,转接入LB液体培养基(利福平:75 mg/L;卡那霉素:50 mg/L)中进行扩大培养,28℃振荡培养至OD值在0.8~1.2之间,离心收集菌体后,用浸染液(1/2 MS液体培养液;5%蔗糖)重悬,调OD值至0.6~0.8,加入 silwet L-77(0.02%V/V),静置 1 h;将 4 周大已去除荚果的拟南芥atassr1突变体花序浸入浸染液中约30 s;浸染完成的拟南芥花序用保鲜膜包裹,置于温室中避光培养16 h以上,随后恢复正常培养条件生长。
将收获的T0代种子经表面灭菌后,平铺于含有25 mg/L潮霉素(hygromycin,Hyg)的 1/2 MS固体培养基上,4℃春化2 d后,于正常生长条件下进行培养筛选,7 d后,将阳性幼苗小心转移至培养土中继续生长,2周后,提取转基因幼苗的DNA,PCR检测潮霉素磷酸转移酶基因Hpt的插入情况,引物为HygII-F:5’-CTA TTT CTT TGC CCT CGG ACG AG-3’和 HygII-R:5’-G ATT CCG GAA GTG CTT GAC AT-3’。
单株收集T1代转基因株系的种子,继续进行潮霉素筛选,继代培养4周后,提取叶片RNA,通过定量RT-PCR的方法检测目的基因AtASSR1的表达情况,所用定量引物为AtASSR1-F:5’-ATTG GCG AGG GAG ATC ACA GTCA-3’和 AtASSR1-R:5’-ACG CAT ACA CTT GAT CTG GAA CCA-3’,内参选择拟南芥肌动蛋白基因2[22](AtActin 2),引物序列为 Actin2-RT-F:5’-GCA CCA CCT GAA AGG AAG TAC A-3’和 Actin2-RT-R:5’-CGA TTC CTG GAC CTG CCT CAT C-3’。对T2代株系进行单株收种后,若在潮霉素筛选培养基中不再出现分离比,即可认为该株系为纯合的单位点插入转基因株系,可用于后续的表型分析实验。
1.2.4 DAB染色
剪取3周大的幼苗叶片,经150 mM NaCl胁迫处理6 h后,进行DAB染色[23]。
1.2.5 不同抗氧化酶的提取与分析
150 mM NaCl处理3周大的幼苗4 d后,分别剪取野生型、突变体及转基因株系的叶片0.1 g,置于液氮中充分研磨,按照南京建成生物工程研究所的丙二醛提取试剂盒及过氧化氢酶提取试剂盒的操作步骤完成提取与检测。在进行过氧化氢酶活性测定前,利用考马斯亮蓝法检测不同样本中总蛋白浓度。
1.2.6 脯氨酸含量测定
150 mM NaCl处理3周大的幼苗4 d后,分别剪取野生型、突变体及转基因株系的叶片0.2 g,置于液氮中充分研磨,测定各自叶片中脯氨酸的含量[24]。
2 结果与分析
2.1 AtASSR1的克隆及植物表达载体的构建
AtASSR1基因位于拟南芥第5对染色体上,全长2155 bp,包含 5个外显子与 4个内含子,除去内含子的基因编码区全长为729 bp。分析该基因编码的氨基酸序列,全长为242个氨基酸,编码的蛋白质分子量为28.1 kDa,等电点pI=7.49。对该蛋白的结构域进行分析(http://smart.embl-heidelberg.de/)发现,在其第144位至181位氨基酸残基之间包含一个RING结构域,该结构域属于典型的C3HC4型RING结构域,是E3连接酶的催化活性中心(图1a)。采用http://www.expasy.org/网站上的SWISS-MODEL程序,预测了该蛋白的三维结构(图1b),可以看到,在蛋白的RING结构域中,包含2个锌离子及α-螺旋及β旋片状折叠。以拟南芥cDNA为模板,通过引物对AtASSR1-CDS-F与AtASSR1-CDS-R进行PCR扩增,随后,利用琼脂糖凝胶电泳检测扩增产物,获得大小约为750 bp的电泳条带(图1c)。
将扩增得到的AtASSR1全长片段经过BamHI与Ecl136II内切酶酶切后,连入经相同内切酶处理的植物表达载体pZh01中,经过酶切验证及测序后,将序列正确的载体保留备用,至此构建成pZh01-AtASSR1,具体构建过程如图2所示。
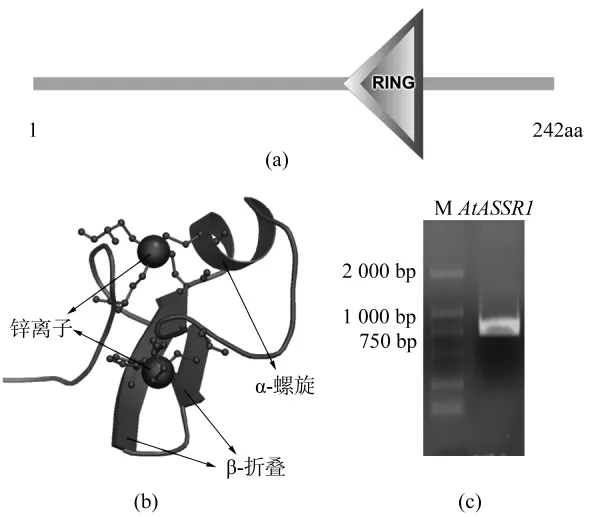
图1 AtASSR1结构域分析及其基因的克隆Figure 1 Analysis and identification of AtASSR1 domain and full-length cDNA sequences
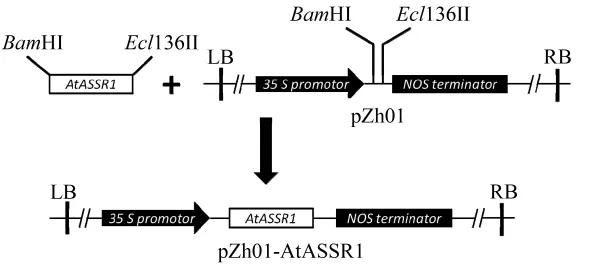
图2 植物表达载体pZh01-AtASSR1构建过程Figure 2 Schematic diagram of the construction of plant expression vector pZh01-AtASSR1
2.2 转基因株系的获得及鉴定
通过农杆菌介导的花序浸染法转化纯合的atassr1突变体,将获得的T0代转基因种子在含有潮霉素的MS筛选培养基上进行筛选,对潮霉素表现抗性的T1代转基因拟南芥植株(图3a),提取其叶片基因组DNA,利用特异引物检测pZh01载体中潮霉素抗性基因Hpt的插入情况,并以pZh01-AtASSR1质粒与野生型拟南芥植株(wild type,WT)DNA分别作为正负对照。如图3b所示,1~4泳道检测的转基因株系 C-2、C-6、C-8、C-12以及质粒正对照均能扩增出预期大小的片段,而在野生型拟南芥WT中不能扩增出目的片段,说明pZh01-AtASSR1质粒片段成功插入atassr1突变体基因组中。
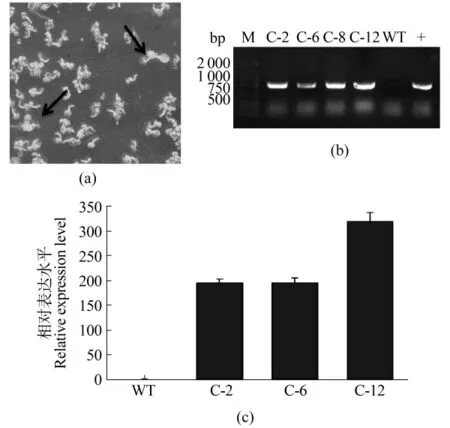
图3 阳性转基因株系的筛选及鉴定Figure 3 Selection and identification of positive transgenic plants
在Hpt检测呈阳性的株系中,单株收取T1代转基因阳性株系的种子,将其铺于含有潮霉素的MS筛选培养基上进行分离比的统计,并观测分离得到纯合转基因株系。将纯合株系幼苗移栽生长3周后,提取叶片RNA,通过定量RT-PCR检测目的基因AtASSR1的mRNA水平。如图3c所示,转基因阳性株系C-2、C-6、C-12中AtASSR1的表达水平较野生型拟南芥有明显升高,升高倍数均在200倍以上,其中,C-12株系中的AtASSR1的表达水平最高,是野生型株系的318倍。以上结果说明,AtASSR1基因成功转入突变体植株中,表达量符合预期,可用于后续表型分析。
2.3 盐胁迫处理对不同基因型株系幼苗根长的影响
为了探究AtASSR1对植物盐胁迫下的响应,将经过春化的野生型、突变体及转基因株系的种子播种于1/2 MS固体平板上,萌发3 d后,分别移至正常和含有150 mM NaCl的1/2 MS平板上继续进行垂直培养,5 d后观察并测量不同株系间根长的差异。如图4所示,在正常1/2 MS平板生长的植株,各株系均生长良好,并无明显差异;当盐浓度升高至150 mM时,突变体的生长状况明显要好于野生型与转基因株系。对根长的统计结果显示,在盐浓度为150 mM时,转基因株系与野生型及突变体根长出现显著性差异,说明由于AtASSR1基因在转基因株系中的超量表达导致了转基因株系对Na+的敏感性增强,从而抑制了植物的生长。
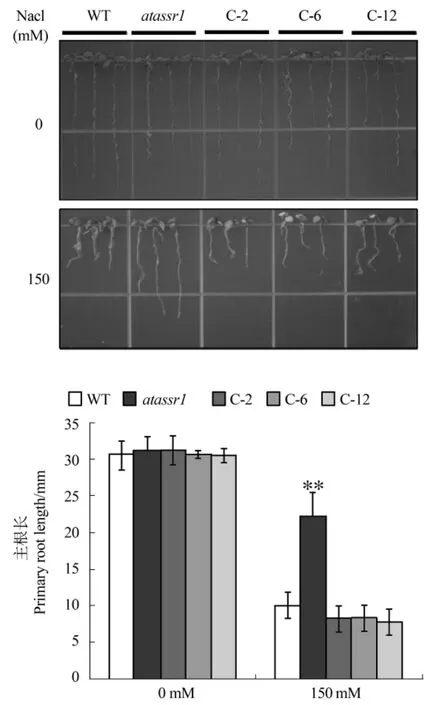
图4 盐胁迫对不同株系幼苗根长的影响Figure 4 Effect of salt press on seedlings of different transgenic lines
2.4 过量表达AtASSR1基因导致植物体内过氧化物的含量增加
先前的研究表明,AtASSR1基因在成熟衰老的组织中积累量多,并且受氧化胁迫诱导明显,表明AtASSR1可能直接或间接参与拟南芥体内的氧化代谢反应[25]。为进一步研究AtASSR1在氧化代谢反应中的作用,首先通过二氨基联苯胺(3,3’-diaminobenzidine,DAB)对盐胁迫处理后的野生型、atassr1突变体及转基因株系C-2、C-6、C-12的叶片进行染色,以检测处理前后叶片中H2O2的含量。DAB染色后发现,转基因株系C-2、C-6、C-12在盐胁迫处理前,其褐色面积及深度就大于野生型及突变体株系(图5a),表明转基因株系较野生型和突变体在体内积累了更多的H2O2;相反,突变体株系中的H2O2的积累量最低。而盐胁迫处理之后,转基因株系中的H2O2积累的更多,导致褐色现象更加明显。
为进一步确认转基因株系中H2O2的过量积累是否是由其体内抗氧化酶活性变化引起的,对关键的抗氧化酶过氧化氢酶(CAT)以及反映植物膜脂过氧化指标的丙二醛(MDA)进行了测定。结果表明,在NaCl处理前,转基因株系中的CAT含量低于野生型及突变体,150 mM NaCl处理后,尽管CAT在不同株系中的含量都有所提高,但仍表现为转基因株系中最低,而突变体中最高(图5b)。同时,MDA的含量在NaCl处理前后均表现为转基因株系中最高,突变体中最低。以上结果说明,植株中过量表达AtASSR1基因能够减少或抑制植物体内过氧化氢酶的活性,破坏了机体清除ROS的机制,导致体内ROS的积累量增加。
2.5 盐胁迫下不同基因型株系中脯氨酸含量的差异
脯氨酸不仅是植物蛋白质的组成部分,而且可以游离状态存在于植物体中,当植物遭受逆境胁迫时,其体内脯氨酸大量积累,并作为一种渗透调节物质,减轻植物细胞在逆境下的损害。因此,植物体内的脯氨酸含量在一定程度上可作为其抗逆性的指标。为研究AtASSR1是否会对植物的抗逆性产生影响,检测了野生型、atassr1突变体及转基因株系C-2、C-12在150 mM NaCl处理前后,各自体内脯氨酸含量的变化情况。如图6所示,未经盐胁迫处理之前,不同基因型株系中的脯氨酸含量基本一致;但是在150 mM NaCl胁迫条件下,atassr1突变体中的脯氨酸含量明显高于野生型与两个转基因株系中的脯氨酸含量,并且,两个转基因株系C-2与C-12中的脯氨酸含量是最低的。这表明,AtASSR1在突变体中的过量表达很可能降低了植株对盐胁迫或渗透胁迫的耐受性。
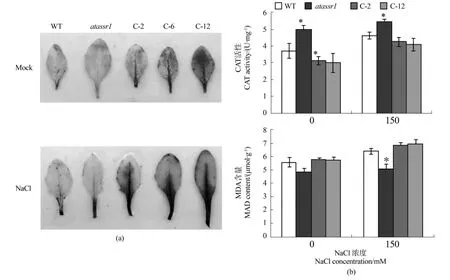
图5 转AtASSR1基因后植株对盐胁迫应答表型分析Figure 5 Phenotypes of transgenic plants AtASSR1 under abiotic stress
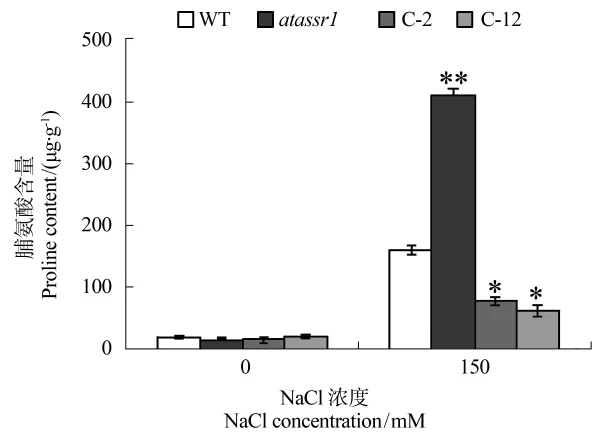
图6 盐胁迫处理前后不同基因型株系中脯氨酸含量的检测Figure 6 Effects of salt stress on activities of proline content in different genotype lines
3 讨论与结论
活性氧(ROS)作为一种信号分子在介导植物应对生物与非生物胁迫的响应过程中具有重要的功能[26]。当植物遭受非生物胁迫,如高盐、干旱、渗透时,会造成体内ROS的过量积累,打破了植物对活性氧清除的动态平衡。积累过多的ROS能够与植物体内的DNA、蛋白质和脂类物质发生反应,从而造成对植物体的伤害。由E3连接酶介导的蛋白泛素化在植物抵御非生物胁迫中起到关键的作用[27-29]。但是,目前在植物中发现的包含RING结构域的E3连接酶,如 KEG、SDIR1、OsHTAS、AtAIRP1/2/3/4 等[12,15-18,21,30],大都与ABA介导的干旱耐受相关,而参与植物氧化胁迫调控的RING E3连接酶鲜有报道。
本研究首先以一个能够受H2O2诱导表达上调的E3连接酶基因拟南芥突变体为母本,通过农杆菌介导的方法筛选出纯合的转基因株系,并在DNA水平与RNA水平分别验证了转基因株系构建成功(图3)。盐胁迫处理不同株系幼苗结果显示,AtASSR1基因的过量表达导致了转基因株系对Na+的敏感性增强(图4)。对NaCl处理前后的离体叶片进行DAB染色结果显示,转基因株系能够在体内积累更多的H2O2(图5a)。并且进一步分析不同株系中过氧化氢酶CAT与丙二醛MDA的含量,发现转基因株系中的CAT含量最低,而MDA含量最高(图5b)。由于过氧化氢酶是广泛存在于动植物中的一种催化过氧化氢分解成氧和水的酶类,主要定位于过氧化物酶体中,是生物防御体系的关键酶之一。植物体内的CAT与其调节非生物胁迫反应之间的关系相当密切,如在农作物中过量表达CAT基因,或者提高CAT的活性,均能够使植物对非生物胁迫的耐受性增加[31]。与此同时,当植物体内的ROS无法及时分解时,会使细胞的膜脂发生过氧化作用,丙二醛MDA既是该作用的最终分解产物,对其含量的测定可以反映植物所遭受的氧化胁迫损害的程度[32]。对不同株系进行NaCl处理后,转基因株系中的CAT与MDA的变化趋势并没有发生明显变化,仍然表现为CAT活性最高而MDA含量最低(图5b)。这一结果表明,AtASSR1的过量表达在植物正常生长条件下就打破了其体内活性氧产生与分解的平衡,考虑到AtASSR1是一个具有RING结构域的E3连接酶,推测其可能是参与泛素化降解活性氧分解代谢过程中的关键酶类。通过检测NaCl处理前后不同株系中脯氨酸含量分析结果显示,盐胁迫处理后突变体内的脯氨酸含量明显高于野生型与转基因株系,而植物体内的脯氨酸水平与其抗逆性成正相关,这表明,AtASSR1的过量表达很可能降低了植株对非生物胁迫的抗性。同时,本研究也发现,尽管C-12转基因株系的AtASSR1表达量要高于C-2株系,但并未发现它们的CAT活性、MDA含量及脯氨酸含量存在显著性差异,推测可能是由于植物体内存在对该基因超量表达的反馈抑制效应。
综上所述,本研究成功构建了AtASSR1单拷贝插入的纯合转基因株系,通过分析野生型、突变体、转基因株系中过氧化物酶的活性、丙二醛与脯氨酸的含量,证实了AtASSR1能够参与植物对逆境胁迫的响应,这项研究结果为进一步研究包含RING结构域的E3连接酶同植物胁迫应答之间的互作关系奠定了基础。
[1]ZHU J K.Abiotic stress signaling and responses in plants[J].Cell,2016,167(2):313-324.
[2]WANG J,HUANG X,ZHONG T,et al.Review on sustainable utilization of salt-affected land[J].ActaGeographicaSinica,2011,66(5):673-684.
[3]DEMIDCHIK V.Mechanisms of oxidative stress in plants:From classical chemistry to cell biology[J].Environmental and Experimental Botany,2015(109):212-228.
[4]STONE S L.The role of ubiquitin and the 26S proteasome in plant abiotic stress signaling.[J].Frontiers in Plant Science,2014,5(5):135.
[5]LEE J-H,KIM W T.Regulation of abiotic stress signal transduction by E3 ubiquitin ligases in Arabidopsis[J].Moleculesandcells,2011,31(3):201-208.
[6]VOERSTRA R D.The ubiquitin-26S proteasome system at the nexus of plant biology[J].Nature Reviews Molecular Cell Biologyl,2009,10(6):385-397.
[7]CHEN L,HELLMANN H.Plant E3 Ligases:Flexible enzymes in a sessile world[J].Molecular Plant,2013,6(5):1388-1404.
[8]KRAFT E,STONE S L,MA L,et al.Genome analysis and functional characterization of the E2 and RING-type E3 ligase ubiquitination enzymes of Arabidopsis[J].Plant Physiol,2005,139(4):1597-1611.
[9]FREMONT P S.RING for destruction?[J].Current Biology,2000,10(2):84-7.
[10]STONE S L,GAO Y,DENG X W,et al.Genome analysis and functional characterization of the E2 and RING-Type E3 ligase ubiquitination enzymes of arabidopsis[J].Plant Physiology,2005,139(4):1597-611.
[11]DING S,ZHANG B,QIN F.Arabidopsis RZFP34/CHYR1,a ubiquitin E3 ligase,regulates stomatal movement and drought tolerance via SnRK2.6-Mediated phosphorylation[J].Plant Cell,2015,27(11):3228-3244.
[12]STONE S L,WILLIAM L A,FARMER L M,et al.KEEP ON GOING,a RING E3 ligase essential for Arabidopsis growth and development,is involved in abscisic acid signaling [J].Plant Cell,2006,18(12):3415-3428.
[13]LIU H,STONE S L.Abscisic acid increases Arabidopsis ABI5 transcription factor levels by promoting KEG E3 ligase self-ubiquitination and proteasomal degradation[J].Plant Cell,2010,22(8):2630-2641.
[14]ZHANG H,CUI F,WU Y,et al.The RING finger ubiquitin E3 ligase SDIR1 targets SDIR1-INTERACTING PROTEIN1 for degradation to modulate the salt stress response and ABA signaling in Arabidopsis[J].Plant Cell,2015,27(1):214-227.
[15]ZHANG Y,YANG C,LI Y,et al.SDIR1 is a RING finger E3 ligase that positively regulates stress-responsive abscisic acid sig-naling in Arabidopsis[J].Plant Cell,2007,19(6):1912-1929.
[16]CHO S K,RYU M Y,SEO D H,et al.The Arabidopsis RING E3 ubiquitin ligase AtAIRP2 plays combinatory roles with AtAIRP1 in abscisic acid-mediated drought stress responses[J].Plant Physiol,2011,157(4):2240-2257.
[17]KIM J H,KIM W T.The Arabidopsis RING E3 ubiquitin ligase AtAIRP3/LOG2 participates in positive regulation of high-salt and drought stress responses[J].Plant Physiol,2013,162(3):1733-1749.
[18]RYUMY,CHOSK,KIMWT.TheArabidopsisC3H2C3-typeRING E3 ubiquitin ligase AtAIRP1 is a positive regulator of an abscisic acid-dependent response to drought stress[J].Plant Physiol,2010,154(4):1983-1997.
[19]BU Q,LI H,ZHAO Q,et al.The Arabidopsis RING finger E3 ligase RHA2a is a novel positive regulator of abscisic acid signaling during seed germination and early seedling development[J].Plant Physiol,2009,150(1):463-481.
[20]LI H,JIANG H,BU Q,et al.The Arabidopsis RING finger E3 ligase RHA2b acts additively with RHA2a in regulating abscisic acid signaling and drought response[J].Plant Physiol,2011,156(2):550-563.
[21]YANG L,LIU Q,LIU Z,et al.Arabidopsis C3HC4-RING finger E3 ubiquitin ligase AtAIRP4 positively regulates stress-responsive abscisic acid signaling[J].Journal Integrative Plant Biology,2016,58(1):67-80.
[22]PAGNUSSAT G C,YU H J,SUNDARESAN V.Cell-fate switch of synergid to egg cell in Arabidopsis eostre mutant embryo sacs arises from misexpression of the BEL1-like homeodomain gene BLH1[J].Plant Cell,2007,19(11):3578-3592.
[23]刘鹏,王帅帅,杨高山,等.农杆菌介导瞬时沉默小麦HCP1的研究[J].中国农业科学,2015,48(20):4188-4196.
[24]KALIFA Y,GILAD A,KONRAD Z,et al.The water-and saltstress-regulated Asr1(abscisic acid stress ripening)gene encodes a zinc-dependent DNA-binding protein [J].Biochem Journal,2004,381(2):373-378.
[25]李俊容,杨凤玺,刘志斌,等.拟南芥AtOHRP1在氧化胁迫应答中的功能初探[J].中国农业科技导报,2013(5):93-99.
[26]BOSE J,RODRIGO-MORENO A,SHABALA S.ROS homeostasis in halophytes in the context of salinity stress tolerance[J].Journal of Experimental Botany,2014,65(5):1241.
[27]LYZENGA W J,STONE S L.Abiotic stress tolerance mediated by protein ubiquitination[J].Journal Experimental Botany,2012,63(2):599-616.
[28]SADANANDOM A,BAILEY M,EWAN R,et al.The ubiquitin-proteasome system:central modifier of plant signalling[J].New Phytologist,2012,196(1):13-28.
[29]YU F,WU Y,XIE Q.Ubiquitin-proteasome system in ABA signaling:from perception to action[J].Molecular Plant,2016,9(1):21-33.
[30]LIU J,ZHANG C,WEI C,et al.The RING finger ubiquitin E3 ligase OsHTAS enhances heat tolerance by promoting H2O2-Induced stomatal closure in rice[J].Plant Physiol,2016,170(1):429-443.
[31]NAGAMIYA K,MOTOHASHI T,NAKAO K et al.Enhancement of salt tolerance in transgenic rice expressing an Escherichia coli catalase gene,katE[J].Plant Biotechnology Reports,2007,1(1):49-55.
[32]FARMER E E,MUELLER M J.ROS-Mediated lipid peroxidation and RES-activated signaling[J].Annual Review of Plant Biology,2013,64(1):429.
Preliminary Study on Function of Arabidopsis RING E3 Ligase AtASSR1 in Salt Stress Response
YANG Liang1,CHANG Wei1*,LI Zhi1,MIAO Ming-jun1,LI Yue-jian1,LIU Zhi-bin2,LI Xu-feng2,YANG Yi2
(1.Horticulture Research Institute,Sichuan Academy of Agricultural Sciences,Vegetable Germplasm Innovation and Variety Improvement Key Laboratory of Sichuan Province,Chengdu 610066,China;2.Key Laboratory of Bio-resources and Eco-environment,Ministry of Education,College of Life Science,Sichuan University,Chengdu 610064,China)
【Objective】The AtASSR1 transgenic plants were constructed and studied to investigate the function of RING E3 ligase AtASSR1 plays an important effect on the responses of Arabidopsis to salt stress.【Method】AtASSR1 homozygous transgenic lines were successfully constructed through the Agrobacterium tumefaciens-mediated transformation.This studies was performed to preliminarily reveal the function of AtASSR1 by analyzing the physiological and biochemical indexes in wild-type,atassr1 mutant,and transgenic lines treated with or without NaCl.【Results】The results show that the transgenic lines have the lowest activity of CAT and the highest content of H2O2and MDA by analyzing the content of H2O2,catalase(CAT),and Malondialdehyde(MDA)in different genotypes of lines treated with or without NaCl.The atassr1 mutant accumulates the highest content of proline after salt stress by analyzing the content of proline in different genotype lines.【Conclusion】Alloftheseresultssuggestedthat AtASSR1 may play an important physiological function in plant abiotic stress responses.
Arabidopsis thaliana;AtASSR1;E3 ligase;salt stress
Q943.2;Q945.78
A
1000-2650(2017)03-0381-08
10.16036/j.issn.1000-2650.2017.03.015
2017-05-05
四川省科技计划应用基础项目(2016JY0164);四川蔬菜(花卉)种质创新与产业提升关键技术研发项目(2017CYTS-001)。
杨亮,博士,助理研究员,主要研究方向为蔬菜分子育种,E-mail:yangshaoliang@163.com。*责任作者:常伟,硕士,副研究员,主要研究方向为蔬菜育种与栽培,E-mail:mchangwei@sohu.com。
(本文审稿:武 晶;责任编辑:刘诗航;英文编辑:刘诗航)
