根皮苷分子印迹聚合物制备及其识别性能研究
2017-11-10郭秀春陈眩杰王海辉周文辉
郭秀春, 陈眩杰, 王海辉, 袁 萌,周文辉*
(1.河南大学 药学院,河南 开封 475004; 2.河南大学 特种功能材料重点实验室,河南 开封 475004)
根皮苷分子印迹聚合物制备及其识别性能研究
郭秀春1, 陈眩杰1, 王海辉2, 袁 萌2,周文辉2*
(1.河南大学 药学院,河南 开封 475004; 2.河南大学 特种功能材料重点实验室,河南 开封 475004)
为了制备对根皮苷具有仿生识别能力的分子印迹聚合物,利用本课题组所建立的紫外光谱法筛选并确定了制备根皮苷分子印迹聚合物所需的功能单体(4-乙烯基吡啶)及其与模板分子间的最佳比例(6∶1). 然后以根皮苷为模板分子,4-乙烯基吡啶为功能单体,乙二醇二甲基双丙烯酸酯为交联剂,合成了根皮苷分子印迹聚合物. 经研磨、过筛、索氏提取去除模板分子后得到相应的分子印迹聚合物颗粒. 采用静态平衡吸附实验研究了该分子印迹聚合物对根皮苷的结合与识别能力. 结果表明与化学组成相同的非印迹聚合物相比,根皮苷分子印迹聚合物对根皮苷具有较好的识别性能.
分子印迹聚合物;紫外光谱;功能单体;根皮苷
根皮苷是由DE KONINCK于1835年从苹果树皮中分离出来的一种苦味物质,属于植物类黄酮-二氢查尔酮苷,是根皮素的2′-D-葡萄糖苷[1-3]. 根皮苷是苹果的特征酚类物质,其广泛存在于苹果的根、茎、芽、叶、果实中,因此苹果常常作为提取根皮苷的重要资源. 自从被发现以来,根皮苷由于具有降低血糖、改善记忆力、抗氧化、抗癌等重要的生物活性,已经被用于人体药物、保健食品、化妆品等[4-14]. 目前根皮苷的主要来源仍为植物提取,其分离纯化的主要方法有:大孔树脂吸附法、聚酰胺柱层析分离法、化学萃取法、阴离子交换树脂法、高效离心分配色谱法和高速逆流色谱法等[15-17]. 大孔树脂法、聚酰胺柱层析分离法、化学萃取法和阴离子交换树脂法操作步骤较繁琐,耗时较长,消耗有机溶剂量大. 高效离心分配色谱法和高速逆流色谱法一般需要与其他检测技术联用,存在仪器设备昂贵的问题,仅适用于少量根皮苷的制备.
分子印迹技术是一种制备对模板分子具有特异识别能力的聚合物的技术,所制备的聚合物称为分子印迹聚合物[18]. 目前,分子印迹技术及分子印迹聚合物已经在色谱分离、传感器、催化剂、抗体模拟酶、药物手性拆分、药品质量控制等诸多领域得到了应用,并显示出诱人的应用前景[19]. 分子印迹聚合物的制备过程通常包括以下三个步骤:一、功能单体与模板分子之间通过相互作用形成功能单体-模板分子复合物;二、在引发剂的作用下,功能单体与交联剂(可能与功能单体相同)交联并形成共聚物,将功能单体上的功能基团在空间和方向上的排列方式固定下来;三、通过物理或化学的方法将模板分子除去. 这样所得到的分子印迹聚合物中存在与模板分子在空间、大小和结构上完全匹配并能与模板分子再结合的三维孔穴,因此模板分子可以被分子印迹聚合物选择性识别[20]. 功能单体在分子印迹聚合物对模板分子的识别中起到关键性作用,因此选择合适的功能单体及其与模板分子的比例是成功制备具有仿生识别能力分子印迹聚合物的关键. 随着各类分析及检测技术的发展,研究人员发展了多种功能单体选择方法[21],其中较为成熟和可行的方法有紫外光谱法[22-23],荧光光谱法[24-25],红外光谱法[26],氢核磁共振波谱法[27-28]以及计算机模拟计算法[29-31]等. 本课题组前期利用紫外光谱法所建立的筛选分子印迹聚合物功能单体及其比例的方法具有方法简单、设备价格低廉、灵敏度较高、易于推广等优点,适用于本体聚合法中功能单体种类及比例的选择[32].
本文报道了利用本课题组前期所建立的紫外光谱法筛选制备根皮苷分子印迹聚合物所需的功能单体(图1)及其与模板分子间的最佳比例,然后采用本体聚合法制备了根皮苷分子印迹聚合物. 经研磨、过筛、索氏提取去除模板分子后得到相应的分子印迹聚合物颗粒,采用静态平衡结合实验研究了其对根皮苷的仿生识别性能.
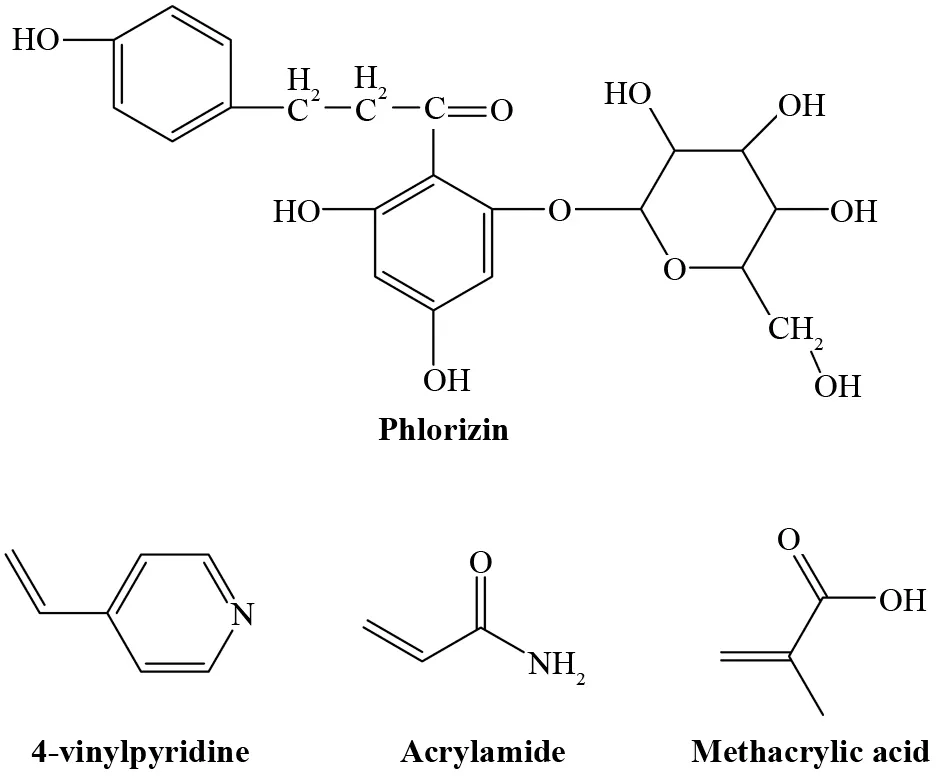
图1 根皮苷及三类功能单体的化学结构式Fig.1 Chemical structures of phlorizin and three different kinds of functional monomers
1 实验部分
1.1 材料与试剂
根皮苷购自Ark Pharm, Inc,纯度≥ 95%. 三类功能单体:甲基丙烯酸(MAA,酸性)、丙烯酰胺(AM,中性)和4-乙烯基吡啶(4-VP,碱性);交联剂:乙二醇二甲基丙烯酸酯(EGDMA);引发剂:偶氮二异丁腈(AIBN)均购自阿法埃莎中国化学有限公司. 乙腈,乙酸,甲醇,丙酮等溶剂均为分析纯,购自天津市科密欧化学试剂有限公司. 根皮苷、不同功能单体的母液均为5 mmol/L的乙腈溶液,使用前避光保存.
1.2 仪器与设备
Nanodrop2000c超微量分光光度计(美国赛默飞世尔科技有限公司)、KQ2200超声波清洗器(昆山舒美超声仪器有限公司)
1.3 紫外光谱研究
1.3.1 根皮苷、功能单体、根皮苷与功能单体混合溶液紫外光谱研究
根皮苷、功能单体、根皮苷与功能单体混合溶液制备方法如下:根皮苷母液50 μL,用乙腈超声定容至25 mL,得到浓度为 0.01 mmol/L的根皮苷待测液. 同样,分别量取三类功能单体母液 200 μL,再分别用乙腈超声定容至25 mL,得到浓度为0.04 mmol/L的三类功能单体待测液. 将50 μL根皮苷母液分别与200 μL三类功能单体母液混合,用乙腈超声定容至25 mL,得到根皮苷与功能单体混合溶液待测液. 各待测液室温静置过夜,次日在波长220~400 nm范围内进行紫外光谱扫描.
1.3.2 根皮苷、不同比例功能单体、根皮苷与不同比例功能单体混合溶液紫外光谱研究
对于确认能与根皮苷形成功能单体-根皮苷复合物的一种功能单体(本文筛选结果为4-乙烯基吡啶),移取不同体积(50~600 μL)的该功能单体母液,分别用乙腈超声定容至25 mL,可以得到浓度为0.01~0.12 mmol/L的该功能单体的待测液(对应根皮苷与功能单体的物质的量比为1∶1~1∶12). 根皮苷与不同比例该功能单体混合溶液待测液由50 μL根皮苷母液与不同体积(50~600 μL)该功能单体母液混合,用乙腈超声定容至25 mL得到. 各待测液室温静置过夜,次日在波长220~400 nm范围内进行紫外光谱扫描.
1.4 根皮苷分子印迹聚合物制备
根皮苷分子印迹聚合物制备采用本体聚合法[33],具体操作如下:将0.1 mmoL(0.043 6 g)模板分子根皮苷、6 mmoL(635 μL)功能单体4-乙烯基吡啶、30 mmoL(5 670 μL)交联剂乙二醇二甲基双丙烯酸酯、0.25 mmoL(41 mg)引发剂偶氮二异丁腈分散于7 mL乙腈中,超声10 min,氩气液面下鼓泡除氧15 min. 密封反应器,在氩气保护下油浴55 ℃反应24 h. 反应结束后将得到的块状聚合物充分研磨,分别过200目和400 目的标准筛,得到的聚合物颗粒的粒径为37~74 μm. 为了除去模板分子及未反应的功能单体及交联剂,用体积分数为20%的乙酸甲醇溶液在索氏提取器中回流提取48 h. 索氏提取后的聚合物颗粒用乙腈洗涤三次,并用丙酮反复沉降三次,最后真空干燥至恒重,得到根皮苷分子印迹聚合物颗粒. 空白非分子印迹聚合物颗粒的制备和处理步骤,除了不加模板分子根皮苷之外,其他步骤相同.
1.5 分子印迹聚合物对根皮苷的识别性能
分别称取10 mg分子印迹聚合物和非印迹聚合物颗粒,并分别加入5 mL质量浓度在0.5~25 mg/L的根皮苷乙腈溶液. 室温条件下,振荡反应8 h后高速离心,吸取上清液. 用紫外可见分光光度计扫描上清液的紫外可见光谱图,采用标准曲线法利用282 nm波长下的吸收检测上清液中根皮苷的含量,最后根据溶液吸附前后的浓度变化计算分子印迹聚合物和非印迹聚合物对根皮苷的吸附量,比较二者对根皮苷的识别能力.
2 结果与讨论
2.1 根皮苷、功能单体、根皮苷与功能单体混合溶液紫外光谱比较
理论上讲,如果模板分子与功能单体之间没有任何作用,则在任一波长下混合溶液的吸光度值是二者同等条件下的加和. 实际情况下,模板分子与功能单体因为带有各种不同性质的活性基团,在非极性溶剂里面二者之间往往会存在一定的相互作用,使得混合溶液的吸光度值与二者同等条件下的加和不同. 通常情况下,两者间的相互作用越强,则混合溶液的吸光度值与二者同等条件下的加和差别越大,这主要源于模板分子与功能单体相互作用越强,则复合物间的共轭结构越大或越紧密. 对于分子印迹技术而言,模板分子与功能单体之间的相互作用是分子印迹聚合物仿生识别能力的来源,因此可以通过紫外光谱研究模板分子与功能单体之间的相互作用,并以此来选择用来制备分子印迹聚合物时的功能单体和最佳比例. 图2是根皮苷、功能单体、根皮苷与功能单体混合溶液的紫外吸收光谱图. 从图2可以看出,根皮苷与功能单体混合溶液的紫外吸收光谱图与二者紫外吸收光谱图的加和有明显的区别. 说明实验中所选择的三类功能单体均能影响根皮苷的紫外光谱吸收,即三类功能单体均与根皮苷有相互作用,这与根皮苷中丰富的各类官能团有较大关系. 仔细对比紫外吸收光谱图会发现,在相同波长条件下甲基丙烯酸和丙烯酰胺与根皮苷混合溶液的吸光度值均小于二者的加和,而4-乙烯基吡啶与根皮苷混合溶液的吸光度值则大于二者的加和. 这一结果说明,根皮苷与4-乙烯基吡啶之间的相互作用非常明显. 可能的原因是根皮苷分子结构中有三个酚羟基,其具有明显的酸性,其可以与碱性功能单体(4-乙烯基吡啶)通过静电吸引而相互作用并形成氢键. 而稳定的氢键则增加了根皮苷分子结构中的共轭结构,因此明显增加了相同波长条件下的吸光度值.

图2 根皮苷、功能单体、二者混合溶液的紫外光谱Fig.2 UV absorption spectra of phlorizin, functional monomer and their mixture in acetonitrile
2.2 根皮苷与不同比例4-乙烯基吡啶混合溶液紫外光谱比较
分子印迹聚合物对模板分子的识别能力不仅与功能单体种类有关,也受到功能单体与模板分子之间的比例的影响. 图3是根皮苷与不同比例4-乙烯基吡啶混合溶液的紫外吸收光谱以及相应的差示紫外光谱. 如图3a所示,虽然随着4-乙烯基吡啶加入比例的逐渐提高,根皮苷与4-乙烯基吡啶混合溶液的紫外吸收逐渐增强,显示出明显的趋势性. 而相应的差示紫外光谱的变化趋势则明显不同,随着随着4-乙烯基吡啶加入比例的逐渐提高,差示紫外光谱表现出先增强后减小的趋势,当根皮苷与4-乙烯基吡啶的物质的量比为1∶6时,差示紫外光谱的吸光度值差值最大(图3b). 这一结果说明,1个根皮苷分子与6个4-乙烯基吡啶分子所形成的复合物应该最稳定,而以此比例所合成的分子印迹聚合物对根皮苷的识别能力也应该是最强的.

图3 根皮苷与不同比例4-乙烯基吡啶混合溶液的紫外吸收光谱(a)及差示紫外吸收光谱(b)Fig.3 UV absorption spectra (a) and differential UV absorption spectra (b) of phlorizin with different ratio of 4-vinyl pyridine in acetonitrile
2.3 分子印迹聚合物对根皮苷的识别性能
根据前述试验所筛选得到的功能单体及其与根皮苷的最佳比例,我们采用本体聚合法制备了根皮苷分子印迹聚合物. 为了研究所制备的分子印迹聚合物对根皮苷的识别性能,我们采用静态平衡吸附法测定了分子印迹聚合物对不同浓度根皮苷溶液的等温吸附曲线. 根据吸附前后根皮苷溶液浓度的变化,计算分子印迹聚合物对根皮苷的吸附量,其结果如图4所示. 从图4中可以明显看出,随着根皮苷溶液浓度的增大,分子印迹聚合物和非印迹聚合物对根皮苷的其吸附量均逐渐增大. 在相同根皮苷浓度的条件下,分子印迹聚合物对根皮苷的吸附量要明显高于非印迹聚合物,这说明所制备的分子印迹聚合物对根皮苷具有明显的识别能力. 非印迹聚合物对根皮苷的吸附属于物理吸附导致的非特异性吸附,而分子印迹聚合物对根皮苷的吸附则主要源于印迹位点引起的特异性吸附.

图4 MIP和NIP对根皮苷的吸附量Fig.4 Binding amounts of phlorizin by MIP and NIP
3 结论
本文采用紫外光谱法研究了根皮苷与不同功能单体之间的相互作用,实验结果表明根皮苷与4-乙烯基吡啶之间的相互作用较强,而当根皮苷与4-乙烯基吡啶的物质的量比为1∶6的时候二者间的相互作用最强. 根据这一结果,我们采用本体聚合法制备了根皮苷分子印迹聚合物并通过静态平衡吸附法测定了分子印迹聚合物对根皮苷的识别能力. 结果表明,与化学组成相同的非印迹聚合物相比根皮苷分子印迹聚合物对根皮苷具有较好的识别性能.
[1] DE KONINCK L. Ueber das phloridzin (phlorrhizin) [J]. European Journal of Organic Chemistry, 1835, 15(1): 75-77.
[2] DE KONINCK L. Weitere notiz über das phloridzin [J]. European Journal of Organic Chemistry, 1835, 15(3): 258-263.
[3] VERSARI A, BIESENBRUCH S, BARBANTI D, et al. Adulteration of fruit juices: dihydrochalcones as quality markers for apple juice identification[J]. LWT-Food Science and Technology, 1997, 30(6): 585-589.
[4] EHRENKRANZ J R L, LEWIS N G, RONALD K C, et al. Phlorizin: a review [J]. Diabetes/Metabolism Research and Reviews, 2005, 21(1): 31-38.
[5] EHRENKRANZ J. Compositions containing botanical extracts rich in phlorizin and methods for using such compositions in blood glucose modification and to affect aging [P]. U.S. Patent Application 11/336,629. 2006-1-20.
[6] GAUDOUT D, MEGARD D, ESTEVE C, et al. Phloridzin-rich phenolic fraction and use thereof as a cosmetic, dietary or nutraceutical agent [P]. U.S. Patent 7,041,322. 2006-5-9.
[7] REZK B M, HAENEN G R M M, VIJGH W J F, et al. The antioxidant activity of phloretin: the disclosure of a new antioxidant pharmacophore in flavonoids [J]. Biochemical and Biophysical Research Communications, 2002, 295(1): 9-13.
[8] SUKHORUKOV V L, KURSCHNER M, DILSK S, et al. Phloretin-induced changes of lipophilic ion transport across the plasma membrane of mammalian cells [J]. Biophysical Journal, 2001, 81(2): 1006-1013.
[9] VALENTA C, CLADERA J, OSHE P, et al. Effect of phloretin on the percutaneous absorption of lignocaine across human skin [J]. Journal of Pharmaceutical Sciences, 2001, 90(4): 485-492.
[10] RUPASINGHE H P V, YASMIN A. Inhibition of oxidation of aqueous emulsions of omega-3 fatty acids and fish oil by phloretin and phloridzin [J]. Molecules, 2010, 15(1): 251-257.
[11] STANGL V, LORENZ M, LUDWIG A, et al. The flavonoid phloretin suppresses stimulated expression of endothelial adhesion molecules and reduces activation of human platelets [J]. Journal of Nutrition, 2005, 135(2): 172-178.
[12] HASSAN M, YAZIDI C E, LANDRIER J F, et al. Phloretin enhances adipocyte differentiation and adiponectin expression in 3T3-L1 cells [J]. Biochemical and Biophysical Research Communications, 2007, 361(1): 208-213.
[13] LIST J F, WOO V, MORALES E, et al. Sodium-glucose cotransport inhibition with dapagliflozin in type 2 diabetes [J]. Diabetes Care, 2009, 32(4): 650-657.
[14] WILDING J P H, NOREOOD P, T’JOEN C, et al. A study of dapagliflozin in patients with type 2 diabetes receiving high doses of insulin plus insulin sensitizers [J]. Diabetes Care, 2009, 32(9): 1656-1662.
[15] 冯雪娇, 曹学丽, 李艳, 等. 根皮苷的应用及分离纯化研究进展[J]. 北京工商大学学报, 2008, 26(4): 13-16.
FENG X J, CAO X L, LI Y, et al. Applications of phlorizin and recent advances of its separation and purification [J]. Journal of Beijing Technology and Business University, 2008, 26(4): 13-16.
[16] 李荣济, 焦中高, 刘杰超, 等. 高效离心分配色谱(HPCPC)分离纯化苹果树枝中的根皮昔[J]. 果树学报, 2010, 27(4): 645-649.
LI R J, JIAO Z G, LIU J C, et al. Isolation and purification of phloridzin from apple branch by high performance centrifugal partition chromatography (HPCPC) [J]. Journal of Fruit Science, 2010, 27(4): 645-649.
[17] KAMMERER J, BOSCHET J, KAMMERER D R, et al. Enrichment and fractionation of major apple flavonoids, phenolic acids and dihydrochalcones using anion exchange resins [J]. LWT-Food Science and Technology, 2011, 44(4): 1079-1087.
[18] 姜忠义, 吴洪. 分子印迹技术[M]. 北京: 化学工业出版社, 2003.
JIANG Z Y, WU H. Molecular imprinting technology [M]. Beijing: Chemical Industry Press, 2003.
[19] 郭秀春, 周文辉. 分子印迹技术研究进展 [J]. 化学研究, 2012, 23(5): 103-110.
GUO X C, ZHOU W H. Research progress of molecular imprinting technology [J]. Chemical Research, 2012, 23(5): 103-110.
[20] 傅强, 曾爱国, 杜玮. 分子印迹技术与药物分析 [M]. 西安交通大学出版社, 2014.
FU Q, ZENG A G, DU W. Molecular imprinting technology and pharmaceutical analysis [M]. Xi An Jiao Tong University Press, 2014.
[21] KARIM K, BRETON F, ROUILLON R, et al. How to find effective functional monomers for effective molecularly imprinted polymers [J]. Advanced Drug Delivery Reviews, 2005, 57(12): 1795-1808.
[22] 高志刚, 周杰, 曲金详. 植物激素吲哚酸分子模板聚合物的分子识别特性 [J]. 分析化学, 2003, 31(10): 1173-1177.
Gao Z G, Z J, QU J X. Characteristics of molecular recognition of plant hormone1H-indole-3-acetic acid molecular template polymer [J]. Chinese Journal of Analytical Chemistry, 2003, 31(10): 1173-1177.
[23] 杜自卫, 刘学涌, 赵小东. 沉淀聚合法制备TNT分子印迹聚合物微球 [J]. 化学通报, 2006, 21(9): 78-85.
DU Z W, LIU X Y, ZHAO X D. Preparation of TNT molecularly imprinted polymer microspheres via precipitation polymerization [J]. Chemistry, 2009, 11: 1041-1044.
[24] 王华芳, 李文友, 何锡文, 等. 荧光法研究L氨基苯硼酸与牛血洁白蛋白间的相互作用 [J]. 化学学报, 2007, 65(1): 43-48.
WANG H F, LI W Y, HE X W, et al. Investigations of the interaction between 3-aminophenylboronic acid and bovine serum albumin using fluorimetry [J]. Acta Chimica Sinica-Chinese Edition, 2007, 65(1): 43-48.
[25] 张晓林, 苏立强, 梁云凯. 硅胶表面亮菌甲素分子印迹聚合物的制备及其性能研究 [J]. 化学通报, 2009, 8: 749-753.
ZHANG X L, SU L Q, LIANG Y K. Synthesis and evaluation of armillarisin a-imprinted polymer on silica surface [J]. Chemistry, 2009, 8: 749-753.
[26] 杨俊, 朱晓兰, 苏庆德, 等. 可天宁印迹聚合物分子识别特性的光谱与XPS研究[J]. 光谱学与光谱分析, 2007, 27(6): 1152-1155.
YANG J, ZHU X L, SU Q D, et al. Spectroscopy and XPS studies on molecular recognition of a molecularly imprinted cotinine-specific polymer [J]. Spectroscopy and Spectral Analysis, 2007, 27(6): 1152-1155.
[27] FARRINGTON K, MAGNER E, REGAN F. Predicting the performance of molecularly imprinted polymers: Selective extraction of caffeine by molecularly imprinted solid phase extraction [J]. Analytica Chimica Acta, 2006, 566(1): 60-68.
[28] 申中兰, 杨俊, 朱晓兰, 等. 甲胺磷分子印迹聚合物的结合机理及其分子识别特性的光谱学研究 [J]. 光谱学与光谱分析, 2009, 29(1): 78-81.
SHEN Z L, YANG J, ZHU X L, et al. Spectroscopy study of binding mechanisms and molecular recognition of methamidophos-specific moleculary imprinted polymer [J]. Spectroscopy and Spectral Analysis, 2009, 29(1): 78-81.
[29] LV Y Q, LIN Z X, TAN T W, et al. Application of molecular dynamics modeling for the prediction of selective adsorption properties of dimethoate imprinting polymer [J]. Sensors and Actuators B-Chemistry, 2008, 133(1): 15-23.
[30] 毕慧敏, 高玉红, 谢鹏涛, 等. 不同功能单体对分子印迹聚合物识别性能的模拟 [J]. 计算机与应用化学, 2009, 26(4): 501-503.
BI H M, GAO Y H, XIE P T, et al. Computer simulation of the recognizing characteristics of quercetin Polymers with different functional monomers [J]. Computers and Applied Chemistry, 2009, 26(4): 501-503.
[31] GHOLIVAND M B, KHODADADIAN M, AHMADI F. Computer aided-molecular design and synthesis of a high selective molecularly imprinted polymer for solid-phase extraction of furosemide from human plasma [J]. Analytica Chimica Acta, 2010, 658(2): 225-232.
[32] 郭秀春, 李圩田, 房鑫鑫, 等. 紫外光谱法选择大叶茜草素印迹聚合物制备功能单体[J]. 化学研究, 2015, 26(5): 480-485.
GUO X C, LI W T, FANG X X, et al. Selection of swertiamarin molecularly imprinted polymer for the preparation functional monomer by ultraviolet spectrophotometry [J]. Chemical Research, 2015, 26(5): 480-485.
[33] 郭秀春, 李欢欢, 周文辉. 染料木素分子印迹聚合物的制备及其识别性能 [J]. 化学研究, 2013, 24(3): 252-255.
GUO X C, LI H H, ZHOU W H. Synthesis of molecular imprinted polymer for genistein and its recognition performance [J]. Chemical Research, 2013, 24(3): 252-255.
Synthesisandrecognitionperformanceofmolecularlyimprintedpolymerforphlorizin
GUO Xiuchun1, CHEN Xuanjie1, WANG Haihui2, YUAN Meng2, ZHOU Wenhui2*
(1.PharmaceuticalCollegeofHenanUniversity,Kaifeng475004,Henan,China; 2.TheKeyLaboratoryforSpecialFunctionalMaterialsofMOE,HenanUniversity,Kaifeng475004,Henan,China)
In order to prepare molecularly imprinted polymer (MIP) for phlorizin with biomimetic recognition ability, functional monomer and proportion selection method established by our group was used to select the functional monomer (4-vinyl pyridine) and optimal proportion (6∶1) suited for phlorizin. Then, using phlorizin as template, 4-vinyl pyridine as functional monomer and ethylene glycol dimethacylate as cross-linker MIPs for phlorizin was prepared. After grinding, screening and Soxhlet extraction, MIPs particles were obtained. Using equilibrium binding experiments, the recognition performance of MIPs particles to phlorizin was studied. The results show that the MIPs particles exhibited much better affinity towards phlorizin than non-imprinted polymers particles.
molecularly imprinted polymer; ultraviolet spectrophotometry; functional monomer; phlorizin
O657.3
A
1008-1011(2017)05-0622-06
2017-06-26.
国家自然科学基金(U1204214).
郭秀春(1982-),女,副教授,研究方向为天然产物.*
, E-mail:zhouwh@henu.edu.cn.
[责任编辑:张普玉]