表面复合修饰磁性颗粒固定化脂肪酶效能研究
2017-11-10赵芬,胡飞
赵 芬,胡 飞
(华南理工大学 食品科学与工程学院,广东 广州 510641)
表面复合修饰磁性颗粒固定化脂肪酶效能研究
赵 芬,胡 飞*
(华南理工大学 食品科学与工程学院,广东 广州 510641)
以表面复合修饰的纳米超顺磁性Fe3O4颗粒聚集体为载体固定胰脂肪酶,比较分析固定化脂肪酶的固载效能及酶学特性,研究了固定化及游离脂肪酶的最适温度和pH值、不同环境下的操作稳定性等应用特性及基本动力学特征。结果表明:在室温下脂肪酶质量浓度为4.01 mg/mL时具有最大的固载酶量0.72 mg/10 mg,固定化脂肪酶最适作用pH为6,最适温度35℃,与游离脂肪酶相比,对酸性环境pH的变化更敏感,但具有更广泛的温度耐受性。固定化脂肪酶催化水解Lineweaver-Burk曲线线性相关,米氏常数Km值为9.65 g/mL,远高于游离脂肪酶,亲和性弱于游离脂肪酶。固定化脂肪酶重复催化反应7次,相对酶活力仍剩余51.6%,半衰期为6.2次,重复操作较稳定。
脂肪酶;磁性颗粒;固定化;酶效能
0 引言
固定化酶可回收利用且易于分离,与游离酶相比具有高效的催化性能以及更优的环境适应性,在工业生产中具有独特而高效的应用[1]。常用的固定化酶载体材料包括聚合物材料[2]、无机材料[3]和复合材料[4]等,载体材料在很大程度上与固定化酶的应用功效密切相关。磁性纳米颗粒作为一种固定化酶新载体,在添加磁场后可以分离固定化酶,具有显著的回收和储存优势。这种载体的核心由磁性纳米颗粒聚集而成,通过分子修饰技术,可以在颗粒体系引入多种反应性功能基团,从而连接酶增强结构,同时表面包覆有机或无机分子的壳,促进酶的固定化和效能的发挥[5]。
脂肪酶(Lipase,三酰基甘油酰基水解酶)能催化甘油三酯合成和水解,广泛应用于食品、日用化工以及医药等方面[6]。然而,游离脂肪酶在较多应用环境下存在催化效率较低、环境适应性较苛刻、难以实现过程连续化等不足[7-8]。为了实现脂肪酶的高效利用,采用固定化技术是一种行之有效的途径。
作者在表面复合修饰的磁性Fe3O4颗粒聚集体为载体固定化脂肪酶(来自猪胰)产品的基础上,以游离脂肪酶为参照,比较分析了固定化脂肪酶的酶学特性及催化水解动力学特征,旨在为脂肪酶的高效利用提供依据。
1 材料与方法
1.1 材料与试剂
磁性Fe3O4颗粒聚集体载体材料:实验室自制;戊二醛(V/V,25%):天津科密欧化学试剂有限公司;聚乙烯醇(PVA):天津市福晨化学试剂厂;猪胰脂肪酶、考马斯亮蓝G250:上海博奥科技有限公司,生物纯;橄榄油:国药集团化学试剂有限公司,化学纯。
1.2 主要仪器设备
pHS-25型酸度计:上海虹益仪器仪表有限公司;752N紫外可见分光光度计:广州市化兴科学仪器有限公司;BAS124S分析天平:赛多利斯科学仪器(德国)有限公司;PTFE水热合成反应釜:上海耀冠仪器有限公司。
1.3 方法
1.3.1 表面复合修饰Fe3O4磁性纳米颗粒聚集体载体材料
采用文献[9]的方法,制备复合修饰纳米超顺磁性Fe3O4@SiO2-DES的磁性纳米颗粒聚集体。
1.3.2 胰脂肪酶固定化
采用戊二醛交联法固定化脂肪酶[10],称取10 mg磁性纳米颗粒,洗涤并用磁铁分离后分散在2 mL 4%(V/V)的戊二醛溶液中超声波处理10 min,室温下(25℃)振荡交联反应1 h,取沉淀物用磷酸缓冲液洗涤至无游离戊二醛,分别加入4 mL质量浓度为 0.5、1、2、3、4、10 g/L 的脂肪酶稀释酶液,室温下搅拌固定化3 h,磁性分离,取上清液检测酶活力。
1.3.3 酶活力及固载量测定
测定上述不同浓度的固定化酶相对酶活力以及固载量,考察酶浓度对固定化脂肪酶活力及载体固载能力的影响。其中,酶浓度参照考马斯亮蓝法[11]测定。脂肪酶活力测定参照 GB/T 23535—2009的方法[12],相对酶活力以同组试验中酶活力最高值为100%,用测定值与最高值的百分比表示。
固载量(mg/10 mg)=(CO-CL)×V,
式中:V为酶液体积,CO为初始酶浓度,CL为固定化后酶浓度。
1.4 复合修饰磁性纳米颗粒聚集体固定化脂肪酶的酶学特性
1.4.1 最适pH值和pH稳定性
以25%(V/V)橄榄油乳化液为底物[13],分别取10 mg固定化脂肪酶于pH值4~9的磷酸缓冲液中40℃水浴,保温2 h后降至室温,测定酶活力,研究酶的pH稳定性以及最适pH值。同时取游离脂肪酶做相同处理,作为对比。
1.4.2 最适温度和温度稳定性
以25%(V/V)橄榄油乳化液为底物,分别取10 mg固定化脂肪酶于pH值7.5的磷酸缓冲液中,在30~55℃的水浴下,保温2 h后降至室温,测定酶活力,研究酶的温度稳定性以及最适温度。同时取游离脂肪酶做相同处理,作为对比。
1.4.3 固定化脂肪酶催化水解的基本动力学
以橄榄油乳化液为底物,分别配制PVA体积分数为 0.2、0.25、0.3、0.4、0.5(对应质量浓度分别为 0.46、0.37、0.27、0.23、0.18 g/mL) 的底物溶液,在适宜的pH和温度下测定底物浓度变化。根据酶催化水解 Lineweaver-Burk理论[14], 由 1/V=(Km/Vmax)(1/[S])+1/Vmax,可得动力学特征参数。其中,V为酶催化速率,Vmax为酶被底物饱和时的反应速率,Km为米氏常数,[S]为底物浓度。
1.4.4 固定化脂肪酶的操作稳定性
固定化脂肪酶在pH值7.5的磷酸缓冲液中40℃下,以25%(V/V)橄榄油乳化液为底物催化反应15 min,磁性分离后测定酶活力。经过磁性分离的固定化脂肪酶再重复上述条件下的催化反应,循环催化7个批次,每次结束后均测定酶活力。以首次酶活力为100%,其他值与最高值的相对百分比为相对酶活力,评价固定化酶的重复使用性[15]。
2 结果与讨论
2.1 固定化脂肪酶的酶活力及固载量测定
6组脂肪酶的质量浓度分别为 0.42、0.60、0.84、1.20、1.64、4.01 mg/mL,由图 1 可知,在质量浓度为0.42、0.60 mg/mL时,酶的固载量分别为0.072、0.22 mg/10 mg,相应的相对酶活力分别为29.59%、36.22%。脂肪酶的质量浓度0.42~1.64 mg/mL时,固载量随酶质量浓度逐渐越大,相对酶活力随固载量的增加而增加,在质量浓度高于1.20 mg/mL时,固载量随质量浓度而增加的速度变缓,质量浓度4.01 mg/mL时具有最大的相对酶活力和固载酶量0.72 mg/10 mg。考虑固定化酶的稳定性及应用成本等因素,脂肪酶固定化选择质量浓度1.0~2.0 mg/mL为宜。

图1 酶质量浓度对固定化酶酶活力及固载量的影响Fig.1 Effect of lipase mass concentrate on activity and loading content of immobilized enzyme
2.2 最适pH值和pH稳定性
由图2可知,固定化脂肪酶的最适pH值为6,游离酶的最适pH值为7。偏离最适pH值时两者的活力均急剧下降,但固定化酶在峰值曲线左端活力下降幅度更显著,在pH 5时只能保持约50%的相对活力。说明脂肪酶经固定化后,酶作用时最适pH环境向酸性端转移,且对pH值变化更为敏感。
由图3可知,固定化酶和游离脂肪酶在不同pH值缓冲溶液保温2 h后降温,游离脂肪酶相对活力变化平缓,尤其在pH值5~9范围内具有优良的pH稳定性。固定化脂肪酶活力下降明显,说明其在储藏或保持状态下对酸碱的耐受性较差。这是因为复合修饰的颗粒载体固定化脂肪酶对酶结构产生了影响,部分酸碱敏感性中心对酸碱更为敏感,当pH值发生改变时,酶的活性发生较大改变。

图2 pH对游离酶和固定化酶活力的影响Fig.2 Effect of pH on relative activity of free and immobilized lipase

图3 游离酶和固定化酶的pH稳定性Fig.3 The pH stability of free and immobilized lipase
2.3 最适温度和温度稳定性
由图4可知,固定化脂肪酶和游离脂肪酶在35℃和40℃时相对酶活力最大。在35~55℃范围内,固定化脂肪酶相对酶活力变化较平缓,最低可保持在66.0%以上,远高于游离脂肪酶的28.2%。在低于35℃或40℃时,两种酶的相对活力均急剧下降,说明两种酶适合作用在较高温度范围内,其中固定化脂肪酶的作用温度适应范围更广。
由图5可知,在20~55℃的范围内保温处理后降温,固定化脂肪酶在各温度下的相对酶活均高于游离脂肪酶,随温度升高固定化脂肪酶酶活力下降较游离脂肪酶缓慢。在55℃时仍有29.4%的相对活力,而游离脂肪酶此时基本失活,说明脂肪酶经固定化处理后热稳定性提高,这主要是由于酶和载体结合使酶的天然构象难于伸展打开,从而提高了固定化酶的热稳定性[16],实用价值颇高。
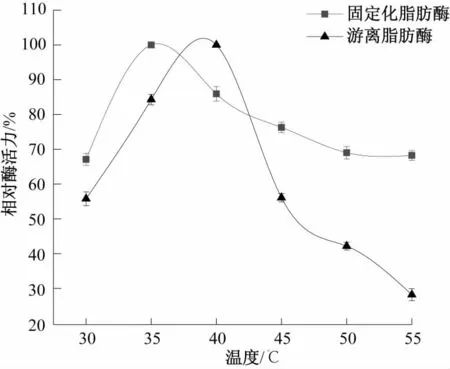
图4 温度对游离酶和固定化酶活力的影响Fig.4 Effect of temperature on relative activity of free and immobilized lipase

图5 游离酶和固定化酶活力的温度稳定性Fig.5 The temperature stability of freeand immobilized lipase
2.4 酶催化水解基本动力学
固定化脂肪酶和游离脂肪酶催化水解V-[S]曲线及Lineweaver-Burk曲线如图6和图7所示,水解特征方程及参数如表1所示。
由图6和图7可知,固定化和游离脂肪酶的酶解速度在底物质量浓度0.18~0.46 g/mL范围内均随底物质量浓度增加而增加,速率匀速增长,近似线性相关。游离脂肪酶的催化水解速率略高于固定化脂肪酶,但当底物质量浓度较高时(0.46 g/mL),固定化脂肪酶的水解速率非常接近游离脂肪酶,表明在较高的底物浓度时固定化酶会有更好的性能体现。
通过Lineweaver-Burk曲线拟合回归线性方程,同时获取特征参数Km。由表1可知,游离脂肪酶和固定化脂肪酶的Km值分别为1.92、9.65 g/mL,固定化脂肪酶的Km值远远高于游离脂肪酶,说明固定化酶的亲和力低于游离酶。这是由于酶分子经固定化后不能自由运动,载体的存在增大了酶周围的空间位阻,从而使固定化酶的亲和力降低[17]。

图6 固定化酶和游离酶的V-[S]曲线Fig.6 V-[S]curves of free and immobilized enzyme

图7 固定化酶和游离酶的1/V-1/[S]曲线Fig.7 Lineweaver-Burk curves of free and immobilized enzyme

表1 固定化脂肪酶和游离脂肪酶的催化水解模型及特征参数Table 1 Mathematical models and parameters of immobilized lipase and free lipase hydrolysis
2.5 固定化脂肪酶的操作稳定性
以残余酶活的负对数与重复使用次数作图,直线的斜率即为酶失活常数。由图8可知,固定化脂肪酶经重复催化反应7次后,酶活力下降较平稳,最终仍有51.6%的相对酶活力。根据拟合方程,酶失活速率常数为0.111 7,操作半衰期为6.2次,误差小于0.46%。因此,脂肪酶经复合修饰磁性纳米颗粒聚集体固定化后,与载体的结合较好,不易脱落导致酶活降低,重复操作使用较稳定[18]。

图8 固定化酶的循环操作稳定性Fig.8 The recycle stability of immobilized enzyme
3 结论
采用表面复合修饰的纳米超顺磁性Fe3O4颗粒为载体固定脂肪酶,以游离脂肪酶为参照,较系统地研究了固定脂肪酶的固载效能及酶学特性,以及不同环境下的操作稳定性和基本动力学特征。研究结果表明:固载量随酶质量浓度增大而增大,在本试验的脂肪酶质量浓度梯度下,酶质量浓度为4.01 mg/mL时具有最大的固载酶量0.72 mg/10 mg。固定化脂肪酶在pH值6、35℃的条件下具有最大的酶活力,与游离脂肪酶相比,对酸性环境pH的变化更敏感,在储藏或保持状态下对酸碱的耐受性较差,但具有更广泛的温度耐受性。固定化脂肪酶活力在底物质量浓度0.18~0.46 g/mL范围内随底物质量浓度增加而匀速增加,Lineweaver-Burk曲线线性相关,米氏常数Km值为9.65 g/mL,远高于游离脂肪酶,亲和性弱于游离脂肪酶。固定化脂肪酶在较高的底物质量浓度时具有更好的催化速度,固定化脂肪酶重复催化反应7次,相对酶活力仍剩余51.6%,半衰期为6.2次,重复操作较稳定。
[1]李丽娟,马贵平,赵林果.固定化酶载体研究进展[J].中国生物工程杂志,2015(11):105-113.
[2]吴汉福,杜海良,龚晓莹,等.用于酶固定化的高分子载体材料研究进展[J].云南化工,2008,35(3):46-48.
[3]王建芝.功能化磁性纳米材料的制备及其固定化酶的研究[D].兰州:兰州大学,2015.
[4]田程程.新型多功能纳米复合材料的合成及其催化性能研究[D].上海:华东理工大学,2014.
[5]刘健.多功能磁性纳米复合材料的合成、表征及其在生物检测和催化反应中的应用[D].兰州:兰州大学,2014.
[6]李阳,韦伟,曹茜,等.脂肪酶固定化新材料[J].中国粮油学报,2014,29(7):122-127.
[7]王华,王莹,詹长娟,等.脂肪酶固定化工艺优化及其酶学性质研究[J].食品研究与开发,2015,36(21):118-123.
[8]VAIDYA B K,INGAVLE G C,PONRATHNAM S,etal.Immobilization ofCandida rugosa lipase on poly (allylglycidylether-coethylene glycoldimethacrylate) macroporous polymer particles[J].Bioresource Technology,2008,99(9):3623-3629.
[9]孙宁,胡飞.超顺磁性颗粒表面复合修饰及用于固定化 α-淀粉酶载体的效果[J].农业工程学报,2016,32(11):290-294.
[10] LING G,WEI H,TANG S,et al.A novel deep eutectic solvent for biodiesel preparation using a homogeneous base catalyst[J].Chemical Engineering Journal,2015,259:647-652.
[11]祖昕,杜凯,曹方,等.有机溶剂处理提高固定化脂肪酶活性及稳定性[J].食品与生物技术学报,2016(1):89-94.
[12]江慧芳,王雅琴,刘春国.三种脂肪酶活力测定方法的比较及改进[J].化学与生物工程,2007 ,24(8):72-75.
[13]刘娟,杨楠楠,姜爱莉.固定化脂肪酶的制备及其酶学性质的研究[J].中国油脂,2013,38(1):44-47.
[14]张树政.酶制剂工业(上)[M].北京:科学出版社,1984:375-377.
[15] DANDAYUDHAM R,RAMANVK,VENKATESH R,etal.Magnetic nano-particlesas versatile carriers for immobilization of laccase[J].Research Journal of Engineering &Technology,2013,4(4):279-283.
[16]SAGIROGLU A.Conversion of sunflower oil to biodieselby alcoholysis using immobilized lipase[J].Artificial Cells Blood Substitutes and Biotechnology,2008,36(2):138-149.
[17]王苗苗,李群艳,韦奇,等.介孔 SiO2/Fe3O4中空磁性微球的漆酶固定化[J].高等学校化学学报,2013,34(2):299-305.
[18]孙宁,胡飞.表面复合修饰纳米超顺磁性材料固定化α-淀粉酶性能研究[J].食品工业科技,2017(2):231-234.
PERFORMANCE OF LIPASE IMMOBILIZED BY SURFACE COMPOSITE MODIFIED MAGNETIC PARTICLE AGGREGATES
ZHAO Fen,HU Fei
(School of Food Science and Engineering,South China University of Technology,Guangzhou 510640,China)
The immobilized enzyme is recyclable and easy to separate,which has high catalytic performance and better environment adaptability compared with the free enzyme. The application performance of immobilized and free lipase were investigated in the present study. Lipase was immobilized by the method of covalent linkage with the composite-modified nano-superparamagnetic Fe3O4particle aggregates as the carrier. The optimum temperature,pH value,the operation stability and the basic kinetics of the afforded immobilized lipase were compared with the free lipase respectively. The results showed that the maximum loading amount of immobilized enzyme was 0.72 mg/10 mg when the lipase concentration was 4.01 mg/mL at room temperature,and the optimum pH and temperature were 6 and 35 ℃. respectively. Compared with free lipase,immobilized lipase was more sensitive to the pH in acid environment,but had a wider range of temperature tolerance. The Lineweaver-Burk curve of immobilized lipase catalyzed hydrolysis was linear correlation. Km value of immobilized lipase was 9.65 g/mL,which was much higher than that of free lipase,and the affinity was weaker than free lipase. The relative activity of immobilized enzyme (lipase)was still remaining 51.6% after 7 times recycle use,the half-life period was 6.2 times and the repetitive operation was stable.
lipase;magnetic particle;immobilization;enzymatic property
TS 201.2 文献标志码:B
1673-2383(2017)05-0011-06
http://kns.cnki.net/kcms/detail/41.1378.N.20171030.0936.006.html
网络出版时间:2017-10-30 9:36:32
2017-04-06
赵芬(1994—),女,湖南张家界人,硕士研究生,研究方向为谷物化学。
*通信作者
