铁皮石斛EST-SSR引物的评价、甄选与应用研究
2017-11-10胡仲义何月秋
胡仲义 付 涛 何月秋 李 文 林 立
(宁波城市职业技术学院,宁波 315502)
铁皮石斛EST-SSR引物的评价、甄选与应用研究
胡仲义 付 涛 何月秋 李 文 林 立
(宁波城市职业技术学院,宁波 315502)
开发、评价已筛选的铁皮石斛EST-SSR引物,并探讨其在遗传多样性、物种鉴定、遗传图谱构建、亲缘关系鉴定等方面应用。利用前期筛选的20对多态性较好的引物用于16份材料(15份铁皮石斛与1份串珠石斛)的聚丙烯酰氨凝胶电泳,统计扩增条带。采用PopGen32软件进行Nei’s基因多样度和Simpson指数等多态性指标的统计,分析单个引物和组合引物的区分率,之后采用NTSYSpc2.1软件计算遗传相似系数聚类图的构建。结果表明,引物DN4等16对引物多态性较高,而DN13、DN23、DN60和DN67多态性较低。单个引物均不能将所有供试样品区分开来,其中DN4、DN10、DN105、DN81、DN39和DN71区分率相对较高;利用组合引物能够将所有样品进行有效区分,其中DN4+DN10+DN105+DN39引物组合可作为核心引物予以使用,可用于铁皮石斛指纹图谱的构建和遗传多样性分析。聚类分析结果表明,该20对引物可以较好地应用于铁皮石斛种内、种间亲缘关系的鉴定。此外,引物DN4、DN13、DN39、DN58、DN65、DN67、DN10和DN99可用于铁皮石斛与串珠石斛的鉴定。本研究开发的20对引物可较好地应用于铁皮石斛遗传多样性分析、种质鉴定、亲缘关系鉴定和遗传图谱构建等方面,具有广泛的应用性。
铁皮石斛;分子标记;EST-SSR;引物评价;应用研究
铁皮石斛(DendrobiumofficinaleKimura et Migo)又名“耳环石斛”,为我国名贵中药材,在我国长期具有“仙草”的美誉,目前,市场上多以其干品—铁皮枫斗出售,尤以外观呈“龙头凤尾”者为最优。铁皮石斛含有多糖、生物碱、黄酮类和氨基酸等多种生物活性成分,具有抗衰老、抗肿瘤、抗氧化和降血糖等作用[1~2]。铁皮石斛分布较广,东亚、东南亚及澳大利亚等国家和地区均有分布,在我国主要分布于安徽、浙江、贵州、云南和广西等地,其中在浙江东部的仙居、天台和鄞县也有野生资源的分布。然而由于近年来人类无节制、掠夺性地滥采、乱用,其野生资源受到极大破坏,已濒临灭绝[3]。浙江省是首先开发铁皮石斛保健产品并实现产业化生产的省份之一。目前,浙江省从原料种植到加工生产保健产品,形成了完整的产业链,初具一定的产业规模。铁皮石斛已实现了组培快繁栽培,形成了“公司(企业)加基地”为主的种植模式。
EST-SSR标记不仅具有基因组SSR标记中技术简单、重复性好、多态性高和共显性遗传等特点,还具有引物开发廉价、通用性较好、条带清楚、容易统计等优点[4]。此外,由于EST-SSR是编码基因的一部分,能够直接获得基因表达的相关信息,这有可能直接鉴定决定重要表型性状的等位基因[5]。随着NCBI中EST数据库不断地丰富与完善,使用其序列开发SSR标记也已成为一种十分简便而有效的方法,时至今日,EST-SSR标记已在众多植物中得到广泛的应用[6]。目前,石斛属(Dendrobium)植物的DNA分子鉴定方面主要采用RAPD、AFLP、ISSR、SRAP和SSR等分子标记技术,如苑鹤等[7]利用RAPD对人工栽培铁皮石斛居群的遗传多样性进行了相关研究,发现其亲缘关系的远近与其地理种源具有显著的相关性,而与栽培地点无关;王慧中等[8]利用AFLP对13种石斛属植物进行了遗传多样性的分析,其结果与传统分类学的结果基本一致;李明焱等[9]利用ISSR进行了铁皮石斛新品种的选育工作;樊洪泓等[10]利用SRAP对药用石斛的遗传多样性及亲缘关系进行了相关研究;邱道寿等[11]对石斛属植物进行了SSR标记的开发及可转移性分析。但至目前为止,有关铁皮石斛的EST-SSR标记却极少见于报道。本文利用本课题组前期开发的铁皮石斛EST-SSR引物用于铁皮石斛种质资源的遗传多样性分析、种质鉴定、亲缘关系鉴定和指纹图谱构建等方面。
1 材料与方法
1.1 试验材料
本研究共采集15份铁皮石斛和1份串珠石斛,由于部分还未被认定为新品种,故本文以代码(DO-1~DO-16;DO-5为串珠石斛,作为外类群)代替,其中DO-8、DO-9、DO-15、DO-14和DO-16均采自浙江省宁波市宁波华夏生态农业研究所;DO-2采自云南思茅;DO-1、DO-3、DO-4、DO-5、DO-6、DO-7和DO-13采自浙江省台州市浙江凤凰源生态农业有限公司;DO-10、DO-11和DO-12分别采自浙江温州雁荡山、云南红河和浙江丽水。样品信息及其来源(原产地)具体详见表1。
表1铁皮石斛样品信息及其来源
Table1SamplesinformationandsourceinD.officinale

编号No.原产地OriginDO-1广东饶平RaopingGuangdongDO-2云南思茅SimaoYunnanDO-3安徽合肥HefeiAnhuiDO-4福建龙岩LongyanFujianDO-5浙江温州WenzhouZhejiangDO-6福建武夷山Wuyimountain,FujianDO-7湖南新宁崀山Langshan,XinningHunanDO-8浙江瑞安RuianZhejiangDO-9浙江萧山XiaoshanZhejiangDO-10浙江温岭雁荡山Yandangmountain,WenlingZhejiangDO-11云南红河Honghe,YunnanDO-12浙江丽水LishuiZhejiangDO-13云南文山WenshanYunnanDO-14浙江富阳FuyangZhejiangDO-15浙江临安LinanZhejiangDO-16浙江富阳FuyangZhejiang
1.2 试验方法
1.2.1 组织培养
将成熟未开裂的铁皮石斛蒴果在超净工作台上用75%的酒精进行表面消毒,剪开蒴果端部,用镊子轻轻敲击蒴果基部,铁皮石斛种子接种至诱导培养基1/2MS+NAA0.05 mg·L-1+30 g·L-1糖+pH5.8中,一个月后种子即可萌发。此时,转移至1/2MS+NAA0.05 mg·L-1+30 g·L-1糖+香蕉汁100 g·L-1+pH5.8进行增殖和生长,以后每两个月转接至同样的培养基中,直至组培苗长至2 cm。最后转移至1/2MS+NAA0.05 mg·L-1+30 g·L-1糖+香蕉汁100 g·L-1+pH5.8+0.05%AC+花宝1号1 g·L-1壮苗和生根培养基,继续培养3个月即可长成5 cm的优质苗。采集嫩叶用于DNA的提取。
1.2.2 基因组DNA提取
采用植物/真菌基因组DNA小量提取试剂盒(上海莱枫生物科技有限公司)进行铁皮石斛DNA的提取,利用Bio-Photometr核酸检测仪(德国Eppendorf公司)检测DNA的浓度和纯度,之后再依据所得的DNA浓度,用预热的TE溶液将DNA样品溶液稀释成50 ng·μL-1,-20℃保存备用。
1.2.3 EST-SSR引物信息
本课题组前期利用NCBI中铁皮石斛近缘种—金钗石斛的EST序列合成了106对引物,通过电泳检测,筛选获得了多态性较高的43对引物,该43对引物普带清晰、多态性较好。本试验从该43对引物中选择其中最好的20对引物用于不同种质(产地)铁皮石斛遗传多样性分析、亲缘关系鉴定等方面的应用(表2)。
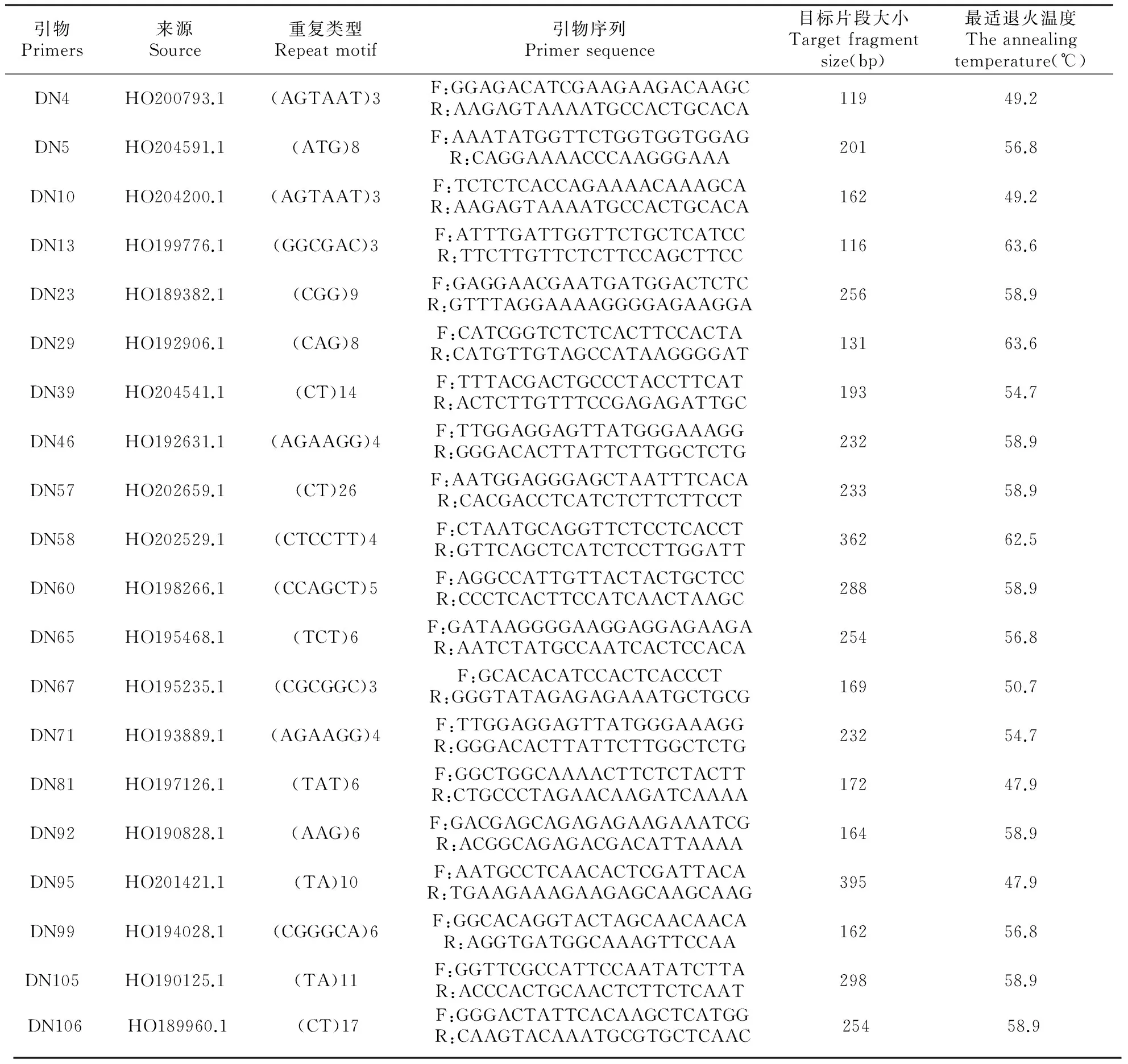
表2 20对EST-SSR引物相关信息
1.2.4 PCR扩增
在Mastercycler普通梯度PCR仪(德国Eppendorf公司生产)进行引物最适复性温度的筛选。2×Taq PCR MasterMix购自天根生物公司(北京),PCR反应体系为20 μL,其中包括:10 μL的2×Taq PCR MasterMix(含有Taq酶、dNTP和优化的反应缓冲液),0.4 μL的模板DNA(50 ng·μL-1),0.8 μL的引物对(5 μmol·μL-1)×2,8 μL的ddH2O。反应程序为94℃预变性5 min,然后进行35个循环,每个循环包括94℃变性30 s,复性(48~64℃)30 s,72℃延伸30 s,最后72℃延伸7 min,4℃保存。在最适退火温度下,对16份材料进行PCR扩增,产物采用6%的聚丙烯酰胺凝胶进行电泳,银染,胶干后利用数码相机进行拍照、保存。
1.3 数据统计与分析
观察各SSR位点在供试样本间PCR扩增条带的差异,清晰带赋值为“1”,无扩增带的赋值为“0”,用Excel软件统计整理。采用PopGen32软件计算多态性位点百分率、Nei’s基因多样度和Simpson指数等指标。采用NTSYSpc2.1软件计算遗传相似系数,并采用UPGMA法构建聚类分析图。
2 结果与分析
2.1 引物多态性指标分析
由表3可知,20对引物在16份材料(图1)中共扩增出79条带,其范围为1~11条,大多数范围在2~5条,平均每条引物扩增出3.95条;其中多态性条带有73条,平均每条引物扩增出3.65条多态性条带。平均多态性百分率为93.33%,其中DN5多态性百分率最低,为50%;DN4、 DN10、
DN13、DN29、DN39、DN57、DN58、DN65、DN67、DN71、DN81、DN95、DN99和DN106多态性百分率均为100%(DN67仅扩增出1条带,在铁皮石斛不同种质间无差异,均有1条带,但在串珠石斛中无带);其余引物多态性百分率介于50%~100%。
表320对引物的扩增结果
Table3Amplificationefficiencyof20pairsofprimer

引物Primers总带数Totalbandnumber多态性位点Polymorphicloci多态性比例Polymorphismproportion(%)Nei’s基因多样度Nei’sgenediversityShannon’s信息指数Shannon’sinformationindexDN4771000.34040.5156DN521500.25000.3466DN1011111000.30110.4633DN13221000.16800.3053DN2354800.17660.2931DN29441000.35740.5298DN39551000.28280.4411DN4643750.22460.3554DN57221000.33980.5225DN58331000.36720.5348DN6043750.18160.2997DN65221000.37500.5623DN67111000.11720.2338DN71331000.32550.4920DN81881000.30660.4682DN923266.70.31250.4410DN95221000.29690.4696DN99441000.36520.5377DN10554800.25620.3955DN106221000.42970.6211总计Total7973———平均Average3.953.6591.330.28870.4414

图1 16份材料的组培苗 上排一列从左至右依次为DO-1~DO-8;下排一列从左至右依次为DO-9~DO-16。Fig.1 The tissue culture seedlings of 16 materials A row of columns from left to right:DO-1~DO-8;the lower row from left to right:DO-9~DO-16.
此外,每对引物的Nei’s基因多样度范围为0.117 2~0.429 7,均值为0.288 7,小于0.2的有DN13、DN23、DN60和DN67,介于0.2~0.3的有DN5、DN39、DN46、DN95和DN105,其余均大于0.3;Shannon’s信息指数范围为0.233 8~0.621 1,均值为0.441 4,小于0.3的有DN23、DN60和DN67,介于0.3~0.4的有DN5、DN23、DN46和DN105,其余均大于0.4。综合结果表明,理论上,DN13、DN23、DN60和DN67引物多态性水平过低,其应用性可能较弱,而其余16对引物多态性水平却相对较高,理论上可较好地应用于不同种质铁皮石斛的遗传多样性分析、亲缘关系鉴定、遗传图谱构建以及功能基因研究等方面,但这均有待后续进一步研究。
2.2 单个EST-SSR引物的区分率分析
由表4可知,20对引物中无任何一个引物能将16份供试材料全部一次性区分开来。20对引物的最大相似性系数均为1.00;引物DN4划分组数(13组)和直接鉴定出的材料数(11个)均为最多,聚类区分率也最大(68.75%),鉴别能力最强;其次为引物DN10,划分组数为12组,直接鉴定出的材料数为9个,聚类区分率为56.25%;引物DN105划分组数为7组,直接鉴定出的材料数为5
个,聚类区分率为31.25%。其它引物则可将16份供试材料划分为2~6组,可以直接区分的材料数0~3个,聚类区分率0~18.75%。该20对引物只有通过组合方式才能将以上16份供试材料一次性区分开。图2为部分引物的扩增图谱。

图2 部分引物在16份供试材料中的扩增Fig.2 Polymorphisms showed in 16 materials by partial primers
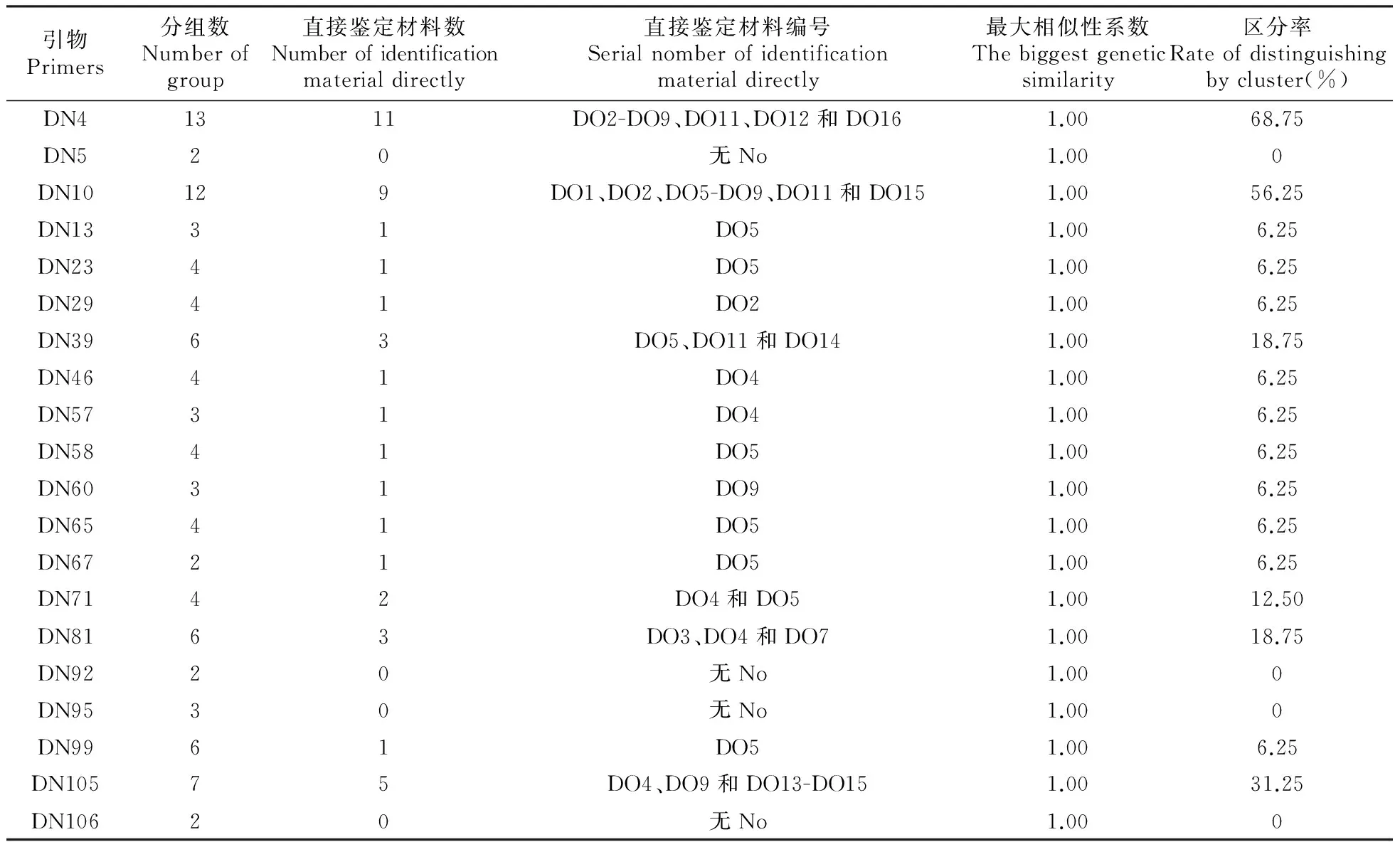
引物Primers分组数Numberofgroup直接鉴定材料数Numberofidentificationmaterialdirectly直接鉴定材料编号Serialnomberofidentificationmaterialdirectly最大相似性系数Thebiggestgeneticsimilarity区分率Rateofdistinguishingbycluster(%)DN41311DO2-DO9、DO11、DO12和DO161.0068.75DN520无No1.000DN10129DO1、DO2、DO5-DO9、DO11和DO151.0056.25DN1331DO51.006.25DN2341DO51.006.25DN2941DO21.006.25DN3963DO5、DO11和DO141.0018.75DN4641DO41.006.25DN5731DO41.006.25DN5841DO51.006.25DN6031DO91.006.25DN6541DO51.006.25DN6721DO51.006.25DN7142DO4和DO51.0012.50DN8163DO3、DO4和DO71.0018.75DN9220无No1.000DN9530无No1.000DN9961DO51.006.25DN10575DO4、DO9和DO13-DO151.0031.25DN10620无No1.000
2.3 组合EST-SSR引物的区分率分析
选择分组数+直接鉴定材料数≥6的引物作为组合引物的首选备选引物,由表5可知,引物DN4、DN10和DN105两两组合中DN4+DN10的组合鉴定效果较好,在最大相似系数0.94处DO12和DO13区分不开;DN4+DN10+DN105组合在0.91处DO8和DO16、DO12和DO13区分不开;此后在DN4+DN10+DN105组合的基础上逐渐增加其它引物直到全部20对引物的组合,在最大相似系数为0.93~0.95处,DO8和DO16始终区分不开,DN4+DN10+DN105+DN39组合之后,再增加引物数量DO8和DO16均区分不开,因此建议将DN4+DN10+DN105+DN39引物组合作为鉴定铁皮石斛种质资源的EST-SSR核心引物予以使用,可直接用于铁皮石斛不同种质资源的遗传多样性分析、指纹图谱构建等方面。图3为引物DN4、DN10、DN105、DN39分别在16份供试材料中的指纹图谱。

图3 4对核心引物在16份供试材料中的扩增Fig.3 Polymorphisms showed in 16 materials by 4 pairs of core primers

引物Primers分组数Nomberofgroup直接鉴定材料数Nomberofidentificationmaterialdirectly亲缘关系最近的材料编号Serialnomberofrecentgeneticrelationships最大相似性系数Thebiggestgeneticsimilarity区分率Rateofdistinguishingbycluster(%)DN4、101515DO12和DO130.94100DN4、1051514DO1和DO101.0087.50DN10、1051415DO2和DO16、DO3和DO130.94100DN4、10、1051415DO8和DO16、DO12和DO130.91100DN4、10、81、1051415DO8和DO16、DO12和DO130.95100DN4、10、39、1051515DO8和DO160.93100DN4、10、39、81、1051515DO8和DO160.94100DN4、10、39、71、81、1051515DO8和DO160.95100DN4、10、39、71、81、99、1051515DO8和DO160.95100……1515DO8和DO16……100全部20对引物All20pairsofprimers1515DO8和DO160.95100
2.4 鉴定铁皮石斛与串珠石斛的引物筛选
由图3~4可知,引物DN4、DN13、DN39、DN58、DN65和DN67对串珠石斛无扩增片段,而对15份不同种质的铁皮石斛均有不同大小的扩增片段。引物DN99和DN10对串珠石斛均有单一扩增片段,引物DN10扩增片段大小约400 bp,明显大于在15份铁皮石斛中的扩增片段的大小(图1:Dn-10);引物DN99扩增片段大小约150 bp,明显小于在15份铁皮石斛中的扩增片段的大小(图1:Dn-99)。因此,引物DN4、DN13、DN39、DN58、DN65、DN67、DN10和DN99可作为鉴定铁皮石斛与串珠石斛的引物。目前市场上铁皮石斛干品—铁皮枫斗混伪品较多,从外形上难以区分,可利用该些引物鉴定其中是否混有串珠石斛。
2.5 聚类分析
依据20对EST-SSR引物扩增结果,再利用NTSYSpc2.10e软件进行Jaccard相似性系数分析,计算出它们之间的遗传相似系数,其中,15份铁皮石斛(去除DO5)其范围在0.582~0.949,串珠石斛(DO5)与15份铁皮石斛之间的范围在0.456~0.709(表6)。

表6 16份材料SSR分析的遗传相似系数

图4 引物DN13、DN58、DN65和DN67在16份供试材料中的扩增Fig.4 Polymorphisms showed in 16 materials by primers DN13,DN58,DN65,DN67

图5 基于SSR结果构建的16份材料的UPGMA聚类分析Fig.5 UPGMA dendrogram of the 16 materials based on SSR results
由遗传相似系数进行UPGMA聚类分析,构建了15份铁皮石斛和1份串珠石斛的遗传关系图(图5)。其中在15份铁皮石斛中DO8和DO16号遗传相似系数最大,为0.949;DO9和DO12、DO13遗传相似系数最小,为0.582。串珠石斛(DO5)与DO8遗传相似系数最大(0.709),与DO4遗传相似系数最小(0.456)。由图4可知,大约在遗传相似系数0.58处,串珠石斛被从铁皮石斛中首先分离出来;大约在遗传相似系数0.68处,15份铁皮石斛被分为3大类。
第一类包括DO9、DO10、DO14和DO15;第二类仅包括DO4;第三类包括DO1、DO11、DO2、DO3、DO7、DO6、DO13、DO12、DO8和DO16。其中大约在0.77处第三类又可分为三小类,第一小类包括DO1、DO11和DO2;第二小类包括DO3、DO7、DO6、DO13和DO12;第三小类包括DO8和DO16。
3 讨论
如今EST-SSR已广泛应用于果树如苹果[12]、梨[13]、杏[14]、甜瓜[15]、草莓[16]、猕猴桃[17]、荔枝[18]等,作物如大麦[19]、小麦[20]、芝麻[21]、棉花[22]、茶树[23]、杜仲[24]等。本研究利用前期从金钗石斛EST序列中获得的20对谱带清晰、多态性好的EST-SSR引物用于铁皮石斛指纹图谱构建的核心引物筛选、物种鉴定、遗传多样性分析和不同种质亲缘关系鉴定等应用方面。
Nei’s基因多样度与Shannon’s信息指数均是反映引物多态性水平高低的指标,数值越大其多态性水平越高[25],但其数值的大小却与所检测材料遗传多样性和EST-SSR标记的鉴别力等有关[26]。本研究中Nei’s基因多样度范围为0.117 2~0.429 7,均值为0.288 7;Shannon’s信息指数范围为0.233 8~0.621 1,均值为0.441 4。略低于猪苓[27]的Nei’s(0.39)和Shannon’s信息指数(0.57),略高于荔枝[18]的Nei’s(0.270)和Shannon’s信息指数(0.425),但总体而言,各引物所表现出的多态信息含量都相对较低,这可能有2方面的原因,一方面与EST-SSR标记本身的特性有关,与Genomic-SSR相比,其转移性高,多态性却较低;另一方面与所检测铁皮石斛的种质资源遗传有关。研究结果表明,DN4、DN10、DN29、DN57、DN58、DN65、DN71、DN81、DN92、DN99和DN106多态性相对较高(Nei’s≥0.3);DN5、DN39、DN46、DN95和DN105次之(0.2≤Nei’s<0.3);DN13、DN23、DN60和DN67最低(Nei’s<0.2)。其中单个引物区分率较高的有DN4(68.75%)、DN10(56.25%)、DN105(31.25%)、DN81(18.75%)、DN39(18.75%)和DN71(12.50%);而引物DN5、DN92、DN95和DN106区分率为0;其余引物区分率均为6.25%。这一方面说明多态性高的引物其品种区分率就高,如DN4、DN10、DN71和DN81等引物;但另一方面部分引物多态性较高,如DN106、DN92、DN95和DN5,其区分率为0,而多态性相对较低的引物,如DN13、DN23、DN60和DN67,却有一定的区分率。造成上述矛盾的原因可能有3方面,其一,本文添加了外类群—串珠石斛(DO5),其中DN13、DN23和DN67均是只能鉴定出串珠石斛,这对本文区分率的统计有一定的影响;其二,有的引物扩增出的条带中有部分品种条带完全一致或基本一致,如一些扩增条带总数比较少的引物(DN106、DN92、DN95和DN5),这就使得获得的分组数较少,能直接鉴定的品种数就越少,造成单个引物的品种区分率较低,甚至为0;其三,本研究试验材料过少对试验数据的统计也有一定的影响。基于上述原因,多态性较高的引物其品种区分率可能不高,而多态性较低的引物却可能有一定的区分率(该类引物多可作为特异性引物,如DN13和DN67可作为鉴定铁皮石斛和串珠石斛的引物),因此要能够最大限度的将所有样品进行有效区分,还需进行引物的组合试验。
本文选择分组数+直接鉴定材料数≥6的引物作为组合引物的首选备选引物,符合要求的引物有DN4、DN10、DN39、DN71、DN81、DN99和DN105,通过不同的组合试验结果发现,DN4+DN10+DN105+DN39组合可将16份材料进行有效区分,之后再增加其它引物也无法再将彼此亲缘关系最近的DO8和DO16(最大相似系数始终维持在0.930~0.95)进行进一步的区分。因此,我们建议DN4+DN10+DN105+DN39引物组合作为核心引物用于铁皮石斛遗传多样性分析和指纹图谱的构建,尤其可用于建立铁皮石斛指纹图谱代码或指纹图谱QR编码[15]。当然若是研究不同品种或产地铁皮石斛的亲缘关系或进化关系,其使用的引物越多,多态性位点也越多,对物种的亲缘关系(进化关系)的鉴定也就越准确,因此,若用该核心引物用于铁皮石斛亲缘关系(进化关系)的鉴定,其结果将会不理想。为了更为准确的表明16份材料彼此间的亲缘关系的远近,使用了全部的20对引物用于聚类分析,结果表明,外类群—串珠石斛最先被分离出来,与15份铁皮石斛遗传距离较远。来自浙江萧山(DO9)、浙江温岭雁荡山(DO10)、浙江富阳(DO14)和浙江临安(DO15)亲缘关系较近而被聚类在一起,而来自浙江瑞安(DO8)和浙江富阳(DO16)彼此亲缘关系最近而被聚类在一起;来自广东饶平(DO1)、云南思茅(DO2)和云南红河(DO11)亲缘关系较近而被聚类在一起。以上来自相同地区或区域的基本被聚类在一起。而来自浙江丽水(DO12)、云南文山(DO13)与来自安徽合肥(DO3)、湖南新宁崀山(DO7)和福建武夷山(DO6)的亲缘关系较近而被聚类在一起,由于目前铁皮石斛产业高度商业化,可能是人为有意、无意携带流入这些地区造成的,亦可能是由于这些种质遗传背景比较复杂,彼此体内流着相同的“血液”,究其原因有待后续进一步研究。总体而言,该20对引物聚类结果能够比较准确地反应种内、种间彼此亲缘关系的远近。
4 结论
本研究结果表明,DN4等16对引物多态性较高,而DN13、DN23、DN60和DN67多态性较低。单个引物均不能将所有供试样品区分开来,其中DN4、DN10、DN105、DN81、DN39和DN71区分率相对较高,利用组合引物能够将所有样品进行有效区分,其中DN4+DN10+DN105+DN39引物组合可作为核心引物予以使用,比较适合用于不同种质铁皮石斛的指纹图谱构建和遗传多样性分析。最后,利用全部20对引物用于聚类分析,结果表明,该20对引物可以较好地应用于铁皮石斛种内、种间亲缘关系的鉴定。此外,研究还发现,引物DN4、DN13、DN39、DN58、DN65、DN67、DN10和DN99可简单、方便地应用于铁皮石斛与串珠石斛的鉴定。
1.高正华,杨兵勋,陈立钻.铁皮石斛的研究进展[J].中国现代应用药学,2008,25(8):692-695.
Gao Z H,Yang B X,Chen L Z.Progress of research on theDendrobiumofficinale[J].Chinese Journal of Modern Applied Pharmacy,2008,25(8):692-695.
2.管惠娟,张雪,屠风娟,等.铁皮石斛化学成分的研究[J].中草药,2009,40(12):1873-1876.
Guan H J,Zhang X,Tu F J,et al.Study on the chemical constituents of theDendrobiumofficinale[J].Chinese Traditional and Herbal Drugs,2009,40(12):1873-1876.
3.李燕,王春兰,王芳菲,等.铁皮石斛化学成分的研究[J].中国中药杂志,2010,35(13):1715-1719.
Li Y,Wang C L,Wang F F,et al.Chemical constituents ofDendrobiumcandidum[J].China Journal of Chinese Materia Medica,2010,35(13):1715-1719.
4.Hokanson S C,Szewc-mcfadden A K,Lamboy W F,et al.Microsatellite(SSR) markers reveal genetic identities,genetic diversity and relationships in aMalus×domesticaborkh.core subset collection[J]. Theoretical and Applied Genetics,1998,97(5-6):671-683.
5.BérubéY,Zhuang J,Rungis D,et al.Characterization of EST-SSRs in loblolly pine and spruce[J].Tree Genetics & Genomes,2007,3(3):251-259.
6.Varshney R K,Sigmund R,Börner A,et al.Interspecific transferability and comparative mapping of barley EST-SSR markers in wheat,rye and rice[J].Plant Science,2005,168(1):195-202.
7.苑鹤,林二培,朱波,等.铁皮石斛人工栽培居群的遗传多样性研究[J].中草药,2011,42(3):566-569.
Yuan H,Lin E P,Zhu B,et al.Genetic diversity in cultivated populations ofDendrobiumofficinale[J].Chinese Traditional and Herbal Drugs,2011,42(3):566-569.
8.王慧中,卢江杰,施农农,等.13种石斛属植物遗传多样性的AFLP分析[J].分子细胞生物学报,2007,40(3):205-210.
Wang H Z,Lu J J,SHI N N,et al.Analysis of genetic diversity among 13 Chinese species ofDendrobiumbased on AFLP[J].Journal of Molecular Cell Biology,2007,40(3):205-210.
9.李明焱,谢小波,朱惠照,等.铁皮石斛新品种“仙斛1号”的选育及其特征特性研究[J].中国现代应用药学,2011,28(4):281-284.
Li M Y,Xie X B,Zhu H Z,et al.Breeding ofDendrobiumofficinalecv.Xianhu 1 and its characteristics[J].Chinese Journal of Modern Applied Pharmacy,2011,28(4):281-284.
10.樊洪泓,李廷春,邱婧,等.药用石斛遗传多样性的SRAP标记研究[J].中国中药杂志,2008,33(1):6-10.
Fan H H,Li T C,Qiu J,et al.Studies on genetic diversity of medicinalDendrobiumby SRAP[J].China Journal of Chinese Materia Medica,2008,33(1):6-10.
11.邱道寿,郑希龙,蔡时可,等.石斛SSR标记的开发及可转移性分析[J].植物科学学报,2013,31(5):500-509.
Qiu D S,Zheng X L,Cai S K,et al.Development and transfer analysis of SSR inDendrobium[J].Plant Science Journal,2013,31(5):500-509.
12.Silfverberg-dilworth E,Matasci C L,van de Weg W E,et al.Microsatellite markers spanning the apple(Malus×domesticaBorkh.) genome[J].Tree Genetics & Genomes,2006,2(4):202-224.
13.王西成,姜淑苓,上官凌飞,等.梨EST-SSR标记的开发及其在梨品种遗传多样性分析中的应用评价[J].中国农业科学,2010,43(24):5079-5087.
Wang X C,Jiang S L,Shangguan L F,et al.Development of EST-derived SSR markers for pear and evaluation of their application in pear genetic diversity analysis[J].Scientia Agricultura Sinica,2010,43(24):5079-5087.
14.上官凌飞,李晓颖,宁宁,等.杏EST-SSR标记的开发[J].园艺学报,2011,38(1):43-54.
Shangguan L F,Li X Y,Ning N,et al.Development of EST-SSR markers in apricot[J].Acta Horticulturae Sinica,2011,38(1):43-54.
15.宋海斌,崔喜波,马鸿艳,等.基于SSR标记的甜瓜品种(系)DNA指纹图谱库的构建[J].中国农业科学,2012,45(13):2676-2689.
Song H B,Cui X B,Ma H Y,et al.Construction of DNA fingerprint database based on SSR marker for varieties(Lines) ofCucumismeloL.[J].Scientia Agricultura Sinica,2012,45(13):2676-2689.
16.董清华,王西成,赵密珍,等.草莓EST-SSR标记开发及在品种遗传多样性分析中的应用[J].中国农业科学,2011,44(17):3603-3612.
Dong Q H,Wang X C,Zhao M Z,et al.Development of EST-derived SSR markers and their application in strawberry genetic diversity analysis[J].Scientia Agricultura Sinica,2011,44(17):3603-3612.
17.王佳卉.软枣猕猴桃EST-SSR分子标记的开发及遗传多样性分析[D].长春:吉林农业大学,2014.
Wang J H.Development of EST-derived SSR markers inActinidiaargutaand genetic diversity analysis[D].Changchun:Jilin Agricultural University,2014.
18.向旭,欧良喜,陈厚彬,等.中国96个荔枝种质资源的EST-SSR遗传多样性分析[J].基因组学与应用生物学,2010,29(6):1082-1092.
Xiang X,Ou L X,Chen H B,et al.EST-SSR analysis of genetic diversity in 96 litchi(LitchichinensisSonn.) Germplasm resources in China[J].Genomics and Applied Biology,2010,29(6):1082-1092.
19.赖勇,王鹏喜,范贵强,等.大麦SSR标记遗传多样性及其与农艺性状关联分析[J].中国农业科学,2013,46(2):233-242.
Lai Y,Wang P X,Fan G Q,et al.Genetic diversity and association analysis using SSR markers in barley[J].Scientia Agricultura Sinica,2013,46(2):233-242.
20.潘海涛.小麦EST-SSR标记的开发和苗期养分吸收QTL定位[D].泰安:山东农业大学,2009.
Pan H T.Development of EST-SSR markers and QTL mapping for absorption of elements in wheat[D].Tai’an:Shandong Agricultural University,2009.
21.Wei W L,Qi X Q,Wang L H,et al.Characterization of the sesame(SesamumindicumL.) global transcriptome using Illumina paired-end sequencing and development of EST-SSR markers[J].BMC Genomics,2011,12(1):451.
22.Han Z G,Wang C B,Song X L,et al.Characteristics,development and mapping ofGossypiumhirsutumderived EST-SSRs in allotetraploid cotton[J].Theoretical and Applied Genetics,2006,112(3):430-439.
23.张曙光,董丽娟,杨阳,等.茶树品种“玉绿”和“玉笋”父本的EST-SSR的标记鉴定[J].茶叶科学,2009,29(6):430-435.
Zhang S G,Dong L J,Yang Y,et al.Identification of male parents for “Yulv” and “Yusun” tea variety based on EST-SSR markers[J].Journal of Tea Science,2009,29(6):430-435.
24.黄海燕,杜红岩,乌云塔娜,等.基于杜仲转录组序列的SSR分子标记的开发[J].林业科学,2013,49(5):176-181.
Huang H Y,Du H Y,Wuyun T N,et al.Development of SSR molecular markers based on transcriptome sequencing ofEucommiaulmoides[J].Scientia Silvae Sinicae,2013,49(5):176-181.
25.鲍露,张东,滕元文,等.DNA标记技术在梨属植物研究中的应用[J].果树学报,2006,23(2):270-275.
Bao L,Zhang D,Teng Y W,et al.DNA marker technologies inPyrusresearch[J].Journal of Fruit Science,2006,23(2):270-275.
26.鲁敏.苹果SSR标记在梨属植物亲缘关系研究中的应用[D].雅安:四川农业大学,2011.
Lu M.Application of apple SSRs in genetic relationship of pyrus[D].Ya’an:Sichuan Agricultural University,2011.
27.陈媛媛.猪苓EST-SSR标记的开发及遗传多样性研究[D].杨凌:西北农林科技大学,2014.
Chen Y Y.Development of EST-SSR markers and genetic diversity forPolyporusumbellatus[D].Yangling:Northwest A& F University,2014.
Scientific research project of Education Department of Zhejiang Province(Y201533793);School Scientific Research Youth Special Topics of Ningbo City College of Vocational Technology(ZZX15064)
introduction:HU Zhong-Yi(1968—),male,Prof.,Major in the teaching and research of plant foundation and plant genetics.
date:2016-07-04
Evaluation,SelectionandApplicationofDendrobiumofficinaleEST-SSRPrimers
HU Zhong-Yi FU Tao HE Yue-Qiu LI Wen LIN Li
(Ningbo City College of Vocational Technology,Ningbo 315502)
By developing and evaluating EST-SSR primers, we studied their application in genetic diversity, species identification, genetic map construction, genetic relationship identification ofDendrobiumofficinale. The early developed 20 pairs of primers with good polymorphism were used for the analysis of 16 samples(15 samples ofD.officinaleand 1 sample ofD.falconeri) by polyacrylamide gel electrophoresis, and the amplified bands were calculated. Nei’s gene diversity and Simpson index were tested using PopGen32 to analysis the differentiation rate of single primer and combination primers. Finally, the construction of genetic similarity coefficient clustering map was calculated by using NTSYSpc2.1. The 16 pairs of primers, such as DN4, were highly polymorphic, while lower in DN13, DN23, DN60 and DN67. Although single primer could not distinguish all the samples, DN4, DN10, DN105, DN81, DN39 and DN71 displayed relatively higher distinguish rate. All the samples could be distinguished effectively by combined primers, and the DN4+DN10+DN105+DN39 primer set could be used as the core primer for fingerprint construction and genetic diversity analysis ofD.officinale. By cluster analysis, the 20 pairs of primers could be used for the identification of both intraspecific and interspecific phylogenetic relationships ofD.officinale. The primers DN13, DN39, DN4, DN58, DN65, DN67, DN10 and DN99 could be used for the identification ofD.officinaleandD.falconeri. The 20 pairs of primers could be wildly used in the application of genetic diversity analysis, germplasm identification, genetic relationship identification and genetic map construction ofD.officinale.
Dendrobiumofficinale;molecular markers;EST-SSR;primer evaluation;applied research
浙江省教育厅科研项目资助(Y201533793);宁波城市职业技术学院校内科研青年专项课题(ZZX15064)
胡仲义(1968—),男,教授,主要从事植物基础及植物遗传教学及科研研究。
2016-07-04
S567.9
A
10.7525/j.issn.1673-5102.2017.01.011
