生物结皮对古尔班通古特沙漠3种荒漠草本植物生长特性与元素吸收的影响
2017-11-10庄伟伟周晓兵张元明
庄伟伟 周晓兵 张元明*
(1.新疆师范大学生命科学学院,新疆特殊环境物种保护与调控生物学实验室,乌鲁木齐 830054; 2.新疆师范大学生命科学学院,干旱区植物逆境生物学实验室,乌鲁木齐 830054; 3.中国科学院新疆生态与地理研究所,中国科学院干旱区生物地理与生物资源重点实验室,乌鲁木齐 830011)
生物结皮对古尔班通古特沙漠3种荒漠草本植物生长特性与元素吸收的影响
庄伟伟1,2周晓兵3张元明3*
(1.新疆师范大学生命科学学院,新疆特殊环境物种保护与调控生物学实验室,乌鲁木齐 830054;2.新疆师范大学生命科学学院,干旱区植物逆境生物学实验室,乌鲁木齐 830054;3.中国科学院新疆生态与地理研究所,中国科学院干旱区生物地理与生物资源重点实验室,乌鲁木齐 830011)
生物结皮有可能通过物理、水文、养分循环影响与之相邻的维管植物,但二者相互关系尚存在着争议。本文以新疆古尔班通古特沙漠广泛分布的地衣结皮为研究对象,分析了生物结皮对3种荒漠草本植物:尖喙牻牛儿苗(Erodiumoxyrrhynchum)、条叶庭芥(Alyssumlinifolium)和琉苞菊(Hyaleapulchella)的生长及其对元素吸收的影响。研究结果表明:(1)生物结皮对3种荒漠草本植物生长的影响在生长期不同阶段存在差异。在前期,生物结皮的存在促进了植物生物量的累积;而后期,生物结皮却抑制了植物生长。生物结皮的存在显著影响了荒漠草本植物生物量的累积和冠根比。(2)生物结皮的存在显著增加了3种荒漠草本植物对N和K的吸收,而对P的吸收没有显著影响。生物结皮对3种植物Cu、Ca、Mg、Na、Cl的吸收存在种间差异。本研究结果将为该荒漠生态系统潜在的植被演替方向提供重要的科学根据。
生物结皮;生长;营养元素吸收;荒漠草本植物;古尔班通古特荒漠
生物结皮是由细菌、真菌、蓝绿藻、地衣和苔藓植物等与土壤形成的有机复合体,也是荒漠地区最具特色的微自然景观[1~2]。在干旱半干旱地区,地表高等植物的覆盖度不足30%,而70%以上的广大区域覆盖着生物结皮[3~4]。生物结皮具有强大的生态功能,对土壤水分含量[5~6]、养分积累[7~8]和维管植物的定居和生长[2,9~11]都有重要影响。同时,生物结皮的存在还可以促进维管植物对一些必需营养元素的吸收[10,12],但是关于它们对维管植物的影响的结果仍然不一[9,11,13~14]。因此,很多学者强调关于生物土壤结皮和维管植物之间关系的研究还有待于进一步的开展,尤其是在不同的植被背景、不同的气候条件下[14~15]。
古尔班通古特沙漠位于我国准噶尔盆地腹地,是中国最大的固定和半固定沙漠。该沙漠广泛发育的生物结皮,是除种子植物以外固定沙面的重要生物因子,也是影响干旱荒漠区植被恢复和重建的重要因素。因此,本研究提出如下科学问题:生物结皮对古尔班通古特沙漠中维管植物生长的影响如何?此研究通过野外原位实验,分析生物结皮对古尔班通古特沙漠中广泛分布的3种短命植物(尖喙牻牛儿苗Erodiumoxyrrhynchum,条叶庭芥Alyssumlinifolium和琉苞菊Hyaleapulchella)生长和元素吸收的影响来验证两个假设:(1)在干旱的古尔班通古特沙漠,由于生物结皮的存在有助于增加土壤养分,加之早春融雪季节水分充足,因此生物结皮会在一定程度上有利于荒漠植物幼苗的生长;但由于初夏季节雨水较少,旱季来临,水分成了该沙漠影响植被最主要的限制因子,生物结皮的存在可能会对荒漠草本植物产生不利影响;(2)由于我们证实了生物结皮的存在显著影响了氮同位素在土壤和植物之间的传递和吸收[8],因此生物结皮也会影响荒漠草本植物对不同营养元素的吸收。
1 材料与方法
1.1 研究区概况
研究区位于准噶尔盆地腹地的古尔班通古特沙漠南缘(44°11′~46°20′N,84°31′~90°00′E),它是中国最大的固定和半固定沙漠,面积约4.88×104km2。这个沙漠的年降水量为70~150 mm,主要集中在春季。年平均蒸发量2 000 mm以上。春季丰富的降水和积雪融化使土壤含水量高,植物和微生物生命活动旺盛。以小半乔木梭梭(Haloxylonammodendron)和白梭梭(Haloxylonpersicum)为沙漠建群种。占据了沙丘中上部的位置;垄间低地和沙丘中下部分布有蛇麻黄(Ephedradistachya)群落;研究区域广泛分布有沙蒿(Artemisiaarenaria)、对节刺(Horanowiaulicina)、尖喙牻牛儿苗(Erodiumoxyrrhynchum)、琉苞菊(Hyaleapulchella)、条叶庭芥(Alyssumlinifolium)角果黎(Ceratocarpusarenarius)等灌木和草本植物[16]。该区域的植被覆盖率高达40%,尤其是五月份。在维管植物之间镶嵌分布着发育良好的生物结皮,包括藻类结皮、地衣结皮和苔藓结皮等类型,其覆盖率也达到了40%[17]。
1.2 样地设计
2011年10月(样地布设前6个月),在古尔班通古特沙漠南缘丘间低地选择一处生物结皮发育良好的典型样地(60 m×100 m),样地生境较均质,地表以地衣结皮为主。将样地四周用围栏围住以避免人为或者动物的干扰。2012年4月(植物落种前),将样地随机划分为40块2 m×2 m的样方。随机地选取其中的20个样方,用小铲子仔细地将样方中的生物结皮去除(厚度约为5~8 cm)[18]。剩余的20个样方不做任何处理,作为完整生物结皮覆盖的样方。去除生物结皮的20个样方与完整生物结皮覆盖的20个样方随机交错分布。因此,实验中共有20个2 m×2 m的完整生物结皮(biocrusts-intact)覆盖的样方,20个2 m×2 m的去除生物结皮(biocrusts-removed)的样方。
1.3 野外数据收集
依据各植物生长期特征,植株生物量的采集是在植物生长季中每隔10或15天收集一次,共收集5次。当每年的三月末,冰雪融化,短命植物开始萌发生长。我们的实验是从2014年4月7日(植物出土后约10天,第二对真叶出现时)开始(经过去除生物结皮处理2年半后),2014年5月25日(植物生长达到其最大生物量并开始落种时)结束。在2014年5月25日时,研究的3种短命植物达到了它们的最大生物量,仅有一小部分开始落种,我们所采集的植物样品都是没有落种的,此次采集的植物样品用于测定植物体内营养元素含量。在生物结皮样地和去除生物结皮样地,每个物种在各样方中随机取样,以消除样方异质性对植物生长的可能影响。由于古尔班通古特沙漠这3种短命植物开始生长于4月初,落种死亡于5月底。根据3种植物的生长周期,我们将“2014年4月7日~2014年4月30日”定义为“生长前期”,把“2014年4月30日~2014年5月25日”定义为“生长后期”。在各样方中随机选取4~5株完整植株,每个物种每次共获取40~50株。采用全株挖掘法进行取样,根系尽可能深挖(幼苗期至成熟期逐渐加深),以保证其完整。将采集的整株植物装入封口袋带回实验室。
试验期间,同时采集了生物结皮样地和去除生物结皮样地不同土层(0~5,5~10和10~15 cm)的土壤,用于分析土壤养分、水分含量。
1.4 生物量的测定
将收获植株的地上部分和地下部分分开,放入烘箱中,在120℃下处理30 min,然后在70℃下处理24 h,随后称量植株干重,用于生物量分析。
1.5植物体内营养元素含量和土壤养分含量的测定
将采集的植物、土壤样品于85℃烘干,粉碎待用。测定前,于105℃烘干3 h,精确称重,采用硫酸—高氯酸消煮法分解植物样品,吸取适量待测液,用凯氏定氮仪(VAP45s,C.Gerhardt Laboratory Instruments Incorporation,Bonn,Germany)测定N含量,紫外分光光度计(752N型,上海光学仪器厂)结合钼锑抗比色法[19]测定P含量;原子吸收法测定K含量[19]。另外,用电感耦合等离子体质谱仪(Sciex D RC II,Perkin Elmer Incorporation,Manhattan,USA)测定植物体内的Cu、Ca、Mg、Na、Cl等5种微量元素的含量。土壤中N、P、K含量的测定方法同上。
1.6 数据分析
用SPSS 17.0(Chicago,IL,USA)对所测各项指标进行描述性统计分析。用一般线性模型(GLM)对有无生物结皮、物种和不同生长期是否对土壤理化性质、3种植物生长和元素吸收存在交互作用进行分析。同时对有无生物结皮间的数据进行t检验,不同物种间的数据进行单因素方差分析(one-way ANOVA)和多重比较(LSD),不同生长期间进行重复测量(Repeated measure ANOVA),并利用Origin 8.0对数据作图。
2 结果与分析
2.1 生物结皮对土壤水分及养分含量的影响

图1 生物结皮影响下不同土层的土壤质量含水量 *指生物结皮区与去除生物结皮区差异显著(*P<0.05,**P<0.01)Fig.1 Variations of soil moisture in different depth under the effects of biological soil crusts during periodic sampling date Asterisks indicated significant difference between crusted soils and uncrusted soils on each growing period(*P<0.05,**P<0.01)
在实验期内,生物结皮区与去除生物结皮区的土壤含水量在不同层次变化一致(图1)。土壤含水量的整体趋势是在实验前期(4月7日~4月30日)均较高,在5月15日降到最低,随后又增高。将两个样地的土壤含水量进行比较,在0~5和5~10 cm土层中,生物结皮区中的土壤含水量在整个实验期始终低于去除生物结皮区的。在10~15 cm土层中,生物结皮区的土壤含水量在实验前期(4月7日~4月17日)高于去除生物结皮区,但是在实验后期(4月30日~5月25日),却是生物结皮区的土壤含水量较低。
土壤养分在植物不同生长期没有显著变化,但是,结皮处理与去除结皮处理之间存在显著差异(表1)。4月7日土壤样品分析表明:在0~5 cm土层中,生物结皮区土壤中的有机物、总N、速效N和速效P均显著高于去结皮区域。在5~10 cm土层中,生物结皮区土壤中的总N、速效N和速效P的含量也显著高于去结皮区域。生物结皮的存在没有显著影响10~15 cm土层的养分含量。

表1 生物结皮区与去除生物结皮区的土壤养分状况
注:*P<0.05,**P< 0.01 下同。
Note:*P<0.05,**P< 0.01 The same as below.
2.2 生物结皮对3种荒漠草本植物生物量的影响
生物结皮对3种草本植物生长的影响不同(图2)。在生长前期(4月7日~4月30日),生物结皮区的3种植物较去除生物结皮区的植物积累了更多的个体生物量。但是在生长后期(4月30日~5月25日),生物结皮区植物的个体生物量较去除生物结皮区的低。在生长末期(5月25日),生物结皮区的尖喙牻牛儿苗和琉苞菊的个体生物量均显著大于去除生物结皮区的(P<0.05)。方差分析表明,生物结皮、物种、生长期以及它们之间的相互作用均显著影响3种植物个体生物量的积累(表2)。
2.3生物结皮对3种荒漠草本植物地上地下生物量分配比的影响
从图3中可以看出,与生物量在生长期中逐渐递增趋势不同,尖喙牻牛儿苗和条叶庭芥的冠根比(S/R)呈现先增加后减少的趋势。这可能与植物的生长策略有关,在生长前期,植物迅速积累地上部分为了获取更多的光合产物。在生长后期(5月15日)植物迅速降低的S/R可能是由于此时土壤水分降低,植物需要快速延长根系,以从土壤中获取足够的水分和养分来保证存活和后期的生长。与去除生物结皮区的琉苞菊相比,生长在生物结皮区的琉苞菊的S/R始终较低,可能与生物结皮区土壤含水量较低有关。重复测量结果显示,生物结皮的存在、物种、生长期以及结皮与生长期、物种与生长期及三者的交互作用均对荒漠草本植物地上地下生物量分配比有显著影响(表2)。
表2生物结皮、物种、生长期和它们的相互作用对植物生长影响的方差分析
Table2Theeffectsofbiocrusts(B),plantspecies(S),growingperiods(P)andtheinteractionamongthemongrowthandphysiologicalcharacteristicsusingfactorialanalysisofvariance
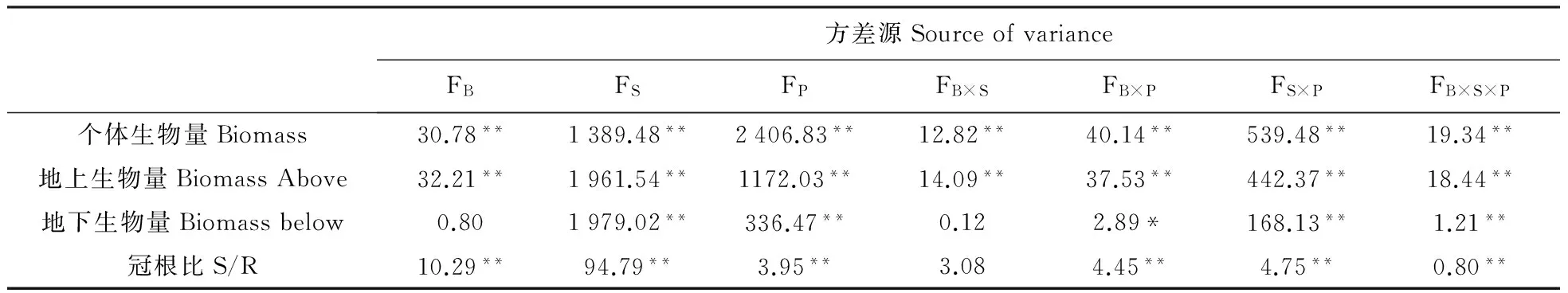
方差源SourceofvarianceFBFSFPFB×SFB×PFS×PFB×S×P个体生物量Biomass30.78**1389.48**2406.83**12.82**40.14**539.48**19.34**地上生物量BiomassAbove32.21**1961.54**1172.03**14.09**37.53**442.37**18.44**地下生物量Biomassbelow0.801979.02**336.47**0.122.89*168.13**1.21**冠根比S/R10.29**94.79**3.95**3.084.45**4.75**0.80**
注:表中数值为F检验值。
Note: Values indicate results of F test.

图2 生物结皮影响下3种植物不同生长期个体生物量变化 *指结皮处理与去除结皮处理间的差异显著(*P<0.05,**P<0.01);%指结皮处理相对于去除结皮处理的变化Fig.2 Variations of individual biomass of three herbs with different growth periods under the effects of biological soil crusts Asterisks indicated significant difference between crusted soils and uncrusted soils on each growing period(*P<0.05,**P<0.01); % indicated the changes in crusted soils compared with uncrusted soils.

图3 3种植物不同生长期冠根比Fig.3 Changes in S/R of three herbs in different growth periods
2.4生物结皮对3种荒漠植物营养元素吸收的影响
实验结果(表3)显示,3种荒漠草本植物对N和K的吸收均因生物结皮的存在而显著增加(P<0.05或P<0.01)。生长在生物结皮区的植物对N和K的吸收均大于去除生物结皮区植物的吸收。生物结皮的存在却对P的吸收没有显著影响(P>0.05),与植物对N和K的吸收有所不同,生长在生物结皮区的尖喙牻牛儿苗和琉苞菊对P的吸收小于去除生物结皮区的。说明生物结皮对植物吸收N、P和K这3种营养元素的影响不尽相同。生物结皮对3种荒漠草本植物元素吸收其它营养元素的影响因物种不同而异。3种荒漠草本植物对Cu、Ca、Mg、Na、Cl的吸收受生物结皮影响较大。其中,生物结皮显著促进了尖喙牻牛儿苗对Ca的吸收,显著抑制了其对Cu和Mg的吸收;显著促进了条叶庭芥对Cu、Mg、Na、Cl的吸收;显著促进了琉苞菊对Ca、Na、Cl的吸收。
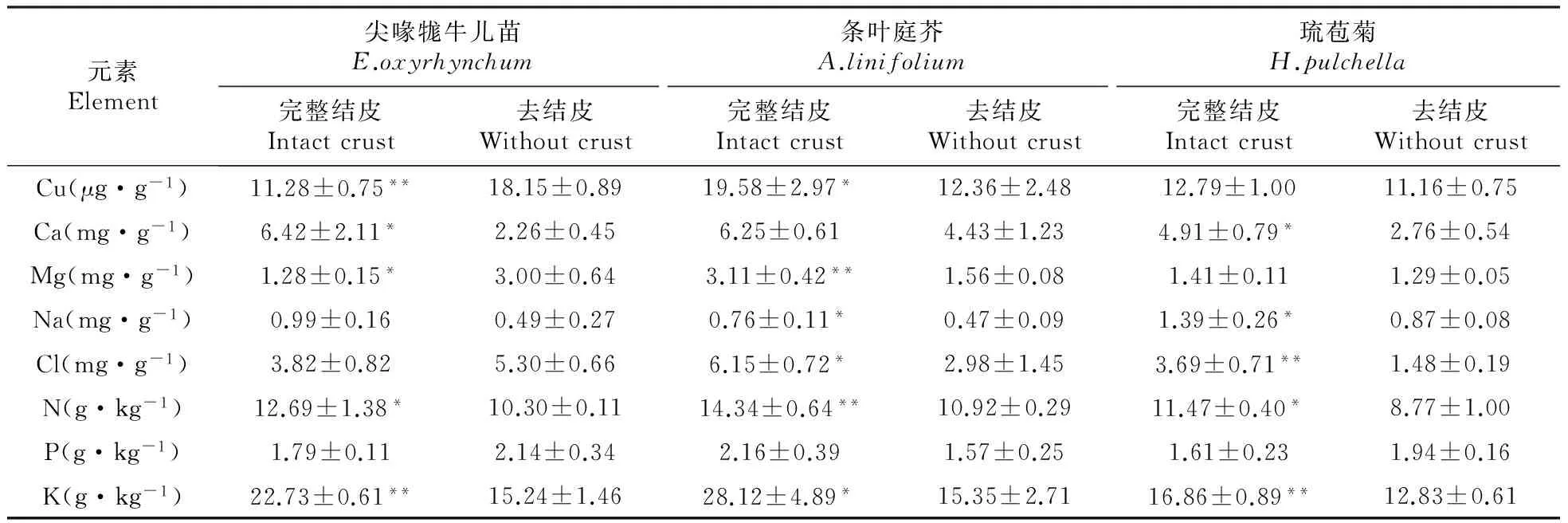
表3 生物土壤结皮对3种荒漠草本植物对元素吸收的影响
3 讨论
3.1生物结皮对荒漠草本植物生物量和植株生长的影响
我们之前的研究也表明,生物结皮能够增加沙漠地表0~5 cm土层中的有机质含量[20]。这在不同程度上促进了荒漠植株的生长,并增加了荒漠草本植物的总生物量和单株生物量[10]。生物结皮和维管植物共同组成了一个小的生态系统,关系非常复杂。很多研究表明它们或者是竞争者[17,21],或者是合作者[9~11],又或是中立关系[22~23],这主要就是由于生物结皮对土壤水分以及养分影响的差异、植物种类的不同和生物结皮类型等原因造成[17,19,24]。
我们的研究结果发现,生物结皮在荒漠草本植物生长前期对其具有积极影响,但是在植物生长后期,生物结皮却对其造成了消极的影响。在干旱、半干旱的荒漠生态系统中,水分和养分成了限制维管植物生长发育最主要的限制性因子[16]。生物结皮对荒漠草本植物前期的促进作用可能是因为生物结皮改变了土壤理化性质,从而能够有利于维管植物的生长发育。通过我们对土壤养分含量的分析结果,也发现生物结皮的存在显著增加了0~5和5~10 cm土层的养分,而生长前期,植物的根系也主要分布在这个区域。对于古尔班通古特沙漠来说,沙漠腹地降水主要集中在春季初期,加之冬季有稳定的降雪,春季降水和积雪融水使得这期间水分相对充足,生物结皮的存在也没有显著影响土壤中的水分含量,因此水分并不是此时限制植物生长的关键因子。对于此时的荒漠草本植物来说,生物结皮的存在无异于养分带,利于植物快速积累生物量。已有的研究也表明生物结皮使土壤表面的稳定性增强,从而加速了土壤中养分的流动和运输,并使土壤中的养分含量增加[20,22],这与我们的研究结果一致。
生物结皮对3种荒漠草本植物生长后期的消极影响可能与这期间土壤水分的缺乏有关。生物结皮对土壤水文过程的影响也一直备受关注,也是一个最具争议性的问题。一部分学者认为生物结皮的存在增加了土壤的粗糙度,大大延长了雨水在土壤表面滞留的时间,因此,提高了土壤水分入渗率[1,25];而另一部分学者则认为结皮的存在阻碍了降水向深层的入渗,增加了地表径流的发生[5~6]。我们的研究结果表明,在植物生长后期,生物结皮的存在显著减少了土壤水分含量。众所周知,在干旱的沙漠生态系统中,尤其是在蒸发量较高而降水量较低的季节,限制生物活性的最主要的因素首先是水分,其次才是养分[26]。在3种荒漠草本植物生长后期,土壤水分缺乏,水分是限制植物生长的主要因子。加之生物结皮的存在显著降低了土壤水分的含量,因此对植物的生长产生了消极的影响,这与其它一些关于草本植物对水分与养分需求平衡的研究结果一致[27]:尽管养分供应充足,如果水分成了限制因素,那么则会对草本植物的生长和生物量累计造成不利影响。
3.2生物结皮对荒漠草本植物营养元素吸收的影响
很多研究表明生物结皮对土壤表面化学性质的改变与植物中所含有的生物所必需元素的变化有关[10,12]。生物结皮对维管植物营养元素吸收的影响可能就是因为生物结皮增加了土壤表面的有机质含量[20,28],再通过某种途径导致生长在生物结皮样地的植物能够吸收到更多的营养物质。我们的研究结果表明,生长在生物结皮样地中植物体内的N含量显著高于生活在去除生物结皮样地,但P的含量在两者间却没有显著差异。De Falco[29]对5种一年生非禾本科植物的N、P含量进行了测量,结果发现,生长在藻结皮上的植物其全N和全P较高,其中,Bromusrubens和Erodiumcicutarium在结皮土壤中生长具有较高的N含量分别高出了6和10倍,P含量分别高出9和10倍。可能是因为在不同的研究区域和结皮类型针对不同的植物研究,因此其结果可能会不尽相同。但是不论是在哪种生物结皮类型上,生物结皮的存在均促进了植物对N的吸收。由于P是生物结皮和植物根二者都必需的营养元素,二者就会对P的吸收产生竞争,这可能是生物土壤结皮对植物中P的含量存在负效应的主要原因,在许多沙漠中,普遍存在的石灰质土壤和沙质土壤中,P经常处于缺乏的状态[12]。因此,生物结皮有机体可能会与维管束植物竞争P元素,对于小种子植物以及扎根较深的短命植物而言,这些竞争尤为激烈,植物的根系出现的表层正是生物结皮影响最为激烈的区域,我们发现,许多植物,包括灌木在内,在土壤表层2 cm处会产生头发状的细丝,尤其在雨量丰富的季节这种现象更为明显[4,12],这些细丝状的根会与表面的生物结皮产生对生物必需营养元素的竞争。
植物吸收营养元素因生物结皮的存在而增加,这可能是由于真菌在土壤与植物之间养分传递上起到了至关重要的作用[7~8]。越来越多的研究支持生物结皮与维管植物之间是由庞大的真菌网络结构联系起来的[30~31]。真菌对于古尔班通古特沙漠中的生物结皮来说是重要的组成部分[32],因此,真菌在其氮素传递过程中的作用也不容小觑。我们的结果也表明,生物结皮的存在增加了植物对于K、Cu、Ca、Mg、Na、Cl的吸收。国内外也有研究报道生物结皮会增加维管植物体内Cu、K、Mg的含量[4,10]。生物结皮促进了维管植物对营养元素的吸收,可能还有很多其他的途径,例如生物结皮覆盖的土壤往往含有更多的黏土[33]。较多的黏土成分更有利于土壤颗粒黏结更多的营养物质,尤其是在湿润的时候,这些土壤颗粒更容易吸附粘性的鞘物质[4],带负电的鞘物质与带正电荷的植物营养元素螯合在一起,因而增加了植物体内营养元素的含量。
4 结论
生物结皮的存在对古尔班通古特沙漠3种荒漠草本植物生长的影响具有很强的时效性。在植物生长前期,生物结皮的存在促进了3种荒漠草本植物的生长;但是在植物生长后期,生物结皮却显著抑制了3种荒漠草本植物的生长。生物结皮的存在显著增加了3种荒漠草本植物对N和K的吸收,却对P的吸收没有显著影响。生物结皮对3种荒漠草本植物吸收Cu、Ca、Mg、Na、Cl的影响因种而异,对不同的植物有不同的影响。总的来说,生物结皮对植物营养元素吸收的积极影响要明显大于消极影响。
1.Eldridge D J,Greene R S B.Assessment of sediment yield by splash erosion on a semi-arid soil with varying cryptogam cover[J].Journal of Arid Environments,1994,26(3):221-232.
2.Belnap J.Nitrogen fixation in biological soil crusts from southeast Utah,USA[J].Biology and Fertility of Soils,2002,35(2):128-135.
3.Belnap J,Harper K T,Warren S D.Surface disturbance of cryptobiotic soil crusts:nitrogenase activity,chlorophyll content,and chlorophyll degradation[J].Arid Soil Research and Rehabilitation,1994,8(1):1-8.
4.Belnap J,Lange O L.Biological soil crusts:structure,function,and management[M]. Berlin:Springer Press,2003.
5.Coppola A,Basile A,Wang X,et al.Hydrological behaviour of microbiotic crusts on sand dunes:example from NW China comparing infiltration in crusted and crust-removed soil[J].Soil and Tillage Research,2011,117:34-43.
6.Chamizo S,Cantón Y,Domingo F,et al.Evaporative losses from soils covered by physical and different types of biological soil crusts[J].Hydrological Processes,2013,27(3):324-332.
7.Green L E,Porras-alfaro A,Sinsabaugh R L.Translocation of nitrogen and carbon integrates biotic crust and grass production in desert grassland[J].Journal of Ecology,2008,96(5):1076-1085.
8.Zhuang W W,Downing A,Zhang Y M.The influence of biological soil crusts on15N translocation in soil and vascular plant in a temperate desert of Northwestern China[J].Journal of Plant Ecology,2015,8(4):420-428.
9.Li X R,Jia X H,Long L Q,et al.Effects of biological soil crusts on seed bank,germination and establishment of two annual plant species in the Tengger Desert(N China)[J].Plant and Soil,2005,277(1-2):375-385.
10.张元明,聂华丽.生物土壤结皮对准噶尔盆地5种荒漠植物幼苗生长与元素吸收的影响[J].植物生态学报,2011,35(4):380-388.
Zhang Y M,Nie H L.Effects of biological soil crusts on seedling growth and element uptake in five desert plants in Junggar Basin,Western China[J].Chinese Journal of Plant Ecology,2011,35(4):380-388.
11.Kidron G J.The negative effect of biocrusts upon annual-plant growth on sand dunes during extreme droughts[J].Journal of Hydrology,2014,508:128-136.
12.Harper K T,Belnap J.The influence of biological soil crusts on mineral uptake by associated vascular plants[J].Journal of Arid Environments,2001,47(3):347-357.
13.Escudero A,Martínez I,de la Cruz A,et al.Soil lichens have species-specific effects on the seedling emergence of three gypsophile plant species[J].Journal of Arid Environments,2007,70(1):18-28.
14.Godínez-alvarez H,Morín C,Rivera-aguilar V.Germination,survival and growth of three vascular plants on biological soil crusts from a Mexican tropical desert[J].Plant Biology,2012,14(1):157-162.
15.Belnap J,Harper K T.Influence of cryptobiotic soil crusts on elemental content of tissue of two desert seed plants[J].Arid Soil Research and Rehabilitation,1995,9(2):107-115.
16.张立运,陈昌笃.论古尔班通古特沙漠植物多样性的一般特点[J].生态学报,2002,22(11):1923-1932.
Zhang L Y,Chen C D.On the general characteristics of plant diversity of Gurbantunggut sandy desert[J].Acta Ecologica Sinica,2002,22(11):1923-1932.
17.Zhang Y M,Chen J,Wang L,et al.The spatial distribution patterns of biological soil crusts in the Gurbantunggut Desert,Northern Xinjiang,China[J].Journal of Arid Environments,2007,68(4):599-610.
18.Serpe M D,Zimmerman S J,Deines L,et al.Seed water status and root tip characteristics of two annual grasses on lichen-dominated biological soil crusts[J].Plant and Soil,2008,303(1-2):191-205.
19.鲁如坤.土壤农业化学分析方法[M].北京:中国农业科学出版社,1999.
Lu R K.Soil argrochemistry analysis protocoes[M].Beijing:China Agriculture Science Press,1999:146-195.
20.张元明,杨维康,王雪芹,等.生物结皮影响下的土壤有机质分异特征[J].生态学报,2005,25(12):3420-3425.
Zhang Y M,Yang W K,Wang X Q,et al.Influence of cryptogamic soil crusts on accumulation of soil organic matter in Gurbantunggut Desert,northern Xinjiang,China[J].Acta Ecologica Sinica,2005,25(12):3420-3425.
21.Prasse R,Bornkamm R.Effect of microbiotic soil surface crusts on emergence of vascular plants[J].Plant Ecology,2000,150(1-2):65-75.
22.West N E.Structure and function of microphytic soil crusts in wildland ecosystems of arid to semi-arid regions[J].Advances in Ecological Research,1990,20:179-223.
23.Beymer R J,Klopatek J M.Effects of grazing on cryptogamic crusts in pinyon-juniper woodlands in Grand Canyon National Park[J].American Midland Naturalist,1992,127(1):139-148.
24.Bowker M A,Maestre F T,Soliveres S.Competition increases with abiotic stress and regulates the diversity of biological soil crusts[J].Journal of Ecology,2010,98(3):551-560.
25.Greene R S B,Chartres C J,Hodgkinson K C.The effects of fire on the soil in a degraded semiarid woodland.Ⅰ.Cryptogam cover and physical and micromorphological properties[J].Australian Journal of Soil Research,1990,28(5):755-777.
26.Mccrackin M L,Harms T K,Grimm N B,et al.Responses of soil microorganisms to resource availability in urban,desert soils[J].Biogeochemistry,2008,87(2):143-155.
27.Zhou X B,Zhang Y M,Ji X H,et al.Combined effects of nitrogen deposition and water stress on growth and physiological responses of two annual desert plants in northwestern China[J].Environmental and Experimental Botany,2011,74:1-8.
28.崔燕,吕贻忠,李保国,等.鄂尔多斯沙地土壤生物结皮的理化性质[J].土壤,2004,36(2):197-202.
Cui Y,Lü Y Z,Li B G,et al.Physico-chemical properties of soil microbiotic crusts on erdos plateau[J].Soils,2004,36(2):197-202.
29.Defalco L A.Influence of cryptobiotic crusts on winter annuals and foraging movements of the desert tortoise[D].Fort Collins,CO:Colorado State University,1995.
30.Johnson N C,Hoeksema J D,Bever J D,et al.From Lilliput to Brobdingnag:extending models of mycorrhizal function across scales[J].BioScience,2006,56(11):889-900.
31.Maestre F T,Bowker M A,Cantón Y,et al.Ecology and functional roles of biological soil crusts in semi-arid ecosystems of Spain[J].Journal of Arid Environments,2011,75(12):1282-1291.
32.Wu N,Zhang Y M,Pan H X,et al.The role of nonphotosynthetic microbes in the recovery of biological soil crusts in the Gurbantunggut Desert,northwestern China[J].Arid Land Research and Management,2010,24(1):42-56.
33.Verrecchia E,Yair A,Kidron G J,et al.Physical properties of the psammophile cryptogamic crust and their consequences to the water regime of sandy soils,north-western Negev Desert,Israel[J].Journal of Arid Environments,1995,29(4):427-437.
The Natural Science Foundation of Xinjiang Uygur Autonomous Region(2016D01B049)
introduction:ZHUANG Wei-Wei(1986—),female,doctor’s degree,engaged in the research of plant physiology and ecology in arid land.
date:2016-09-20
EffectsofBiologicalSoilCrustsonGrowthandNutrientUptakeinThreeDesertHerbsintheGurbantunggutDesert,NorthwesternChina
ZHUANG Wei-Wei1,2ZHOU Xiao-Bing3ZHANG Yuan-Ming3*
(1.Xinjiang Key Laboratory of Special Species Conservation and Regulatory Biology,College of Life Sciences,Xinjiang Normal University,Urumqi 830054;2.Key Laboratory of Plant Stress Biology in Arid Land,College of Life Sciences, Xinjiang Normal University,Urumqi 830054;3.Xinjiang Institute of Ecology and Geography,Chinese Academy of Sciences,Key Laboratory of Bioresource in Arid Land,Chinese Academy of Sciences,Urumqi 830011)
As an important component for desert ecosystem, biological soil crusts(biocrusts) may possibly affect adjacent vascular plants via hydrology, soil erosion and nutrient cycling, while experimental evidences are still scarce and controversial. In the present research, we attempted to experimentally investigate whether and how biocrusts affect growth and nutrient uptake in vascular plants of the Gurbantunggut Desert. We conducted the experiments to examine the effects of biocrusts on growth and nutrient uptake in three widely distributed species ofErodiumoxyrrhynchum,AlyssumlinifoliumandHyaleapulchella. The results showed that the effects of biocrusts on the growth of three desert vascular plants were different in different growing phases. The biomass the three species in crusted soils were higher than those in uncrusted soils in the early growth period and lower in the later part of the growing period. While biocrusts did not significantly affect the biomass allocation between shoot and root. Biocrusts also influenced nutrient uptake by plants, especially promoting uptake of N and K, while did not affect the uptake of P. The influence on uptake of other elements(Cu, Ca, Mg, Na, Cl) was species-specific. We expect to provide important scientific basis on the potential vegetation succession direction in this desert ecosystem.
biological soil crusts;growth;nutrient uptake;desert herbs;the Gurbantunggut Desert
新疆维吾尔自治区自然科学基金项目(2016D01B049)
庄伟伟(1986—),女,博士,主要从事干旱区植物生理生态方面的研究工作。
* 通信作者:E-mail:zhangym@ms.xjb.ac.cn
2016-09-20
* Corresponding author:E-mail:zhangym@ms.xjb.ac.cn
S727.23
A
10.7525/j.issn.1673-5102.2017.01.006
