甘草提取物的有效部位诱导人宫颈癌HeLa细胞株凋亡及对凋亡相关蛋白Caspase-3和Caspase-9表达的影响
2017-11-07王吉锡邓伟生王凤儒史之茂张玉瑶
王吉锡 邓伟生 王凤儒 史之茂 孟 丹 徐 强 张玉瑶
甘草提取物的有效部位诱导人宫颈癌HeLa细胞株凋亡及对凋亡相关蛋白Caspase-3和Caspase-9表达的影响
王吉锡 邓伟生 王凤儒 史之茂 孟 丹 徐 强 张玉瑶
目的研究甘草提取物的有效部位(GL)体外诱导HeLa细胞凋亡情况及对Caspase家族蛋白表达的调控,进一步阐明GL的抑癌机制。方法将25 μg/mL的GL作用于HeLa细胞24 h后,采取MTT比色法,吖啶橙/溴乙锭荧光双染法,透射电子显微镜法,观察GL诱导HeLa细胞凋亡情况,并采用Western blot法检测Caspase-3、Caspase-9蛋白表达水平的变化。结果MTT结果显示,GL可以有效抑制HeLa细胞的增殖,呈剂量-时间相关性。AO/EB双染色及透射电镜观察发现GL作用HeLa细胞24 h后,可见大量早期凋亡细胞。Western blot测定结果显示,药物组Pro-caspase-9蛋白表达量与对照组比较差异具有统计学意义(P<0.05);Cleaved-caspase-3蛋白表达量高于对照组。结论GL能够促进Caspase-3、Caspase-9酶原活化,具有体外诱导HeLa细胞凋亡的作用。
甘草;抗肿瘤作用;细胞凋亡;HeLa细胞;凋亡蛋白
恶性肿瘤是人类因疾病致死的第一因素[1]。而宫颈癌更是妇科常见的恶性肿瘤之一,位居妇科恶性肿瘤第二位,严重影响和侵害女性的身心健康[2]。目前从中草药中提取有效成分治疗肿瘤正成为研究热点,研究天然植物诱导肿瘤细胞凋亡,目前已取得了一定的进展[3]。并且根据肿瘤的发病机制,探寻新的药物作用靶点[4]。本研究从天然植物药甘草根中提取物的有效部位(GL),作用到人宫颈癌HeLa细胞中,判定该活性成分的抗癌效果及相应的作用靶点。为甘草抗肿瘤活性成分的进一步研究提供实验基础,也为中草药抗肿瘤作用的开发和研究提供相关的实验方法与理论基础。
1 材料与方法
1.1 主要试剂
MEM培养基(美国GIBCO公司);胎牛血清(天津灏洋生物制品科技有限公司);胰蛋白酶、二甲基亚砜(DMSO)、BCA蛋白浓度测定试剂盒、Western blot及IP细胞裂解液(上海碧云天生物技术有限公司);Caspase-3、Caspase-9兔抗人抗体(武汉博士德生物公司);兔抗GAPDH多克隆IgG抗体(杭州贤至生物科技公司);蛋白Marker(美国GIBCO公司)。
1.2 细胞株及细胞培养
人宫颈癌传代细胞(HeLa)购自中国科学院上海细胞研究所。细胞培养过程中,培养液浓度比例为含5%胎牛血清,1%双抗的MEM培养基;培养条件为36.5℃,CO2恒温培养箱中培养;消化细胞过程加入0.25%胰蛋白酶,温箱中消化2 min。每天镜下观察细胞生长状态,适时更换培养液及传代细胞。
1.3 GL的提取
将甘草粉以1 g∶20 mL溶解于蒸馏水中,搅动摇匀,浸泡过夜后,超声波振1 h,低温离心15 min(4℃,4 000 r/min),去上清,收集沉淀物;干燥后,以1 g∶10 mL比例与丙酮溶液混合,搅动摇匀,浸泡过夜,使之充分混合,低温离心15 min(4℃,4 000 r/min),收集上清液;经旋转蒸发浓缩,鼓风干燥烘干,再经甲醇溶解,低温离心15 min(4℃,4 000 r/min),得到GL,提取率为2.4%。
1.4 MTT比色法检测GL对HeLa细胞增殖的抑制作用情况
将1.0×105个/mL的细胞悬液按照100 μL/孔加入96孔板,温孵24 h。加入甘草提取物GL的量依次为6.25 μg/mL、12.5 μg/mL、25 μg/mL、50 μg/mL、100 μg/mL,每孔100 μL。并设立顺铂药物阳性对照组、溶媒阴性对照组以及空白对照组。培养12 h、24 h和48 h。加入0.5 mg/mL的MTT,每孔200 μL,继续孵育4 h。观察到蓝紫色沉淀形成后,弃掉MTT溶液,加入200 μL DMSO,振荡10 min。用酶标仪在490 nm波长处测定吸光度值。
1.5 AO/EB双染色法检测GL诱导HeLa细胞凋亡情况
将1.0×105个/mL的细胞悬液按照2 mL/孔的液体量,加入6孔板,温孵24 h。加入提取物GL的浓度为25 μg/mL,每孔2 mL,同时设立溶媒对照组和顺铂药物阳性对照组,继续培养24 h。调整细胞悬液密度为1.0×106个/mL,取90 μL,加入AO/EB染液5 μL,浓度100 μg/mL,染色10 min。荧光显微镜下观察细胞形态学变化情况。
1.6 透射电子显微镜观察HeLa细胞凋亡的超微结构变化
将处于对数生长期状态良好的HeLa细胞平行传代分组。GL给药浓度25 μg/mL,另设溶媒阴性对照组,培养24 h。1 500 r/min离心5 min,PBS清洗,收集细胞。再经常规过程:固定、脱水、包埋、切片。透射电子显微镜观察HeLa细胞形态结构。
1.7 Western blot检测Caspase-3和Caspase-9蛋白的表达情况
冰上操作,提取总蛋白,BCA测定蛋白质浓度。制胶:分离胶-15%;积层胶-5%。取100 μg的上样蛋白,加入5×上样缓冲液,沸水2 min,进行蛋白质变性。电泳缓冲液冲洗加样孔,兔抗人GAPDH多克隆抗体作为内参,各加样孔依次加入蛋白Marker(3 μL)和处理过的样品蛋白,设定70 V积层胶电泳电压,120 V分离胶电泳电压,恒压电泳;溴酚蓝达凝胶下缘0.5 cm时,停止电泳。依据蛋白Marker,获取目标蛋白凝胶片断。处理PVDF膜,目标蛋白Caspase-3用200 mA恒流转膜55 min;Caspase-9和GAPDH用300 mA恒流转膜65 min,4℃转膜。阻断非特异性结合蛋白,使用TBST液清洗膜3次,每次10 min;置于1%的BSA封闭液中,37℃,1.5 h。加入一抗,4℃冰箱孵育过夜;使用TBST液清洗膜3次,每次10 min。加入二抗,37℃,孵育1 h。一抗稀释浓度(Caspase-3、Caspase-9抗体均为1∶200稀释;GAPDH抗体用1∶1 000稀释),二抗稀释浓度(山羊抗兔二抗用1∶1 000稀释)。使用TBST液和TBS液各清洗膜3次,每次10 min;加入显色液,显现条带后,去离子水冲洗终止显色。应用双色红外激光成像系统,扫描记录目标蛋白条带的灰度值,进行统计分析。
1.8 统计学分析
应用SPSS 19.0统计软件进行分析,计量资料数据以均数±标准差表示,多组间比较采用方差分析;重复测量资料数据做重复测量方差分析,两两比较采用SNK-q检验;P<0.05为差异具有统计学意义。
2 结果
2.1 MTT比色法检测GL对HeLa细胞增殖的抑制作用结果
在同一作用时间内,随GL的作用浓度增加,其对HeLa细胞增殖的抑制作用增强;当在同一作用浓度下,抑制作用的效果随作用时间的延长而增强。可以看出GL对HeLa细胞增殖抑制作用具有剂量-时间依赖性,随着作用浓度的增高、作用时间的延长,抑制作用越明显,其抑制率与对照组比较,差异具有统计学意义(P<0.05)(图1)。

图1 不同浓度GL作用HeLa细胞12、24、48 h的增殖抑制率Figure 1 Cell proliferating curves of HeLa cell treated with GL for 12,24 and 48 hours
2.2 AO/EB双染色法检测HeLa细胞凋亡结果
从AO/EB双荧光染色照片来看,溶媒对照组(图2C)HeLa细胞显示正常细胞染色情况,表现为AO将细胞核染色质染成绿色-黄色荧光,细胞结构正常。25 μg/mL的GL作用组(图2B)HeLa细胞表现为早期细胞凋亡为主的特征,凋亡的HeLa细胞呈现均匀增强的荧光绿色,也有核染色质被EB染色呈橙黄色的结果,并可见核固缩的情况。DDP对照组(图2A)可见核被EB染色呈橙黄或橙红色,结构不清,边缘模糊;呈细胞凋亡晚期状态,并可见坏死细胞。
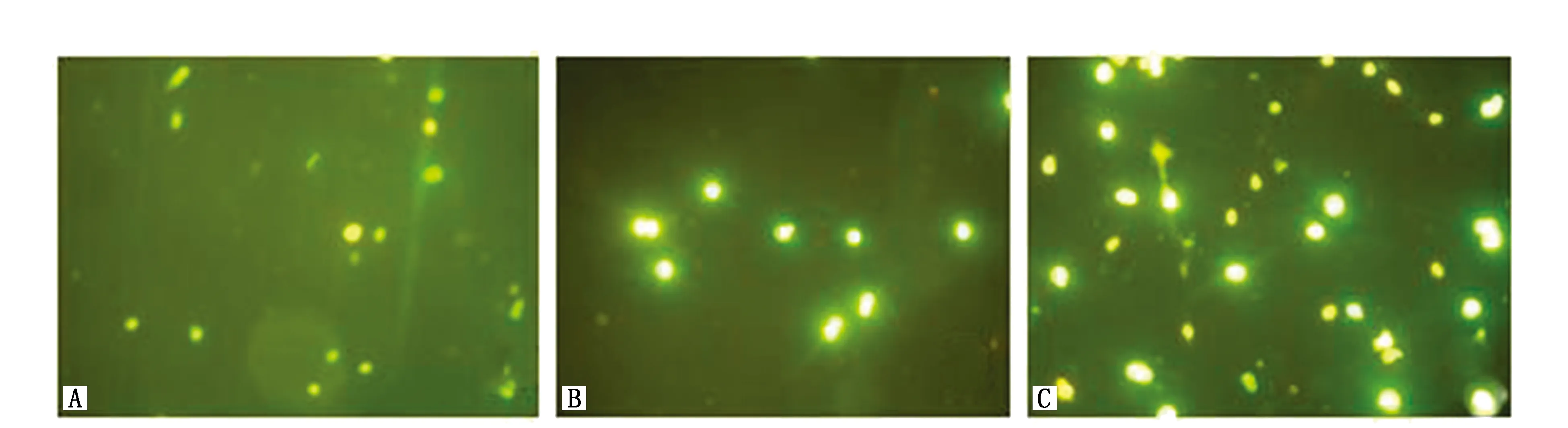
图2 经AO/EB荧光双染后,各组HeLa细胞凋亡染色表达情况(10×)Figure 2 Morphological changes of HeLa cells stained by AO/EB dyes(10×)Note:A.DDP group;B.GL group;C.Control group.
2.3 透射电镜观察HeLa细胞凋亡形态学变化结果
从电镜照片的结果看,溶媒对照组(图3B)细胞呈HeLa细胞正常形态,圆形居多,呈不规则形状;核膜完整,核仁清晰;细胞器正常完整,可见线粒体嵴及微绒毛。25 μg/mL的GL作用组(图3A)的HeLa细胞超微形态与溶媒对照组有明显不同,可见凋亡小体形成。其中,部分HeLa细胞的核仁消失,核染色质边缘聚集;胞浆内见空泡,细胞膜破裂,胞浆溢出等改变。
2.4 Western blot测定HeLa细胞凋亡相关蛋白Caspase-3、Caspase-9的表达水平结果
将实验药物GL分为两个作用浓度组,分别为25 μg/mL和50 μg/mL,同时设立溶媒对照组,给药作用时间为24 h。检测Caspase-3、Caspase-9蛋白的表达情况,统计分析蛋白的相对表达水平。根据Caspase-9蛋白表达条带结果,检测到了Caspase-9裂解后的活性片段Cleaved-caspase-9条带,表明了Capase-9酶原的裂解活化,Pro-caspase-9蛋白表达量降低,与对照组比较,差异具有统计学意义(P<0.05)。根据Caspase-3蛋白的检测结果,可以看到三条条带。表明Caspase-3已活化,Pro-caspase-3蛋白37 kD被剪切活化成19 kD和17 kD的两个小蛋白发挥作用。Caspase-3的活化,表明细胞凋亡将不可避免的继续。Cleaved-caspase-3的表达量增加(图4,图5)。
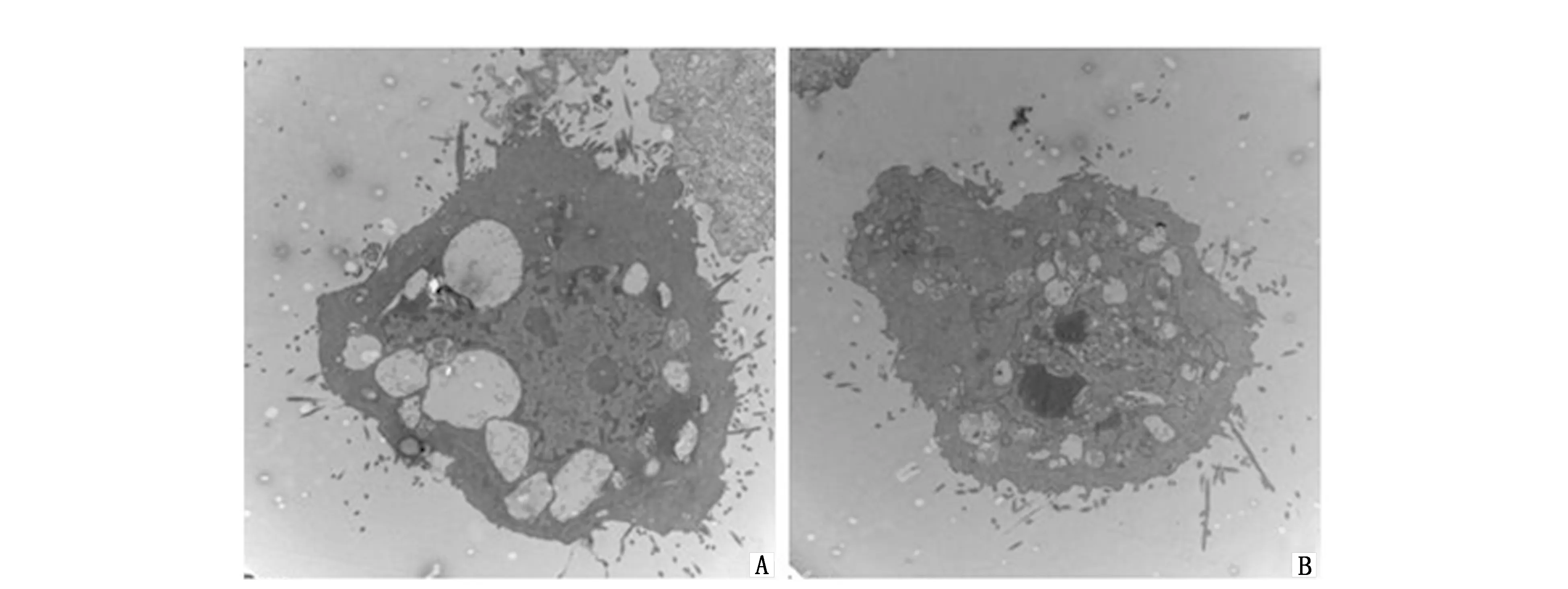
图3 GL作用24 h后,透射电子显微镜下HeLa细胞的凋亡形态改变 Figure 3 Morphological changes of GL-treated and control cells by transmission electron microscopyNote:A.GL group;B.Control group.

图4 不同浓度GL作用HeLa细胞后,凋亡相关蛋白Caspase-9、Caspase-3蛋白的表达情况Figure 4 The expression of Caspase-9 and Caspase-3 protein in HeLa cells treated with different concentration of GL

图5 不同浓度GL作用HeLa细胞后,蛋白Caspase-9、Caspase-3的相对表达量Figure 5 The statistical analysis of caspase-9 and caspase-3 protein expression in HeLa cells
3 讨论
MTT比色法能够精确、简便且自动的检测活细胞数,是检测活细胞的一种方法[5],目前主要应用于筛选抗肿瘤药物实验中[6-7]。从本次实验结果看,GL药物具有作用浓度越高,作用时间越长,其抑制HeLa细胞的作用越明显的特点,抑制作用具有剂量-时间依赖性。
经AO/EB双染色可以看到GL干预HeLa细胞后,HeLa细胞呈现出了凋亡细胞的形态变化,证实了GL能够诱导HeLa细胞凋亡。透射电镜可以直接观察到细胞核和细胞器等超微结构的变化[8],细胞凋亡主要表现在细胞核的变化。透射电镜的观察结果可以确定了GL对HeLa细胞的诱导凋亡作用,解释了GL可以通过诱导肿瘤细胞的凋亡,抑制肿瘤细胞的增殖发展。本研究可以为下一步的凋亡机制研究提供参考依据。
大量研究已经证实,抗肿瘤药物的作用可以干扰细胞线粒体的功能及结构,导致线粒体膜电位下降,细胞色素C的释放等改变,诱发凋亡的发生发展[9]。因此,药物诱导肿瘤细胞凋亡与信号通路内源性激活途径相关[10]。而本研究主要探讨了GL诱导HeLa细胞凋亡过程中,Caspase内源性激活途径的信号通路。根据Western blot结果,从Caspase家族蛋白在HeLa细胞中的表达情况看,Pro-caspase-9蛋白表达量略低于正常对照组,而Cleaved-caspase-9蛋白表达量增高,表示细胞凋亡的发生;同样可以得出HeLa细胞随着药物的作用,Cleaved-caspase-3的表达增加,随之细胞凋亡也增多。而同时剪切前的Casepase-3表达量是逐渐减少的。
当Caspase-9蛋白活化后,可以激活Caspase-3蛋白,它们之间存在上、下游的关系[11-12]。GL可以通过加速Caspase-9和Caspase-3的裂解,从而激活Caspase的上、下游级联反应,促进细胞的凋亡。考虑药物GL作用到HeLa细胞后,细胞在应激、受到细胞毒或化疗药物作用时[13],细胞受到凋亡刺激,导致线粒体去极化及线粒体膜通透性转换孔开放,其开放后使线粒体发生肿胀、外膜破坏、线粒体损伤,释放出细胞色素C及其他促凋亡物质,Caspase的内源性激活途径由此开始[14-15]。
本次研究的实验结果有利于指导今后甘草抗肿瘤活性成分单体的实验研究,并为进一步研究甘草提取物对宫颈癌的治疗机制提供理论和实验基础。
1 Parkin DM.The global health burden of infection-associated cancers in the year 2002[J].Int J Cancer,2006,118(12):3030-3044.
2 Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
3 Chen W,Zheng R,Zhang S,et al.The incidences and mortalities of major cancers in China,2009[J].Chin J Cancer,2013,32(3):106-112.
4 Yeh CF,Wang KC,Chiang LC,et al.Water extract of licorice had anti-viral activity against human respiratory syncytial virus in human respiratory tract cell lines[J].J Ethnopharmacol,2013,148(2):466-473.
5 Sgonc R,Wick G.Methods for the detection of apoptosis[J].Int Arch Allergy Immunol,1994,105(4):327-332.
6 Hengartner MO.Apoptosis:corralling the corpses[J].Cell,2001,104(3):43-56.
7 李桂玲,夏晴,陈松华,等.掌叶半夏提取物的有效部位对宫颈癌细胞株HPVE6和P53基因表达的影响[J].中华中医药杂志,2012,27(1):110-113.
8 Evan GI,Vousden KH.Proliferation,cell cycle and apoptosis in cancer[J].Nature,2001,411(6835):342-348.
9 Seon MR,Park SY,Kwon SJ,et al.Hexane/ethanol extract of Glycyrrhiza uralensis and its active compound isoangustone A induce G1 cycle arrest in DU145 human prostate and 4T1 murine mammary cancer cells[J].J Nutr Biochem,2012,23(1):85-92.
10 Telford WG,King LE,Fraker PJ.Comparative evaluation of several DNA binding dyes in the detection of apoptosis-associated chromatin degradation by flow cytometry[J].Cytometry,1992,13(2):137-143.
11 Fadok VA,Voelker DR,Campbell PA,et al.Exposure of phosphatidylserine on the surface of apoptotic lymphocytes triggers specific recognition and removal by macrophages[J].J Immunol,1992,148(7):2207-2216.
12 盛磊,武贵臻,胡尔西旦·尼牙孜,等.维吾尔族宫颈癌患者Th1/Th2型细胞因子表达水平及临床意义[J].实用肿瘤学杂志,2016,30(5):91-95.
13 Williams GT,Smith CA.Molecular regulation of apoptosis:genetic controls on cell death[J].Cell,1993,74(5):777-779.
14 Feng Yeh C,Wang KC,Chiang LC,et al.Water extract of licorice had anti-viral activity against human respiratory syncytial virus in human respiratory tract cell lines[J].J Ethnopharmacol,2013,148(2):466-473.
15 杨毅,丁妍,于爱清,等.自噬对宫颈癌细胞增殖和迁移能力的影响[J].实用肿瘤学杂志,2016,30(6):81-86.
ActivepartofGlycyrrhizaextractinducesapoptosisinhumancervicalcancerHeLacellsanditsrelatedproteincaspase-3andcaspase-9expression
WANGJixi,DENGWeisheng,WANGFengru,SHIZhimao,MENGDan,XUQiang,ZHANGYuyao
Heilongjiang University of Chinese Medicine,Harbin 150040,China
ObjectiveThe aim of this study was to determine whether active part of Glycyrrhiza extract(GL)induced apoptosis in Hela cells and its inhibitory mechanism.MethodsHeLa cells were treated with 25 g/mL of GL for 24hs.Cell viability and apoptosis in HeLa cells were determined by MTT,AO/EB fluorescent double staining,transmission electron microscope(TEM),and Western blot.ResultsThe MTT results showed that GL significantly inhibited the proliferation of HeLa cells in a dose-response.After treatment for 24 hrs,large number of early apoptotitc cell were observed using AO/EB fluorescent double staining and TEM.The expression of Pro-caspase-9 and Cleaved-caspase-3 protein was higher in GL-treated cells them those of the control cells(P<0.05).ConclusionGL can activate Caspase-3 and Caspase-9 genes to induce apoptosis in HeLa cells.
Licorice;Anti-tumor effect;Apoptosis;HeLa cells;Apoptosis protein
黑龙江省教育厅科学技术研究项目(12541764)
黑龙江中医药大学(哈尔滨 150040)
王吉锡,男,(1979-),博士,副教授,从事中草药抗肿瘤作用的研究。
王凤儒,E-mail:wangfengrurr@163.com
R737.33
A
10.11904/j.issn.1002-3070.2017.05.002
(收稿:2017-02-09)
