流式细胞仪检测恶性淋巴瘤患者外周血T细胞亚群的临床研究
2017-11-07王景胜刘正君高会广
王景胜 刘正君 陈 楠 李 丹 高会广
流式细胞仪检测恶性淋巴瘤患者外周血T细胞亚群的临床研究
王景胜 刘正君 陈 楠 李 丹 高会广
目的探讨流式细胞仪检测恶性淋巴瘤患者外周血T细胞亚群的效果及其与临床病理、肿瘤类型的关系。方法选取我院于2014年8月—2016年9月收治的98例恶性淋巴瘤患者为研究组,同期选取98例健康体检者为对照组。应用流式细胞仪检测两组外周血T细胞亚群(CD3+、CD4+、CD8+、CD4+/CD8+)并进行比较。结果研究组CD3+、CD4+/CD8+水平分别为(55.63±11.25),(1.32±0.62),显著低于对照组的(68.96±12.63),(1.59±0.59),差异具有统计学意义(P<0.05);研究组CD4+、CD8+水平(33.67±8.14),(26.02±4.67)与对照组的(34.12±8.33),(25.67±4.53)相比差异无统计学意义(P>0.05)。霍奇金淋巴瘤、非霍奇金淋巴瘤患者CD3+、CD4+/CD8+水平分别为(54.63±11.36),(1.22±0.65)和(55.52±12.02),(1.34±0.71),显著低于对照组的(68.96±12.63),(1.59±0.59),差异具有统计学意义(P<0.05);霍奇金淋巴瘤、非霍奇金淋巴瘤患者CD4+、CD8+水平分别为(33.78±8.23),(25.74±4.88)和(33.62±8.74),(26.32±4.85)与对照组的(34.12±8.33),(25.67±4.53)相比,差异无统计学意义(P>0.05)。Ⅲ~Ⅳ期恶性淋巴瘤患者CD3+、CD4+、CD4+/CD8+水平分别为(52.66±12.47),(28.25±6.32),(1.30±0.62)明显低于对照组的(68.96±12.63),(34.12±8.33),(1.59±0.59),差异具有统计学意义(P<0.05);Ⅰ~Ⅱ期恶性淋巴瘤患者CD3+水平为(58.63±11.85),显著低于对照组的(68.96±12.63),而CD8+水平为(29.63±3.57),显著高于对照组的(25.67±4.53),差异具有统计学意义(P<0.05)。结论流式细胞仪检测外周血T细胞亚群可以作为诊断恶性淋巴瘤患者的病情、分期以及免疫状态的重要手段,具有较高的应用价值。
流式细胞仪;恶性淋巴瘤;外周血T细胞亚群
恶性淋巴瘤是临床比较常见的一种恶性肿瘤,原发于淋巴结或淋巴组织,具有较高的发病率[1]。患者临床表现以淋巴结无痛性、进行性肿大、发热、乏力、盗汗、贫血等为主,严重危害人类健康[2]。临床发现,大部分恶性淋巴瘤患者伴有机体免疫机能紊乱和下降,且在肿瘤的发生、发展中起到重要作用[3]。本研究采用流式细胞仪对不同类型、临床分期的恶性淋巴瘤患者及健康体检者的外周血T细胞亚群进行检测和比较,旨在探讨流式细胞仪检测恶性淋巴瘤患者外周血T细胞亚群的效果及T细胞亚群与本病的发生、发展的关系,为了临床更好的诊治恶性淋巴瘤提供依据[4]。
1 资料与方法
1.1 一般资料
选取我院于2014年8月—2016年9月收治的98例恶性淋巴瘤患者为研究组,其中男56例,女42例;年龄42~69岁,平均年龄(55.63±3.74)岁;肿瘤类型:霍奇金淋巴瘤18例,非霍奇金淋巴瘤80例;临床分期:Ⅰ~Ⅱ期48例,Ⅲ~Ⅳ期50例。选取98例同时期健康体检者为对照组,其中男58例,女40例;年龄40~66岁,平均年龄(55.42±3.56)岁。研究组患者性别、年龄等一般资料与对照组相比,差异无统计学意义(P>0.05),可进行比较研究。
1.2 方法
采用美国BD公司生产的BD FACSCanto II流式细胞仪对CD3+、CD4+、CD8+、CD4+/CD8+水平进行测定。抽取两组2 mL静脉血,使用乙二胺四乙酸二钠进行抗凝。各试管中加入20 μL的CD3+/CD4+/CD8+三色标记的单克隆抗体及100 μL抗凝全血,混匀后室温避光染色10 min~15 min。使用磷酸盐缓冲液洗涤1遍,弃上清后加入磷酸盐缓冲液重悬细胞0.5 mL。立即加入15 mL肝素抗凝,用流式细胞仪检测。并分离出单个的核细胞,将核细胞进行洗涤,将细胞数量控制在(1~3)×106。再取试管中加入100 μL的核细胞,依次在每支试管中加入20 μL荧光标记过的CD3+、CD4+、CD8+、CD4+/CD8+等。
1.2 观察指标
观察比较研究组、对照组患者的恶性肿瘤类型,临床分期对CD3+、CD4+、CD8+、CD4+/CD8+及NK细胞水平的影响。
1.3 统计学分析
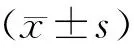
2 结果
2.1 两组外周血T细胞亚群比较
研究组CD3+、CD4+/CD8+水平分别为(55.63±11.25),(1.32±0.62),均明显低于对照组(68.96±12.63),(1.59±0.59),差异具有统计学意义(P<0.05);研究组CD4+、CD8+水平(33.67±8.14),(26.02±4.67)与对照组的(34.12±8.33),(25.67±4.53)相比,差异无统计学意义(P>0.05)(表1)。
2.2 霍奇金淋巴瘤、非霍奇金淋巴瘤患者T细胞亚群与对照组比较
霍奇金淋巴瘤、非霍奇金淋巴瘤患者CD3+、CD4+/CD8+水平分别为(54.63±11.36),(1.22±0.65)和(55.52±12.02),(1.34±0.71),较对照组的(68.96±12.63),(1.59±0.59)均明显偏低,差异具有统计学意义(P<0.05);不同类型恶性淋巴瘤患者CD4+、CD8+水平分别为(33.78±8.23),(25.74±4.88)和(33.62±8.74),(26.32±4.85)与对照组的(34.12±8.33),(25.67±4.53)相比,差异无统计学意义(P>0.05)(表2)。

表1 两组外周血T细胞亚群比较
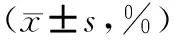
表2 霍奇金淋巴瘤、非霍奇金淋巴瘤患者T细胞亚群与对照组比较
2.3 不同临床分期恶性淋巴瘤患者T细胞亚群与对照组比较
Ⅲ~Ⅳ期恶性淋巴瘤患者CD3+、CD4+、CD4+/CD8+水平分别为(52.66±12.47),(28.25±6.32),(1.30±0.62)较对照组的(68.96±12.63),(34.12±8.33),(1.59±0.59)明显降低,差异具有统计学意义(P<0.05);Ⅰ~Ⅱ期恶性淋巴瘤患者CD3+水平为(58.63±11.85)较对照组的(68.96±12.63)明显偏低,而CD8+水平为(29.63±3.57)较对照组的(25.67±4.53)明显偏高,差异具有统计学意义(P<0.05)(表3)。
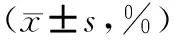
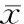

GroupsCD3+CD4+CD8+CD4+/CD8+Controlgroup(n=98)68.96±12.6334.12±8.3325.67±4.531.59±0.59Ⅰ~Ⅱperiod(n=48)58.63±11.8534.52±8.4429.63±3.571.49±0.66Ⅲ~Ⅳperiod(n=50)52.66±12.4728.25±6.3226.02±4.951.30±0.62F31.3310.8013.723.68P<0.01<0.01<0.010.027
3 讨论
近年来,我国恶性淋巴瘤的发病率不断上升,给患者的生存质量造成严重的负面影响[5]。恶性淋巴瘤发病原因复杂,目前研究提示可能与人类疱疹病毒、逆转录病毒、免疫功能低下、免疫抑制剂的应用及幽门螺杆菌等有关[6-7]。流式细胞术是一种将计算机技术、激光技术、免疫荧光化学与单克隆抗体进行结合的一项检测技术,可快速测定细胞或细胞器生物学性质,具有速度快、对异常细胞鉴别能力高、准确性好、可进行多参数测量等优点,被广泛应用于多种恶性肿瘤的诊治中[8-10]。
恶性淋巴瘤是一类全身性疾病,与机体免疫系统功能状态密切相关[11]。细胞免疫是机体抗肿瘤的主要免疫效应,尤其是T细胞介导的特异性细胞免疫[12]。当T细胞亚群的功能及数量出现异常时,可导致机体发生免疫紊乱,降低机体免疫功能,引发一系列病理变化[13-14]。本研究结果显示,研究组CD3+、CD4+/CD8+水平较对照组均明显更低。表明恶性淋巴瘤患者的免疫功能低下[15]。分析原因为CD3+仅存在于T细胞表面,由6条肽链组成,可与T细胞受体进行结合,形成复合物,参与T细胞的信号转导,且与T细胞的活化密切相关。恶性淋巴瘤患者的CD3+水平与T细胞的功能密切相关,CD3+分子的数量与T细胞功能呈正相关[16]。CD4+、CD8+作用T细胞表面的辅助分子,在组织相容性复合体限制性T细胞的活化起到重要作用[17]。大部分CD4+细胞为辅助性T细胞,可分泌大量的淋巴因子,对其他效应细胞进行激活,产生炎症反应。自然杀伤细胞(NK细胞)和CD8+细胞参与了初次免疫反应,而CD4+细胞在再次抗肿瘤免疫反应中发挥着巨大作用[18]。在CD4+细胞和其分泌的淋巴因子作用下,可杀死一部分肿瘤细胞(主要为带有致敏抗原肽-MHCⅠ类分子的细胞)及抑制性T细胞,对NK细胞及T细胞的活性进行抑制[19]。CD4+/CD8+的动态平衡可决定机体的免疫水平及免疫状态,若CD4+/CD8+下降,抑制NK细胞的活性,为肿瘤的转移、复发及扩散提供了有利条件。
武晓博研究指出[20],淋巴瘤患者化疗前外周血CD4+、CD4+/CD8+水平低于对照组,CD3+、CD8+水平高于对照组;但本研究的结果显示,不同类型恶性淋巴瘤患者CD3+、CD4+/CD8+水平较对照组低,其中,Ⅲ~Ⅳ期恶性淋巴瘤患者CD3+、CD4+、CD4+/CD8+低于对照组,CD4+、CD4+/CD8+水平变化则与武晓博的研究数据有较好的一致性,CD3+水平变化与之相反,低于对照组患者。但在乔文斌等的研究中[21],淋巴瘤患者CD3+、CD4+/CD8+水平较对照组低,本研究结果与之具有一致性。
在本研究中,Ⅰ~Ⅱ期恶性淋巴瘤患者CD3+水平低于对照组,而CD8+更高。可能是因为恶性淋巴瘤患者在早期时,其免疫功能下降,但机体可通过自身免疫调节功能对T细胞亚群的数量进行调控,减少CD8+细胞数量,减轻对CD4+细胞的抑制程度。Ⅲ~Ⅳ期恶性淋巴瘤患者CD3+、CD4+、CD4+/CD8+水平较对照组明显更低,与淋巴系统损伤有关;因为恶性淋巴瘤患者在晚期时,其淋巴系统受到严重损害,增加CD8+细胞数量,增强对CD4+细胞的抑制程度,从而降低CD4+/CD8+水平。本研究中,不同类型的恶性淋巴瘤患者CD3+、CD4+、CD8+、CD4+/CD8+水平未见明显差异,表明不同类型恶性淋巴瘤患者均存在免疫功能下降的情况。
综上所述,流式细胞仪检测恶性淋巴瘤患者外周血T细胞亚群对于判断患者病情、临床分期及免疫状态具有重要意义。
1 何春燕,徐琼,曹丽芳,等.非霍奇金淋巴瘤患者的病理类型及分布特点[J].浙江临床医学,2016,18(11):2112-2113.
2 易思华,张晓薇,赵丽,等.多参数流式细胞术在非霍奇金淋巴瘤诊断中的应用及价值[J].国际检验医学杂志,2013,34(22):2982-2983.
3 吴宜嘉.流式细胞仪在淋巴瘤患者外周血T细胞亚群诊断中的应用研究[J].海南医学院学报,2010,16(2):1660-1662.
4 Waldman M,Crew RJ,Valeri A,et al.Adult minimal-change disease:clinical characteristics,treatment,and outcomes[J].J Am Soc Nephrol,2007,2(11):445-453.
5 邹煦,常炳庆,黄新春,等.恶性淋巴瘤患者外周血T淋巴细胞亚群变化的讨论[J].癌症进展,2012,10(4):396-398.
6 Sahali D,Pawlak A,Le Gouvello S,et al.Transcriptional and post-transcriptionalalterations of Ikappa Baloha in active minimal change nephritic syndrome[J].J Am Soc Nephrol,2001,12(8):1648-1658.
7 Morita R,Schmitt N,Bentebibel SE,et al.Human blood CXCR5(+)CD4(+)T cells are counterparts of T follicular cells and contain specific subsets that differentially support antibody secretion[J].Immunity,2011,34:108-121.
8 袁顺宗,苏航.利用嵌合抗原受体的T细胞(CAR-T)治疗复发和难治B细胞淋巴瘤/白血病的转化医学研究[J].中国实验血液学杂志,2014,22(4):1137-1141.
9 邹煦,常炳庆,黄新春,等.恶性淋巴瘤患者外周血T淋巴细胞亚群变化的讨论[J].癌症进展,2012,10(4):396-398,404.
10 Veldhoen M,Hocking RJ,Atkins CJ,et al.TGF beta in the context of an inflammatory cytokine milieu supports de novo differentiation of IL-17 producing T cells[J].Immunity,2006,24(2):179-189.
11 Feintzeig ID,Dittmer JE,Cybulsky AV,et al.Antibody,antigen,and glomerular capillary wall change interactions:influence of antigen location on in situ immune complexformation[J].Kidney Int,2006,29(3):649-657.
12 Zhou W,Andrews PA,Wang Y,et al.Evidence for increased synthesis of complement C4 in the renal epithelium of rats with passive heymann nephritis[J].J Am Soc Nephrol,2007,8(2):214-222.
13 Lagrue G,Xheneumont S,Branellec A,et al.A vascular permeability factor elaborated from lymphocytes I Demonstration in patients with nephritic syndrome[J].Biomedicine,2015,23(1):37-40.
14 Cho MH,Lee HS,Choe BH,et al.Interleukin-8 and tumor necrosis factor-alpha are increased in minimal change disease but do not alter albumin permeability[J].Am J Nephrol,2003,23(4):260-266.
15 马军,朱军,石远凯,等.T细胞淋巴瘤研究新进展:2014年国际T细胞淋巴瘤临床治疗大会报道[J].白血病·淋巴瘤,2014,23(11):641-645,653.
16 Selllier-Leclerc AI,Duval A,Riceron S,et al.A humanized mouse model of idiopathicnephritic syndrome suggests a pathogenic role for immature cells[J].J Am Soc Nephrol,2007,18(11):2732-2739.
17 杨德芬.外周血T细胞亚群检测在恶性肿瘤中的应用及临床意义[J].海南医学院学报,2013,19(10):1390-1392.
18 Ettinger R,Sims GP,Fairhurst AM,et al.IL-21 induces differentiation of human naïve and memory B cells into antibody-secreting plasma cells[J].J Immunol,2005,175(12):7867-7879.
19 Bryant VL,Ma CS,Avery DT,et al.Cytokine mediated regulation of human B cell differentiation into Ig-secreting cells:predominant role of IL-21 produced by CXCR5+ T follicular helper cells[J].J Immunol,2007,192(12):8180-8190.
20 武晓博.难治性淋巴瘤患者外周血T淋巴细胞亚群与自然杀伤细胞表达水平的检测及其临床意义[D].太原:山西医科大学,2011:5-7.
21 乔文斌.弥漫大B细胞淋巴瘤患者外周血T淋巴细胞亚群与NK细胞检测的临床意义[D].乌鲁木齐:新疆医科大学,2011:9-12.
ClinicalstudyofperipheralbloodTcellsubsetsinpatientswithmalignantlymphomabyflowcytometry
WANGJingsheng,LIUZhengjun,CHENGNan,LIDan,GAOHuiguang
Department of Clinical Laboratory,The 404th Hospital of PLA,Weihai 264200,China
ObjectiveThe aim of this study was to investigate the effect of flow cytometry on peripheral blood T cell subsets in patients with malignant lymphoma and its relationship with clinicopathological and tumor types.MethodsNinety-eight patients with malignant lymphoma treated in our hospital from August 2014 to September 2016 were selected as the study group.Ninety-eight healthy subjects were selected as the control group.The peripheral blood T cell subsets(CD3+,CD4+,CD8+,CD4+/CD8+)were detected in patients and healthy controls by flow cytometry.ResultsThe levels of CD3+and CD4+/CD8+in the study group were(55.63±11.25)and(1.32±0.62),respectively,which were significantly lower than those(68.96±12.63)and(1.59±0.59)of the control group(P<0.05).The levels of CD4+and CD8+were(33.67±8.14)and(26.02±4.67),respectively in the study group,were no difference from the control group(34.12±8.33)and(25.67±4.53)(P>0.05).The levels of CD3+and CD4+/CD8+in patients with Hodgkin′s lymphoma were(54.63±11.36),(1.22±0.65),respectively,and(55.52±12.02),(1.34±0.71)for non-hodgkin lymphoma.They were significantly decreoseg in the control group(68.96±12.63 for CD3+and 1.59±0.59 for CD4+/CD8+)(P<0.05).The level of CD4+and CD8+were no difference amoupst Hodgkin′s lymphoma(33.78±8.23 for CD4+and 25.74±4.88 for CD8+),non-Hodgkin′s lymphoma(25.74±4.88 for CD4+and 33.62±8.74 for CD8+)and control group(34.12±8.33 for CD4+and 25.67±4.53 for CD8+)(P>0.05).The levels of CD3+,CD4+and CD4+/CD8+in patients with Ⅲ ~Ⅳ stage malignant lymphoma were(52.66±12.47),(28.25±6.32)and(1.30±0.62),respectively,which were significantly lower than those(68.96±12.63),(34.12±8.33)and(1.59±0.59)in the control group(P<0.05).The level of CD3+in patients with phase I-II malignant lymphoma(58.63±11.85)was significantly lower than that in the control group(68.96±12.63)(P<0.05).The level of CD8+in patients with phase I-II malignant lymphoma(29.63±3.57)was significantly higher than that in the control group(25.67±4.53)(P<0.05).ConclusionThe detection of peripheral blood T cell subsets by flow cytometry can be used as an important methods to diagnose the disease,staging and immune status of patients with malignant lymphoma,which has high application value.
Flow cytometry;Malignant lymphoma;Peripheral blood T cell subsets
解放军第404医院检验科(威海 264200)
王景胜,男,(1960-),本科,主任技师,从事检验医学,血液病诊断的研究。
王景胜,E-mail:hamosk@sina.com
R733
A
10.11904/j.issn.1002-3070.2017.05.008
(收稿:2017-05-11)
