不同氮量肠外营养对胃肠肿瘤术后患者的干预作用*
2017-11-07周路琦程艳芬王艳新
周路琦,程艳芬,王艳新,孙 超
(承德医学院附属医院,河北承德 067000)
不同氮量肠外营养对胃肠肿瘤术后患者的干预作用*
周路琦,程艳芬,王艳新△,孙 超
(承德医学院附属医院,河北承德 067000)
目的:评价不同氮量全肠外营养支持对胃肠肿瘤患者术后营养状况和免疫指标的影响。方法:50例胃肠肿瘤术后患者随机分为实验组和对照组,每组25例。两组患者均于术后第1d开始经中心静脉行全肠外营养,非蛋白热量均为83.7-104.6kJ/(kg·d);同时,实验组氮量按0.20g(0.15-0.22g)/(kg·d)给予,对照组氮量按0.10g(0.09-0.11g)/(kg·d)。比较两组患者术后第14d的血红蛋白、白蛋白,CD3+、CD4+和CD4+/CD8+值。结果:术后第14d,实验组患者血红蛋白、白蛋白,CD3+、CD4+和CD4+/CD8+值均明显高于对照组(P<0.05)。结论:在给予相同热量的基础上,按正常氮量[0.20g/(kg·d)]供给的全肠外营养有助于改善胃肠肿瘤术后患者的营养和免疫状况。
胃肠肿瘤;全肠外营养;氮量;干预作用
胃肠肿瘤术后患者由于禁食、手术应激及高分解代谢,普遍存在营养障碍,营养风险及营养不足的发生率较高[1-2];且由于胃肠肿瘤患者术后禁食水,需经静脉补充一定的热量及外源性氮[1]。为此,本研究探讨了在给予相同热量肠外营养的基础上,给予不同氮量对患者营养和免疫指标的影响,为临床合理应用肠外营养方案提供参考。
1 资料与方法
1.1 患者一般资料 2013年9月至2014年10月我院收治拟行胃肠肿瘤手术的患者50例,男27例、女23例,平均年龄(56.72±6.54)岁。入选标准:年龄45-70岁;胃、结直肠恶性肿瘤患者,符合中华人民共和国卫生部制定的《胃癌规范化诊疗指南(2013版)》和《结直肠癌诊疗规范(2010版)》中的诊断标准;术后需全肠外营养(TPN)≥14d;未接受放化疗治疗;无内分泌及代谢性疾病病史;术前无免疫功能低下。所有患者对营养支持方案均知情并签署同意书,且本研究经我院医学伦理委员会批准。
50例患者随机分为实验组和对照组,每组25例,两组患者年龄、性别、手术部位等一般资料比较,差异无统计学意义,具有可比性(P>0.05)。见表1:
表1 两组患者一般资料比较(n=25)
1.2 干预方法 两组患者均于术后第1d开始经中心静脉行全肠外营养,方案均由营养科营养医师会诊出具,由静脉用药调配中心在层流净化台配制成“三升袋”,经中心或外周静脉给入。两组非蛋白热量(碳水化合物与脂肪提供能量)供给均为83.7kJ-104.6kJ/(kg·d);同时,实验组氮量按0.20g[(0.18-0.22)/(kg·d),相当于8.5%复方氨基酸18AA-II 250m1×3.5~4瓶]给予,对照组氮量按0.10g[(0.09-0.11)/(kg·d),相当于8.5%复方氨基酸18AA-II 250ml×2瓶]给予;两组电解质、微量营养素和矿物质的供给参照成人营养素推荐摄入量(RNI)和适宜摄入量(AI)给予[3]。
1.3 观察指标 术后第1d和术后第14d,收集两组患者清晨空腹静脉血。采用日本希森美康公司的Susmex XE-2100无分类血球分析仪检测血红蛋白;应用日本日立公司7600-020 HITACHI生化分析仪检测白蛋白;所抽取的静脉血EDTA抗凝处理,淋巴细胞分离液分离淋巴细胞,使用美国BECKMAN COULTER公司生产的流式细胞仪测定CD3+、CD4+、CD4+/CD8+。
1.4 统计分析 采用SPSS 19.0统计软件进行数据分析,计量资料以(±s)表示,组间比较采用两独立样本的t检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者血红蛋白、白蛋白比较 术后第1d,两组患者血红蛋白、白蛋白比较,差异无统计学意义(P>0.05);术后第14d,实验组患者血红蛋白、白蛋白均明显高于对照组,组间比较差异有统计学意义(P<0.05)。见表2:
表2 两组患者血红蛋白、白蛋白比较(±s ,n=25)

表2 两组患者血红蛋白、白蛋白比较(±s ,n=25)
组别 血红蛋白(g/L) 白蛋白(g/L)术后第1d 术后第14d 术后第1d 术后第14d实验组 114.28±14.11 133.30±7.64 32.46±2.78 35.50±2.36对照组 115.13±13.06 116.54±11.93 32.79±3.41 33.13±2.83 P >0.05 <0.05 >0.05 <0.05
2.2 两组患者免疫指标比较 术后第1d,两组患者CD3+、CD4+、CD4+/CD8+比较差异无统计学意义(P>0.05);术后第14d,实验组患者的CD3+、CD4+、CD4+/CD8+值均明显高于对照组,组间比较差异有统计学意义(P<0.05)。见表3:
表3 两组患者免疫指标比较(±s ,n=25)
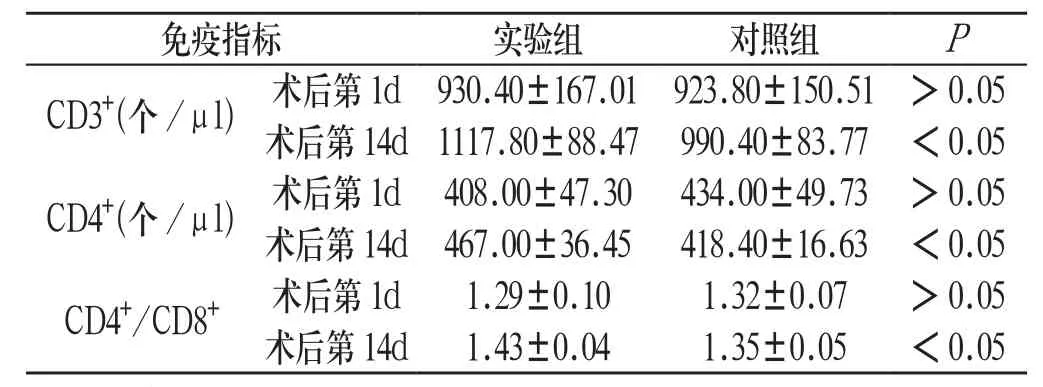
表3 两组患者免疫指标比较(±s ,n=25)
免疫指标 实验组 对照组 P CD3+(个/μl)术后第1d930.40±167.01923.80±150.51>0.05术后第14d 1117.80±88.47 990.40±83.77 <0.05 CD4+(个/μl)术后第1d408.00±47.30434.00±49.73>0.05术后第14d 467.00±36.45 418.40±16.63 <0.05 CD4+/CD8+ 术后第1d 1.29±0.10 1.32±0.07 >0.05术后第14d 1.43±0.04 1.35±0.05 <0.05
3 讨论
Mider[4]的研究发现,迅速增长的胃肠道肿瘤不仅摄取食物中的氮,还直接摄取机体蛋白质中的氮,与机体竞争营养底物氨基酸;另外,胃肠肿瘤患者术前、术后均需禁食一定时间,营养缺乏和手术应激等因素使机体处于免疫低下状态[5];同时,患者术后机体处于高应激状态,分解代谢明显增强,且伴有免疫功能的降低和蛋白质丢失。因此,术后短期全肠外营养支持,有助于改善患者术后的营养和免疫状况,从而提高手术成功率[6-8]。肠外营养治疗方案中的氨基酸是蛋白质的基本组成单位,在机体生长发育、免疫防御、损伤修复等方面具有不可替代的作用[9]。
围手术期肠外营养方案中关于氮量的供给众说纷纭,我国正常成人膳食蛋白质推荐量为1.2~1.5g/(kg·d)[10],折算氮量为0.19~0.24g(kg·d)。但有研究者认为,低氮量(0.10g/kg·d)肠外营养在改善患者营养及免疫状况方面与正常氮量(0.20g/kg·d)比较,差异无统计学意义[11]。为此,本研究探讨了胃肠肿瘤手术患者术后给予全肠外营养时,在热量供给相同的情况下,不同氮量供给对患者营养状况和免疫功能的影响。结果显示,干预后实验组[正常氮量(0.20g/(kg·d))]患者血红蛋白、白蛋白、CD3+、CD4+和CD4+/CD8+值均明显优于对照组[低氮量(0.10g/(kg·d))],与其他学者的研究结果一致。余追等研究证实[12],正常氮量的肠外营养较低氮量肠外营养能更好地改善多发伤患者血清白蛋白水平;莫佳萍等发现[13],正常氮量全肠外营养液可维持大肠癌患者术后白蛋白水平,改善患者营养状况;张泽等的研究表明[14],正常氮量肠外营养能够提高胃肠道术后患者的CD3+、CD4+和CD4+/CD8+值,促进患者体液和细胞免疫功能的恢复,增强患者免疫力。
综上所述,胃肠肿瘤患者术后,在为其提供适宜非蛋白热量的前提下,按正常氮量[0.20g/(kg·d)]供给的全肠外营养有助于更改善患者术后营养状况和免疫功能,值得临床应用和推广。
[1]中华医学会.临床诊疗指南:肠外肠内营养学分册(2008版)[M].北京:人民卫生出版社,2009.7-9,16-21.
[2]Schwegler I, Vonholzen A, Gutzwilhr JP, et al. Nutritional risk is a clinical predictor of postoperative mortality and morbidity in surgery for colorectal cancer[J]. Br J Surg, 2010, 97(1): 92-97.
[3]Brage ML, Jungqvisy O, Soeter P, et al. ESPEN guidelines on parenteral nutrition: surgery[J].Clin Nutr, 2009, 28(4): 378-386.
[4]Mider GB. Some aspects of nitrogen and energy metabolism in cancerous subjects: a review[J]. Cancer Res, 1951, 11(11): 821-829.
[5]陈小明.低氮低热量肠外营养与传统氮热量肠外营养对胃癌术后患者的影响[D].南昌:南昌大学,2015.
[6]Tu MY, Chien TW, Chou MT. Using a nutritional screening tool to evaluate the nutritional status of patients with colorectal cancer[J]. Nutr Cancer, 2012, 64(2): 323-330.
[7]Panis Y, Maggiori L, Caranhac G, et al. Mortality after colorectal cancer surgery: a French survey of more than 84,000 patients[J].Ann Surg, 2011, 254(5): 738-744.
[8]Gómez Sánchez MB, GarcíaTalavera Espín NV, Sánchez AC,et al. Perioperative nutritional support in patients with colorectal neoplasms[J]. Nutr Hosp, 2010, 25(5): 797-805.
[9]Buckman SA, Heise CP. Nutrition considerations surrounding restorative proctocolectomy[J]. Nutr Clin Pract, 2010, 25(3): 250-256.
[10]中国营养学会.中国居民膳食营养素参考摄入量[M].北京:中国轻工业出版社,2000.35.
[11]谢春玲,邢志嵩,黄贝玉,等.不同氮量低热量肠外营养对食管癌术后患者临床结局的影响[J].齐齐哈尔医学院学报,2011,3(214):2229-2230.
[12]余追,严娟娟,张迪,等.不同氮量肠外营养对严重多发伤患者白蛋白水平的影响[J].临床外科杂志,2013,21(12):959-961.
[13]莫佳萍,刘孟娟,王增.不同剂量复方氨基酸全肠外营养液对大肠癌术后患者营养指标的影响[J].浙江医学,2014,36(17):1472-1475.
[14]张泽.胃癌患者术后肠内外营养支持对其免疫功能和并发症的影响[J].实用癌症杂志,2016,3(18):1287-1289.
INTERVENTION EFFECTS OF PARENTERAL NUTRITION WITH DIFFERENT NITROGEN-CONTENT IN PATIENTS WITH GASTROINTESTINAL TUMORS AFTER SURGERY
ZHOU Lu-qi, CHENG Yan-fen, WANG Yan-xin, et al
(the Affiliated Hospital of Chengde Medical College, Hebei Chengde 067000, China)
Objective:To evaluate the intervention e ff ects of parenteral nutrition with di ff erent nitrogen-content on nutriture and immune indice of patients with gastrointestinal tumors after surgery.Methods:50 patients with gastrointestinal tumors after surgery were randomly divided into experimental group and control group with 25 patients in each group. All the patients were given total parenteral nutrition through central vein on the fi rst day after operation, and the non-protein calorie were all 83.7-104.6kJ/(kg•d). Meanwhile, the nitrogen-content of experimental group was 0.20g(0.15-0.22g)/(kg•d), while the control group was 0.10g(0.09-0.11 g)/(kg•d). The hemoglobin, albumin, CD3+, CD4+and CD4+/CD8+of patients in 2 groups on the 14thday after operation were compared.Results:14thday after operation, the hemoglobin, albumin, CD3+, CD4+and CD4+/CD8+of patients in experimental group were all obviously higher than control group (P<0.05).Conclusions:On the basis of giving the same heat quantity, total parenteral nutrition provided by normal nitrogen-content [0.20g/(kg•d)]can improve the nutritional and immune status of patients after gastrointestinal tumor surgery.
Gastrointestinal tumor; Total parenteral nutrition; Nitrogen-content; Intervention eff ects
R735.3
A
1004-6879(2017)06-0476-03
* 2013年承德市科学技术研究与发展计划项目(20132062)
△ 通讯作者
2017-03-11)
