基于离子液体的椰壳纤维纳米纤维素的制备与表征
2017-11-07胡英成陈培培李慧芳
曹 菲, 赵 鑫, 胡英成, 陈培培, 李慧芳
(东北林业大学 材料科学与工程学院;生物质材料科学与技术教育部重点实验室, 黑龙江 哈尔滨 150040)

CAO Fei
基于离子液体的椰壳纤维纳米纤维素的制备与表征
曹 菲, 赵 鑫, 胡英成*, 陈培培, 李慧芳
(东北林业大学 材料科学与工程学院;生物质材料科学与技术教育部重点实验室, 黑龙江 哈尔滨 150040)
采用酸性离子液体1-丁基-3-甲基咪唑硫酸氢盐([Bmim][HSO4])/1,4-丁二醇/水体系对椰壳纤维进行组分分离,采用亚氯酸钠对综纤维素进行漂白处理得到纯纤维素,利用酸水解-超声波辅助法制备纳米纤维素。采用扫描电子显微镜(SEM)、透射电子显微镜(TEM)、傅里叶红外光谱(FT-IR)仪、X射线衍射(XRD)仪、热重分析(TG)对纳米纤维素的形貌、化学成分、结晶度、热性能进行表征,并探讨了[Bmim][HSO4]对纳米纤维素得率及性能的影响。结果表明:[Bmim][HSO4]提高了木质素脱除率,提高了纤维素的易处理性,有利于纯纤维素的制备;椰壳纤维纳米纤维素仍具有纤维素的基本化学结构和结晶结构,属于纤维素I型;离子液体使得综纤维素质量损失率提高,进而导致纳米纤维素得率降低;椰壳纤维纳米纤维素纤丝平均长度(271±81)nm,平均直径(6.3±1.8)nm,[Bmim][HSO4]对纳米纤维素粒径尺寸分布(3~9 nm)无明显影响。
纳米纤维素;1,4-丁二醇;离子液体
纳米纤维素是一种从生物质原料中分离得到的可再生材料,具有比表面积大、杨氏模量高、长径比大的优良性能,其在生物成像、生物医学、药物载体、绿色纳米复合材料、膜材料以及透明材料等领域被广泛的应用[1]。由于生物质材料细胞壁的层级结构以及各化学组分之间稳定的三维结构,使得将纳米纤维素从生物质材料的细胞壁中分离出来具有一定的难度。常用的纳米纤维素的制备方法包括机械分离法等、强酸水解法和化学预处理结合机械分离法等[2]。为了降低能耗,得到纯度较高的纤维素,往往要对生物质原料进行化学预处理。其中,碱-酸预处理农林生物质原料有很好的效果,但木质素和半纤维素组分未能得到有效利用,造成严重的资源浪费和环境污染。因此,将生物质三大组分有效分离并分别制备高附加值化学品对生物质资源的高值化利用具有重要意义。醇体系对木质素具有一定的溶解性,常用作生物质处理溶剂,但单独的醇体系难以达到很好的处理效果[3]。离子液体作为一种绿色溶剂,具有高效溶解聚合物的能力,其优异的催化效力也在生物质预处理过程中发挥重要作用[4]。孙茉莉等采用离子液体/乙醇/水体系处理毛竹,当反应温度170 ℃、反应时间4 h时,体系中大部分木质素被溶解,而纤维素基本不发生水解[5]。目前,有一些研究表明离子液体可以将纤维素分离成纤维素单链用于制备纳米纤维素,但很少有利用离子液体对木质纤维材料进行组分分离进而利用富纤维素进行一步制备纳米纤维素的研究[6]。因此,本研究采用酸性离子液体/醇/水体系对椰壳纤维进行组分分离,得到木质素和综纤维素,采用亚氯酸钠对综纤维素进行漂白处理得到纯纤维素,利用酸水解-超声波辅助制备纳米纤维素,对纳米纤维素的形貌、化学成分、结晶度、热性能进行表征,探讨了1-丁基-3-甲基咪唑硫酸氢盐([Bmim][HSO4])对纳米纤维素得率及性能的影响。
1 材料与方法
1.1原料、试剂与仪器
椰壳纤维(密度0.15 g/cm3),购于山东潍坊椰棕制品有限公司,使用前将椰壳纤维粉碎,筛选粒径≤0.15 mm的粉末,水洗后干燥,备用。1,4-丁二醇、浓硫酸、氢氧化钠、亚氯酸钠,均为分析纯;1-丁基-3-甲基咪唑硫酸氢盐([Bmim][HSO4]),纯度为98%。
DF-101S集热式恒温加热磁力搅拌器;SHZ-D循环水式真空泵;Thermo Fisher Scientific Nicolet 6700系列显微傅里叶红外光谱(FT-IR)仪,同时配备LN-cooled MCT检测器;D/max2200型X射线衍射(XRD)仪;Quanta200型扫描电子显微镜(SEM);Hitachi-7650型透射电子显微镜(TEM);STA-6000型同步热分析仪。
1.2椰壳纤维素的提取分离
1.2.1原料预处理 将粉碎后椰壳纤维粉末利用丙酮在90 ℃下进行索氏抽提4 h,干燥后再以2% NaOH水溶液50 ℃下预处理1 h,水洗至中性,干燥,备用,即得预处理后椰壳纤维(CHF)。
1.2.2综纤维素的提取
1.2.2.11,4-丁二醇/水提取 称取1 g的CHF加入到50 mL水热反应釜中,随后加入24 mL的1,4-丁二醇和 6 mL 蒸馏水,搅拌均匀,除去生物质原料中可能含有的气泡,然后将反应釜放入已经预热到200 ℃的油浴锅中加热1 h。反应完成后,待反应釜冷却至室温,对反应液进行真空抽滤,得到滤液和滤渣,滤渣经蒸馏水洗涤3次后干燥,即得到1,4-丁二醇/水体系处理综纤维素(CRM)。
1.2.2.21,4-丁二醇/水/离子液体提取 称取1 g的CHF加入到50 mL水热反应釜中,随后加入 24 mL 的1,4-丁二醇和6 mL蒸馏水,最后加入1 g酸性离子液体1-丁基-3-甲基咪唑硫酸氢盐([Bmim][HSO4])。按1.2.2.1节操作,分离得到1,4-丁二醇/水/离子液体体系处理综纤维素(CRM-i)[7]。
1.2.3木质素的分离 向1.2.2节得到的滤液中加入蒸馏水,使溶解的木质素沉淀出来,真空抽滤,滤渣水洗至中性干燥,得到再生木质素。
1.2.4纤维素的分离
1.2.4.11,4-丁二醇/水/离子液体处理纤维素 称取1 g CRM-i,加入1.5 g亚氯酸钠和8~10滴冰醋酸,20 mL蒸馏水,在60 ℃下冷凝回流2 h,反应完成后对反应液进行真空抽滤,滤渣多次水洗,抽滤后,干燥,即得1,4-丁二醇/水/离子液体处理椰壳纤维素(CL-i)。
1.2.4.21,4-丁二醇/水处理纤维素 称取1g CRM,按1.2.4.1节操作并重复一次,即得1,4-丁二醇/水处理椰壳纤维素(CL)。
1.3椰壳纳米纤维素的制备
称取1 g CL或CL-i,加入20 mL 64% H2SO4,45 ℃下反应1 h,真空抽滤并水洗,8 000 r/min离心3次,透析至pH值呈中性,然后在功率300 W下超声波处理15 min,得到纳米纤维素悬浮液,分离,干燥备用。将以CL-i为原料制备得到的纳米纤维素命名为NCC-i,将以CL为原料制备得到的纳米纤维素命名为NCC。
1.4表征方法
1.4.1组分含量测定 根据文献方法测定椰壳纤维原料及处理产物的组分含量[8- 9]。木质素脱除率(y1)、综纤维素得率(y2)、木质素得率(y3)及纳米纤维素得率(y4)计算方法如公式(1)~(4)所示。
y1=(w-w1)/w×100%
(1)
y2=m1/m0×100%
(2)
y3=m2/m0×100%
(3)
y4=m3/m0×100%
(4)
式中:m0—原料绝干质量,g;w—原料中木质素质量分数,%;w1—原料处理后木质素质量分数,%;m1—预处理后综纤维素绝干质量,g;m2—再生木质素绝干质量,g;m3—纳米纤维素绝干质量,g;
1.4.2傅里叶变换红外光谱(FT-IR)分析 通过红外光谱仪测定椰壳纤维及分离得到的生物质组分的变化。采用溴化钾压片法,测量范围650~4000 cm-1,分辨率为4 cm-1,扫描次数为32次。
1.4.3X射线衍射(XRD)测定 纤维物质的结晶度通过X射线衍射仪测定,仪器配备Cu靶,扫描衍射波长为0.154 06 nm,加速电压40.0 kV,电流30 mA,扫描速率4(°)/min,扫描方式为步进式,扫描步长为0.02°,扫描范围为5~40°。样品结晶度(ICr)计算方法如公式(5)所示[10]。
ICr=(I002-Iam)/I002×100%
(5)
式中:I002—2θ约为22°处的衍射强度,对应着(002)晶格衍射;Iam—无定形区衍射强度。
1.4.4扫描电镜(SEM)分析 样品的微观形貌通过扫描电子显微镜测定,加速电压为15 kV。
1.4.5透射电镜(TEM)分析 利用透射电子显微镜(TEM)观察纳米纤维素的微观形态。将一滴分散良好的悬浮液样品滴加在碳膜上,用滤纸吸去多余水分并晾干,然后在磷钨酸中进行负染,待样品干燥后进行观测。
1.4.6热重(TG)分析 利用热重分析仪测定纳米纤维素的热性能,测试过程中采取氮气保护,气体流速为20 mL/min,升温速率为10 ℃/min,测试温度范围为40~800 ℃。
2 结果与讨论
2.1NCC得率及木质素脱除率
酸性离子液体[Bmim][HSO4]对1,4-丁二醇/水体系木质素抽提效率以及纳米纤维素得率的影响如表1所示。
由表1可知,经过1,4-丁二醇/水/[Bmim][HSO4]处理后,CRM-i中69.2%的木质素被脱除,是CRM(10.2%)的6.78倍。[Bmim][HSO4]使1,4-丁二醇/水体系木质素脱除率明显提升,主要是因为[Bmim][HSO4]加快了木质素和碳水化合物复合体连接键的断裂[11]。[Bmim][HSO4]提高木质素脱除效率的同时使得综纤维素的得率明显降低,从87.55%下降到53.56%,因为[Bmim][HSO4]提高了1,4-丁二醇/水体系断裂生物聚合物连接键的能力,木质素的有效脱除过程伴随着半纤维素和纤维素的降解和质量损失。[Bmim][HSO4]对纤维素的结晶区有一定的破坏,使得综纤维素质量损失明显,NCC-i的得率为11.6%。

表1 不同条件下椰壳纤维组分含量及纤维素得率Table 1 The components content of coconut husk fiber and nanocellulose yield under different conditions
1) CHF:预处理后椰壳纤维coconut husk fiber;CRM:1,4-丁二醇/水处理综纤维素cellulose-rich material treated with 1,4-butylene glycol/water;CRM-i:基于离子液体的CRM CRM-based ionic liquid;NCC:纳米纤维素 nanocrystalline cellulose; NCC-i: 基于离子液体的NCC NCC-based ionic liquid
2.2NCC的结构性能表征
2.2.1SEM分析 预处理椰壳纤维、综纤维素和纤维素的微观形貌如图1所示。
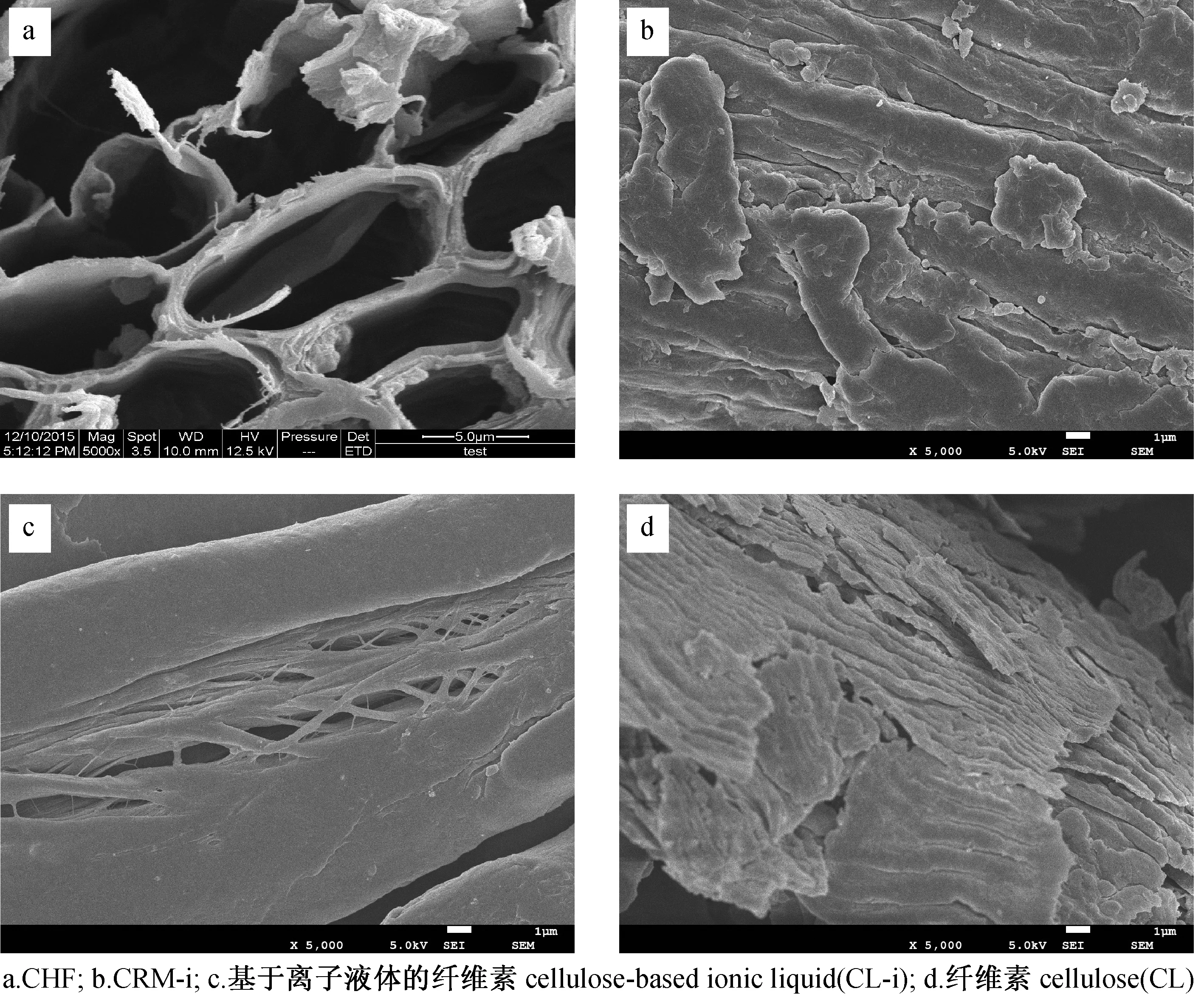
图1 不同处理阶段的椰壳纤维SEM图(×5 000)
由图1可见, 1,4-丁二醇/水/[Bmim][HSO4]处理后形成大量纤维素碎片,有助于木质纤维进一步降解(图1(b))。纤维素碎片包含了数以万计的基元纤丝,由于分子内和分子间的氢键作用聚集在一起,酸水解-超声波辅助处理将纤丝彼此分离开来,制备得到NCC。从图1(d)中可以观察到扁平的片状结构,剥离了纤维素表面的半纤维素和木质素,表面较为光滑。图1(c)和图1(d)对比发现,图1(c)中纤维素部分纤丝化,由此可知,酸性离子液体[Bmim][HSO4]对纤维素均匀开纤化至关重要。
2.2.2TEM分析 纳米纤维素的TEM图如图2所示。

图2 纳米纤维素的TEM图
样品NCC-i中85%的纳米纤维素的直径分布在4~9 nm(图3(a)),平均直径(6.3±1.8) nm,而样品NCC中83%的纳米纤维素直径分布在4~9 nm(图3(b)),平均直径(6.6±1.5) nm,与文献中采用硫酸水解法制备椰壳纤维纳米纤维素的粒径尺寸(5.3~6.6 nm)符合[12]。NCC-i、NCC的纤丝长度分别为271 nm±81 nm和451 nm±74 nm,比传统的硫酸水解制备纳米纤维素的尺寸(124~166 nm)长[13],因此具有更高的长径比(46±11,72±15),有利于其在复合材料增强等领域的应用。由于单根纳米纤维素的直径约为2~5 nm,说明所观察到的纳米纤维素为椰壳纤维细胞壁内部的1~2根基元纤丝聚集体,说明纤维素的开纤化程度较高。纳米纤维素表面含有大量的羟基,由于氢键作用使得纳米纤维素很容易以聚集体的形式存在,形成网状结构。NCC-i的纤丝长度(271 nm)比NCC长度(451nm)短,说明酸性离子液体对纤维素的结晶区有影响,使其酸水解的纤丝长度变短。
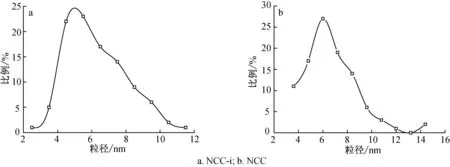
图3 纳米纤维素粒径分布图

2.2.4XRD分析 椰壳纤维处理不同阶段样品的XRD谱图如图5所示。
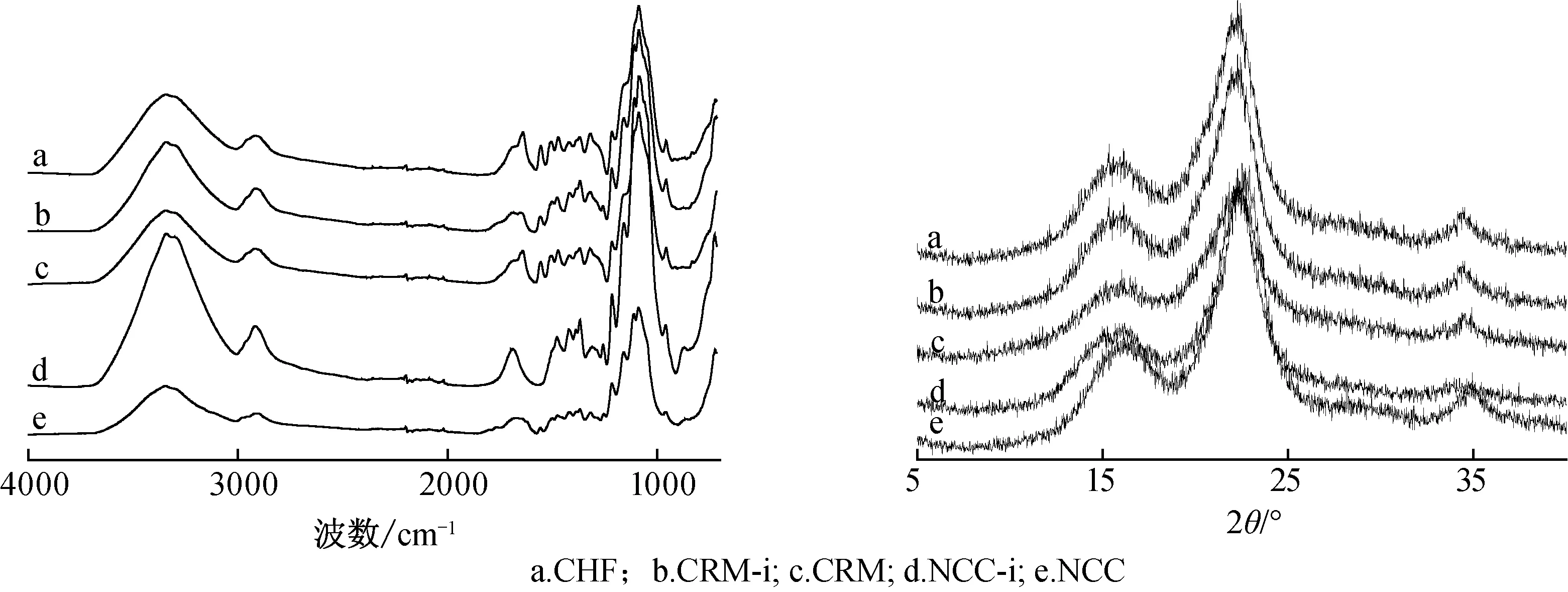
图4椰壳纤维不同处理阶段的红外光谱图
Fig.4FT-IRspectraofcoirhuskfiberatdifferentstages
图5椰壳纤维不同处理阶段的XRD谱图
Fig.5X-raydiffractionpatternsofcoirhuskfiberatdifferentstages
椰壳纤维化学处理前后均在2θ=16.5°,22.4°处具有纤维素的特征峰,所有样品均为纤维素I型结构[15]。1,4-丁二醇/水处理后的样品CRM结晶度(53.8%)与CHF相比提高了5.5个百分点;经过 1,4-丁二醇/水/[Bmim][HSO4]处理后的样品CRM-i结晶度(65.0%)相比CHF的结晶度(48.3%)明显提高,说明酸性离子液体提高了木质素的脱除率,使得纤维素的相对结晶度提高。处理后样品仍为纤维素I型结构,说明该处理过程有效的将无定形物质(半纤维素、木质素)脱除,但没有改变纤维素的晶型结构。随着亚氯酸钠对综纤维素的进一步漂白处理,木质素被进一步脱除,酸水解-超声波辅助制备得到的纳米纤维素(NCC-i、NCC)相对结晶度进一步提高,NCC的结晶度(70.5%)比NCC-i的结晶度(68.6%)高,可能是因为酸性离子液体虽然提高了体系的木质素抽提效率,有利于获得纯度更高的纤维素,但也对纤维素的结晶区造成了一定的破坏,导致结晶度略有下降。

图6 椰壳纤维不同处理阶段的TG和DTG图Fig.6 TG and DTG graphs of coir husk fiber at different stages
2.2.5TG-DTG分析 椰壳纤维不同处理阶段的TG和DTG曲线如图6所示。在温度为40~140 ℃时,样品出现一定的质量损失,主要是由于样品中水分蒸发所致。CHF的起始热降解温度为213 ℃,热降解速率加快,这部分质量损失主要来自于椰壳纤维中的半纤维素的降解。纳米纤维素(NCC-i和NCC)的初始降解温度均有所降低,NCC-i的起始降解温度为203 ℃,而后在260~280 ℃ 迅速降解;样品NCC初始降解温度为195 ℃,DTG曲线显示最大降解速率温度为212 ℃,因此样品NCC-i的热稳定性更好。相比于椰壳纤维原料,纳米纤维素样品的热降解速率更慢,最大降解速率温度均有一定下降,热性能更稳定。主要是因为在组分分离过程中离子液体的硫酸盐基团以及硫酸水解过程中硫酸盐基团吸附到纤维素的表面造成的[12]。在温度超过400 ℃,样品 NCC-i和NCC的质量残余均比椰壳纤维原料少。
3 结 论
3.1酸性离子液体[Bmim][HSO4]使1,4-丁二醇/水体系木质素脱除率提高了6.78倍,有利于获得纤维素含量更高的纤维物质。
3.21,4-丁二醇/水/[Bmim][HSO4]体系没有改变纤维素的晶型结构,仍为纤维素I型结构,有利于纤维物质的进一步处理及利用。利用纤维物质通过酸水解制备的纳米纤维素的纤丝长度(271 nm±81 nm),长径比(46±11)比传统的硫酸水解法制备纳米纤维素更高,有利于纳米纤维素在复合材料增强等领域的应用,说明该体系是实现生物质多组分高值化利用的良好选择。
[1]NASCIMENTO D M,ALMEIDA J S,DIAS A F,et al. A novel green approach for the preparation of cellulose nanowhiskers from white coir[J]. Carbohydrate Polymers,2014,110:456 - 463.
[2]陈文帅,于海鹏,李勍,等.纳米纤维素机械法制备与应用基础[M].北京:科学出版社,2014.
CHEN W S,YU H P,LI Q,et al. Preparation and Application of Nanocellulose by Mechincal method[M]. Beijing:Science Press,2014.
[3]HUANG H J,YUAN X Z,ZHU H N,et al. Comparative studies of thermochemical liquefaction characteristics of microalgae,lignocellulosic biomass and sewage sludge[J]. Energy,2013,56:52 - 60.
[4]RAMLI N A S,AMIN N A S. Catalytic hydrolysis of cellulose and oil palm biomass in ionic liquid to reducing sugar for levulinic acid production[J]. Fuel Processing Technology,2014,128:490 - 498.
[5]孙茉莉,刘钧,付严,等. 离子液体-乙醇-水体系水热法分离毛竹组分[J]. 过程工程学报,2016,16(1):86 - 92.
SUN M L,LIU J,FU Y,et al. Fractionation of bamboo in ionic liquid-ethanol-H2O system by hydrothermal method[J].The Chinese Journal of Process Engineering,2016,16(1):86 - 92.
[6]卢芸,孙庆丰,于海鹏,等. 离子液体中的纤维素溶解、再生及材料制备研究进展[J]. 有机化学,2010,30(10):1593 - 1602.
LU Y,SUN Q F,YU H P,et al. Dissolution and regeneration of cellulose and development in processing cellulose-based materials with ionic liquids[J].Chinese Journal of Organic Chemistry,2010,30(10):1593 - 1602.
[7]程芳超. 基于离子液体的农林生物质组分分离及催化转化研究[D]. 哈尔滨:东北林业大学博士学位论文,2015.
CHENG F C. Fractionation and catalytic conversion of agricultural and forestry biomass based on ionic liquids[D]. Harbin:Doctoral Dissertation of Northeast Forestry University,2015.
[8]李艳娜. 乙醇溶剂热法预处理木质纤维及制备纳米纤维素的研究[D]. 哈尔滨:东北林业大学硕士学位论文,2016.
LI Y N. Pretreatment of lignocelluloses by ethanol solvothermal method and fabrication of nanocellulose[D].Harbin:Master Degree Thesis of Northeast Forestry University,2016.
[9]YOKOYAMA T,KADLA J F,CHANG H M. Microanalytical method for the characterization of fiber components and morphology of woody plants[J]. Journal of Agricultural and Food Chemistry,2002,50(5):1040 - 1044.
[10]SEGAL L,CREELY J J,MARTIN J A E,et al. An empirical method for estimating the degree of crystallinity of native cellulose using the X-ray diffractometer[J]. Textile Research Journal,1959,29(10):786 - 794.
[11]ZHANG Y,DU H,QIAN X,et al. Ionic liquid-water mixtures:Enhanced KWfor efficient cellulosic biomass conversion[J]. Energy & Fuels,2010,24(4):2410 - 2417.
[12]ROSA M F,MEDEIROS E S,MALMONGE J A,et al. Cellulose nanowhiskers from coconut husk fibers:Effect of preparation conditions on their thermal and morphological behavior[J]. Carbohydrate Polymers,2010,81(1):83 - 92.
[13]KARGARZADEH H,AHMAD I,ABDULLAH I,et al. Effects of hydrolysis conditions on the morphology,crystallinity,and thermal stability of cellulose nanocrystals extracted from kenaf bast fibers[J]. Cellulose,2012,19(3):855 - 866.
[14]陈为健,程贤甦. 竹子高沸醇溶剂法制备纸浆纤维与木质素的研究[J]. 林产化学与工业,2004,24(1):34 - 38.
CHEN W J,CHENG X S. Research on preparation of fiber and lignin from bamboo with high-boiling alcohol solvent[J]. Chemistry and Industry of Forest Products,2004,24(1):34 - 38.
[15]朱宛萤,李利芬,胡英成. 乙二醇/碳酸乙烯酯预处理对椰壳纤维成分及结构的影响[J]. 林产化学与工业,2017,37(1):123 - 128.
ZHU W Y,LI L F,HU Y C. Effect of ethylene glycol/ethylene carbohydrate pretreatment on components and structure of coconut fiber[J]. Chemistry and Industry of Forest Products,2017,37(1):123 - 128.
Preparationand Characterization of Nanocellulose from Coconut Husk Fibers Based on Ionic Liquids
CAO Fei,ZHAO Xin, HU Yingcheng, CHEN Peipei, LI Huifang
(Key Laboratory of Bio-based Material Science and Technology of Ministry of Education, MaterialScience and Engineering, Northeast Forestry University, Harbin 150040, China)
The main components of coconut husk fibers was separated by the 1,4-butylene glycol/water system combined with 1-butyl-3-methylimidazolium hydrogen sulfate([Bmim][HSO4]) as a catalyst, and the cellulose-rich material was subjected to bleaching treatment of sodium chlorite to obtain pure cellulose. Then, the nanocellulose was prepared by acid hydrolysis followed by ultrasonication. The morphological behavior, chemical characterization, crystallinity index, thermostability of nanocellulose were characterized by scanning electron microscopy(SEM), transmission electron microscopy(TEM), Fourier transform infrared spectroscopy(FT-IR), X-ray diffraction(XRD) and thermogravimetric analysis(TG). The effects of [Bmim][HSO4]on the yield and properties of nanocellulose were investigated. The results showed that [Bmim][HSO4] the extraction rate of lignin and the disposability of the cellulose, which was beneficial to the preparation of pure cellulose. Nanocellulose from coconut husk fibers still maintain the basic chemical structure and the cellulose I crystalline structure. The [Bmim][HSO4]increased the mass loss rate of the cellulose, which led to the decrease of the nanocellulose yield. The nanocellulose from Coconut husk fiber based on ionic liquid exhibited an average length of(271±81)nm and a diameter of(6.3±1.8)nm.[Bmim][HSO4] had no significant effect on the size of diameter(3-9 nm).
nanocellulose; 1,4-butylene glycol; ionic liquid
2017- 03- 14
国家级大学生创新训练项目资助(201510225009)
曹 菲(1995— ),女,河南新乡人,本科生,主要从事椰壳纤维组分分离及利用研究工作
*通讯作者:胡英成,教授,博士生导师,研究领域为生物质材料性能;E-mail: yingchenghu@163.com。
10.3969/j.issn.0253-2417.2017.05.019
TQ35
A
0253-2417(2017)05- 0139- 07
曹菲,赵鑫,胡英成,等.基于离子液体的椰壳纤维纳米纤维素的制备与表征[J].林产化学与工业,2017,37(5):139 - 145.
