交联羧甲基壳聚糖小球对水体中Ni2+的去除研究*
2017-11-07谢燕华张璐璐刁志强黄敏睿
谢燕华 张璐璐 刁志强 刘 壮 黄敏睿 罗 婷
(成都理工大学环境与土木工程学院,四川 成都 610059)
交联羧甲基壳聚糖小球对水体中Ni2+的去除研究*
谢燕华 张璐璐 刁志强 刘 壮 黄敏睿 罗 婷
(成都理工大学环境与土木工程学院,四川 成都 610059)
以羧甲基壳聚糖为原料,采用滴加到冰乙酸溶液中形成小球并用戊二醛交联的方法,制备了交联羧甲基壳聚糖小球(以下简称小球)。研究了pH、小球投加量以及温度对Ni2+去除率的影响,同时考察了小球对其他金属离子的去除效果。结果表明,制得的小球的平均粒径为(2.04±0.05)mm,溶胀率为77%±1%;在pH为2.28~6.62,温度为25~60 ℃,小球投加量≥0.77g/L的条件下,小球对50mg/L的Ni2+的去除率在30min内达到了平衡,Ni2+去除率达到了100%。此外,利用了X射线光电子能谱(XPS)、扫描电子显微镜(SEM)等手段对反应前后的小球进行了表征分析,探讨其作用机理。
羧甲基壳聚糖Ni2+重金属 去除
Abstract: A kind of cross-linked carboxymethyl chitosan beads (hereinafter called beads) were prepared by droping the carboxymethyl chitosan solution into glocial acetic acid and being cross-linked by glutaraldeyde. The effects of pH,dosages of beads and temperature on the removal rate of Ni2+were studied. The results showed that the average diameter of the beads was (2.04±0.05) mm,and the swelling ratio was 77%±1%. When the pH was 2.28-6.62,temperature was 25-60 ℃ and dosage of beads≥0.77 g/L,the removal rate of the beads on 50 mg/L Ni2+reached equilibrium within 30 min,the removal rate reached 100%. The samples were analyzed by X-ray photoelectron spectroscopy (XPS),scanning electron microscope (SEM),and the removal mechanism was discussed.
Keywords: carboxymethyl chitosan; Ni2+; heavy metal; removal
含镍废水是一种危害较大的工业废水,主要来自矿业、有色冶金、电镀、仪器仪表及各种应用镍化合物的企业[1]。镍是人体必需的生命元素,在人体内含量极微,一旦摄入过量则会引起各种疾病[2]。镍污染具有长期性、累积性、潜伏性和不可逆性等特点,危害大、治理成本高。目前常用的处理方法有化学沉淀法、混凝沉淀法、吸附法、浮选法、重金属螯合法等[3],但仍需寻找经济、高效的处理方法。
近年来,对具有特别选择性、螯合离子能力强的高分子化合物的研究与日俱增[4]。壳聚糖是一种多糖[5],其分子链中含有大量—NH2和—OH基团[6],对多种金属离子具有良好的螯合作用[7-8]。但是,壳聚糖难溶于水,在实际应用中有很大的局限性。壳聚糖分子链中的—NH2和—OH具有良好的化学反应活性[9-10],便于进行功能化改性[11]。羧甲基壳聚糖是壳聚糖羧化后的一种衍生物,与壳聚糖相比,羧甲基壳聚糖具备良好的水溶性、生物相容性、安全无毒等优点。由于羧甲基化破坏了壳聚糖的晶体结构,增加了壳聚糖无定形结构[12-13];同时,功能基团—COOH 的引入,使得羧甲基壳聚糖对重金属离子的吸附性能更为优秀[14]。
本研究以羧甲基壳聚糖为原料,采用简单的滴加成球方法,制备了交联羧甲基壳聚糖小球(以下简称小球),并用于Ni2+及其他重金属离子的去除研究,考察了pH、投加量、温度等因素的影响,并初步探讨了作用机理。
1 材料与方法
1.1 仪器与试剂
1.1.1 实验试剂
羧甲基壳聚糖(白色片状,脱酰度≥80%);戊二醛(质量分数为50%);镍粉(纯度≥99%);冰乙酸、氢氧化钠、丁二酮肟、柠檬酸铵、乙二胺四乙酸二钠、碘、硝酸铜、硫酸锌、七水硫酸亚铁均为分析纯。
1.1.2 实验仪器
电子天平(TB-214);恒温磁力搅拌器(78HW-1);鼓风干燥箱(101-3);超纯水机(UPT-I-10T);恒温水浴振荡器(SHZ-82);可见光分光光度计(V-1100D);火焰原子吸收分光光度计(GGX-9);台式pH计(FiveEasy PlusTMFE28);X射线光电子能谱(XPS)仪(Thermo ESCALAB 250XI);冷场发射扫描电子显微镜(SEM,S4800)。
1.2 实验方法
1.2.1 小球的制备
称取一定量的羧甲基壳聚糖溶解于超纯水中,制得质量分数为3%~5%的羧甲基壳聚糖溶液。用注射器移取配制好的羧甲基壳聚糖滴加到0.7 mol/L的冰乙酸溶液中形成小球,并在30 ℃下强化2 h。之后,将小球置于质量分数为2%的戊二醛溶液中,在60 ℃下交联5 h。最后,将交联好的小球浸没于1 mol/L的氢氧化钠溶液中5~15 min,并用超纯水清洗至中性备用。
1.2.2 小球溶胀率
随机选取30~50颗小球称重,将称量好的小球放入烧杯中,用超纯水浸泡1 h,取出再次称重,按式(1)计算小球的溶胀率。
Sw=(mt-md)/md×100%
(1)
式中:Sw为溶胀率,%;mt和md分别为小球溶胀后和溶胀前的质量,g。
1.2.3 XPS分析
采用XPS仪对小球进行成分分析,阳极操作电压为15 kV,操作电流为10 mA,并将所得谱图以284.6 eV的C1s基碳峰校正,采用Avantage 3.22软件拟合谱峰。
1.2.4 SEM分析
分别取去除重金属前后的小球,在70 ℃的鼓风干燥箱烘干至恒质量,用研钵将干燥的小球研成粉末状,采用SEM对小球进行观察。
1.2.5 去除实验
取100 mL Ni2+污染液于三角烧瓶中,加入一定量的小球,在(25±1) ℃的恒温水浴中振荡反应,反应结束后过滤,采用丁二酮肟分光光度法[15-16]测定去除前后溶液中Ni2+的浓度,按照式(2)计算去除率。
Q=(C0-C)/C0×100%
(2)
式中:Q为去除率,%;C0为去除前溶液中Ni2+的质量浓度,mg/L;C为去除后溶液中Ni2+的质量浓度,mg/L。
2 结果与讨论
2.1 小球的物理性质
图1为小球溶胀前和溶胀后的对比图。从图1可以看出,小球的平均粒径约为(2.04±0.05) mm。此外,实验测得小球质量约为0.008 8 g,其密度约为1.981 g/cm3。相对于溶胀前,溶胀后小球的体积增加了约4倍,溶胀率约为77%±1%。此实验结果与朱寿进等[17]所合成小球的溶胀率(76%)基本一致。小球在吸水溶胀时,体积增加,内部孔径扩大,有利于污染物质快速扩散进入小球体内,减少迁移时间,实现污染物快速高效的去除。并且,小球的沉降性能良好,在去除污染物过后利用自身的重力自然沉降,从而实现固液分离。

图1 溶胀前与溶胀后的小球Fig.1 The cross-linked carboxymethyl chitosan beads before and after swelling
2.2 去除实验结果分析
2.2.1 pH对Ni2+去除率的影响
由于Ni2+污染液的初始pH较低(约为2.28),溶液pH对Ni2+去除的影响较大。图2显示了Ni2+质量浓度为50 mg/L,不同pH下,小球对Ni2+的去除率随时间变化曲线。在实验条件下,随着pH的增大,交联羧甲基壳聚糖对Ni2+的去除率也大致呈增加趋势。由图2可知,当pH为1.03时,小球对Ni2+的去除率基本不到20%。当pH≥2.28时,小球对Ni2+的去除效果显著提升,反应30 min后,Ni2+的去除达到平衡,去除率达到100%。可能的原因是羧甲基壳聚糖和Ni2+之间的主要作用力来源于羧甲基壳聚糖分子结构上的—COOH和—NH2基团。当pH低时,—COOH的离解度减小,—NH2以—NH3+形式存在,络合能力变小,去除率低;随着pH的增大,—COOH和—NH2官能团增加,络合能力随之变大[18]。当pH>6.62时,随着溶液中OH-浓度增加,Ni2+的去除以沉淀为主。
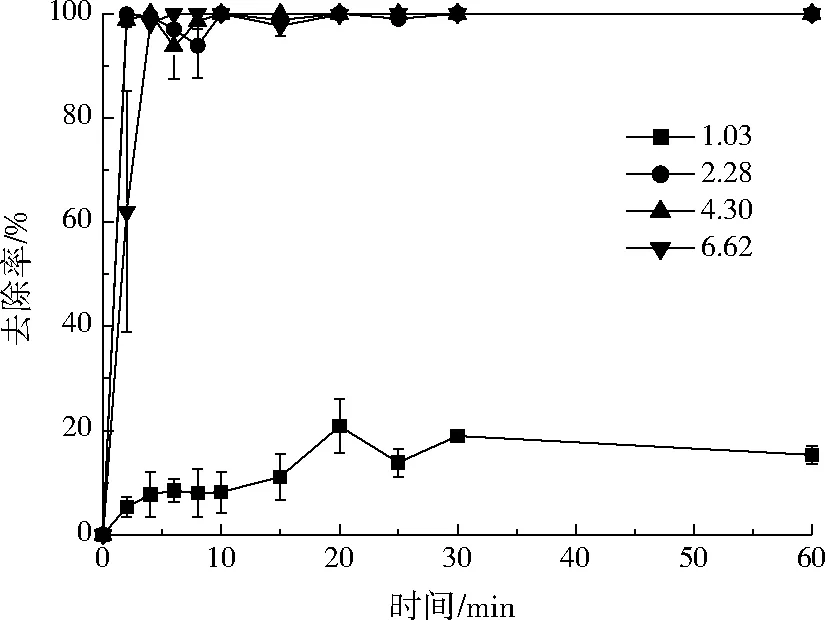
图2 pH对Ni2+去除率的影响Fig.2 Effect of pH on the adsorption capacity of Ni2+
图3为小球去除Ni2+后的pH变化曲线。由图3可知,当溶液初始pH为1.03时,反应后pH变化不大,仍为强酸性环境。因羧甲基壳聚糖不溶于酸,过低的pH会使其变成实心小球,无法吸水溶胀,从而去除效果较差。随着溶液初始pH的不断增加,反应后溶液呈强碱性,pH大致为10.00~12.00。产生这一结果的原因可能是交联后的小球在氢氧化钠中浸泡溶胀,使得小球内部含有大量OH-,在后续的去除反应过程中释放进入溶液,使得溶液pH上升。当pH≥2.28时,除络合作用之外,Ni2+可在小球内部及表面与OH-形成Ni(OH)2沉淀而被去除。故在实际应用中,溶液的pH应不低于2.28。
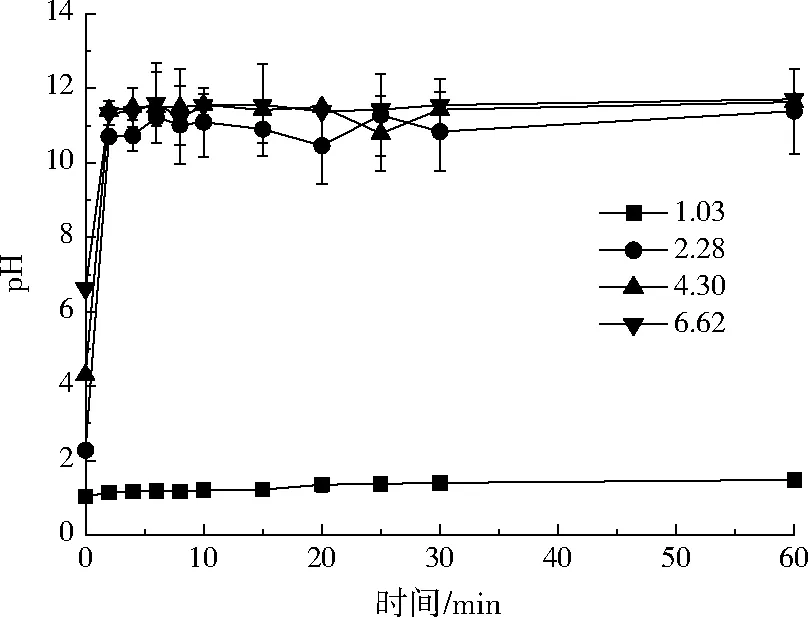
图3 反应后溶液的pHFig.3 pH of the solution after the reaction
2.2.2 小球投加量对Ni2+去除率的影响
图4为小球投加量对Ni2+去除率的影响。由图4可知,随着投加量的增加,Ni2+的去除率基本呈增大趋势。当投加量≤0.38 g/L时,小球对Ni2+的去除率小于10%;当小球投加量≥0.77 g/L时,小球对Ni2+的去除效果迅速增加,反应15 min后,Ni2+的去除达到平衡,去除率达到100%。可能原因为:随着小球投加量的增加,所携带的活性官能团—COOH和—NH2也随之增加,对Ni2+络合能力增强;此外,随着投加量的增加,小球携带的OH-随之增加,可与Ni2+生成Ni(OH)2沉淀,增加去除效率。在本实验条件下,综合考虑经济成本和去除效率,确定较佳的投加量为0.77 g/L。
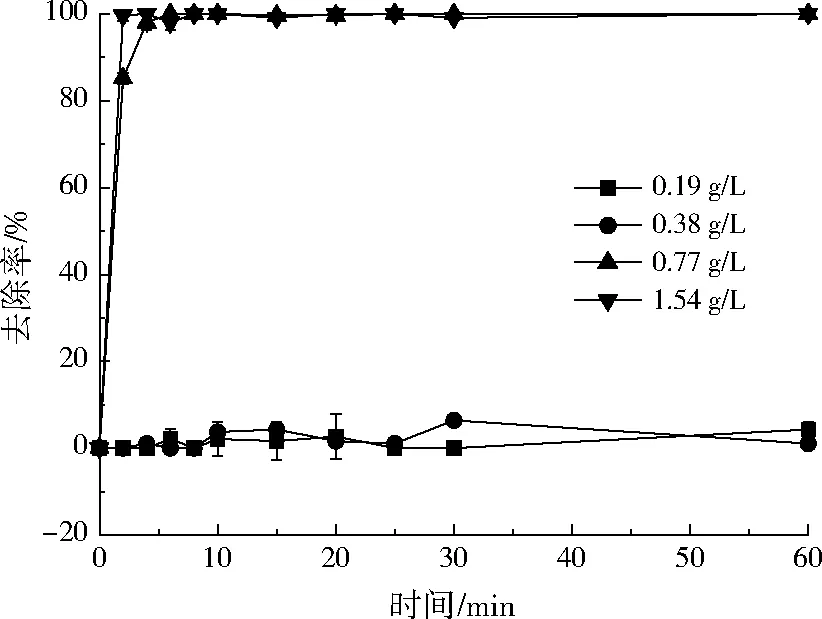
图4 小球投加量对Ni2+去除率的影响Fig.4 Effect of the dosage of cross-linked carboxymethyl chitosan beads on the removal rate of Ni2+
2.2.3 温度对Ni2+去除率的影响
图5为小球对Ni2+的去除率随温度的变化曲线。由图5可知,当反应温度≤50 ℃时,温度对Ni2+的去除影响较小,小球对Ni2+的去除在2 min内即可达到平衡,去除率达到100%。当温度进一步提高,反应趋于平衡所需的时间延长。当反应温度增加到60 ℃时,系统达到平衡所需的时间较常温条件下延长到了8 min,即低温有利于去除反应的进行。综上,温度对小球去除Ni2+的影响较小,反应可在常温条件下进行,无需提供苛刻的反应条件。
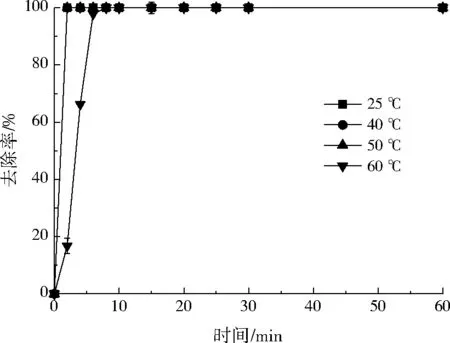
图5 温度对Ni2+去除率的影响Fig.5 Effect of temperature on Ni2+ removal rate
2.2.4 小球对其他金属离子去除效果
在电镀废水和工业废水中,不仅仅只有Ni2+,还含有其他重金属离子,本实验探讨了小球对其他金属离子的去除效果,结果如图6所示。在混合溶液中,各金属离子的初始质量浓度均为50 mg/L,小球投加量为0.77 g/L,反应时间为1 h。由图6可知,相同条件下,小球能高效去除Cu2+和Fe2+,反应在10 min内大致可达到平衡,去除率将近100%。此外,小球对Zn2+也有较好的去除效果,反应在2 min内基本达到平衡,去除率约为85%。由于其他金属离子的竞争作用,小球对Ni2+的去除在30 min后才逐渐趋于平衡,去除率约为75%。综上,小球对共存的金属离子具有良好的去除作用,去除的先后顺序大致为:Fe2+、Cu2+、Zn2+、Ni2+。当多种金属离子共同存在的情况下,由于存在竞争作用,要提高Ni2+的去除率,需增加小球的投加量。此外,使用该小球处理电镀废水和工业废水相比于现有处理工艺的费用稍高,总价约为7元/t。但是该反应所需时间短,反应容器小,从而减少了基本建设的费用。因此,该小球在处理电镀废水和工业废水上有较好的应用前景。
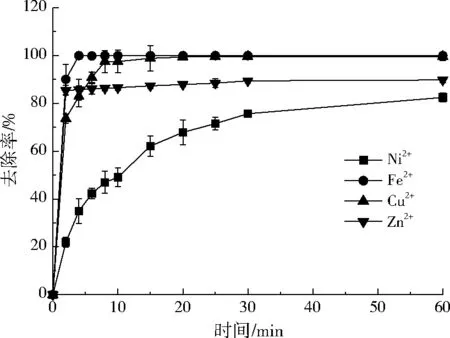
图6 小球对其他金属离子去除率的影响Fig.6 Effect of cross-linked carboxymethyl chitosan beads on the removal rate of other metal ions
2.3 小球的SEM分析结果
对反应前后小球的局部表面进行了SEM分析,结果见图7。与施晓文等[19]所合成表面光滑的羧甲基壳聚糖微球相比,本实验合成的小球表面(见图7(a))较为粗糙和疏松,具有多孔结构,有利于金属离子向小球内部迁移。由图7(b)可知,反应后小球表面变得光滑密实,可能是由于小球溶胀后,内部孔径扩大,Ni2+可进入小球内部空隙,并发生络合和沉淀反应填充小球表面和内部多孔结构,使表面变得密实少孔。
2.4 小球的XPS分析结果
图8为小球的XPS谱图。由图8(a)、图8(c)、图8(e)可知,反应前,小球分别在284.64、286.26、289.84 eV处探得C1s的3个峰;在结合能399.80、405.55 eV处观察到—NH—和—NH2的2个峰;在530.96、533.04 eV处探得O1s的2个峰。由图8(b)、图8(d)、图8(f)可知,反应后,羧甲基壳聚糖表面的C1s结合能分别为284.57、286.18、287.73 eV。配位后羧甲基壳聚糖表面的C原子所处的化学环境没有发生显著变化,即C原子没有参与配位反应[20]。而O1s和N1s在XPS谱上均只剩下1个峰,其结合能分别是532.40、399.61 eV,表明O和N参与了Ni2+的配位去除反应,即—COOH和—NH2与Ni2+发生了络合反应,使得O和N的结合能发生了改变[21]。反应后小球表面在结合能为856.09 eV处探测到Ni2+的特征峰(见图8(g)),进一步表明,Ni2+已通过配位或沉淀作用结合于交联羧甲基壳聚糖小球表面。

图7 反应前后小球的SEM图Fig.7 SEM images of cross-linked carboxymethyl chitosan beads before and after reaction
3 结 论
本实验以羧甲基壳聚糖为原料,采用简单的滴加成球并用戊二醛交联的方法制备得到小球,该小球对Ni2+、Fe2+、Cu2+、Zn2+等金属离子具有快速、高效的去除效果。实验研究了溶液的pH、温度、小球的投加量等对Ni2+去除率的影响。结果表明,Ni2+的去除率大致随pH的增加而增加,当溶液pH≥2.28时,Ni2+的去除率可达到100%;低温有利于Ni2+的去除,随着温度的升高,去除Ni2+所需的平衡时间延长;此外,随着小球投加量的增加, Ni2+的去除率大体随之提高。SEM分析结果表明,所合成的小球表面具有多孔结构,有利于金属离子的扩散迁移。XPS分析结果显示,羧甲基壳聚糖小球的—COOH和—NH2基团参与了Ni2+去除反应过程。综合溶液反应前后pH的变化情况可知,Ni2+的去除是由—COOH和—NH2基团络合与沉淀共同作用的结果。
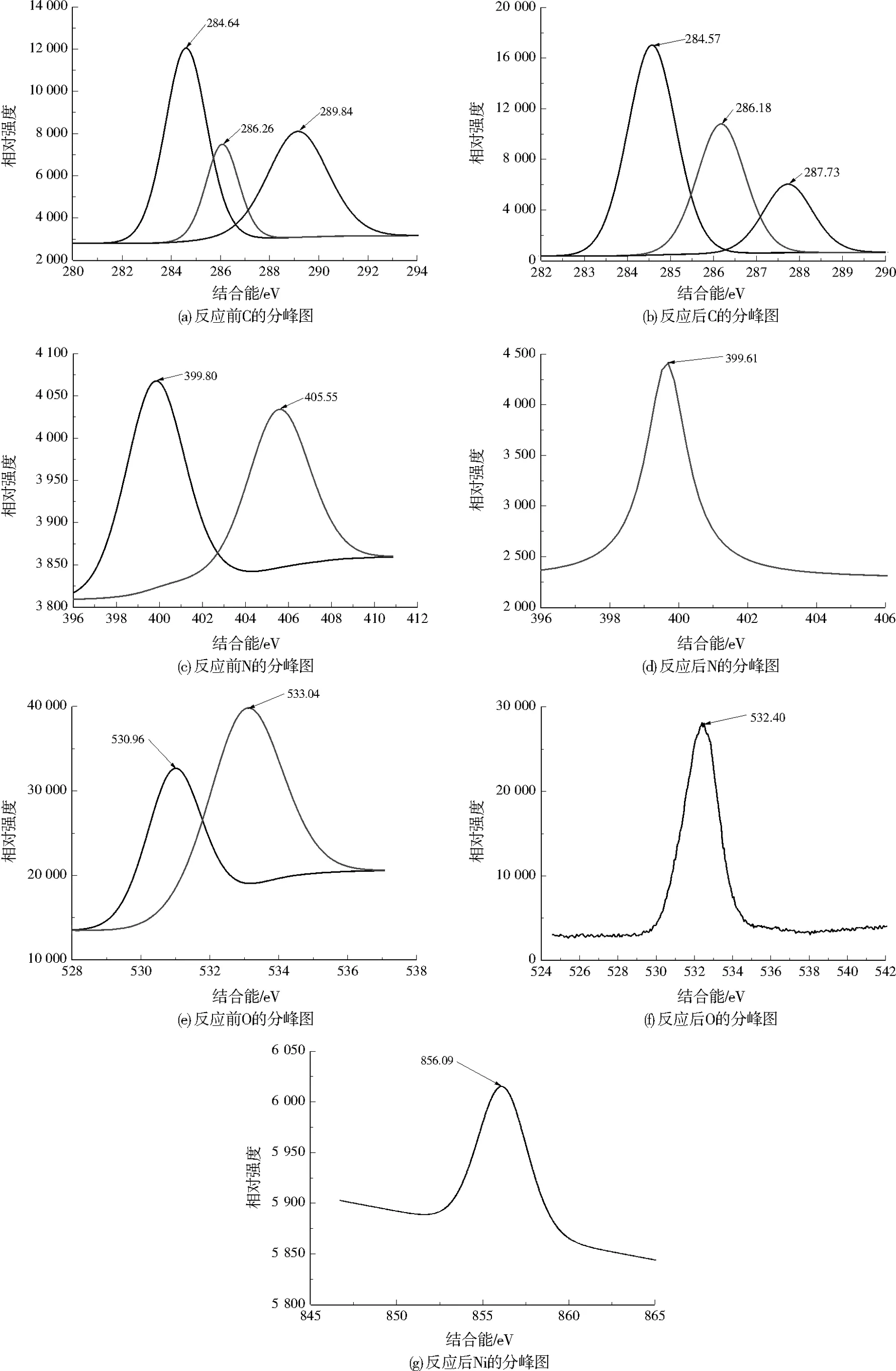
图8 小球的XPS谱图Fig.8 XPS spectra of cross-linked carboxymethyl chitosan beads
(致谢:在实验研究过程中,得到了整个课题组帮助和指导,尤其是后期的论文修改,课题组更是给出了宝贵的意见,在此表示感谢!)
[1] LIAO Bing,SUN Weiyi,GUO Na,et al.Equilibriums and kinetics studies for adsorption of Ni(Ⅱ) ion on chitosan and its triethylenetetramine derivative[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2016,501:32-41.
[2] 赵家军.电镀铜镍合金废水中铜,镍离子的去除研究[D].南京:南京理工大学,2008.
[3] 冯立伟,刘绪光.吉恩镍业选矿厂工业废水循环利用生产实践[J].有色矿冶,2011,27(2):51-53.
[4] SUN Shengling,WANG Li,WANG Aiqin.Adsorption properties of crosslinked carboxymethyl-chitosan resin with Pb(Ⅱ) as template ions[J].Journal of Hazardous Materials,2006,136(3):930-937.
[5] 刘维俊.高分子壳聚糖对微量金属离子的螯合作用研究[J].环境科学与技术,2003,26(3):11-12.
[6] NGAH W S W,TEONG L C,TOH R H,et al.Comparative study on adsorption and desorption of Cu (Ⅱ) ions by three types of chitosan-zeolite composites[J].Chemical Engineering Journal,2013,223:231-238.
[7] GUIBAL E.Interactions of metal ions with chitosan-based sorbents:a review[J].Separation and Purification Technology,2004,38(1):43-74.
[8] NGAH W S W,TEONG L C,HANAFIAH M.Adsorption of dyes and heavy metal ions by chitosan composites:a review[J].Carbohydrate Polymers,2011,83(4):1446-1456.
[9] 孙新枝,苏中兴.改性壳聚糖的制备及其对金属离子的吸附性能[J].化学研究,2005,16(1):29-31.
[10] 张艳雅,马启敏.壳聚糖改性吸附剂的制备及其吸附性能研究[J].中国海洋大学学报(自然科学版),2006,36(增刊):153-156.
[11] SAKKAYAWONG N,THIRAVETYAN P,NAKBANPOTE W.Adsorption mechanism of synthetic reactive dye wastewater by chitosan[J].Journal of Colloid and Interface Science,2005,286(1):36-42.
[12] LASKO C L,HURST M P.An investigation into the use of chitosan for the removal of soluble silver from industrial wastewater[J].Environmental Science & Technology,1999,33(20):3622-3626.
[13] WONGPANIT P,SANCHAVANAKIT N,PAVASANT P,et al.Preparation and characterization of microwave-treated carboxymethyl chitin and carboxymethyl chitosan films for potential use in wound care application[J].Macromolecular Bioscience,2005,5(10):1001-1012.
[14] 尚超.羧甲基壳聚糖吸附剂对铀离子的吸附特性研究[D].抚州:东华理工大学,2013.
[15] 赵春禄,孙鹏程,刘辉.接枝交联改性壳聚糖吸附性能研究[J].青岛理工大学学报,2011,32(1):53-57.
[16] 国家环境保护总局《水和废水监测分析方法》编委会.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002.
[17] 朱寿进,刘法谦.新型羧甲基壳聚糖水凝胶的合成与表征[J].高等学校化学学报,2014,35(4):863-868.
[18] 林友文,陈伟,罗红斌.羧甲基壳聚糖对铅离子的吸附性能研究[J].离子交换与吸附,2001,17(4):333-338.
[19] 施晓文,杜予民,覃采芹,等.交联羧甲基壳聚糖微球的制备及其对Pb2+的吸附性能[J].应用化学,2003,20(8):715-718.
[20] 张军丽,李瑞玲,潘庆才.DNS改性壳聚糖对重金属镍离子的吸附研究[J].非金属矿,2011,34(4):62-65.
[21] 郝志峰,杨阳,余坚.壳聚糖膜与Co(Ⅱ),Ni(Ⅱ),Cu(Ⅱ)复合物的IR光谱和XPS谱[J].光谱实验室,2003,30(6):799-802.
StudyonNi2+removalbycross-linkedcarboxymethylchitosanbeadsinthewater
XIEYanhua,ZHANGLulu,DIAOZhiqiang,LIUZhuang,HUANGMinrui,LUOTing.
(CollegeofEnvironmentandCivilEngineering,ChengduUniversityofTechnology,ChengduSichuan610059)
2016-11-02)
谢燕华,女,1981年生,博士,副教授,主要从事地表水及地下水污染修复与防治、纳米材料的开发与应用、微污染水体的治理研究。
*国家自然科学基金资助项目(No.41472230);中国博士后科学基金第57批面上资助项目。
10.15985/j.cnki.1001-3865.2017.08.005
