骨形态发生蛋白2表达载体的构建及生物学功能鉴定
2017-11-06姥伟代建宁景调平邓彩霞杨海旭
姥伟,代建宁,景调平,邓彩霞,杨海旭
解放军第五医院 a.骨科中心;b.麻醉手术科;c.高压氧;宁夏 银川 750004
骨形态发生蛋白2表达载体的构建及生物学功能鉴定
姥伟a,代建宁a,景调平b,邓彩霞c,杨海旭a
解放军第五医院 a.骨科中心;b.麻醉手术科;c.高压氧;宁夏 银川 750004
目的:从真核细胞中获得骨形态发生蛋白2(BMP2)编码基因,构建其真核表达载体并进行鉴定。方法:提取人HeLa细胞总RNA,经反转录后用特异性引物扩增BMP2编码区,连接至pcDNA3.1载体,筛选阳性克隆并进行功能学鉴定。结果:反转录PCR获得1100bp的片段,经分子克隆后鉴定序列与BMP2一致,并且在真核细胞中能够诱导Smad1/5/8的磷酸化。结论:构建了真核表达载体pcDNA3.1-BMP2并验证了其体内功能,为后续探讨BMP2在骨发育中的作用机制打下基础。
骨形态发生蛋白2;真核表达载体;Smad1/5/8
骨形态发生蛋白(bone morphogenetic pro⁃teins,BMP)家族成员有20种,在结构上相对保守,在骨骼的发育、再生和修复过程中发挥重要作用[1-2]。其中,对BMP2的研究较多。BMP2通过自分泌或旁分泌的方式刺激间充质干细胞向成骨细胞的分化,并进一步促进成骨细胞分化为骨细胞[3]。BMP2可以激活细胞内诸多发育相关信号通路的活化,如PI3K/Akt通路、Smad通路、WNT通路等。因此,充分明确BMP2的功能及其在骨形成中的作用机制,对于骨相关疾病的研究和治疗具有重要意义[4-6]。我们利用重组DNA技术构建了BMP2真核表达载体,为后续的功能研究打下基础。
1 材料与方法
1.1 材料
HeLa细胞和HepG2细胞购自中国科学院细胞库;大肠杆菌TOP10、限制性内切酶及连接酶购自TaKaRa公司;pcDNA3.1表达质粒和脂质体2000购自Invitrogen公司;BMP2抗体和磷酸化Smad1/5/8抗体购自Cell Signaling Technology公司;β-actin购自博士德公司。
1.2 pcDNA3.1-BMP2重组质粒的构建及鉴定
提取HeLa细胞总RNA并反转录成cDNA,根据BMP2的编码序列设计引物进行PCR扩增。上游引物为5'-GAATTCATGGTGGCCGGGACCCGC-3',酶切位点为EcoRⅠ;下游引物为5'-CTCGAGC⁃TAGCGACACCCACAACC-3',酶切位点为 XhoⅠ。PCR反应条件:95℃预变性5min;95℃变性30s,55℃退火30s,72℃延伸90s,30个循环;72℃充分延伸10min。PCR产物经电泳、胶回收,用EcoRⅠ和XhoⅠ双酶切,回收酶切产物,连接至pcDNA3.1质粒反应过夜,将连接产物转化大肠杆菌感受态TOP10,待单克隆长至肉眼可见菌落时转接至含氨苄西林的LB培养基,扩增宿主菌并进行酶切鉴定,对阳性克隆进行测序。
1.3 细胞转染实验
将HeLa细胞和HepG2细胞接种至6孔板,待细胞密度长至约60%时,取4μg pcDNA3.1质粒(阴性对照)或4μg pcDNA3.1-BMP2重组质粒,分别与10μL脂质体2000混匀,转染至细胞,24h后收取细胞,分别进行实时定量PCR实验和Western印迹实验。
1.4 实时定量PCR
用TRIzol试剂盒分别提取HeLa细胞和HepG2细胞pcDNA3.1、pcDNA3.1-BMP2过表达实验组样品的总RNA,RT-PCR反转录合成cDNA,通过实时定量PCR实验分别检测各组中BMP2(上游引物:5'-ACTACCAGAAACGAGTGGGAA-3',下游引物:5'-GCATCTGTTCTCGGAAAACCT-3')和内参照GAPDH(上游引物:5'-ACCCAGAA GACTGTGGATGG-3',下游引物:5'-TCTAGACGG CAGGTCAGGTC-3')mRNA的表达量。PCR扩增条件:94℃预变性5min;94℃变性10s,55℃退火10s,72℃延伸 10s,30个循环。PCR 反应结束后,将所得循环数按照公式进行数据分析。
1.5 Western印迹
分别收取阴性对照、过表达pcDNA3.1-BMP2的HeLa细胞和HepG2细胞,用预冷的PBS溶液洗涤细胞,加入RIPA蛋白裂解液,超声波裂解细胞提取蛋白;离心后收取蛋白上清,通过BCA定量法对各组蛋白进行定量;按照一定体积加入5×上样缓冲液,于沸水中10min,保证蛋白充分变性;取30μg蛋白样品进行蛋白电泳实验(SDSPAGE),浓缩胶电压为120 V,分离胶电压为160 V;电泳完成后,将凝胶上的蛋白转移至硝酸纤维素膜(NC膜)上,用5%脱脂奶粉封闭1h;分别用BMP2抗体(1∶1000稀释)、磷酸化Smad1/5/8抗体(1∶1000稀释)和β-actin抗体(1∶500稀释)与NC膜于4℃孵育过夜,次日用含0.5%Tween-20的TBST洗 3次,5min/次,再分别加入1∶5000的HRP标记的二抗,室温摇床孵育1h,TBST洗3次,5min/次,ECL发光检测,胶片显色,分析结果。以β-actin为内参照。
2 结果
2.1 pcDNA3.1-BMP2重组质粒的构建及鉴定
以HeLa细胞的cDNA为模板,PCR扩增出BMP2编码区域,将BMP2和pcDNA3.1分别经EcoRⅠ和XhoⅠ酶切后进行连接,转化大肠杆菌感受态TOP10,挑取克隆提取质粒,酶切鉴定,发现1号和2号克隆均可在1000~2000bp位置切得条带,此为BMP2编码区基因序列(图1)。经测序鉴定正确后准备进行后续实验。
2.2 BMP2 mRNA表达水平鉴定
为了验证BMP2是否能在真核细胞中正确转录翻译,将pcDNA3.1-BMP2和阴性对照pcDNA3.1空载体瞬时转染HeLa细胞或HepG2细胞。通过实时定量PCR实验发现,与阴性对照相比,转染pcDNA3.1-BMP2质粒的细胞中,BMP2的mRNA水平显著升高,提示pcDNA3.1-BMP2质粒能够在真核细胞中表达(图2)。
2.3 BMP2蛋白表达及Smad1/5/8磷酸化水平鉴定
Smad1/5/8复合体是BMP2下游作用的信号分子,在BMP2高表达时,Smad1/5/8的磷酸化水平显著增加。为了验证pcDNA3.1-BMP2重组质粒是否在细胞中发挥作用,我们通过Western印迹实验进行了验证。结果显示,在HeLa和HepG2细胞中,转染pcDNA3.1-BMP2重组质粒均可显著诱导BMP2蛋白水平的表达,同时Smad1/5/8的磷酸化水平也显著增加(图3)。这表明pcDNA3.1-BMP2重组质粒在细胞内可成功表达并在体内发挥功能。
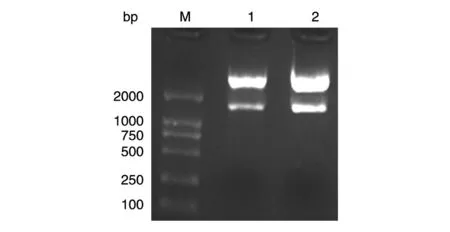
图1 重组质粒pcDNA3.1-BMP2的EcoRⅠ/XhoⅠ双酶切电泳图谱
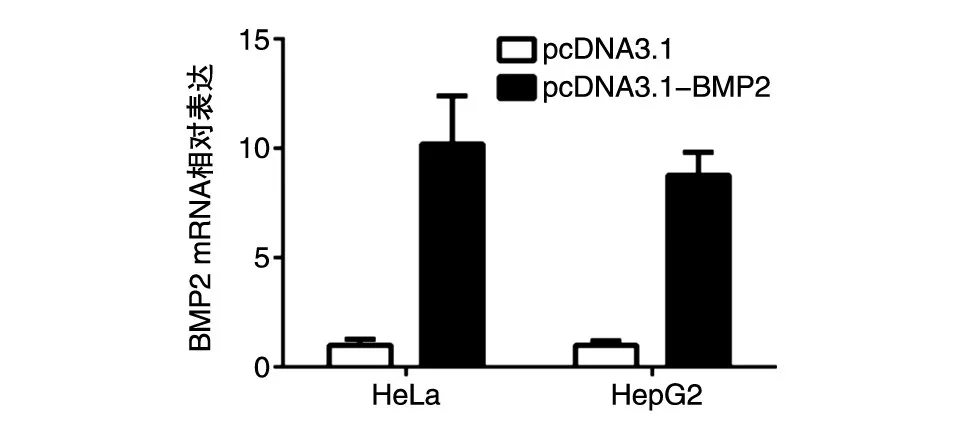
图2 实时定量PCR检测BMP2 mRNA表达
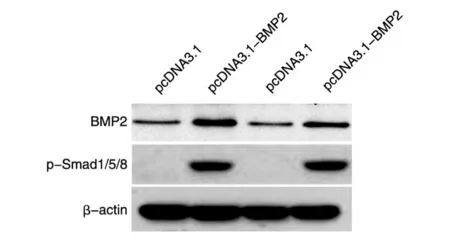
图3 Western印迹检测BMP2和磷酸化Smad1/5/8表达水平
3 讨论
生长因子在诱导干细胞向骨细胞发育的过程中扮演重要角色,目前已知BMP、转化生长因子β(transforming grouth factor β,TGF-β)、胰岛素样生长因子(insulin-like growth factor,IGF)、成纤维素样生长因子(fibroblast growth factor,FGF)在骨分化方面具有重要作用[7]。自1988年发现BMP2可以诱导骨和软骨形成,BMP家族成员就已成为骨骼生物学研究的重要内容[8]。BMP是TGF-β超家族成员,包含20多种亚型,通过调控BMP信号通路,可以改善骨骼质量,治疗骨生长相关疾病,修复骨和关节的损伤[9]。
BMP2作为BMP家族中的一种亚型,在调节间充质干细胞和成骨细胞向骨细胞分化的过程中具有重要意义[10]。许多研究表明,BMP2表达降低或基因突变,可导致骨折、骨密度下降等骨相关疾病的发生。细胞膜表面分布着BMP受体,包括Ⅰ型受体(BMPRIA、BMPRIB和ACVRI)和Ⅱ型受体(BMPRII、ActRIIA和 ActRIIB)[11-12]。在BMP2刺激下,Ⅱ型受体被识别和激活,进而募集Ⅰ型受体,Ⅰ型受体可活化下游R-Smad(包括Smad1、Smad5、Smad8)[13-14]。R-Smad与Smad4结合进入细胞,调控骨发育相关基因的转录[15]。此外,BMP2还可以通过激活WNT/β-Catenin、MAPK/ERK等非经典的通路调节关键转录因子的表达,促进成软骨、成骨信号,如软骨分化转录因子Sox9、成骨分化转录因子Runx2[16-17]。
本实验构建了BMP2的真核表达载体,并利用细胞学实验对其功能进行了初步验证,BMP2的过表达显著促进了R-Smad的磷酸化水平。上述结果为后续研究BMP2在骨发育中对干细胞分化的功能以及探讨相关机制打下了重要基础。
[1] Lahiri S,Roy A,Baby S M,et al.Oxygen sensing in the body[J].Prog Biophys Mol Biol,2006,91(3):249-286.
[2] Anusuya G S,Kandasamy M,Jacob Raja S A,et al.Bone morphogenetic proteins: signaling periodontal bone regeneration and repair[J].J Pharm Bioallied Sci,2016,8(Suppl 1):S39-S41.
[3] Salazar V S,Gamer L W,Rosen V.BMP signalling in skeletaldevelopment,disease and repair[J].Nat Rev Endocrinol,2016,12(4):203-221.
[4] Liu D D,Zhang J C,Zhang Q,et al.TGF-β/BMP signaling pathway is involved in cerium-promoted os⁃teogenic differentiation of mesenchymal stem cells[J].J Cell Biochem,2013,114(5):1105-1114.
[5] Hou X,Shen Y,Zhang C,et al.A specific oligodeoxy⁃nucleotide promotesthe differentiation ofosteoblasts via ERK and p38 MAPK pathways[J].Int J Mol Sci,2012,13(7):7902-7914.
[6] Gu Y X,Du J,Si M S,et al.The roles of PI3K/Akt signaling pathway in regulating MC3T3-E1 preosteo⁃blastproliferation and differentiation on SLA and SLActive titanium surfaces[J].J Biomed Mater Res A,2013,101(3):748-754.
[7] Estes B T,Diekman B O,Gimble J M,et al.Isola⁃tion of adipose-derived stem cells and their induction to a chondrogenic phenotype[J].Nat Protoc,2010,5(7):1294-1311.
[8] Wozney J M,Rosen V,Celeste A J,et al.Novel regu⁃lators of bone formation:molecular clones and activi⁃ties[J].Science,1988,242(4885):1528-1534.
[9] Lo K W,Ulery B D,Ashe K M,et al.Studies of bone morphogenetic protein-based surgicalrepair[J].Adv Drug Deliv Rev,2012,64(12):1277-1291.
[10]Kaewsrichan J,Wongwitwichot P,Chandarajoti K,et al.Sequential induction of marrow stromal cellsby FGF2 and BMP2 improves their growth and differentia⁃tion potential in vivo[J].Arch Oral Biol,2011,56(1):90-101.
[11]Greenwald J,Groppe J,Gray P,et al.The BMP7/Act⁃RIIextracellulardomain complex provides new in⁃sights into the cooperative nature of receptor assembly[J].Mol Cell,2003,11(3):605-617.
[12]Wu H.Assembly of post-receptor signaling complexes for the tumor necrosis factor receptor superfamily[J].Adv Protein Chem,2004,68:225-279.
[13]Matsumoto Y,Otsuka F,Hino J,et al.Bone morphoge⁃netic protein-3b(BMP-3b)inhibits osteoblast differenti⁃ation via Smad2/3 pathway by counteracting Smad1/5/8 signaling[J].Mol Cell Endocrinol,2012,350(1):78-86.
[14]Fuentealba L C,Eivers E,Ikeda A,et al.Integrating patterning signals:Wnt/GSK3 regulates the duration of the BMP/Smad1 signal[J].Cell,2007,131(5):980-993.
[15]Chen J,Shi Z D,Ji X,et al.Enhanced osteogenesis of human mesenchymal stem cells by periodic heat shock in self-assembling peptide hydrogel[J].Tissue Eng Part A,2013,19(5-6):716-728.
[16]Drissi M H,Li X,Sheu T J,et al.Runx2/Cbfa1 stim⁃ulation by retinoic acid is potentiated by BMP2 signal⁃ing through interaction with Smad1 on the collagen X promoter in chondrocytes[J].J Cell Biochem,2003,90(6):1287-1298.
[17]Liao J,Hu N,Zhou N,et al.Sox9 potentiates BMP2-induced chondrogenic differentiation and inhibits BMP2-induced osteogenic differentiation[J].PLoS One,2014,9(2):e89025.
Construction and BiologicalFunction Characterization of BMP2 Expression Plasmid
LAO Weia,DAI Jian-Ninga,JING Diao-Pingb,DENG Cai-Xiac,YANG Hai-Xua*
a.Department of Orthopedics;b.Department of Anesthesiology;c.Department of Hyperbaric Oxygen;the 5th Hos⁃pital of PLA,Yinchuan 750004,China
*Corresponding author,E-mail:bioyhx@126.com
Objective:To clone bone morphogenetic protein 2(BMP2) full length gene from mammal cells,and then construct and characterize the mammal expression vector.Methods:The total RNA was extracted from HeLa cells.Amplify BMP2 full length cDNA through RT-PCR with a pair of specific gene primers.Clone it into pcD⁃NA3.1 vector.The positive clone was selected and sequenced.Verify the biological function of BMP2 in mammal cells.Results:The 1100bp specific fragment was obtained by RT-PCR.After the molecular cloning and sequenc⁃ing,BMP2 over-expressed in mammal cells can induce the phosphorylation of Smad1/5/8.Conclusion:We con⁃stucted pcDNA3.1-BMP2 and confirmed its function.These data provide a basis of the mechanistic study of BMP2 function in bone development.
bone morphogenetic protein 2;mammal expression vector;Smad1/5/8
Q78;Q24
A
1009-0002(2017)04-0506-04
2016-12-26
姥伟(1979- ),男,硕士,主治医师,(E-mail)mulaowei@126.com
杨海旭,(E-mail)bioyhx@126.com
10.3969/j.issn.1009-0002.2017.04.020
