蜱传脑炎病毒E抗原蛋白的原核表达及鉴定
2017-11-06温中华李建民陈薇
温中华,李建民,陈薇
军事医学科学院 生物工程研究所,北京 100071
蜱传脑炎病毒E抗原蛋白的原核表达及鉴定
温中华,李建民,陈薇
军事医学科学院 生物工程研究所,北京 100071
目的:构建蜱传脑炎病毒(TBEV)结构蛋白E的原核表达载体,表达重组蛋白。方法:PCR扩增E蛋白全长基因片段,插入原核表达载体pET-32a并转化大肠杆菌进行诱导表达,镍柱纯化、复性。结果:E蛋白在大肠杆菌中获得表达,表达量达60 mg/L;重组E蛋白能与人抗TBEV多克隆抗体产生特异反应;用重组E抗原免疫家兔后,能检测到较高的抗体水平。结论:原核表达的E抗原蛋白具有抗体结合活性,可用于制备ELISA诊断试剂。
蜱传脑炎病毒;E蛋白;原核表达
蜱传脑炎病毒(tick-borne encephalitis virus,TBEV)在分类学上属黄病毒科(Flavivirade)黄病毒属(Flavivirus),有3个亚型,即欧洲亚型、西伯利亚亚型和远东亚型[1-2],能够引起人体急性中枢神经系统传染病——蜱传脑炎。世界卫生组织统计该病每年发病10 000~12 000例,在我国多发于东北、西南及西北林区[3],已被列为5大职业性传染病之一。TBEV为单正链RNA包膜病毒,包含3个结构蛋白,即衣壳蛋白C、前膜蛋白M(prM)、包膜蛋白E,以及7个非结构蛋白NS1、NS2A、NS2B、NS3、NS4A、NS4B、NS5[4],其中结构蛋白E是病毒的主要抗原成分,能刺激机体产生中和抗体,决定着病毒的细胞嗜性与毒力。制备并纯化E抗原蛋白,既可作为TBE的诊断制剂,又可作为新的免疫原蛋白,亦可用于中和抗体的筛选和中和表位的鉴定。
1 材料和方法
1.1 材料
大肠杆菌感受态细胞Top10、BL21购自天根生化有限公司;质粒pET-32a为本实验室留存;TBEV结构蛋白E基因(含结构域Ⅰ、Ⅱ、Ⅲ)由博迈德公司合成;引物由Invitrogen公司合成;Ex Taq酶、核酸及蛋白marker购自TaKaRa公司;限制性内切酶、T4DNA连接酶、pMD18-T载体购自NEB公司;凝胶回收、质粒提取试剂盒购自Omega公司;HisTrap镍柱购自GE公司;HRP羊抗兔及羊抗人IgG二抗购自Sigma公司;化学发光显色液购自Millipore公司。
1.2 原核表达质粒构建
利用上游引物(5'-CATATGTCGCGTTGCACA CACTTGGAAAAC-3')和下游引物(5'-GCGGCCG CCGCCCCCACTCCAAGGGTCATGGCCAAG-3')(分别引入NdeⅠ和NotⅠ酶切位点)扩增E基因,回收PCR扩增产物,连T载体,转化感受态Top10细胞,挑单克隆培养过夜,PCR鉴定阳性克隆。将鉴定正确的基因与pET-32a质粒用NdeⅠ和NotⅠ双酶切、连接并转化感受态Top10细胞,挑单克隆培养过夜,PCR鉴定阳性克隆,抽提阳性克隆质粒进行双酶切鉴定并测序。
1.3 重组蛋白诱导表达
将鉴定正确的阳性克隆质粒转化BL21细胞,经氨苄西林选择培养后,挑单克隆到5mL含100μg/mL氨苄西林的 LB培养基,37℃、220r/min振荡培养,D600nm值达0.6~0.8时加入IPTG至终浓度为1mmol/L诱导表达4h,诱导结束后,3000r/min离心10min收取菌体沉淀,加入1mL PBS重悬后超声波裂解10min,12 000r/min离心10min,分别取超声波后的全菌液、上清、沉淀(用等体积PBS重悬),加入4×SDS上样缓冲液,100℃加热5min,SDS-PAGE分析表达结果。
1.4 重组蛋白大量表达及纯化
将阳性克隆菌株接种到100mL含氨苄西林的LB培养基,37℃、220r/min振摇过夜,将其全部接种到1 L含氨苄西林的LB培养基中继续培养,当 D600nm值达 0.6~0.8时,加入1mmol/L IPTG诱导4h,8000r/min离心10min收菌体;用100mL缓 冲 液 A(含 50mmol/LTris,0.5mmol/L EDTA,50mmol/L NaCl及5%甘油)重悬菌体,超声波破碎30min,4℃、12 000r/min离心20min,弃上清;PBS洗涤沉淀2次;在沉淀中加入100mL缓冲液 A、100μL DTT(0.5 mol/L)及 1.5mL 十二烷基肌氨酸钠(20%)重悬,4℃静置过夜;4℃、12 000r/min离心20min,取上清,加入1050μL PEG4000(浓度 0.2%)、2100μL氧化型谷胱甘肽(50mmol/L)和还原型谷胱甘肽(100mmol/L),室温静置2h;用TE缓冲液(含10mmol/L Tris-HCl和 1mmol/L EDTA,pH8.0)透析 72h。将透析后的E蛋白用结合缓冲液(含10mmol/L磷酸二氢钠、300mmol/L NaCl、5mmol/L咪唑,pH7.4)稀释至1/10,上镍柱,用洗脱缓冲液(含10mmol/L 磷 酸 二 氢 钠 、300mmol/L NaCl、500mmol/L咪唑,pH7.4)进行线性梯度洗脱,收集峰用10mmol/L磷酸氢钠缓冲液(pH7.4)超滤换液,Bradford法测蛋白浓度。取10μg加入SDS上样缓冲液,加β巯基乙醇,100℃加热5min,SDSPAGE分析结果。
1.5 Western印迹
取10μg纯化的E蛋白进行 SDS-PAGE,转PVDF膜,用5%脱脂牛奶封闭过夜;加入商品化疫苗免疫过的志愿者阳性血清(用封闭液1∶50稀释),室温孵育 1h;TBST洗涤4次,7min/次;加入HRP羊抗人二抗,室温孵育1h;TBST洗涤4次,7min/次;淋加显色液,观察结果。
1.6 ELISA实验
取2μg/mL的E蛋白包被酶标板,4℃包被过夜,PBST洗涤3次,5min/次;用5%脱脂牛奶于37℃封闭1h;洗涤,加入一抗(人和猴抗TBEV多抗,浓度 10μg/mL),37℃孵育 1h;洗涤,加入HRP羊抗人二抗(1∶1000),37℃孵育1h;洗涤,加显色液,37℃显色15min,加终止液终止反应,测定D450nm值。同时,用Abcam公司商品化TBEV ELISA试剂盒进行检测,比较结果。
1.7 兔多克隆抗体制备及检测
将纯化的E抗原蛋白与弗氏完全佐剂等体积混合后免疫新西兰大白兔(免疫前取血清),采用背部皮下注射免疫,每7d免疫1次,共计3次,剂量1 mg/(次·只)。第28d天耳缘静脉取血,分离血清,用间接ELISA法检测血清抗体效价。
2 结果
2.1 质粒构建及鉴定
TBEV结构蛋白E基因PCR扩增后,获得约1500bp的片段(图1);构建的pET-32a/E质粒经NdeⅠ和NotⅠ双酶切鉴定,得到目的条带(图2),基因测序与原序列一致,无碱基突变。
2.2 E蛋白诱导表达及纯化
将表达质粒pET-32a/E转化BL21细胞诱导表达,菌体超声波破碎后进行SDS-PAGE鉴定,结果在全菌液和沉淀中均出现目的蛋白大小条带(相对分子质量约55 000),而上清中则无(图3),说明E抗原蛋白以包涵体形式表达。包涵体经十二烷基肌氨酸钠变性,在含氧化型谷胱甘肽和还原型谷胱甘肽的氧化还原体系中透析复性,用Ni柱纯化获得纯度较高的蛋白(图4);测定浓度后计算,1 L菌液诱导后能获得约60 mg蛋白。
2.3 Western印迹
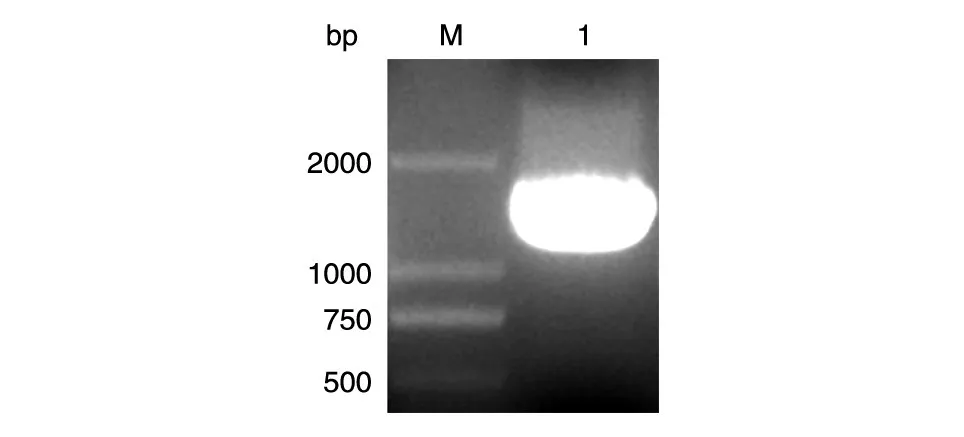
图1 TBEV E基因的PCR扩增

图2 pET-32a/E重组质粒的双酶切鉴定
用人TBEV阳性血清对纯化的E抗原蛋白进行Western印迹检测,在相对分子质量约55 000处出现惟一目的条带(图5)。
2.4 ELISA结果
用纯化的E抗原包被酶联板,对商品化疫苗免疫后的人和猴的阳性、阴性血清纯化多抗进行ELISA检测,结果表明我们纯化的E抗原蛋白能与阳性多抗发生特异性反应(图6)。同时,我们将三免第7d的兔血清1∶300稀释后与E抗原进行间接ELISA反应,结果如图6,说明E蛋白具有免疫原性。
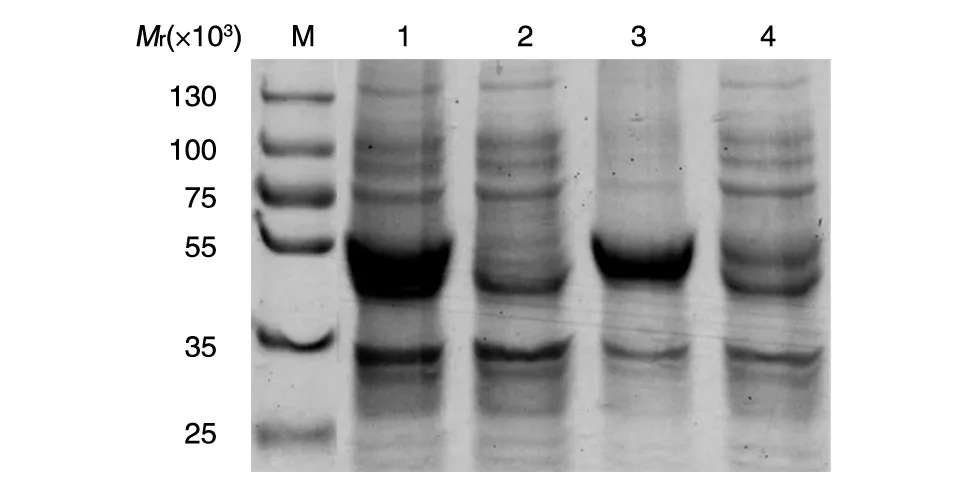
图3 TBEV E蛋白原核诱导表达的SDS-PAGE

图4 TBEV E蛋白的Ni柱纯化
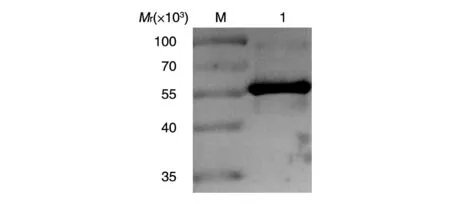
图5 TBEV E蛋白的Western印迹
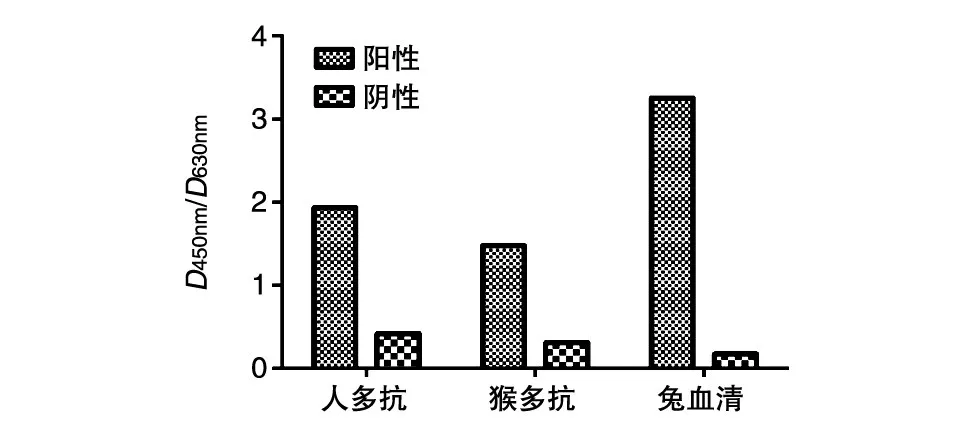
图6 重组E抗原蛋白的ELISA检测
3 讨论
目前商品化的蜱传脑炎ELISA诊断试剂大多用的是灭活TBEV,昂贵且存在一定的安全隐患,同时与其他黄病毒属病毒还有交叉结合[5]。E抗原蛋白是TBEV的主要抗原成分,决定着病毒的细胞嗜性与毒力,利用重组E蛋白作为诊断抗原是一种经济安全的选择。
王丹[6]、朱晓磊[7]等原核表达了E蛋白结构域Ⅲ,并以之作为TBEV特异性诊断抗原。与之相比,我们表达的E抗原全蛋白分子覆盖了全部抗原表位,在作为诊断试剂时可能会有更高的检测准确率,但这还需要进一步的血清学验证。邵宾等[8]亦通过原核表达了蜱传脑炎病毒E蛋白,但获得的包涵体未能复性,可能影响其蛋白活性。在本研究中,我们利用pET-32a载体在原核细胞中表达了TBEV抗原E蛋白,该蛋白以包涵体的形式存在。我们首先试图用尿素作为变性剂,将包涵体变性后通过减少尿素浓度逐步透析复性,结果发现在复性过程中E蛋白总是会析出。于是又使用了比较温和的变性剂十二烷基肌氨酸钠,并在复性过程中加入氧化还原体系(还原型谷胱甘肽与氧化型谷胱甘肽),最终得到了复性后的E抗原蛋白。
综上所述,本研究获得了重组E抗原蛋白,该蛋白既可作为TBEV特异性诊断抗原之一,又可作为新的TBEV疫苗成分,亦可用于中和抗体的筛选和中和表位的鉴定。
[1] Ecker M,Allison S L,Meixner T,et al.Sequence analysis and genetic classification of tick-borne en⁃cephalitis viruses from Europe and Asia[J].J Gen Vi⁃rol,1999,80(1):179-185.
[2] Gould E A,De Lamballerie X,Zanotto P M,et al.Evolution,epidemiology,and dispersal of flaviviruses re⁃vealed by molecularphylogenies[J].AdvVirusRes,2001,57:71-103.
[3] 杨蓝萍,张天寿,袁晓平,等.从云南蝙蝠及牛蜱中分离出两株森林脑炎病毒[J].中国人兽共患病学杂志,1993,1:22-23.
[4] McMinn P C.The molecular basis of virulence of the encephalitogenic flaviviruses[J].J Gen Virol,1997,78:2711-2721.
[5] Niedrig M,Vaisviliene D,Teichmann A,et al.Compar⁃ison of six different commercial IgG-ELISA kits for the detection ofTBEV-antibodies[J].JClin Virol,2001,20:79-182.
[6] 王丹,康晓平,郝淮杰,等.蜱传脑炎病毒TBE-E-D3抗原的原核表达纯化及ELISA方法鉴定[J].生物技术通讯,2011,22(5):636-639.
[7] 朱晓磊,林方,康晓平,等.森林脑炎病毒E基因Do⁃mainⅢ段的克隆表达及鉴定[J].吉林农业大学学报,2012,34(6):667-671.
[8] 邵宾,陈斌,谢菲,等.蜱传脑炎病毒E基因的重组质粒构建及其在原核细胞的表达[J].河北农业大学学报,2010,33(3):87-91.
Expression and Identification of Recombinant Tick-Borne Encephalitis Virus Envelope Protein in Escherichia coli
WEN Zhong-Hua,LI Jian-Min,CHEN Wei*
Beijing Institute of Biotechnology,Beijing 100071,China
*Corresponding author,E-mail:cw0226@foxmail.com
Objective:To construct prokaryotic expression vectors for tick-borne encephalitis virus(TBEV) enve⁃lope(E) protein,and express recombinant TBEV E protein in Escherichia coli.Methods:The coding sequence of full length E protein was amplified by PCR and cloned into the pET-32a vector.The protein of interest was ex⁃pressed in E.coli with IPTG induction and purified by Ni-NATB bead.Results:We obtained recombinant E pro⁃tein in E.coli with the yields of ~60 mg/L,and it was identified by specific human anti-TBEV polyclonal antibod⁃ies.After being immunized with E antigen in rabbits,specific high-level antibodies could be detected in serum.Conclusion:The prokaryotically expressed recombinant E protein with the antibody binding activity can be devel⁃oped as a ELISA diagnostic reagents.
tick-borne encephalitis virus;envelope protein;prokaryotic expression
Q78;R392.1
A
1009-0002(2017)04-0495-04
2017-02-13
“重大新药创制”科技重大专项(2013ZX09304103)
温中华(1989- ),男,硕士研究生,(E-mail)zhonghuawen2014@163.com
陈薇,(E-mail)cw0226@foxmail.com
10.3969/j.issn.1009-0002.2017.04.017
