Mn对生物医用Ti-Mo合金组织与力学性能的影响
2017-11-06武晓峰杨会齐王春雨
武晓峰,杨会齐,王春雨
Mn对生物医用Ti-Mo合金组织与力学性能的影响
武晓峰,杨会齐,王春雨
(辽宁工业大学材料科学与工程学院,锦州 121001)
采用非自耗真空电弧炉制备Ti-8Mo-Mn系列合金,以考察Mn的添加对生物医用Ti-Mo合金显微组织与力学性能的影响。结果表明:两元Ti-Mo合金主要由细小的针状″马氏体相组成,加入1%Mn(质量分数)后,等轴晶的相大部被保留;当Mn的加入量达到3%后,相全部被保留到室温。拉伸力学测试发现:相不稳定的Ti-8Mo-1Mn合金在拉伸过程中发生应力诱导的从相到″相的马氏体转变,呈现出“双屈服”现象。加入少量Mn(1%和3%)提高合金塑性,伸长率由35%最大提高到53%。Mn量增加到5%、7%后,合金强度得到大幅提高,抗拉强度最大由856 MPa提高到1201 MPa,同时伸长率为22%。所有含Mn合金的显微硬度都较高,最高为386HV,是两元Ti-Mo合金的(251HV)1.65倍。含相的Ti-8Mo-1Mn合金的弹性模量最高,达150 GPa。其它含Mn合金的弹性模量在76~87 GPa之间,与人骨骼的接近,有潜力成为生物医用材料。
Ti-Mo合金;锰;显微组织;力学性能;生物材料
与其他生物医用金属材料相比,钛及钛合金由于具有较低的密度、高的比强度、良好的耐蚀性和生物相容性等显著特点,因此成为矫形外科、骨骼置换及关节修复等医疗外科手术中广泛应用的金属材料[1]。目前, 在临床医学中应用的钛及钛合金主要是纯Ti(CP-Ti)和Ti-6Al-4V(TC4)合金,但它们具有较高的弹性模量(约110 GPa),远高于人骨(3~20 GPa),如果植入人体,会对周围的骨骼产生“应力屏蔽”,导致植入体周围出现骨吸收,最终引起植入体的无菌松动,缩短使用寿命[2]。另外,在TC4合金中析出的极微量的钒离子和铝离子,会降低细胞的适应性,长期使用存在安全隐患[3]。研究结果表明:在构成钛合金的各类相中,具有体心立方结构的相弹性模量最低[2]。因此,研究无毒的、具有更低弹性模量和更好生物相容性的新型生物医用型或亚稳型钛合金已成为近年来的研究热点之一。
目前,研究和开发的医用型钛合金主要有Ti-Nb[4]、Ti-Mo[5]和Ti-Ta[3]等二元系, Ti-Mo-Nb[6]、Ti-Nb-Zr[7]及Ti-Nb-Ta[8]等三元系及Ti-Nb-Ta-Zr[7]等四元系合金。这些合金中都含有Nb、Mo及Ta等相稳定元素。虽然这些元素无毒性,但由于它们稳定相的作用不强,因此加入量大,而它们的熔点都很高,如Mo的熔点高达2620 ℃,这势必造成熔炼的困难,形成的组织易产生偏析,影响力学和耐腐蚀性能。另外,Nb、Mo及Ta等元素都属于贵重的稀有元素。因此,以廉价的强相稳定元素Fe、Mn等完全或一部分代替Nb、Mo及Ta等元素形成的型钛合金具有很大的研究、开发价值。近年来,研究的这类合金主要为Ti-Fe[9]、Ti-Mn-Fe[1]、Ti-Sn-Cr[1]、Ti-Mo-Fe[10]和Ti-Mn[11]等。
Mn是强相稳定元素,且其对相具有较大的固溶强化效应[12]。作为世界卫生组织确认的14种人体必需的微量元素之一,微量Mn对维持人体正常的新陈代谢具有重要作用。最近,SANTOS等[11]对医用Ti-Mn合金的浸渍和细胞活性试验表明,当(Mn)≤13%时,Ti-Mn合金具有优良的细胞存活率,与CP-Ti的相当。目前,Mn元素加入二元Ti-Mo合金的研究并未见有报道。本文作者在低钼Ti-8Mo合金的基础上,研究Mn对Ti-Mo合金显微组织与力学性能的影响,以期开发性能优良的型Ti-Mo-Mn三元及含Mn多元生物医用Ti合金。
1 实验
所设计的母合金为Ti-8Mo-Mn(简称为TMM)(=0、1、3、5及7(质量分数,%),分别简称为M0,M1、M3、M5和M7),采用Ti、Mo及Mn纯金属,在高纯氩气保护和Ti吸收条件下用非自耗真空电弧炉熔炼。合金的成分见表1(括号内数据是名义成分)。为使合金锭成分均匀,反复熔炼5遍以上。
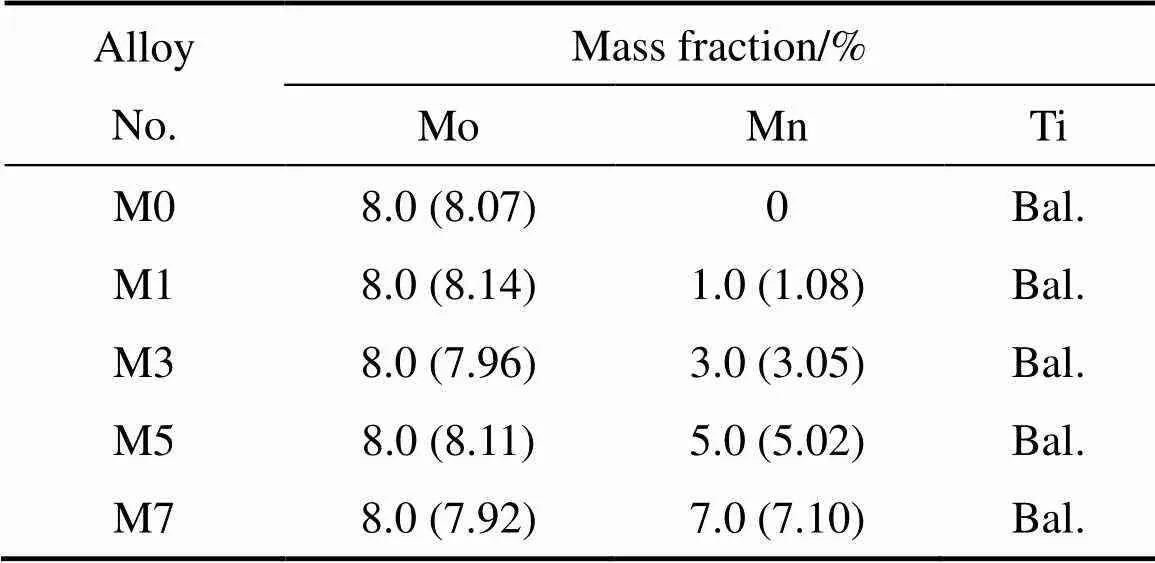
表1 试验合金的名义成分和实际成分
为获得相,将各合金成分的母合金锭进行固溶处理,首先将母合金锭加热到相区,然后在900 ℃固溶30 min,最后水淬,得到固溶处理后的合金锭。经打磨及线切割后得到XRD、金相及拉伸试样。试样经研磨、电解抛光和浸蚀处理,用金相显微镜观察显微组织,采用的腐蚀剂为氢氟酸、硝酸及水的混合溶液,体积比为(HF):(HNO3):(H2O)=4:8:88。合金的相结构采用D/max−2500X射线衍射仪(Cu K辐射)进行分析。用CMT 5105 电子万能试验机进行拉伸性能测试,得到合金的抗拉强度b、屈服强度s、伸长率、弹性模量等力学性能。拉伸试样尺寸如图1 所示,测试温度为室温,每种合金的试样重复测试4次。
2 结果与讨论
2.1 合金的相结构和显微组织
图2所示为固溶处理后不同含Mn量的TMM合金的XRD谱。由图2可以看出,Ti-8Mo两元合金主要由HCP马氏体″相组成,同时还有极少量的BCC相。这与ZHANG等[6]报道的结果相类似。所不同的是,Ti-8Mo合金全部由″相组成,这可能是由于不同的固溶温度和冷却速度所致。″相为斜方晶格马氏体,通过淬快冷析出。其它的两元Ti合金如Ti-Nb[4]、Ti-Fe[13]等当添加元素含量相对较低时也出现这种相。
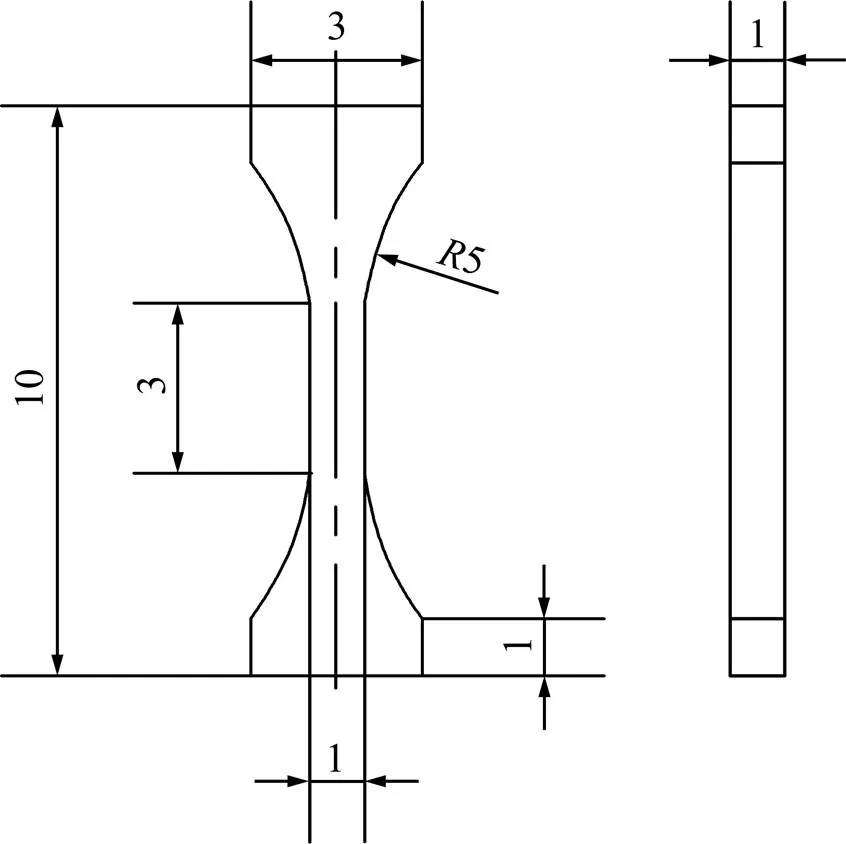
图1 拉伸试样示意图
Mn的加入对Ti-8Mo合金的相结构的影响是显著的。1%的Mn就使得大量的相保留到室温。加入3%的Mn可使整个合金变为体心立方晶的相。继续增加Mn量从5%到7%,仍为相,只是相的衍射峰向左偏移,这是Mn固溶于Ti基体的结果。Mn一直被认为是强相稳定元素。最近在一系列的Ti-Mn合金的研究中,SANTOS等[11]发现,对于Ti-Mn合金,当Mn量高于9.0%后,相会全部保留到室温。
值得注意的是,在M1合金中出现了极少量的具有六方晶格结构的亚稳相,这在图2的右上角的放大图中看得更清楚。这种现象在Ti-Mo-Fe三元合金中也出现过[10]。亚稳相从相中析出,并与之存在共格关系。→转变为无扩散型相变,极快的冷却速度也不能抑制其进行[12]。虽然相析出量很少,但对Ti合金的力学性能尤其是弹性模量影响很大,这在后面测试的力学性能中可清楚地看到。
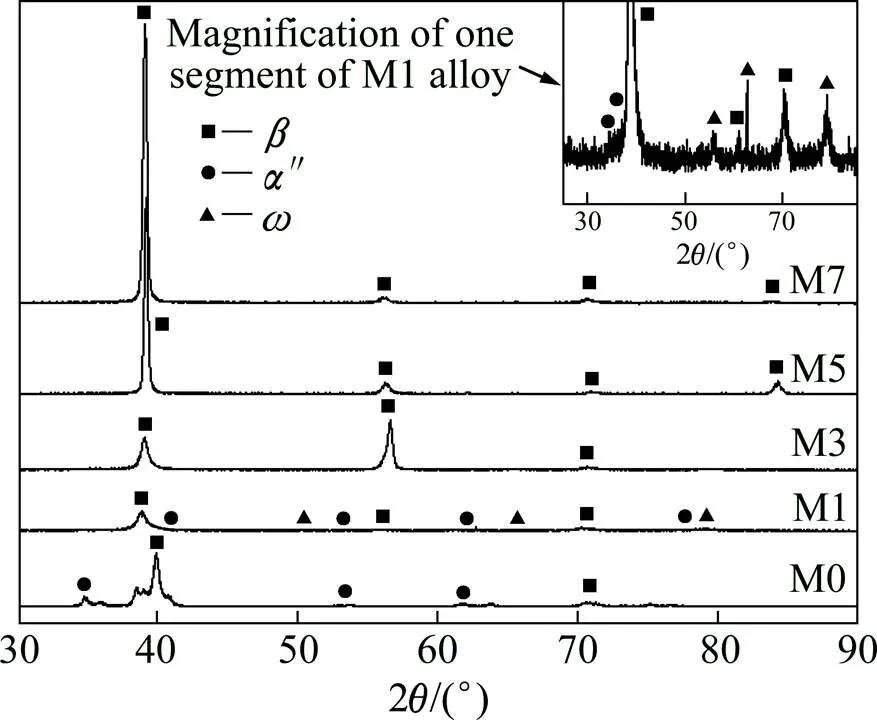
图2 不同含Mn量的TMM合金XRD谱
图3所示为TMM合金的光学显微组织。由图3可见,M0两元合金的组织主要为细小的针状马氏体(XRD鉴定为″相)(见图3(a))。加入1%的Mn使整个合金转变为等轴晶的相,晶界清晰可见。另外,还有少量针状的″相沿晶界析出(见图3(b))。继续增加Mn,″相消失,各合金全部由等轴晶的相组成(见图3(c)和(d))(M7金相组织图略)。
图4所示为TMM合金中相的晶格常数。由图4可见,随着Mn量的增加,相的晶格常数随之减小。这是由于Mn的原子半径(0.131 nm)比Ti的(0.147 nm)小得多,以Mn原子取代Ti原子形成置换固溶体,造成其晶格常数的减小。
2.2 合金的力学性能
图5和6所示分别为TMM合金室温下的拉伸应力−应变曲线和由此得到的含Mn量与屈服强度s、抗拉强度b及伸长率的关系曲线。由图5可见,所有合金的拉伸曲线都经历弹变−屈服−塑变−断裂的过程,所不同的是,M1合金出现了“双屈服”(Double yielding)现象。在841 MPa首先屈服,然后在964 MPa发生第二次屈服。由图6可见,加入1%的Mn,合金的s、b及值都有所提高。Mn量增加到3%,s、b有所下降,值继续增加,达到53%;之后,随着Mn量的进一步增加,强度值大幅增加。含Mn量达到7%后,s和b值达到最大,分别为1182 和1201 MPa。而合金的值不断下降,由Mn量3%的53%下降到Mn量7%的22%。
上述力学性能结果与合金中相的种类、数量及大小密切相关。据报道,在Ti合金中有两种相,即非热(Athermal)相和等温(Isothermal)相[14]。前者通常从高温相区冷却到室温的淬火过程中形成,为无扩散转变,而后期则是在固溶后通过其后的时效处理而析出,为扩散转变。已有证据充分表明,Ti合金的脆性与非热相的数量、大小密切相关[15]。当相的数量多、晶粒相对大时,会导致Ti合金的韧性急剧降低,如Ti-7.5Mo-1Fe合金[10],而当相的数量较少且为极其细小的颗粒时,并不降低合金的韧性,如非轧制的Ti-10Mo合金[15]。综合以上XRD谱(见图2)、金相组织(见图3)及应力−应变拉伸(见图5和6)结果,可以认为,M1合金中的相数量有限且晶粒尺寸很小,并不会对合金的韧性造成损伤。相反,该合金与未添加Mn的两元M0合金相比,强度和塑性都得到提高。M1合金良好的塑性在于除含有极少量的相外,主要由相组成。相为体心立方结构,比两元M0合金中的斜方马氏体″相的塑性变形能力更强[16]。M3强度的下降与相的消失有关。M5和M7的高强度是由Mn元素的固溶强化效应引起的。

图3 不同含Mn量TMM合金的光学显微组织
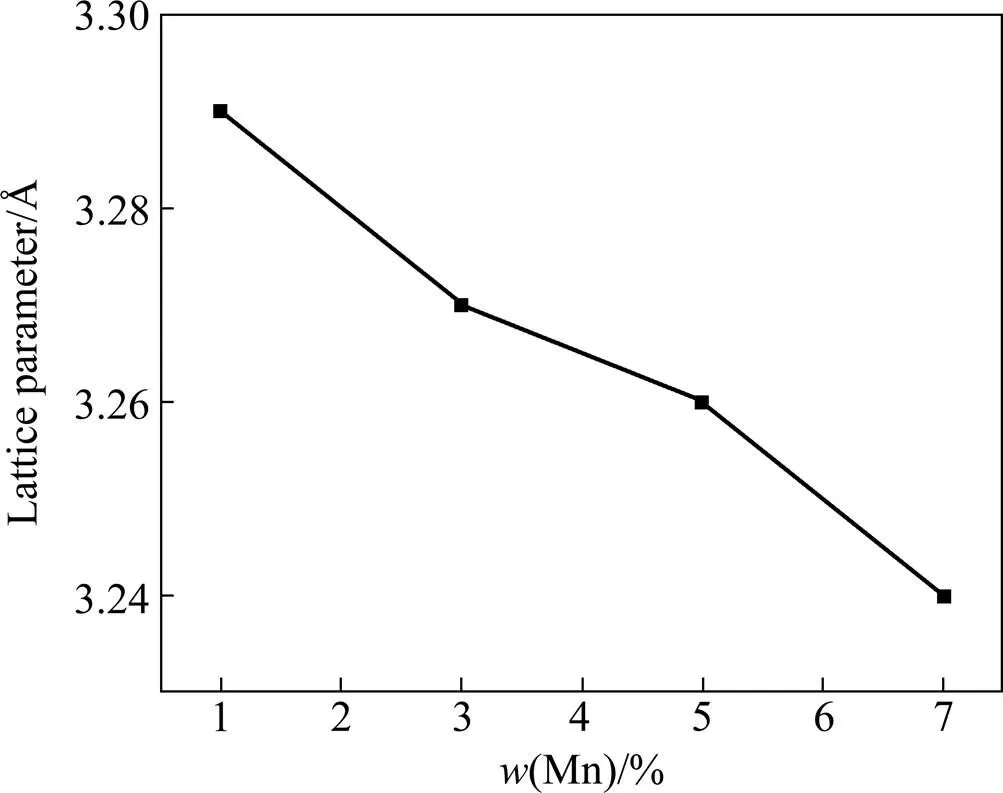
图4 β相的晶格常数与含Mn量的关系
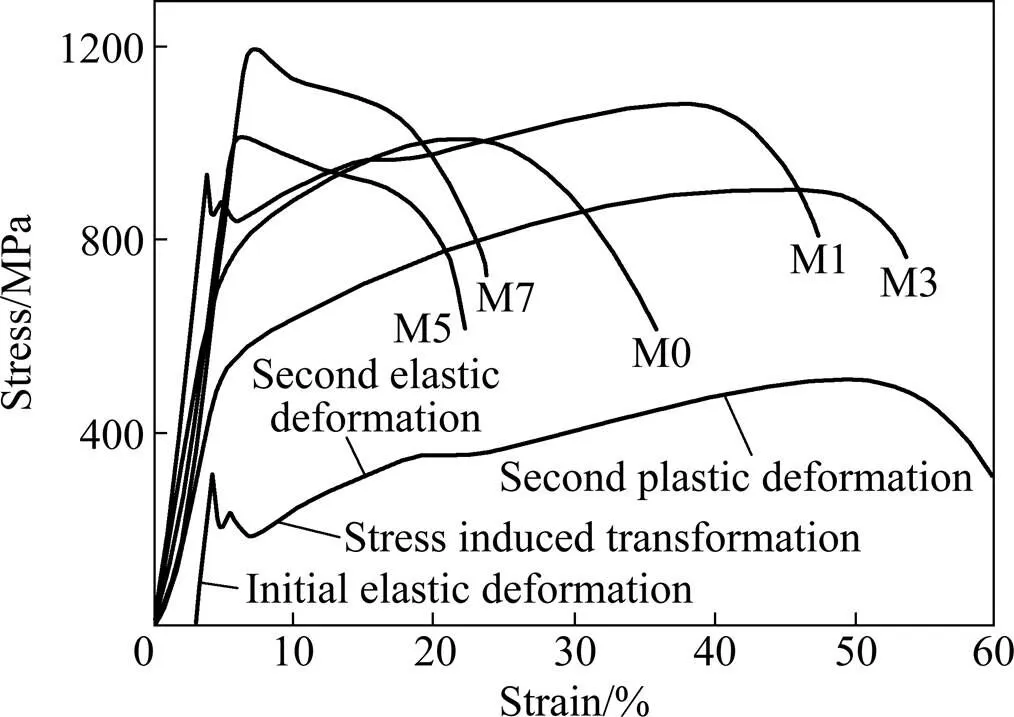
图5 TMM合金的应力−应变曲线
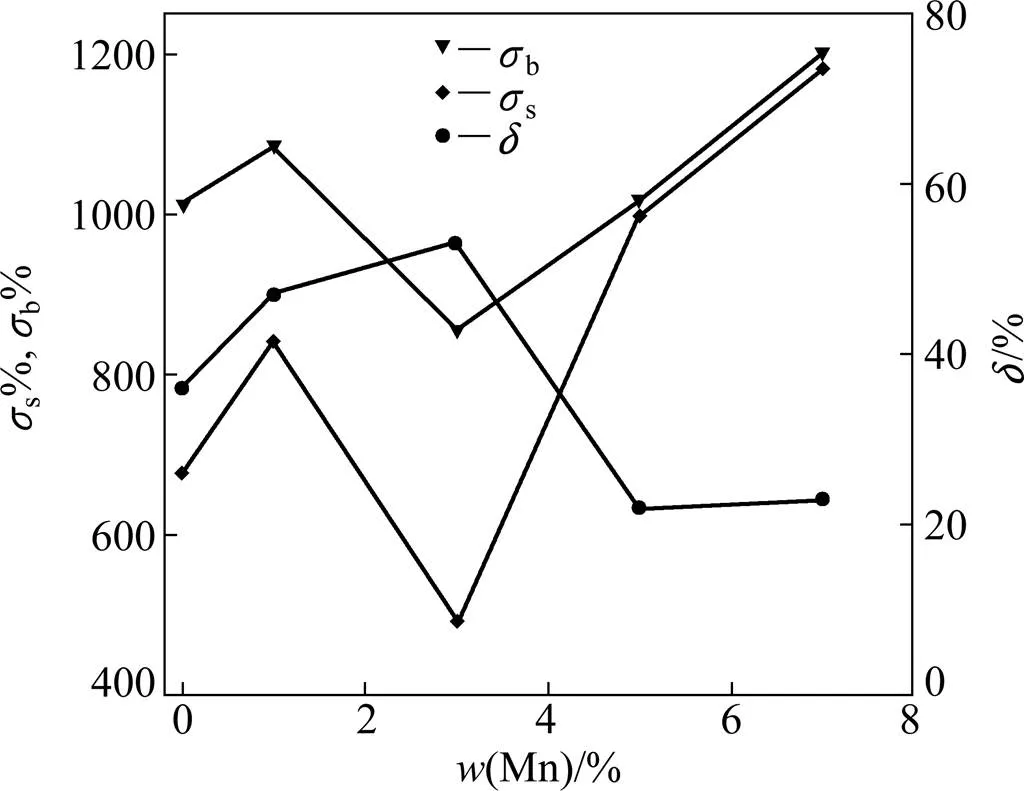
图6 拉伸性能与含Mn量的关系曲线
M1合金产生的二次屈服现象与其不同的变形机理有关。含相Ti合金的变形机理主要为位错滑移、应力诱导的马氏体转变(SIMT)及它们的组合[16−18],取决于相的稳定性。当相中所含稳定元素少、Ms点接近室温,相不稳定时,合金受到应力作用,就会有部分相转变为″相。变形首先按应力诱导的马氏体转变进行,然后位错滑移。当相中所含稳定元素多、Ms点处于高温,相稳定,SIMT不易发生,变形按位错滑移进行。Ti合金的轧制或拉伸等受应力作用时变形就可能以SIMT方式进行。TAVARES等[19]对Ti-35Nb-0.35Si合金拉伸后的断口附近做X衍射,观察到在拉伸前所没有的″衍射峰,证明了亚稳的相在拉伸过程中经历了拉伸应力所导致的″马氏体转变。对于本研究的M1合金,由于所含相稳定元素(Mn)含量低,相不稳定,拉伸时,首先通过SIMT变形方式产生第一次屈服,之后产生快速、短暂的加工硬化,这增大了″ 相形成的难度,继而以位错滑移方式产生第二次屈服,然后以这种方式塑性变形,直至断裂。其它的含Mn合金,由于Mn含量高,相稳定,塑性变形只能以位错滑移方式进行。
图7所示为TMM合金的显微硬度、弹性模量和Mn含量的关系。由图7可看出,显微硬度和弹性模量具有相同的变化趋势。Ti-8Mo两元合金的硬度值最低,仅为251HV。加入1%的Mn后,硬度值骤升到386HV,提高65%。当Mn加入量增加到3%后,硬度值减小到348HV;之后,随着Mn的增加,硬度值略有增加,M1的弹性模量最高,为150 GPa;M3的最低,为76 GPa;M5、M7的与M0的相当,其值在80~90 GPa之间。
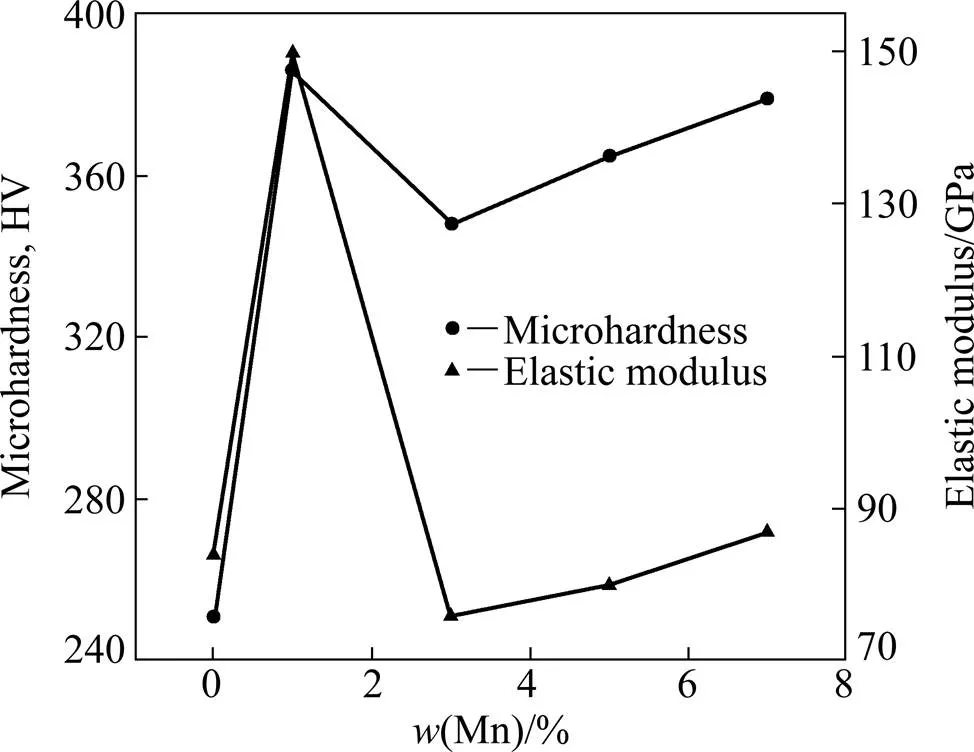
图7 TMM合金的显微硬度、弹性模量和Mn含量的关系
注意到,Ti-8Mo-1Mn合金的硬度值最大,增幅也最高。这也与该合金中含有的相有关。是硬而脆的相。研究表明,在Ti合金中所有的相(、′、″、及相)中,相的硬度最高[5],这使得含相的M1合金的硬度值达到最大。由于Mn元素的强烈稳定相的作用,在Mn加入量为3%时,相消失,硬度值下降。之后,硬度值略有提高是由于Mn元素对Ti基体的固溶强化作用。
众所周知,弹性模量是材料的本质性能,取决于原子间的结合力[17]。这种结合力与材料的晶体结构和原子间距有关。许多研究表明,在Ti合金的各种相中,弹性模量的顺序由大到小依次为、′、″、,相的最高,的最低[18, 20−22]。只有M1合金中含有相,故该合金高的弹性模量主要是淬火中析出的相造成的。其次,相的析出导致了Mn和Mo元素在相中的富集,使得其Ms点下降,弹性模量增大[23]。再次,M1高的值还与Mn固溶于Ti中的效应有关。由图4可知,Mn原子加入到Ti基体中减小了晶格常数和单位晶胞体积,单位晶胞体积越小,原子间的结合力就越强,值就越大[24]。当含Mn量增加到3%时,相消失,同时Mn和Mo元素在相中的富集现象也消失,虽然Mn量增加,Mn的固溶效应增加,但比相对弹性模量的影响要小得多,故仅剩相的M3合金的弹性模量大幅降低。之后,随着Mn量的增加,Mn的固溶效应增加,原子间结合力增大,M5和M7合金的E值略为增大。由此可以看出,在Ti合金中,晶体结构对弹性模量的影响比原子间距的大得多,尤其是相的影响最大,相急剧增加弹性模量值。因此,要获得低弹性模量的生物医用Ti合金必须控制相的形成。
如前所述,金属生物材料具有的低的弹性模量可以为骨愈合和重构提供更有利的条件。弹性许用应变值,即屈服强度与弹性模量的比值()是衡量金属材料是否适用于骨科及整形外科等生物医用领域的一个十分有用的参数[24]。值越高,材料越适用于生物医用领域。TMM和常用的金属生物医用材料的s、和值如表2所示。由表2可看出,与传统的生物医用金属材料CP-Ti[25]和316 L[25](不锈钢)相比,所有的TMM合金的s和值都高,除M1合金外,值更低。与T64(Ti-6Al-4V)[25]及Ti-15Mo合金[6]相比,这些合金同样值低,其中M5和M7合金的值更高。这两种合金的值甚至比目前生物医用型或亚稳型钛合金中具有优良生物相容性和力学性能的TNTZ (Ti-29Nb-13Ta-5Zr)合金[7]的值都高,前者分别为12.5×10−3和13.4×10−3,后者为10.8×10−3。因此,从力学相容性角度,TMM合金比传统的生物医用金属材料更适合用于骨科及整形外科等生物医用领域。
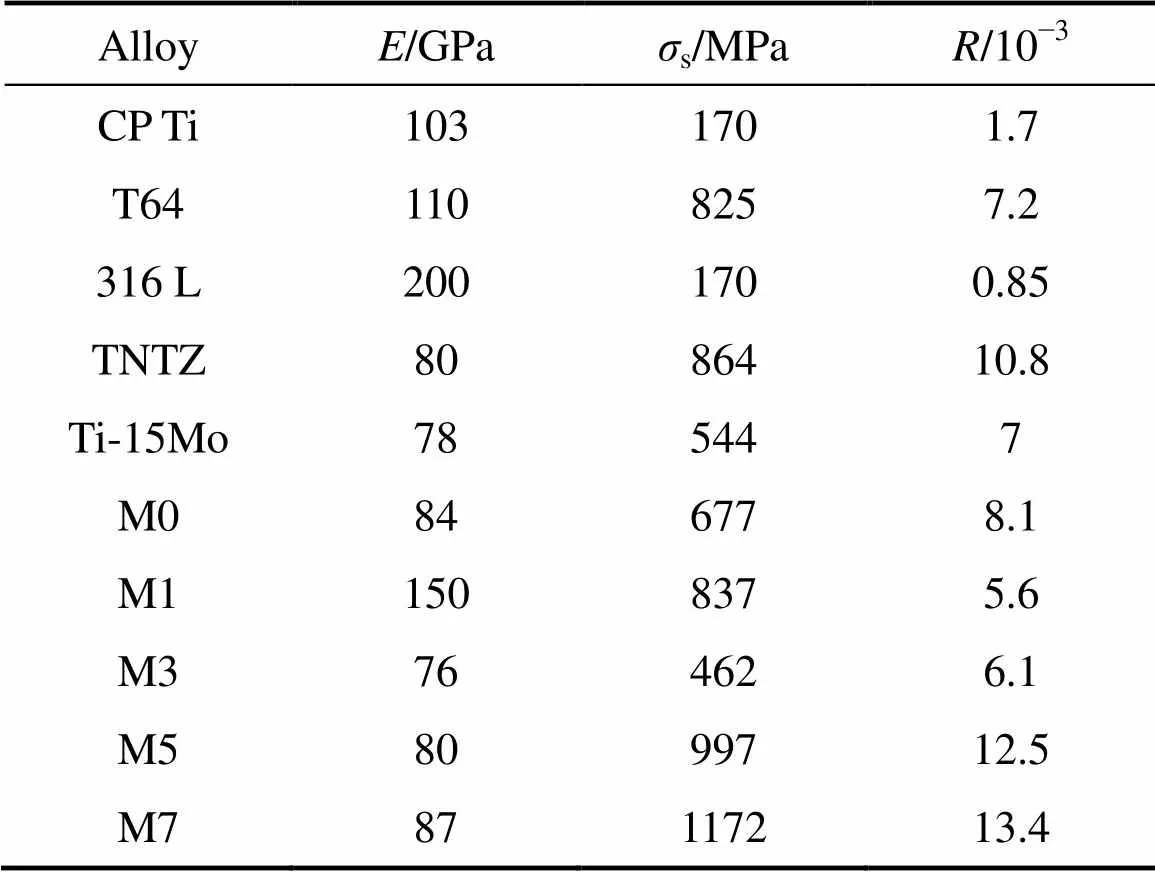
表2 TMM合金的E、σs和R值
3 结论
1) 两元Ti-Mo合金主要由细小的针状″马氏体相组成。加入强相稳定元素Mn后,抑制了淬火中″相的析出,1%Mn使得等轴晶的相绝大部分被保留,但仍有少量″析出,并出现少量相。当Mn的加入量达到3%后,相全部被保留到室温。
2)相不稳定的M1合金在拉伸过程中发生应力诱导的从相到″相的马氏体转变,呈现出“双屈服”现象,Mn量提高后消失,转变为单一屈服。
3) 加入少量Mn(1%、3%)提高合金塑性,伸长率由35%最大提高到53%。Mn量提高到5%、7%后,合金强度得到提高,抗拉强度由854 MPa提高到1201 MPa,同时具有22%的伸长率。所有含Mn合金的显微硬度很高,最高为386HV,是两元Ti-Mo合金的1.65倍。含相的M1合金的弹性模量最高,达150 GPa。其它含Mn合金的弹性模量值在76~87 GPa之间,与人骨骼的接近。
4) Mn含量为5%和7%合金的值(屈服强度与弹性模量的比值)比现广泛使用的医用合金钛CP-Ti和Ti-6Al-4V高得多,最能满足金属生物材料力学相容性的要求。另外,Ti-Mo-Mn系列合金还具有熔点低、易熔炼、不易产生偏析,成本低等优点。
[1] NIINOMI M, NAKAI M, HIEDA J. Development of new metallic alloys for biomedical applications[J]. Acta Biomaterialia, 2012, 8(11): 3888−3903.
[2] 刘恩雪, 王 清, 马仁涛, 查钱锋, 冀春俊, 董 闯. 低Nb含量Ti-Mo-Nb-Zr-Sn BCC低弹性模量固溶体合金的成分设计[J].中国有色金属学报, 2012, 22(12): 3378−3385.LIU En-xue, WANG Qing, MA Ren-tao, CHA Qian-feng, JI Chun-jun, DONG Chuang. Composition design of BCC Ti-Mo-Nb-Zr-Sn solid solution alloy with low content Nb and modulus of elasticity[J]. The Chinese Journal of Nonferrous Metals, 2012, 22(12): 3378−3385.
[3] ZHOU Y L, NIINOMI M, AKAHORI T. Effects of Ta content on Young's modulus and tensile properties of binary Ti-Ta alloys for biomedical applications[J]. Materials Science and Engineering A, 2004, 371(1/2): 283−290.
[4] GUO S, ZHANG J S, CHENG X N. A metastable-type Ti-Nb binary alloy with low modulus and high strength[J]. Journal of Alloys and Compounds, 2015, 644(25): 411−415.
[5] HO W F, JU C P, CHERN LIN J H. Structure and properties of cast binary Ti-Mo alloys[J]. Biomaterials,1999, 20(7): 2115−2122.
[6] ZHANG L B, WANG K Z, XU L J, XIAO S L, CHEN Y Y. Effect of Nb addition on microstructure, mechanical properties and castability of-type Ti-Mo alloys[J]. Transactions of Nonferrous Metals Society of China, 2015, 25(7): 2214−2220.
[7] ZHOU Y, LI Y X, YANG X J. Influence of Zr content on phase transformation, microstructure and mechanical properties of Ti75-Nb25Zr(=0−6) alloys[J]. Journal of Alloys and Compounds, 2009, 486(1/2): 628−632.
[8] 王国辉, 孙 威, 赵 颉, 陈 斌, 胡常青. Ti-25Nb-25Ta合金剪切带形成与结构特征的电子显微研究[J]. 电子显微学报, 2014, 33(5): 399−405.WANG Guo-hui, SUN Wei, ZHAO Jie, CHEN Bin, HU Chang-qing. Electron microscopic study on the formation of shear bands and structural characteristics of Ti-25Nb-25Ta alloy[J]. Journal of Electron Microscopy, 2014, 33(5): 399−405.
[9] 孟庆宇, 路 新, 徐 伟, 支玲玲, 陈 骏, 曲选辉. 粉末冶金Ti-Fe合金的显微组织及力学性能[J].材料热处理学报, 2016, 37(8): 36−40.MENG Qing-yu, LU Xin, XU Wei, ZHI Ling-ling, CHEN Jun, QU Xuan-hui. Microstructure and mechanical properties of powder metallurgy Ti-Fe alloy[J]. Journal of Heat Treatment of Materials, 2016, 37(8): 36−40.
[10] LIN D J, LI CHERNN J H, JU C P. Structure and properties of Ti-7.5Mo-Fe alloys[J]. Biomaterials,2002, 23(8): 1723−1730.
[11] SANTOS P F, NIINOMI M, CHO K. Microstructures, mechanical properties and cytotoxicity of low cost beta Ti-Mn alloys for biomedical applications[J]. Acta Biomaterialia, 2015, 26(15): 366−376.
[12] 张 翥, 王群骄, 莫 畏. 钛的金属学和热处理[M]. 北京:冶金工业出版社, 2014: 16−74.ZHANG Zhu, WANG Qun-jiao, MO Wei. Metallography and heat treatment of titanium[M]. Beijing: Metallurgical Industry Press, 2014: 16−74.
[13] HAGHIGHI S E,LU H B,JIAN G Y,CAO G H,HABIBI D. Effect of″ martensite on the microstructure and mechanical properties of beta-type Ti-Fe-Ta alloys[J]. Materials and Design, 2015, 76(5): 47−54.
[14] CARDOSO F F, FERRANDINI P L, LOPES E S N. Ti–Mo alloys employed as biomaterials: Effects of composition and aging heat treatment on microstructure and mechanical behavior[J]. Journal of Mechanical Behavior of Biomedical Materials, 2014, 32(4): 31−38.
[15] ZHOU Y L, LUO D M. Microstructures and mechanical properties of Ti-Mo alloys cold-rolled and heat treated[J]. Materials Characterization, 2011, 62(10): 931−937.
[16] WILLIAMS J C, FONTAINE D, PATON N E. Thephase as an unusual shear transformation[J]. Metallurgical Materials Transactions B, 1973, 4(10): 2701−2708.
[17] ZHANG D C, YANG S, WEI M, MAO Y F, TAN C G, LIN J G. Effect of Sn addition on the microstructure and superelasticity in Ti-Nb-Mo-Sn alloys[J]. Journal of Mechanical Behavior of Biomedical Materials, 2012, 13(13): 156−165.
[18] DING D, ZHANG D C, LUO Z C, TAN C G, ZHANG Y, LIN J G.Effects of Si addition on mechanical properties and superelasticity of Ti-7.5Nb-4Mo-2Sn shape memory alloy[J]. Materials and Design, 2014, 61(9): 146−149.
[19] TAVARES A M G, RAMOS W S, BLAS J C G. Influence of Si addition on the microstructure and mechanical properties of Ti–35Nb alloy for applications in orthopedic implants[J]. Journal of Mechanical Behavior of Biomedical Materials, 2015, 51(11): 74−87.
[20] SOUZA S A, MANICARDI R B, FERRANDINI P L. Effect of the addition of Ta on microstructure and properties of Ti-Nb alloys[J]. Journal of Alloys and Compounds, 2010, 504(2): 330−340.
[21] ZHOU Y L, NIINOMI M, AKAHORI T. Decomposition of martensite″ during aging treatments and resulting mechanical properties of Ti-Ta alloys[J]. Materials Science and Engineering A, 2004, 384(1/2): 92−101.
[22] FAN Z. On the Young’s moduli of Ti-6Al-4V alloys[J]. Scripta Metallurgica et Materialia, 1993, 29(11): 1427−1432.
[23] KIM H Y, HASHIMOTO S, KIM J I. Effect of Ta addition on shape memory behavior of Ti-22Nb alloy[J]. Materials Science and Engineering A, 2006, 417(1/2): 120−128.
[24] SONG Y, XU D S, YANG R, LI D, WU W T, GUO Z X. Theoretical study of the effects of alloying elements on the strength and modulus of-type bio-titanium alloys[J]. Materials Science and Engineering A, 1999, 260(1/2): 269-276.
[25] NIINOMI M. Mechanical properties of biomedical titanium alloys[J]. Materials Science and Engineering A, 1998, 243(1/2): 231−236.
(编辑 李艳红)
Effect of manganese addition on microstructure and mechanical properties of Ti-Mo Biomedical alloys
WU Xiao-feng, YANG Hui-qi, WANG Chun-yu
(School ofMaterials Science and Engineering, Liaoning University of Technology, Jinzhou 121001, China)
A series of Ti-8Mo-Mn alloys were fabricatedby nonconsumable electrode vacuum arc furnace, the effect of Mn addition on the structure and mechanical properties of the alloy was investigated. The results indicate that″ phase-dominated binary Ti-Mo alloy exhibits a fine, acicular martensitic structure. When 1% Mn (mass fraction) is added, most of equiaxedphase structure is retained. With Mn content increasing to 3% (mass fraction), entirephase is retained. Mn alloy with instabilityphase exhibits the two-stage yielding from stress-strain curves due to the stress-induced martensite transformation fromto″ during tensile deformation. Addition of a small amount of Mn (1% and 3 %) improves the plasticity of alloys, and the elongation increases from 35% to 53%. With Mn content increasing to 5% and 7% (mass fraction), the strength dramatically improves and tensile strength increases from 854 MPa to 1201 MPa, companied with 22% elongation. All the alloys with Mn exhibits the high microhardness, the highest is 386HV,which is 1.65 times than that of binary Ti-Mo alloy. The elastic modulus of Ti-8Mo-1Mn alloy withphase is the highest of all alloys 150 GPa. The elastic modulus of the other alloys with Mn are about 76~87 GPa, close to those of human skeletons. These alloys seem to have a great potential for use as an implant material.
Ti-Mo alloy; manganese; microstructure; mechanical property; biomaterial
Project (51104016) supported by Natural Science Foundation of China; Project (SKL-SPM-201204) supported by State Key Laboratory of New Technology for Comprehensive Utilization of Rare and Precious Metals, China
2016-07-21; Accepted date: 2016-12-26
WU Xiao-feng; Tel: +86-416-4199650; E-mail:hgd901@126.com
10.19476/j.ysxb.1004.0609.2017.09.19
1004-0609(2017)-09-1902-07
TG146.2;TG113.1;TG113.2
A
国家自然科学基金资助项目(51104016);稀贵金属综合利用新技术国家重点实验室开放课题资助(SKL-SPM-201204)
2016-07-21;
2016-12-26
武晓峰,教授,博士;电话:0416-4199650;E-mail:hgd901@126.com
