从医疗器械分类角度探究国内监管能力
2017-11-06王越许慧雯兰禹葶张春青母瑞红李静莉中国食品药品检定研究院北京100050
王越 许慧雯 兰禹葶 张春青 母瑞红 李静莉 中国食品药品检定研究院 (北京 100050)
◎ 专题·监管评价
从医疗器械分类角度探究国内监管能力
王越 许慧雯 兰禹葶 张春青*母瑞红 李静莉*中国食品药品检定研究院 (北京 100050)
通过统计分析国内近两年医疗器械产品分类情况,探讨目前分类工作的主要特点和存在的问题,并结合当前我国医疗器械分类管理改革的要求,提出完善医疗器械分类管理工作的对策和建议,为提高分类工作质量和效率提供参考。
医疗器械 分类 属性界定 监管
随着人们健康意识的逐渐增强,公众对医疗器械的使用需求也日益增高。医疗器械潜在的使用风险,一直来也是监管部门工作的重中之重。按照国务院推进医疗器械审评审批制度改革的原则要求,进一步提高和完善我国现有的医疗器械监管水平和管理模式是当前的首要任务之一。分类管理作为医疗器械监管工作的基础,直接关系着医疗器械研制、生产、流通和使用各环节制度的建立,因此医疗器械管理类别划分的科学性和准确性至关重要[1]。
本文通过分析我国几年来医疗器械分类工作情况,有针对性的提出做好医疗器械分类管理工作的具体建议,希望对医疗器械分类人员全面了解分类工作要求,提高分类工作质量和效率提供参考。
1.我国医疗器械产品分类界定工作现状
1.1 信息化基础上的医疗器械分类工作模式
国家食品药品监督管理总局(以下简称“总局”)对医疗器械分类工作的工作部署和要求[2]。国家食品药品监督管理总局医疗器械标准管理中心(以下简称“标管中心”)于2013年建立了独立的门户网站,向社会提供分类进度查询及分类目录查询等公众查询和专业查询服务;与此同时,标管中心建成并启用了“医疗器械分类管理系统”,基本实现了企业填报申请、省局受理、标管中心受理、提出分类技术建议、告知企业和上报国家总局的信息化工作流程(图1)。分类申请的全过程均采用以电子化方式与纸版申请并存的方式开展。

图1. 分类界定工作程序
为了满足注册和监管工作的需求,“医疗器械分类管理系统”开通了“食药总局”和“国家技术审评中心”的登录端口。食药总局可通过登录端口,查看产品办理情况以及回复标管中心报送的产品技术建议[3]。国家医疗器械技术审评中心可以通过登录查看已提交申请的办理状态和办理意见,并可根据产品资料,早期介入,实时提出建议,为后续的技术审评工作顺利开展奠定基础。目前现行的医疗器械分类管理系统,基本保证了医疗器械分类管理工作的正常、有序开展。
1.2 医疗器械分类申请情况
截至2015年12月底,全国共有25个省(市)通过医疗器械分类管理系统开展医疗器械分类工作。据统计,2014年和2015年,境内产品分类申请数量分别为832件和1193件,整体是上升趋势。本文利用信息平台的数据,对国内分类工作情况进行讨论和分析。
1.2.1 分类申请的区域分布
按照总局对分类工作的要求,当省局依据分类目录、分类文件及分类规则,仍然不能判定产品类别时,可将初步技术建议提交至标管中心。基于此,通过统计发现,在2014年和2015年,境内申请上报率较高的地区均是国内医疗器械产业大省(见表1)。
1.2.2 区域内分类技术建议的一致性比对
解析各省递交的技术建议情况,梳理各省给出的产品技术建议和中心技术建议的一致性,对分析结论的一致性情况进行了统计,统计数据见表2。通过分析发现,2015年的一致性结论普遍高于2014年,可以说标管中心一直以来坚持的集中培训、实例讲解和网络远程培训等多样化培训形式,有效提升了分类技术水平。
1.2.3 区域内分类技术建议差异性比对

表1. 区域内分类整体情况
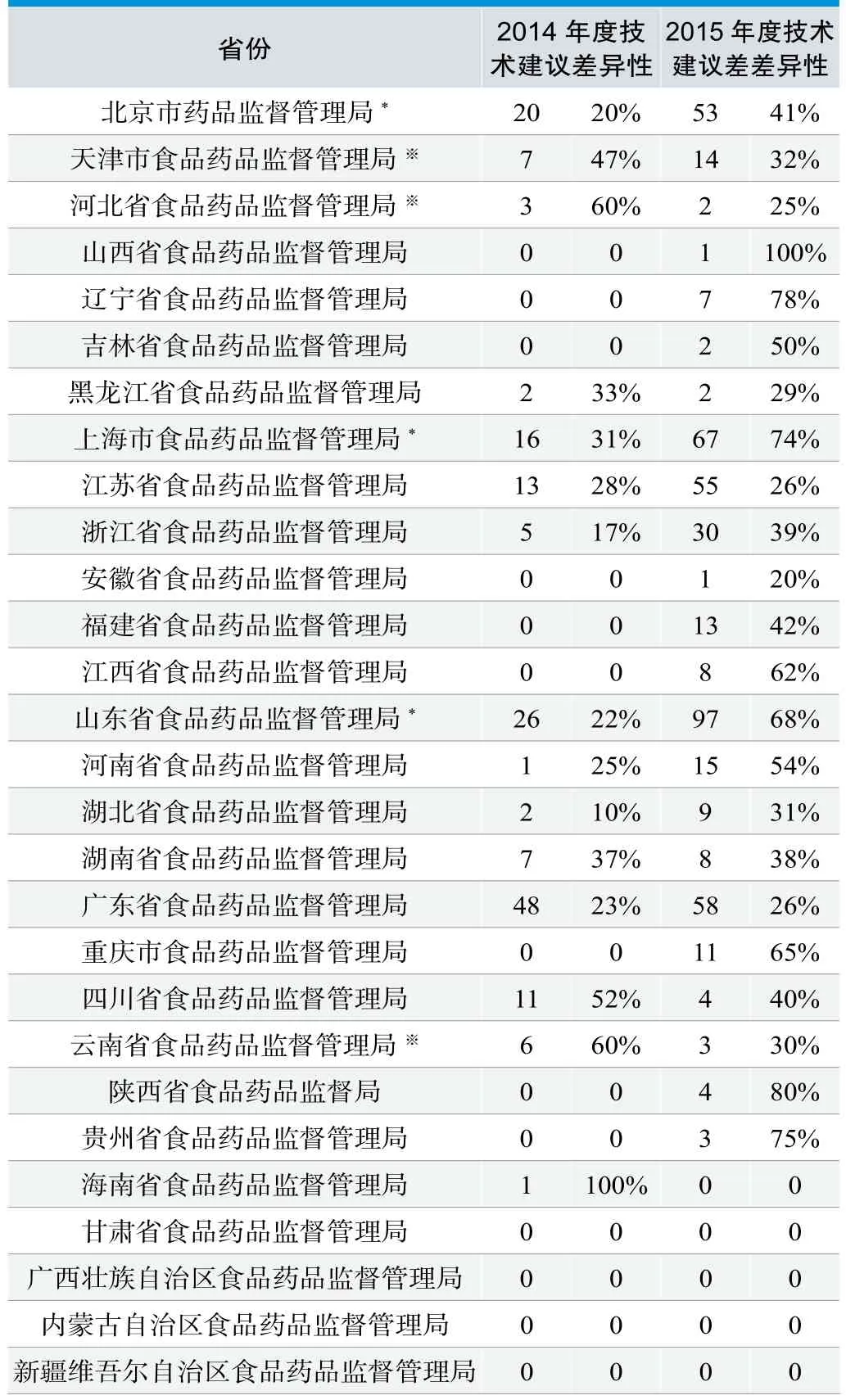
表3. 分类技术建议差异性比对
为了进一步剖析区域内的分类能力,详细比较了省局和标管中心技术建议为:“分类编码一致,但是管理类别不同”的情况。通过对比差异率,并结合上述各省提交总量情况,可以看出2015年在提交总数增加的情况下,各省对分类技术建议的差异性也呈现了递增趋势,详见表3。
2.问题及分析
通过上述数据的整理、分析和比较,我国医疗器械产品分类界定工作中还存在着如下问题:
2.1 规范性文件逐步完善,对分类技术支持不足
我国《医疗器械分类目录》修订工作正在进行,在新《分类目录》还未颁布实施之前,按照现行2002年《分类目录》进行类别划分。而现行《分类目录》仅包含了管理类别和品名举例,尚未涉及产品的预期目的、结构特征、使用形式、使用状态、接触人体情况等内容。加之我国开展医疗器械命名研究工作起步较晚,长期以来没有规范命名的统一原则,已上市医疗器械同名异物、同物异名的现象难以避免[4,5]。因此,容易导致对产品的理解不一致,从而出现同一产品在不同地区监管的强度不同,最终影响后续监管工作的一致性。
当然申请数量的增加,还有一个不可忽视的因素,就是在2014年5月30日,食药总局发布了《第一类医疗器械分类目录》(8号公告),政策的变化,必然会影响一定时期内产品申请数量的变化。
2.2 分类申请资料的质量有待提高
目前,我国的分类工作仍存在时间过长的问题,标管中心工作人员年受理337.5份/人。与此同时,申报企业对产品的风险点把握不准确,提供的资料普遍不能按照要求进行报送,导致分类申请均需要一次或多次补充资料,比如有些产品描述过于宽泛,常用采用具有宣传色彩的词语表达产品的功能,比如“本产品可获取生物体有关身、心、灵具体的健康或异常信息,并做出全方位的健康检测和调节,达到提升人体自愈的功能”,或对“产品组成”描述为:“本产品为一体机”等等诸如此类的问题,均已成为日常分类工作的限速环节。
3.对策及建议
3.1 推进医疗器械分类管理体系的建设
加快推进分类目录的修订工作,补充和完善产品的结构组成、使用方法、预期目的等产品信息,全面梳理产品注册信息,保证分类目录修订工作的可覆盖性。按照命名规则规范分类目录中的品名举例,根据分类目录框架建立配套使用的通用名称目录。探索并建立分类目录实时的动态维护机制。
3.2 完善信息平台,增进互动和交流
按照新的分类目录完善与注册数据动态对接程序,建立可开放使用的“分类目录数据库”,逐步建成以注册证数据库、分类目录数据库、命名管理数据库、标准管理数据库“四库一体”的网络信息化平台,形成相互支持,互为补充的强大数据支持系统。在此基础上,完善区域内的信息互动功能。使各区域内能及时、全面了解分类产品的各种动态信息,避免区域间因信息不对称造成的监管尺度不一致的问题。
3.3 加强人才培养,统一理解和认识
建立医疗器械分类管理能力的考核和评估体系,从分类申请数量、分类技术建议质量以及产品注册情况来全面评价其分类管理能力。通过分析考核结论,对其薄弱环节有针对性的开展培训工作,统一对分类工作的理解和认识,统一分类尺度,加强分类管理专业队伍建设。
3.4 开展医疗器械分类管理体系的研究工作
医疗器械分类管理是医疗器械审评审批体系中的重要组成分,然而,我国的分类工作起步较晚,2000年才有了第一版的《分类规则》,2014年,新版《医疗器械监督管理条例》(650号令)[6]发布,为了配合新版《医疗器械监督管理条例》的实施,食药总局在短短2年内,密集性的修订并发布了8个规章制度和7个规范性文件。比如,2014年发布的《第一类医疗器械目录》和2015年发布的新《分类规则》。在如此大规模的改革背景下,现行的医疗器械管理模式难免会出现一些不良反应,加之我国医疗器械分类管理研究工作本来就相对滞后,因此,建议深入开展医疗器械分类管理体系的研究,早日实现分类工作的规范化管理体系[7]。
4.结语
随着我国医疗器械市场的增长,医疗器械产品的分类作为医疗器械监管中重要的基础性工作将越来越重要。因此,我们以正在开展和深化的医疗器械分类管理改革工作为契机,完善动态分级管理制度,如此才能科学合理、准确的判定产品类别,为科学监管、公众用械安全及促进我国医疗器械产业的健康发展提供参考依据和制度保障。
[1] 王越,杨晓芳.我国医疗器械分类界定工作现状与思考[J].医疗装备,2014,27(8):4-6.
[2] 国家食品药品监督管理总局.进一步规范医疗器械分类界定有关工作的通知[R].2013-03-26.http://www.sda.gov.cn/WS01/CL0845/79616.html.
[3] 母瑞红,王越,郭世富,等.浅析医疗器械分类界定工作中应注意的几个问题[J].中国医疗器械杂志,2013,37(6):451-453.
[4] 郭世富,黄颖,母瑞红,等.我国医疗器械分类监管改革的现状及思考[J].中国医疗器械杂志,2016,40(5):355-358.
[5] 杨婉娟,郑建,李军,等.全球医疗器械术语系统(GMDN) 适用性研究初探[J].中国医疗器械杂志,2015,39(5):349-352.
[6] 中华人民共和国国务院,国务院令第650 号《医疗器械监督管理条例》[R].2014-06-01.http://www.sda.gov.cn/WS01/CL0784/97814.html.
[7] 李建玲.医疗器械的监管对策与建议[J].中国医疗器械杂志,2011,26(9):73-76.
Exploring Regulation Capacity from the View of Classification of Medical Device in China
WANG Yue XU Hui-wen LAN Yu-ting ZHANG Chun-qing*MU Rui-hong LI Jing-li*Nation Institutes of Food and Drug Control (Beijing 100050)
The paper supplies an annalysis on the general situation of medical device regulatory classification in the last two years of China. The key features and problems of classification on medical device are iscussed, combined with requests of reform on medical device regulatory lassification, this paper puts forward some suggestions to improve the quality and efficiency on regulatory classification of medical device in China.
medical device, classification, attribute definition,supervision
1006-6586(2017)17-0001-03
TH77
A
2017-08-10
王越,第一作者;许慧雯共同第一作者;张春青、李静莉,通讯作者,工程师,执业中药师,主要从事医疗器械不良事件监测和安全研究工作。。
