单眼致盲后大鼠视觉通路锰增强磁共振成像的实验研究
2017-11-06肖泽彬唐作华冯晓源佶王吴灵捷钟玉凤王文韬
肖泽彬 王 容 唐作华 冯晓源 钱 雯 熊 佶王 杰 吴灵捷 钟玉凤 王文韬
实验研究
单眼致盲后大鼠视觉通路锰增强磁共振成像的实验研究
肖泽彬1王 容1唐作华1冯晓源2钱 雯1熊 佶3王 杰4吴灵捷5钟玉凤6王文韬7
目的:探讨单眼盲大鼠视觉通路锰增强磁共振成像(ME MRI)的形态学改变,并与病理结果相对照,探寻是否建立新的视觉代偿通路及视觉与听觉中枢是否有神经纤维联系。方法:14只健康新生雄性Sprague-Dawley(SD)大鼠随机分为双眼盲组(Group A)与正常组(Group B)(每组n=7),采用右眼视神经离断法使大鼠致盲,盲后4个月分别经两组大鼠的左侧玻璃体内注入0.2M MnCl2,24h后比较MEMRI表现,并与病理结果相对照,以帮助确定视觉代偿通路的产生。结果:MEMRI显示单眼盲大鼠左侧视觉通路代表结构(视神经、视束、外侧膝状体、上丘及视皮层)的对比度(CNR)明显高于右侧(P<0.001),而比正常大鼠的左眼的视觉通路信号稍差 (P<0.05)。 MEMRI表现与病理结果具有较好一致性。结论:新生大鼠单眼致盲4个月后,ME MRI改变结合病理结果,提示双侧视觉通路有功能重组。
MnCl2;磁共振成像;视觉通路;锰离子增强磁共振成像;单眼盲
目前,探究单眼视觉障碍患者视觉中枢各结构是否发生不可逆性改变已成为神经科学领域的热点问题,它关系到人工视觉和基因治疗的可行性及治疗靶点的选择[1]。尽管目前有关单眼视觉障碍引起视皮层等视觉中枢改变的研究报道较多,但以往多关注单眼视觉剥夺引起视觉中枢的改变。而关于单眼致盲后的视觉障碍,仍以视觉诱发电位(VEP)、辣根过氧化物酶(HRP)、免疫荧光造影剂及磁共振波谱(MRS)等研究方法为主[2-3]。锰增强磁共振成像(manganese-enhanced MRI,ME MRI)能客观、直接、完整地显示神经纤维和脑皮层形态[4],近年来已被广泛用于活体动物的视觉通路的成像研究。然而,利用ME MRI研究单眼致盲后双侧视觉通路改变至今鲜有文献报道。本文利用MEMRI来研究单眼盲大鼠双侧视路的ME MRI表现,并与病理结果相对照,进一步探寻单眼致盲后是否建立新的视觉代偿通路及视觉与听觉中枢是否有神经纤维联系。
方 法
1. 实验动物与分组
本动物实验通过研究生院医学伦理委员会批准,选取复旦大学实验动物科学部提供的14只健康雄性Sprague-Dawley(SD)新生大鼠(出生后约一周),平均体重250±30g。采用随机数字表法随机分为单眼盲组(Group A)和对照组(Group B)(每组n=7)。实验前禁水、禁食约12h。体温维持在38℃。大腿后上部肌群肌注氯胺酮和甲苯噻嗪混合液分别约0.1ml(视神经离断法)、0.3ml(玻璃体内给药)及0.4ml(MR检查),俯卧位分别固定于自制模板及大鼠专用磁共振线圈。
2. 模型制备
采用视神经离断法,先剪开右侧颞侧球结膜,钝性分离球筋膜组织直至清晰暴露球后视神经。缝线在眼球正上方偏鼻侧方的结膜,向鼻下方牵引,在其上方剪一切口,紧贴巩膜向后寻找视神经,离巩膜0.5mm处剪断视神经,并将断段取下,即可确定视神经完全离断,缝合结膜并予复位,结膜囊内涂托百士眼膏。
3. 左眼玻璃体内注射MnCl2过程
将已麻醉的单眼致盲4个月后的大鼠放在已消毒的铺巾上,先用盐酸奥布卡因表面麻醉,洁霉素滴眼液滴入眼内几滴,将一小段皮管(输液皮条管煎成)放在左眼角膜中央,使水面成凹面向上。调整显微镜后,即可显示视网膜、视乳头及其周围眼底血管,先用一次性1ml注射针经角巩膜缘外侧约1~2mm处进针,可以看到在视乳头上方,扎入玻璃体内(切忌深达视乳头和血管表面,以防眼底出血),注入0.2M MnCl22μl+0.5μl气泡(气泡在大鼠玻璃体内,使胶样状态的玻璃体变成透明状态,锰离子分子容易弥散开,从而使视网膜易于吸收锰离子),注射速度约为0.1μl/min,约15~20 min后,注射完留针5min,缓慢拔针。模型建立成功标致:给药后24h行大鼠磁共振常规平扫T1WI扫描,大鼠右侧上丘T1WI呈高信号,说明视觉通路模型建立成功,如未见高信号区,表示未成功。
4. 磁共振成像扫描技术
在 Siemens-Magnetom Verio 3.0T MR 扫 描仪上完成,梯度场45mT/m,最大切换率200T/m/s。信号采集线圈为大鼠专用线圈。肌注全麻,俯卧位放置于线圈内,头部位于线圈中央位置。薄布单覆盖保暖,胶带固定大鼠胸部以适当限制呼吸运动。扫描序列及主要参数:三平面定位扫描后,行全脑T1WI轴位、T1WI 3D FLASH(fast low angle shot,FLASH)矢状位扫描。主要扫描参数:T1WI采用自旋回波序列(spin echo,SE),TE/TR=13ms/400ms,FOV=78mm×78mm,层厚1.5mm,层间距0mm,矩阵256×256,激励次数2次,翻转角90°,扫描层数8层。T1WI 3D FLASH成 像, 采 用 GRE序 列,TE/TR=4.3ms/12ms,FOV=78mm×78mm, 层 厚 0.2mm, 矩 阵384×384,激励次数12次,翻转角25°,扫描层数112层。总扫描时间约40min。
5. 数据后处理
将所有数据全部传送至西门子磁共振后处理工作中,并重建双侧视觉通路全程的多平面重组图像、最大密度投影及薄层最大密度投影的图像。
6.图像分析
磁共振图像分析在西门子后处理工作中完成。两组大鼠经ME MRI检查后,分别测定各解剖结构的信号强度值(signal intensity,SI)。视觉通路信号强度通过在左侧视神经、右侧视束、右侧外侧膝状体、右侧上丘和右侧视皮层等不同解剖部位的中央区勾画感兴趣区(region of interest,ROI)获得,ROI大小约2~3mm2。通过磁共振自带软件分析,可直接测得ROI平均信号强度值及信号标准差值(standard deviation,SD)。通过下列公式定义参数CNR(contrast-to-noise ratio,CNR)=0.665(SMn-S0)/ SDair,其中SMn和S0分别表示注入MnCl2后强化的和正常大鼠未强化(同侧)的视神经、视束、外侧膝状体、上丘、视皮层等部位兴趣区内的SI值,SDair为空气中感兴趣区内的两次信号强度的SD平均值。
7. 病理学检查
ME MRI检查后的大鼠行多聚甲醛灌流并取脑固定。于10%中性甲醛固定液中两次固定约2天至1周,经轴位、冠状位、矢状位分别切取视神经、视束、外侧膝状体、视皮层的标本染色。经大脑半球视觉通路代表区的矢状位连续石蜡切片,厚度4μm,并行HE和快蓝(LFB)染色。视觉通路定位参照Georg Paxinos&Charles Watson所著大鼠脑立体定位图谱。显微镜下,观察双侧视觉通路的大体改变情况,包括整个通路及各个重要解剖结构的具体部位、形态、大小、范围、粗细、色泽等特点,并比较双侧是否对称。
8.统计学分析
应用SPSS 18.0统计软件,致盲侧与未致盲侧、致盲侧与正常大鼠视觉通路CNR差异采用单因素方差分析和post-hoc Bonferroni多重比较分析,P<0.05为差异有统计学意义。
结 果
单眼致盲后4个月,左眼注入0.2 M MnCl224h后,7例大鼠T1WI均显示右侧上丘信号增高,表明单眼致盲后4个月后ME MRI造模成功,造模成功率100%(7/7)。再行T1WI 3D FLASH扫描,经过三维重建后处理,TSMIP通过旋转均可立体观察到完整的视觉通路。
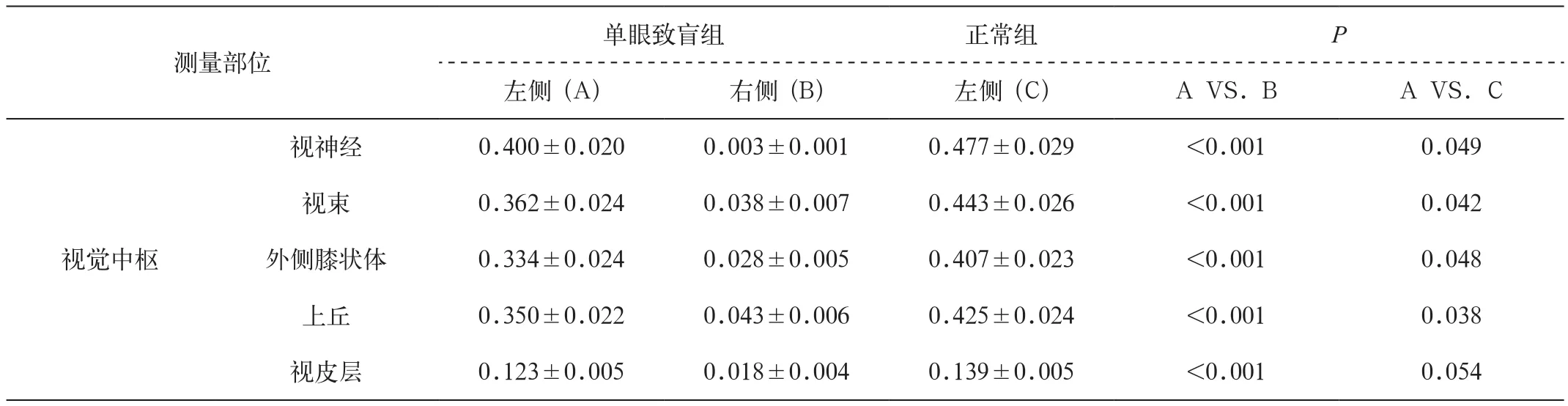
表1 右眼致盲后,左侧视觉通路分别与右侧及左侧正常视觉通路ME MEI对比度(CNR)比较
如表1所示,单眼致盲4个月后大鼠的致盲眼(右眼)与未盲眼(左眼)MEMRI显示的视觉通路信号有明显不同,左侧视觉通路各代表结构(包括视神经、视束、外侧膝状体、上丘及视皮层)的对比度(CNR)明显高于右侧,即信号明显较右侧更亮,且差异具有显著统计学意义(P<0.001)。未致盲眼与正常大鼠左眼ME MRI显示的视觉通路信号稍有不同,即左侧视觉通路各代表结构的信号较正常稍差,此差异亦有统计学意义(P<0.05)。此外,本组研究发现一只单眼盲大鼠双侧视皮层及下丘信号略增高。
正常组及单眼盲组大体观察显示,单眼盲组右侧视神经已断,断端后神经纤维紊乱或纠缠,似与周围纤维纠缠在一起,为本身纤维紊乱或异常反应增生所致。单眼盲组中有三只大鼠视束、外侧膝状体、上丘及视皮层萎缩变小。另外,单眼盲组左侧视神经及视交叉部分有扭曲增粗,外侧膝状体亦有增粗、扭曲,为注入 MnCl2 后引起水肿或代偿所致可能(图1)。
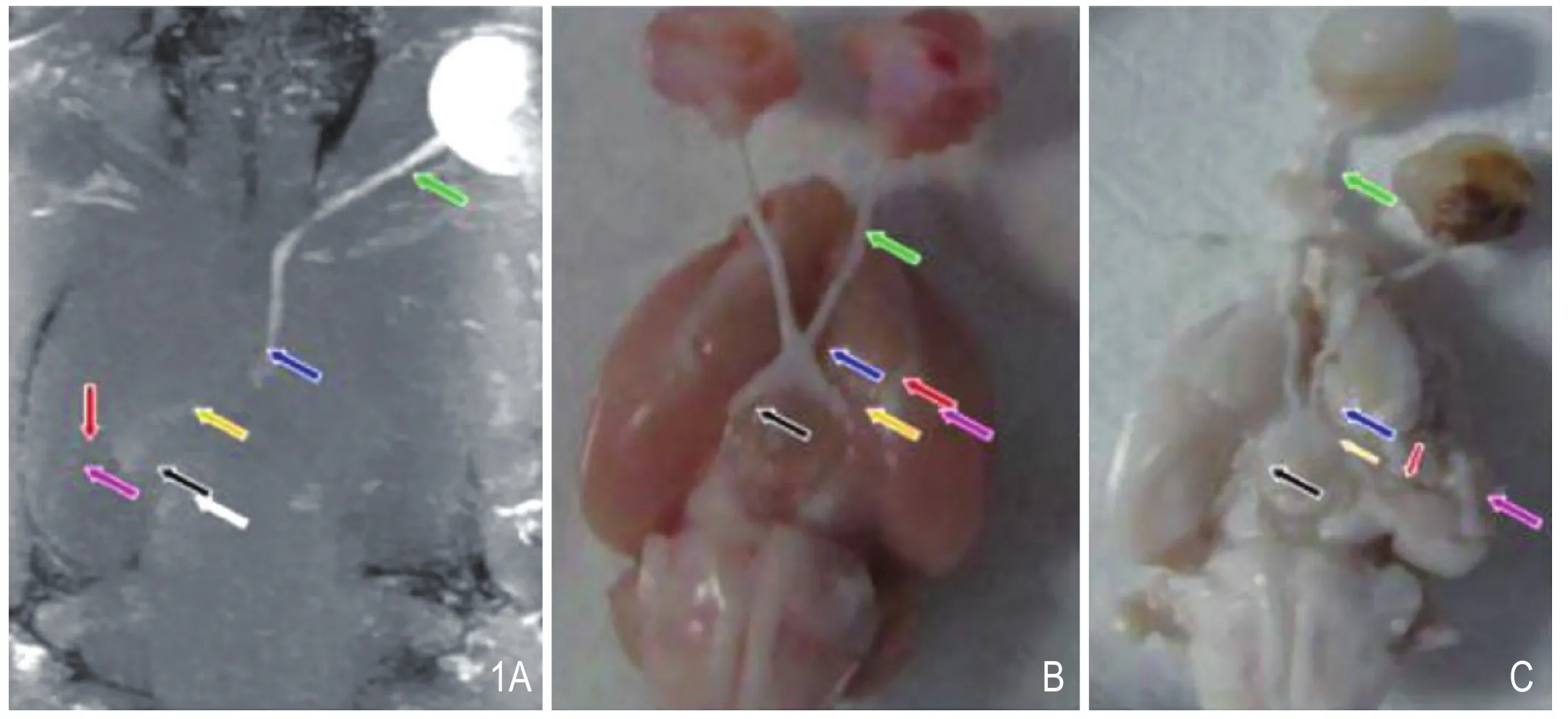
图1 左眼玻璃体内注入 0.2 M MnCl2。A.右眼致盲,左眼经ME MRI显示的视觉通路;B.正常大鼠经ME MRI显示双侧视觉通路的大体标本;C.右眼致盲,经ME MRI显示双侧视觉通路的大体标本。注:视神经(绿箭)、视交叉(蓝箭)、视束(黄箭)、LGN(黑箭)、上丘(白箭)、视放射(红箭)及视皮层(紫箭)。
视觉通路 HE 及 LFB 染色显示,与正常组相比,单眼盲组右侧视神经纤维已断,残余段萎缩变小并被肌肉替代,周围或伴有增生纤维缠结,并见长条状堆积排列的蓝色(HE染色)或紫色(LFB染色)细胞核为少枝突胶质细胞或星形细胞包裹神经纤维。单眼盲组中,有三只大鼠左侧视束、视交叉、外侧膝状体、上丘均较右侧变细。此外,所有大鼠双侧听皮层均大致对称,未见与视皮层、上丘或外侧膝状体有神经纤维联系(图2)。
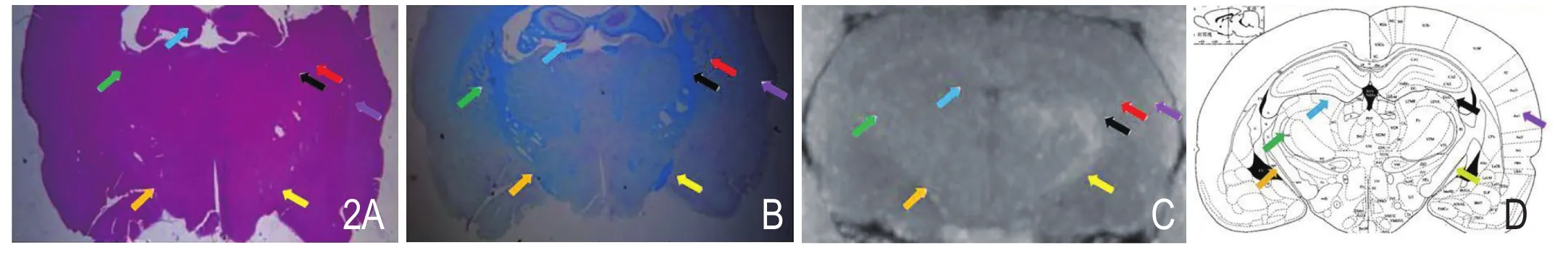
图2 A.双侧视束及 LGN 等 HE 染色;B.双侧视束及 LGN 等 LFB 染色;C.ME MRI 冠状位显示双侧视束及LGN等;D.大鼠双侧视束及 LGN 等冠状位定位图。注:右侧视束(黄箭)、右侧LGN(黑箭)、左侧视束(橙箭)、左侧LGN(绿箭)、视放射(红箭)、听皮层(浅绿箭)及海马(蓝箭),LGN: 外侧膝状体。
讨 论
1.锰增强磁共振成像在单眼盲视觉通路中的应用价值
随着人们对于生活质量要求的不断提高,对于青光眼等引起视神经功能完全丧失后的单眼失明患者而言,探究视觉中枢各结构是否发生不可逆性改变显得尤为重要,亦为未来眼科学领域炙手可热的发展趋势之一[5]。目前,采用ME MRI方法关于单眼致盲方面的研究仅见最近Chan等[6]一篇报道,但Chan等[6]未对单眼致盲后的双侧视束及视皮层等结构的改变情况进行研究,我们在以往研究的基础上,通过利用ME MRI分别比较单眼盲大鼠与正常大鼠的视觉通路的改变情况,且与病理检查相结合,以探讨单眼致盲后的外侧膝状体、上丘及视皮层等结构的变化,研究皮层水平的神经元是否发生了跨突触变性、萎缩或死亡,以便今后为盲人进行完整视觉通路的深入研究奠定基础,指导临床治疗和手术方案的选择。
2.单眼致盲后大鼠的双侧视觉中枢的ME MRI表现
ME MRI显示致盲眼(右眼)与未盲眼(左眼)的视觉通路信号有明显不同,左侧视神经、视束、外侧膝状体、上丘及视皮层的对比度(CNR)明显高于右侧,提示当单眼致盲后未致盲眼一侧的视觉通路有代偿可能,而致盲眼一侧的视路功能退化。同时,单眼致盲后的未致盲眼与正常大鼠的左眼的视觉通路信号稍有不同,前者的左侧视觉通路各代表结构的信号较正常稍差,提示未致盲眼一侧的视觉通路功能亦有所下降。另外,我们尚发现一只单眼盲大鼠双侧视皮层亦略增高,此结果与Toldi等[7]采用电生理方应的结果相一致,认为可能由于双侧视皮层通过胼胝体相互连接和作用而引起[8],虽然仅一只发现这一结果,但因与未致盲眼同侧的视皮层信号本身就较低,而致盲眼侧的信号更低,有时亦就难以观察到,可以通过增加样本量进行深入研究来证实。此外,有一只大鼠双侧下丘信号均稍有增高,我们推测可能因为下丘与外侧膝状体及上丘有关联[9],因此,当一侧单眼致盲4个月后,可通过双侧外侧膝状体或上丘将MnCl2(亮信号)传递到下丘造成,至于视觉通路在下丘水平是否产生代偿,尚须进一步研究来验证,但总体上,我们的MEMEI成像显示视皮层与听皮层未见明显神经纤维联系。
3.单眼致盲后大鼠的双侧视觉中枢的病理学表现
右眼致盲后4个月,双侧视觉通路的大体观察发现致盲眼断端神经纤维紊乱纠缠,可能为异常反应增生引起[10]。左眼视神经、视交叉及外侧膝状体均稍增粗或扭曲,可能为代偿所致[11]。视觉通路HE及LFB染色镜下观察发现:右眼视神经残余段萎缩变小并被肌肉替代,周围或伴有增生纤维缠结,另见少枝突胶质细胞或星形细胞包裹神经纤维,说明神经纤维本身及周围支持细胞均有增生反应,亦与本组大体解剖及MEMRI结果均一致。另外,我们发现三只单眼盲大鼠左侧视束、视交叉、外侧膝状体及上丘较右侧变细小,可能为左侧萎缩造成[12],亦可能为右侧代偿增粗或中毒水肿引起[13]。
综上所述,本组ME MRI结果基本上均可被病理检查所验证,提示新生大鼠单眼致盲4个月后(关键期内),致盲眼一侧视觉通路以功能退化为主,而未致盲眼一侧以功能代偿为主,双侧视觉通路可能经胼胝体产生相互连接或新突触,即为一种适应性改变。
[1]Nau A C, Pintar C, Arnoldussen A, et al. Acquisition of Visual Perception in Blind Adults Using the BrainPort Artificial Vision Device . Am J Occup Ther, 2015, 69:6901290010p1-p8.
[2]Hidajat R R, Mclay J L, Goode D H, et al. The value of VEP in the diagnosis and post-operative monitoring of meningioma . Documenta Ophthalmologica, 2006, 113:165-9.
[3]Bernabeu A, Alfaro A, Garcia M, et al. Proton magnetic resonance spectroscopy (1H-MRS) reveals the presence of elevated myoinositol in the occipital cortex of blind subjects . Neuroimage, 2009,47:1172-6.
[4]文 颂, 高歌军, 余 辉,等. 大鼠脑皮层结构的高分辨锰离子增强7.0 T MRI研究 . 中华放射学杂志, 2010, 44:202-6.
[5]张 放, 文 雯, 朱文卿, 等. 原发性青光眼视放射损害的磁共振弥散张量成像研究 . 中国医学计算机成像杂志, 2016, 22:17-21.Chan K C, Fan S J, Chan R W, et al. In vivo visuotopic brain
[6]mapping with manganese-enhanced MRI and resting-state functional connectivity MRI . Neuroimage, 2014, 90:235-45.Toldi J, Feher O, Wolff J R. Neuronal plasticity induced by neonatal
[7]monocular (and binocular) enucleation . Progress in Neurobiology,1996, 48:191-209.
[8]Chan K C, Cheng J S, Fan S, et al. In vivo evaluation of retinal and callosal projections in early postnatal development and plasticity using manganese-enhanced MRI and diffusion tensor imaging .Neuroimage, 2012, 59:2274-83.
[9]Chuang K H, Koretsky A P. Accounting for nonspecific enhancement in neuronal tract tracing using manganese enhanced magnetic resonance imaging . Magnetic Resonance Imaging, 2009, 27:594.
[10]Marschinke F, Hashemian S, Matozaki T, et al. The absence of CD47 promotes nerve fiber growth from cultured ventral mesencephalic dopamine neurons . Plos One, 2012, 7:e45218.
[11]Sabel B A, Kasten E. Restoration of vision by training of residual functions . Current Opinion in Ophthalmology, 2000, 11:430-6.
[12]Nakamura M, Ito S, Terasaki H, et al. Incomplete congenital stationary night blindness associated with symmetrical retinal atrophy.American Journal of Ophthalmology, 2002, 134:463-5.
[13]Haenold R, Herrmann K H, Schmidt S, et al. Magnetic resonance imaging of the mouse visual pathway for in vivo studies of degeneration and regeneration in the CNS . Neuroimage, 2012,59:363-76.
Manganese-enhanced MR imaging (MEMRI) in the Study of the Visual Pathway in Experimental Rat models with Monocular Blindness
XIAO Ze-bin1, WANG Rong1, TANG Zuo-hua1, FENG Xiao-yuan2, QIAN Wen1, WANG Jie3,WU Ling-jie4, ZHONG Yu-feng5, WANG Wen-tao6
The Grant of Science and Technology Commission of Shanghai Municipality NO. 09ZR1405600, 14411962000; The Funds for Key Basic Research of Science and Technology Commission of Shanghai Municipality NO. 09JC1403100.
Purpose:To investigate the changes of visual pathway of rats with grown blind eye by MEMRI, and to verify the changes by pathology results.Methods:The operation of optic nerve transection was performed to obtain monocular blindness (right eye) models in 14 newborn normal rats. Four months later (critical period), 0.2M MnCl2 was intravitreally injected into the left eyes, 24h later, MEMRI of visual pathway of right and left eyes were acquired and compared. We aimed to find if there was new visual compensatory pathway by comparing the MEMRI findings of visual pathway in the normal rats and pathology results in monocular blindness rats.Results:Four months after the blindness model was built, MEMRI demonstrated the CNR of visual pathway of the non-blind eye was much higher than that of blind eye (P<0.001), the CNR of visual pathway of the non-blind eye was slightly lower than that of left eye in normal rat( P<0.05), the CNR of the non-blind eye was slightly higher than that of right eye accompanied with atrophy in normal rat. The results of MEMRI of visual pathway were con firmed by the pathology results.Conclusion:Four months after the blindness model was built in new born rats, MEMRI and pathology results demonstrated that bilateral different structures of visual pathway of both blind and non-blind eyes were reorganized.
MnCl2; Magnetic resonance imaging; Visual pathway; MEMRI; Monocular blindness
R814.42
A
1006-5741(2017)-04-0385-05
中国医学计算机成像杂志,2017,23:385-389
1复旦大学附属眼耳鼻喉科医院放射科
2复旦大学附属华山医院放射科
3复旦大学附属华山医院病理科
4复旦大学附属眼耳鼻喉科医院放疗科
5复旦大学附属眼耳鼻喉科医院耳鼻喉科
6复旦大学附属金山医院放射科
7复旦大学附属眼耳鼻喉科医院中心实验室
通信地址:上海市徐汇区汾阳路83号,上海市200031
唐作华 ( 电子邮箱:tzh518sunny@163.com)
共同通信作者:冯晓源(电子邮箱:cjr.fengxiaoyuan@vip.163.com)
上海市科委自然科学基金项目NO. 09ZR1405600,14411962000;上海市科委基础重点项目NO. 09JC1403100。肖泽彬、王容为共同第一作者
Chin Comput Med Imag,2017,23:385-389
1Department of Radiology, Eye & ENT Hospital of Shanghai Medical School, Fudan University
2 Department of Radiology, Huashan Hospital of Shanghai Medical School,Fudan University
3 Department of Radiotherapy, Eye & ENT Hospital of Shanghai Medical School, Fudan University
4 Department of Otolaryngology, Eye & ENT Hospital of Shanghai Medical School, Fudan University
5 Department of Radiology, Jinshan Hospital of Shanghai Medical School,Fudan University
6 Central Laboratory, Eye & ENT Hospital of Shanghai Medical School,Fudan University
Address: No. 83, Fenyang Rd, Shanghai 200031,P.R.C.
Address Correspondence to TANG Zuo-hua(Email: tzh518sunny@163.com)
Address Co-Correspondence to FENG Xiao-yuan(cjr.fengxiaoyuan@vip.163.com)
2017.04.05;修回时间:2017.05.06)
