磁共振双反转恢复序列检测健康人群大脑皮质变异情况的初步研究
2017-11-06曾蒙苏陈财忠施伟斌
孙 伟 蔡 旸 丁 晶 曾蒙苏 陈财忠 汪 昕 施伟斌
磁共振双反转恢复序列检测健康人群大脑皮质变异情况的初步研究
孙 伟1蔡 旸2丁 晶2曾蒙苏1陈财忠1汪 昕2施伟斌3
目的:分析并比较双反转恢复序列(DIR)联合磁共振T1、FLAIR成像对健康人群不同特征大脑皮质变异的检测情况。方法:选择在我院经临床诊断排除中枢神经系统疾病的健康受检者27例,行脑磁共振T1、FLAIR和DIR扫描,统计并比较常规T1、FLAIR成像和联合DIR成像在健康人群中探测到的皮质灰白质交界模糊、脑沟回异常、皮质增厚的变异数,归纳各型皮质变异在大脑中的主要分布特点。结果:在27例健康受检者中,T1、FLAIR共发现皮质变异38处,其中灰白质交界模糊13处,沟回异常21处,皮质增厚4处,人均变异总数为1.407±0.162。T1、FLAIR联合DIR共发现皮质变异69处,其中灰白质交界模糊28处,沟回异常34处,皮质增厚7处,人均变异总数为2.556±0.187。在总皮质变异、灰白质交界模糊数、沟回异常数的检测中,两组比较具统计学显著差异。结论:DIR联合T1、FLAIR可较好显示健康人群的皮质变异。
双反转恢复序列;脑回变异;灰白质交界模糊;沟回异常;皮质增厚
大脑皮质(cerebral cortex)由位于大脑半球表面的灰质组成。随着种系的发育及进化,大脑皮质已从初期简单的嗅觉功能,逐渐发展出运动、感觉、思维、内脏等多种复合功能。随着发育中不同皮质功能区的完善,大脑皮质在结构上可以出现多种变异,如不同的脑沟走行、折叠度、沟回数、毗邻结构等[1]。大脑皮质形态多样性与功能复杂性密切相关,如Gomez等[2]对218例人类与206例黑猩猩进行大脑MRI扫描后处理图像后分析显示,人类脑沟回差异的变异程度远高于黑猩猩,基因学比较提示这与人类大脑高度可塑性密切相关。
解剖学上将非病理状态下较为少见的结构异常称为变异,伴功能障碍者称为异常。大脑皮质异常存在于多种疾病,包括脑皮质发育不良(malformations of cortical development, MCDs)[3]、癫痫、阿尔茨海默病(Alzheimer's disease,AD)等。其脑皮质异常可表现为多种形式,如巨脑回以脑沟减少、脑回增宽、皮质异常增厚为主要表现;无脑回显示脑回、脑沟缺失;多微脑回畸形可表现为皮质增厚、脑沟变浅、灰白质交界平滑[4];AD患者则以皮质萎缩、沟回增宽为主要特点[5]。
常规MRI虽可显示脑回类型、皮质厚度,对脑裂畸形、灰质异位的诊断灵敏度较高,但因对皮质的分辨率较低、难以显示皮质微小病灶,在其他皮质内MCDs或轻度皮质异常的诊断上受到了诸多限制,特别是局灶性皮质发育不良(focal cortical dysplasia,FCD)及其亚型的诊断[6]。此外,轻度的皮质异常与皮质变异在大体解剖结构上界限模糊,影像学上存在图像分辨率较低、部分容积效应等缺点,更增加了对微小皮质异常的诊断难度。
双反转恢复序列(double inversion recovery,DIR)采用两个反转脉冲,分别抑制脑脊液和白质信号,显著提高了灰白质信号对比度,是一种灰质特异性显示序列[7]。目前DIR主要应用于对皮质异常信号的探测,如多发性硬化和癫痫患者中异常病灶的检出,但对大脑皮质的其他特征却少有探讨。本研究采用T1、FLAIR联合DIR序列检测健康人群的大脑皮质,统计分析健康人群大脑皮质变异的发现数目及特点,比较T1、FLAIR联合DIR能否增加健康人群皮质变异的发现率,进一步为DIR在发现其他疾病皮质异常中的影像学应用奠定基础。
方 法
1. 临床资料
收集2015年1月~2016年6月我院神经内科门诊经临床诊断排除神经系统疾病的健康受检者27例,男9例,女18例,年龄17~45岁,中位年龄30岁。均行头颅T1W,FLAIR序列和DIR序列扫描。27例健康受检者均否认重大内科疾病史、药物服用及过敏史、手术及外伤史、家族遗传史。所有被试均于检查前签署知情同意书,且经临床试验伦理委员会批准。
2. MRI检查方法
采 用 GE Magnetic Resonance 3.0T Signa HDX核磁共振成像系统。DIR序列扫描参数:层数20层;层厚4mm;层间距1.0 mm;TR 15000ms;TE 80ms;TI 2950ms。T1W序列扫描参数:层数21层;层厚5mm;层间距1.5mm;TR 1750ms;TE 24ms;TI 860ms。FLAIR序列扫描参数:层数21层;层厚5mm;层间距1.5mm;TR 9000ms;TE 150ms;TI 250ms。
3. 图像分析
根根据国际解剖术语,本研究采用目测法分别观测27例健康受检者MRI图像中左、右侧中央前回,额上回、额中回、额下回、额前回、眶回、直回、中央后回、顶上小叶、缘上回、角回、颞上回、颞中回、颞下回、枕颞内侧回、枕颞外侧回、枕叶区、扣带回、楔前叶、楔叶、舌回、海马旁回等共计44处的皮质变异特点。对27例健康受检者的皮质图像目测法发现,主要存在灰白质交界模糊、脑沟回异常、皮质增厚共3种变异类型(图1),并分别统计T1、FLAIR联合或不联合DIR两种情况下对3种皮质异常的检出数目,并比较二者对皮质变异数的发现率差别。本研究排除因颅骨伪影所致的灰白质交界模糊,排除因脑回自身特点存在的假性沟回增多(如岛叶、舌回等)。当某处脑回存在2种或以上变异时,将主要变异计数为1,不计数次要变异。当变异连续累及2处或以上脑回,将主要累及脑回计数为1,不计数次要脑回。当沟回增多或灰白质交界模糊表现为假性皮质增厚,将皮质变异主要计为前者。各序列检出的皮质变异数目及类型经2位研究人员共同审查、复核并确认。
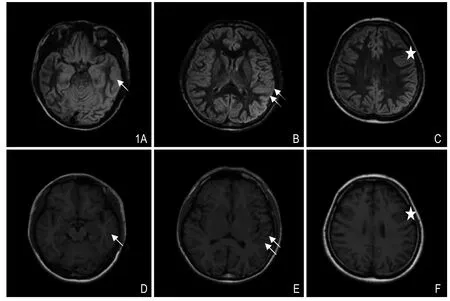
图1 DIR 及T1图像对健康人群大脑皮质3种变异的显示。A. DIR图像示左侧颞中回皮质增厚(单箭头);B. DIR图像示左侧颞上回灰白质交界模糊(双箭头);C. DIR图像示左侧额中回沟回异常(星号);D. T1图像示左侧颞中回皮质增厚(单箭头);E. T1图像示左侧颞上回灰白质交界模糊(双箭头);F. T1图像示左侧额中回沟回异常(星号)。
4. 统计学方法
统计采用SPSS 21.0软件,对T1、FLAIR联合DIR序列及T1、FLAIR在大脑皮质检测出的变异总数比较采用配对t检验,对各变异在不同脑区中的分布情况采用Wilcoxon配对符号秩检验,对单个脑区的T1、FLAIR联合DIR及T1、FLAIR序列变异差异采用Pearson卡方检验、似然比卡方检验或精确概率法(视最小理论频数而定),以P<0.05为有统计学差异。
结 果
1. DIR与T1+FLAIR检测各变异数比较
对27例健康被试的总变异数统计得到,T1、FLAIR联合DIR共发现总变异数69处,其中灰白质交界模糊28处,沟回异常34处,皮质增厚7处,每人变异总数1~4不等,平均变异数为2.556±0.187/人。单纯性T1、FLAIR序列共发现变异数38处,其中灰白质交界模糊数13处,沟回异常21处,皮质增厚4处,每人变异总数0~3不等,平均变异数为1.407±0.162 /人。T1、FLAIR联合DIR能检测出更多的皮质变异,包括灰白质交界模糊及沟回异常,差异具有统计学意义。T1、FLAIR联合DIR虽能够检测出更多的皮质增厚变异,但差异无统计学意义(表1)。
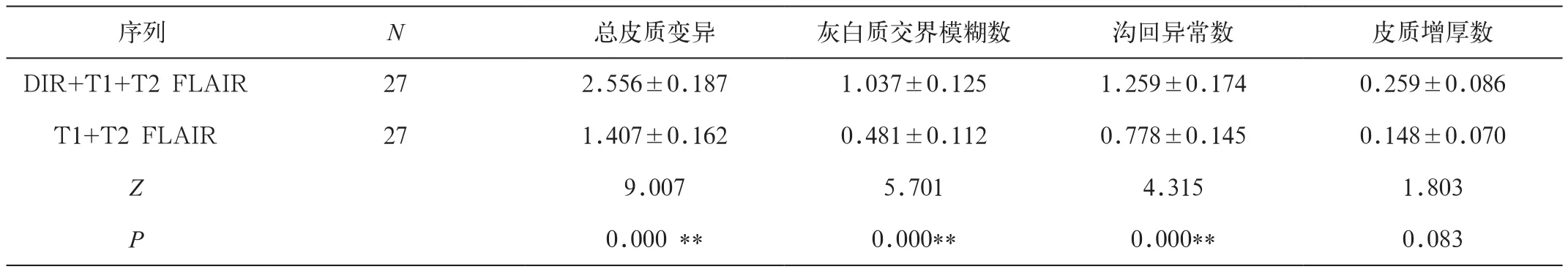
表1 DIR+T1+ T2 FLAIR与T1+T2 FLAIR对27例正常人的各变异数检测比较( x ± s)(n=27)
2. DIR与T1+FLAIR检出变异数在各脑回的分布情况
对27例健康被试各变异数在各脑回的分布统计得到,T1、 FLAIR联合DIR在各脑回发现的中位变异数、灰白质交界模糊、脑沟回异常大于T1、FLAIR,差异具有统计学意义。其中灰白质交界模糊主要存在于双侧额中回(42.857%)、双侧颞上回(32.143%),沟回异常主要见于双侧额中回(41.176%)、左侧缘上回(23.529%)、左侧颞上回(26.471%),皮质增厚主要见于双侧颞中回(100%),左半球个体平均变异数(1.509±0.098)大于右半球(1.192±0.037)。T1、FLAIR联合DIR 序列对单个脑区变异的统计分析得到,除对右侧颞上回的总变异具统计意义(表2)外,其余脑回均无统计学意义。
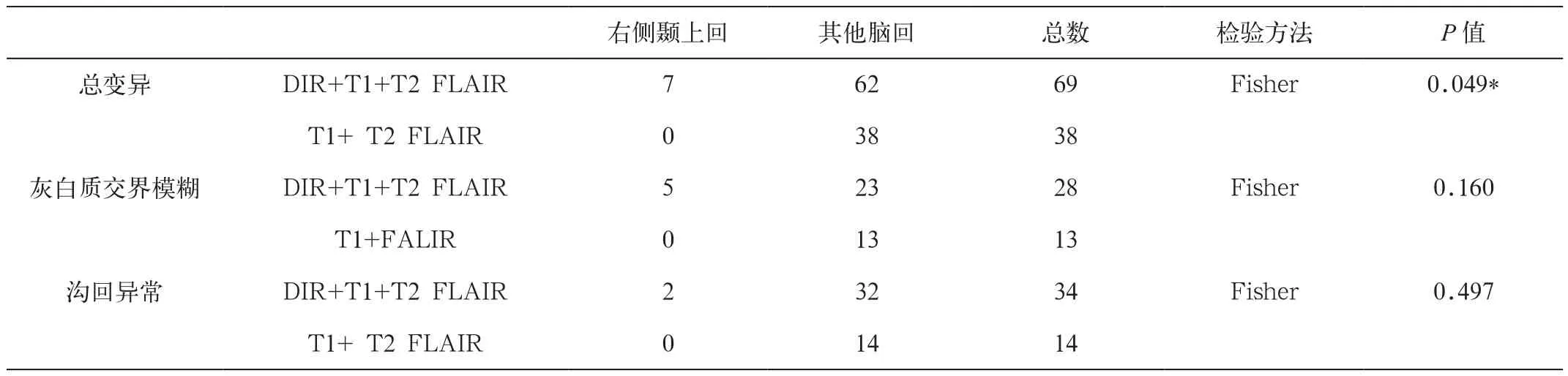
表2 DIR+T1+ T2 FLAIR与T1+T2 FLAIR对右侧颞上回检出变异情况比较
讨 论
由于脑皮质形态变化过大难以统计,对脑回的正常形态分类至今没有统一的标准。鉴于观察脑回形态方法的局限性,本研究将健康人群脑皮质在影像学图像上的变异情况归为3类主要特征,灰白质交界模糊、沟回异常及皮质增厚,并分别观测T1、FLAIR联合DIR对该3种变异的发现情况。
对27例健康受检者的T1、FLAIR及DIR图像观测得出,T1、FLAIR联合DIR可以发现更多的皮质变异,特别是灰白质交界模糊及沟回异常的发现。各序列对3种变异在各脑回分布情况、左右半球的分布情况均显示,双侧额中回、颞上回存在更多的灰白质交界模糊及沟回异常,缘上回出现更多的沟回异常,颞中回出现更多的皮质增厚,左侧比右侧半球存在更多的变异。其中,灰白质交界模糊、沟回异常或皮质增厚可同时表现于某一特定脑区,例如灰白质交界模糊及沟回异常合并存在于某一脑回。此外,沟回卷褶过多可表现为假性皮质增厚,当皮质沟回卷绕并夹杂有白质、脑脊液成分时,还可表现为灰白质交界模糊。
本文对总变异数在各脑回分布情况的统计与既往对人脑皮质的解剖学变异研究有较高的相关性。左右半球的不对称性自解剖研究初始就已被发现[8],优势半球变异更大,本研究左半球变异明显多于右侧,与国人以左侧为优势半球有较大关联。Bartley等[9]对10例同卵和9例异卵双生子Brodmann 46区的研究显示,该区的多态性及变异性主要源于其发育过程中形成较晚、外在环境因素影响较大且功能更为复杂,并提出后天的成长环境而非基因是脑沟回变异的主要影响因子。近年来,葛伟丽等[10]对63例人大脑半球外侧面脑回肉眼观察示,顶下小叶、颞中回分别是顶叶、颞叶脑回形态中变化最大的部分,其中颞中回与颞上、下回的连接增多,这些变异与顶下小叶和颞叶功能的复杂性密切相关,同样与本文中观测到的颞叶形态多样性一致。
双反转恢复序列(double inversion recovery,DIR)于1993年被Shen等首次提出, 1994年Redpath等[11]将其首次应用于人脑皮质的显示。该序列在FLAIR抑制脑脊液的基础上,进一步添加第二个射频反转脉冲,实现了对脑脊液和白质的双重抑制并特异性显示灰质。然而,由于存在磁场不均匀性,SNR低,扫描时间过长,易受运动伪影干扰等缺点,该序列于临床上一直未正式应用。随着对TR /TE、TI1、TI2、场强等各参数的改善及3D技术的加入[12],DIR的扫描时间已逐渐缩短,图像分辨率更为清晰,目前已逐步用于对脑皮质相关疾病的研究,如多发性硬化(multiple sclerosis,MS)、癫痫、精神分裂症等。由于DIR可有效增加灰白质对比度,使灰质显示更为清晰,并显著提高灰质病灶的检出率,2011年更被推荐为MS皮质病灶的标准影像学诊断方法,用于对皮质亚结构的显示及皮质病灶的分级[13]。近年来,DIR在癫痫中的研究也逐渐增多,如2013年Morimoto 等[14]通过比较3D DIR与3D FLAIR、3D T2WI 等其他序列在21例颞叶癫痫患者中的影像学表现,显示3D DIR对前颞叶白质异常信号的显示最佳,并指出该部位DIR信号的增高是癫痫侧向性的强烈预示指标。2016年Soares等[15]描述了DIR在婴幼儿癫痫图像中的应用,指出DIR有助于对各类致痫灶的发现,但由于婴幼儿白质髓鞘化的不完全,在DIR图像上可表现为假性高信号,使其与真正的病灶鉴别带来了困难。然而,对DIR在MS及癫痫中的研究目前多侧重于对异常信号灶的发现,对皮质形态或其他异常皮质改变却少有探讨,如沟回异常、皮质厚度、灰白质交界情况目前暂无研究。
本研究中,DIR对健康人群大脑皮质变异的发现情况可见,T1、FLAIR联合DIR可显示更多的灰白质交界模糊、沟回异常、皮质增厚变异,其中灰白质交界模糊、沟回异常与常规检测组比较具有显著性差异。提示磁共振DIR序列检测能提供更多的皮质信息,有助于发现更多的皮质病灶。然而,由于目前DIR序列的扫描时间至少为5min,在大规模应用上尚存一定限制性,本研究采用目测法进行观察研究,亟需建立计算机后处理方案,有助于进一步临床应用开展。
综上所述,T1、FLAIR、DIR在健康人群中均可探测出一定数量的皮质变异,主要位于额中回、缘上回、颞上、下回。T1、FLAIR联合DIR有助于发现更多的皮质变异,本文在健康人群中的研究为DIR对其他类型皮质异常的发现,及在皮质相关疾病中的应用提供了一定的参考价值。
[1]Yeo BT, Eickhoff SB. Systems neuroscience: A modern map of the human cerebral cortex. Nature, 2016, 536:152-154.
[2]Gomez-Robles A, Hopkins WD, Schapiro SJ, et al. Relaxed genetic control of cortical organization in human brains compared with chimpanzees. Proc Natl Acad Sci U S A, 2015, 112:14799-14804.
[3]Liu W, An D, Xiao J, et al. Malformations of cortical development and epilepsy: A cohort of 150 patients in western China. Seizure,2015, 32:92-99.
[4]丁国成,王 杰,王卫芳.脑神经元移行异常的CT表现及临床意义. 中国医学计算机成像杂志.1999,5:84-87
[5]李亚迪,何慧瑾,冯晓源.基于体素的轻度阿尔茨海默病全脑灰质MRI成像分析.中国医学计算机成像杂志,2009,2:97-101
[6]程彦昊,蔡立新,李坤成等.局灶性脑皮质发育不良病理分型的MRI特点.中华放射学杂志.2007,5:493-495
[7]Ryan ME. Utility of Double Inversion Recovery Sequences in MRI.Pediatr Neurol Briefs, 2016, 30:26.
[8]Zilles K, Schleicher A, Langemann C, et al. Quantitative analysis of sulci in the human cerebral cortex: development, regional heterogeneity, gender difference, asymmetry, intersubject variability and cortical architecture. Hum Brain Mapp, 1997, 5:218-221.
[9]Bartley AJ, Jones DW, Weinberger DR. Genetic variability of human brain size and cortical gyral patterns. Brain, 1997, 120:257-269.
[10]葛伟丽.人大脑半球外侧面脑回形态整体观.广西医科大学,2013,47-53.
[11]Redpath TW, Smith FW. Technical note: use of a double inversion recovery pulse sequence to image selectively grey or white brain matter. Br J Radiol, 1994, 67:1258-1263.
[12]Pouwels PJ, Kuijer JP, Mugler JP 3rd, et al. Human gray matter:feasibility of single-slab 3D double inversion-recovery high-spatialresolution MR imaging. Radiology, 2006, 241:873-879.
[13]Geurts JJ, Roosendaal SD, Calabrese M, et al. Consensus recommendations for MS cortical lesion scoring using double inversion recovery MRI. Neurology, 2011, 76:418-424.
[14]Morimoto E, Okada T, Kanagaki M, et al. Evaluation of focus laterality in temporal lobe epilepsy: a quantitative study comparing double inversion-recovery MR imaging at 3T with FDG-PET.Epilepsia, 2013, 54:2174-2183.
[15]Soares BP, Porter SG, Saindane AM, et al. Utility of double inversion recovery MRI in paediatric epilepsy. Br J Radiol, 2016, 89:20150325.
Pilot Study on Detection of Cortex Variation in Healthy Population by MRI with Double Inversion Recovery Sequence
SUN Wei1,CAI Yang2,DING Jing2,ZENG Men-su1,CHEN Cai-zhong1,WANG Xin2,SHI Wei-bin3
Purpose:To discuss the capability of double inversion recovery (DIR) sequence, combined with T1WI, FLAIR sequences in identifying the MRI characteristics of cortex variation in healthy population.
Methods:Twenty-seven healthy people without any history of central nervous diseases were included. All of them underwent MRI scanning with T1WI, FLAIR and DIR sequences. Three main MRI variation features were found,including the blurring at the grey/white matter junction, abnormal gyral/sulcal patterns and cortical thickness.After counting the number of variations detected on each of the MRI images, we analyzed the brain distribution of different variation types and compare the capability for T1, FLAIR with or without DIR in identifying each of them.Results:Among 27 healthy people, the number of cortex variation detected by T1WI, FLAIR was 38,including 13 blurring at the grey/white matter junction, 21 abnormal gyral/sulcal patterns and 4 cortical thickness,with a per capita total variation number of 1.407±0.162. The number of that identified by T1WI, FLAIR, combinedwith DIR was 69, including 28 blurring at the grey/white matter junction, 34 abnormal gyral/sulcal patterns and 7 cortical thickness, with a per capita total variation number of 2.556±0.187. The number of that detected by T1WI, FLAIR with DIR was higher in total cortex variation (P<0.001), grey-white matter junction (P<0.001)and abnormal gyral/sulcal patterns (P<0.001)with significant statistical differences.Conclusion:Double inversion recovery combined with T1WI,FLAIR is better at showing the cortex variation in healthy population.
Double inversion recovery; Cortex variation; Blurring at the grey/white matter junction; Abnormal gyral/sulcal patterns; Cortical thickness
R445.2
A
1006-5741(2017)-04-303-05
中国医学计算机成像杂志,2017,23:303-309
1复旦大学附属中山医院放射科
2复旦大学附属中山医院神经内科
3 复旦大学附属中山医院体检中心
通信地址:上海市徐汇区枫林路130号,上海 200032
施伟斌(电子邮箱:shi.weibin@zs-hospital.sh.cn)
Chin Comput Med Imag,2017,23:303-309
1 Department of Radiology, Zhongshan Hospital Affiliated to Fudan University
2 Department of Neurology, Zhongshan Hospital Affiliated to Fudan University
3 Department of Physical Examination, Zhongshan Hospital Affiliated to Fudan University
Address: 130 Fenglin Rd, Huhui District, Shanghai 200032, P.R.C.
Address Correspondence to SHI Wei-bin (E-mail: shi.weibin@zs-hospital.sh.cn)
2017.02.07;修回时间:2017.04.20)
