芬戈莫德调控小胶质细胞表型转化对少突胶质前体细胞的影响
2017-11-06李瑾樊文慧杨园潘邓记
李瑾 樊文慧 杨园 潘邓记
·论 著·
国家自然科学基金项目(NSFC) 81571206资助
430030 武汉,华中科技大学同济医学院附属同济医院神经内科
芬戈莫德调控小胶质细胞表型转化对少突胶质前体细胞的影响
李瑾 樊文慧 杨园 潘邓记
目的研究芬戈莫德(FTY720)对原代培养的小胶质细胞表型的影响及干预后的小胶质细胞对少突胶质前体细胞分化成熟的影响。方法体外培养原代小胶质细胞及少突胶质前体细胞(OPCs),采用RT-PCR法检测FTY720干预后小胶质细胞M1及M2型指标的变化;ELISA法检测小胶质细胞上清TNF-α、TGF-β、IL-1β、IL-13分泌量的变化;将干预后的小胶质细胞上清液加入纯化后的少突胶质前体细胞中采用Olig2与MBP共染免疫荧光染色方法观察FTY720对少突胶质前体细胞分化成熟的影响。结果向M2型转化;FTY720干预后的小胶质细胞促进少突胶质前体细胞的分化成熟。结论FTY720通过促进小胶质细胞向M2型转化,从而促进少突胶质前体细胞的分化。
FTY720 小胶质细胞 表型转化 少突胶质前体细胞
小胶质细胞是中枢神经系统中定居的巨噬细胞,是对抗损伤的第一道防线[1-2]。小胶质细胞在中枢神经系统中调节免疫和炎症反应。对各种微环境信号小胶质细胞可以表达特定的功能反应程序,存在两种极化状态[3-4],即经典(促炎,M1)型及替代(抗炎,M2)型, 参与组织的修复或损伤过程[5-7]。小胶质细胞表型主要呈现为各种细胞表面受体的表达及特定功能的可溶性细胞因子等及释放:在LPS和IFN-γ的刺激下小胶质细胞可以极化M1型小胶质细胞(促炎型、经典激活型),而在IL-4刺激下小胶质细胞可以极化为M2型小胶质细胞(抗炎型、替代激活型)。M1型小胶质细胞可以分泌各种炎性因子如IL-1b,IL-6,TNF-a,CCL2,及 CXCL10,还可以分泌 ROS, NO和基质金属蛋白酶-9、基质金属蛋白酶-3[8-12]。M1型小胶质细胞的功能是抗原提呈作用并杀伤细胞内的病原体以维持环境稳态[13]。M2型小胶质细胞表现为Arginase-1,Ym1,IGF-1,CD206等表达水平增高,主要抑制炎症反应和发挥神经保护作用[14-15]。
芬戈莫德(Fingolimod,FTY720)作为一种口服的免疫抑制剂,被美国食品和药物管理局批准作为多发性硬化的一线治疗药物[16];在多发性硬化动物模型中通过促进少突胶质细胞生长、成熟及髓鞘再生而发生保护作用[17]。最近研究表明,FTY720在脑血管疾病中也可以发挥抗炎和神经保护作用[18-19]。本研究通过体外培养原代小胶质细胞及少突胶质前体细胞(OPCs),探讨FTY720对小胶质细胞表型的调控,进而观察不同表型的小胶质细胞对少突胶质前体细胞分化成熟的影响,并探讨FTY720发挥中枢神经损伤后髓鞘修复的可能机制。
1 材料与方法
1.1 实验动物 出生0~3 d的SPF级C57乳鼠,从华中科技大学附属同济医学院动物实验中心获得。
1.2 主要试剂 FTY720(美国Cayman生物公司),LPS、T3(Sigma公司),IL-4、IFN-γ,Human PDGF-AA,Mouse-FGF-Basic、Mouse-CNTF(Peorotech公司),N2 supplement(100×),B27supplement (50×)(GIBCO公司),DMEM/F12细胞培养基,DMEM/F12高糖培养基(Hyclone公司),胎牛血清(四季青公司),多聚 L- 赖氨酸(PLL,Sigma 公司),兔抗小鼠Olig2多克隆抗体(Millipore 公司),兔抗 Iba-1 单克隆抗体(wako 公司),大鼠抗 MBP 单克隆抗体小鼠(Millipore 公司),IL-1β,TNF-α,TGF-β ELISA检测试剂盒(深圳达科为公司),小鼠IL-13 ELISA检测试剂盒购自(Abcam公司),Trizol Reagent(Invitrogen 公司),逆转录 kit、SYBR gene PCR Master Mix (TOYOBO公司),引物GAPDH(武汉谷歌生物公司)。
1.3 Real-time PCR引物见表1
1.4 方法
1.4.1 混合胶质细胞原代培养 根据文献[24-25]方法改进,原代培养小鼠小胶质细胞及少突胶质前体细胞。取出生0~3 d的C57乳鼠,在无菌条件下取出小鼠全脑,去脑膜和血管,PBS液冲洗后留大脑半球及中脑,保留胼胝体,放入预先已加入2 mL PBS液中,剪碎后加入2 mL 0.25%的胰酶,在37 ℃条件下消化15 min,用含20%胎牛血清的DMEM/F12培养基终止消化,终止消化后用200目钢丝筛网过滤细胞悬液,800 r/min 4 ℃离心过滤后的细胞悬液8 min,弃去上清后用含20%胎牛血清的DMEM/F12培养基重悬沉淀的细胞,按照106密度将细胞悬液接种于T75细胞培养瓶中,95% O2、5% CO2的37 ℃培养箱培养,每3~4 d换液1次(更换为含20%胎牛血清DMEM/高糖培养基),当细胞100%汇合后进行下面的分离纯化步骤。
1.4.2 小胶质细胞及少突胶质前体细胞的分离纯化 原代培养的混合胶质细胞长满后拧紧瓶盖,放到恒温水平摇床上振摇纯化小胶质细胞,37 ℃下250 r/min震摇1.5 h,取振摇后的细胞上清4 ℃ 800 r/min离心8 min,弃上清,用含20%胎牛血清的DMEM/高糖培养基重悬细胞,接种于6孔培养板或铺有盖玻片(多聚赖氨酸包被)24孔板中,用于下游实验。分离后的小胶质细胞使用Iba1(1∶200)抗体进行免疫荧光法检测纯度。按上述方式纯化小胶质细胞后更换培养基,继续37 ℃恒温摇床振摇(180 r/min,18 h),然后按照差速贴壁方法去除多余的星形胶质细胞及小胶质细胞,后将悬浮细胞800 r/min 4 ℃离心8 min,弃上清,用OPCs培养基重悬细胞沉淀,细胞按2×105密度接种于铺有用多聚赖氨酸包被过的盖玻片的24孔板中,分离后的OPCs细胞使用Olig2(1∶200)抗体进行免疫荧光法检测纯度。纯化3 d后的OPCs细胞更换为分化培养基及干预培养基,诱导分化3 d,收集细胞爬片用于免疫荧光染色。

表1 Real-time PCR引物
1.4.3 小胶质细胞及少突胶质前体细胞的干预 (a)纯化后的小胶质细胞种植于6孔板中24 h后按如下分组进行干预:未刺激组(M0组),LPS+IFNγ组(M1组),LPS plus IFNγ+FTY720组,IL-4组(M2组),干预24 h后收集细胞及细胞上清用于下游实验;(b)纯化3 d后的OPCs细胞用干预后的小胶质细胞上清(MG培养基)和OPCs分化培养基(比例为1∶1)培养3 d,分组如下:OPCs分化培养基组;M0小胶质细胞上清液+OPCs分化培养基;M1小胶质细胞上清液+OPCs分化培养基;M1+FTY720小胶质细胞上清液+OPCs分化培养基;M1小胶质细胞上清液+单独预处理后的FTY720培养基+OPCs分化培养基;M2小胶质细胞上清液+OPCs分化培养基,OPCs细胞干预3 d后收集细胞爬片用于免疫荧光染色。
1.4.4 免疫荧光染色 干预后的小胶质细胞及OPCs细胞,按以前的方法[26],弃去上清,以4%多聚甲醛固定15 min后用0.25%Triton X-100破膜液室温破膜15 min,再用封闭液(PBS含1%BSA,0.1%Triton)室温下封闭60 min,加入兔抗小鼠Iba1抗体(1∶200)、兔抗小鼠Olig2抗体(1∶200)、大鼠抗小鼠MBP抗体(1∶200)4 ℃孵育过夜,用PBS洗3遍,每遍10 min,之后以相应的二抗(Cy3 标记的山羊抗兔 IgG、Cy3 标记的山羊抗大鼠 IgG、FITC 标记的驴抗兔 IgG 1∶200)室温下避光孵育1 h,PBS洗3遍,每遍10 min;DAPI染色10 min,PBS洗3遍,每遍10 min;甘油封片,荧光倒置显微镜下观察。
1.4.5 RT-PCR 小胶质细胞干预24 h后弃去培养基,按照先前的方法[27]用Trizol 溶液裂解细胞提取RNA。提取出的RNA按照逆转录试剂盒说明书方法将RNA逆转录为cDNA,然后将逆转录出的cDNA用实时荧光定量试剂盒检测 mRNA的表达水平,以三磷酸甘油醛脱氢酶(GADlPH)作为内参对照。反应参数:94 ℃预变性10 min;(94 ℃变性45 S,56 ℃退火30 s,72 ℃延伸30 s)×35个循环:72 ℃延伸10 min。每个样本设置3个复孔,CT值代表荧光实时定量PCR的水平,△CT =CT(目的基因)-CT(内参基因),ΔΔCT=ΔCT(实验组)-△CT(对照组)。根据公式可以算出各组细胞中目的基因表达/对照组细胞中目的基因表达=2-ΔΔCT[28]。
1.4.6 ELISA 小胶质细胞干预24 h后收集细胞上清液,按照试剂盒说明书检测上清液中炎性因子TNF-α、TGF-β、IL-13、IL-1β的表达水平,显色后在酶标仪450 nm处测吸光度值,建立标准曲线,根据标准曲线计算表达水平。
1.4.7 统计学处理法
采用实验数据用均数±标准误(Mean±SEM)表示,SPSS19.0进行单因素方差分析及 t检验,组间比较用 SNK 法。以P<0.05认为差异有统计学意义。
2 结 果
2.1 小胶质细胞及少突胶质前体细胞的鉴定
采用Iba1与DAPI免疫荧光共染法鉴定小胶质细胞的纯度显示小胶质细胞的纯度可达99%;Olig2与DAPI免疫荧光共染法鉴定OPCs的纯度显示OPCs的纯度可达95%(图1)。
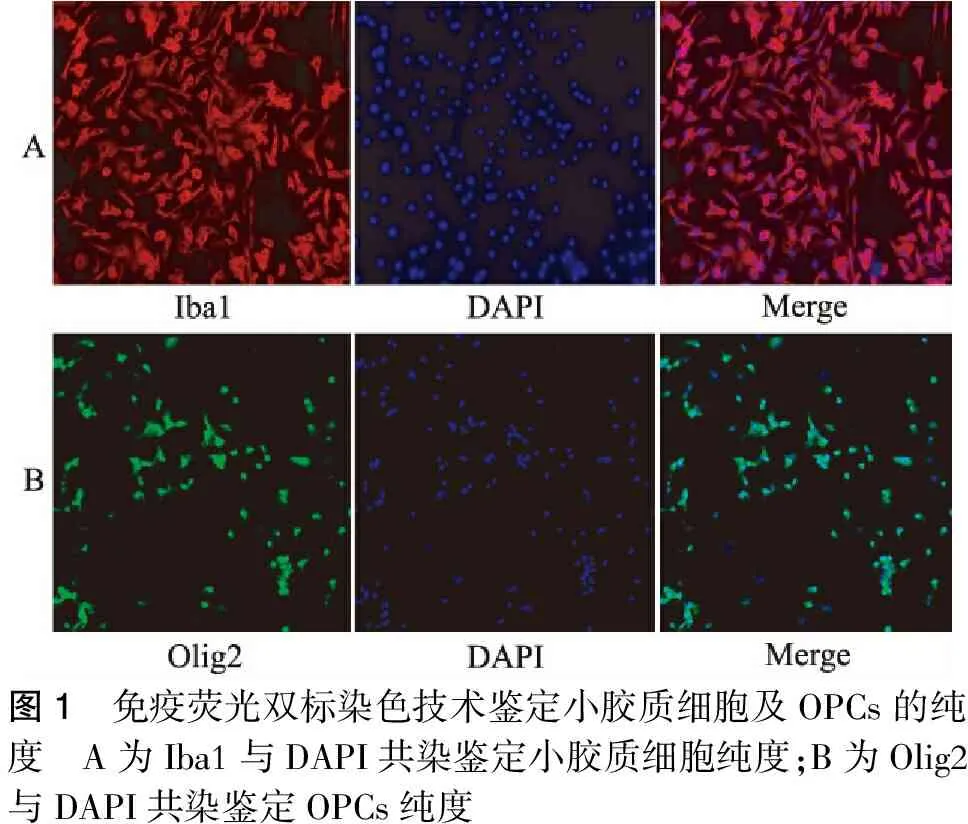
图1 免疫荧光双标染色技术鉴定小胶质细胞及OPCs的纯度 A为Iba1与DAPI共染鉴定小胶质细胞纯度;B为Olig2与DAPI共染鉴定OPCs纯度
2.2 FTY720在体外细胞实验中对小胶质细胞表型的影响
通过RT-PCR检测显示:LPS+IFNγ+FTY720干预较LPS+IFNγ刺激组的M1型小胶质细胞生物学标志物iNOS,CD86,TNF-α,CD32及IL-1β 的mRNA表达水平低,LPS+IFNγ+FTY720干预较LPS+IFNγ刺激组M2型小胶质细胞生物学标志物Arg 1,CD206,YM,IL-10,TGF-β 的mRNA表达水平高;与IL-4组比较,这2组的M1型小胶质细胞生物学标志物mRNA表达水平都较之要高,而M2型小胶质细胞生物学标志物的mRNA表达水平较之要低(P<0.05或P<0.01)(表2)。
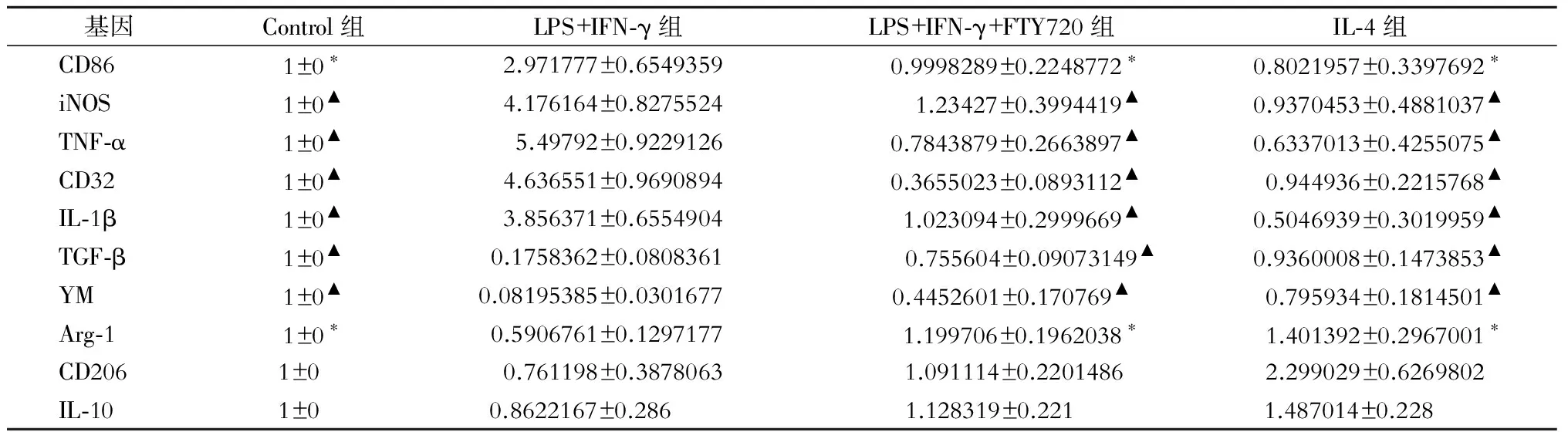
表2 在体外细胞实验中 FTY720干预后小胶质细胞细胞表型的变化(Mean±SEM,pg/mL)
注:与LPS+IFN-γ组比较,*P<0.05,▲P<0.01
2.3 FTY720在体外细胞实验中对小胶质细胞上清液炎性因子表达水平的影响
LPS+IFNγ+FTY720干预较LPS+IFNγ刺激组的炎性细胞因子TNF-α,IL-1β表达水平显著降低,炎性细胞因子TGF-β,IL-13表达水平显著增高(P<0.05或P<0.01)(表3)。
2.4 小胶质细胞表型转化对少突胶质细胞前体细胞分化成熟的影响
M1(LPS+IFN-γ)+FTY720干预后的小胶质细胞条件培养基后的0PCs分化较用M1型小胶质细胞条件培养基干预的OPCs分化增多,提示FTY720通过促进M1型小胶质细胞向M2型小胶质细胞转化而促进OPCs的分化(图2,表4)。
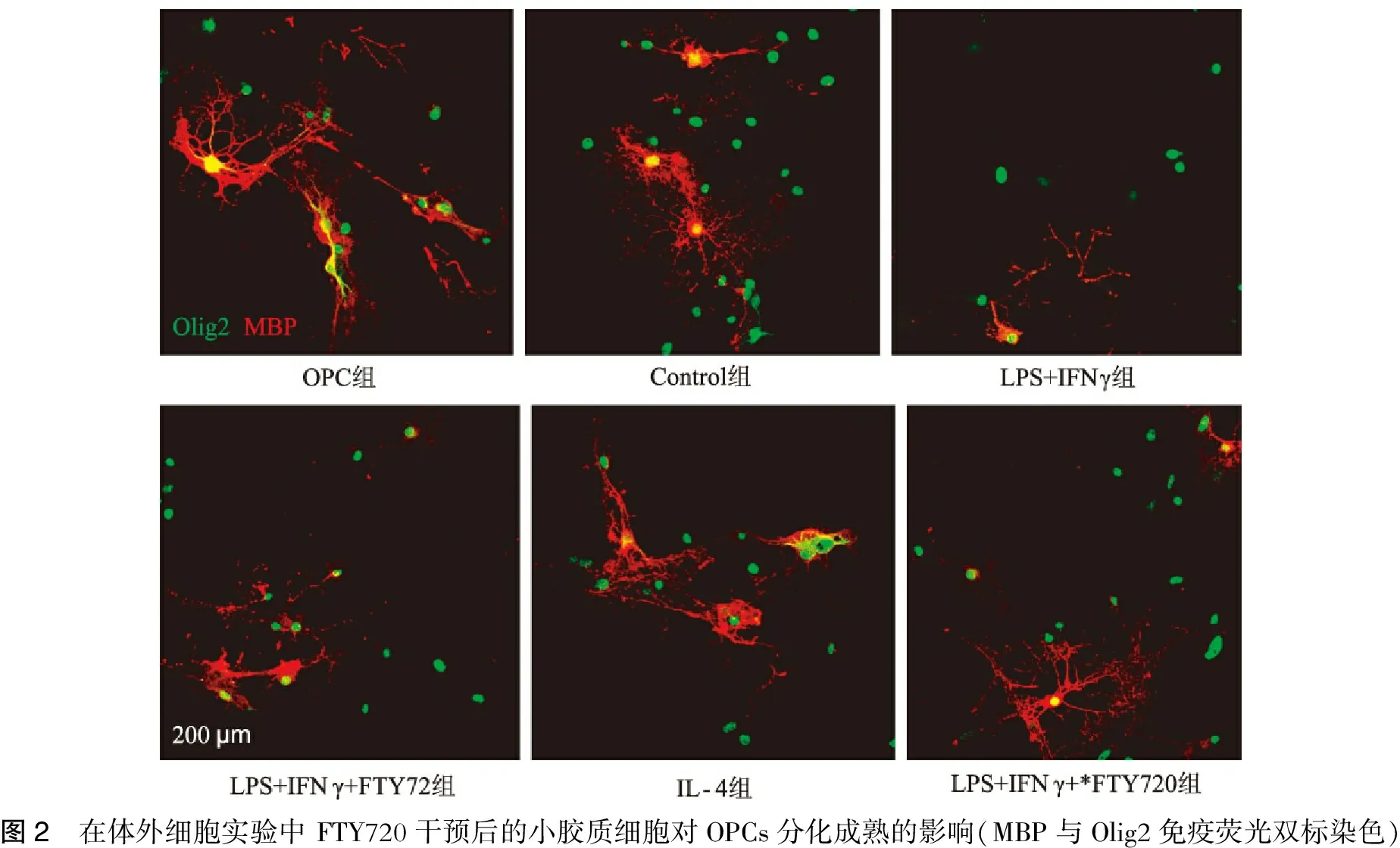
图2 在体外细胞实验中FTY720干预后的小胶质细胞对OPCs分化成熟的影响(MBP与Olig2免疫荧光双标染色)

表3 在体外细胞实验中 FTY720干预后小胶质细胞上清释放的炎性因子表达水平的改变(Mean±SEM,pg/mL)
注:与LPS+IFN-γ组比较,*P<0.01,▲P<0.01,#P<0.05

表4 在体外细胞实验中 FTY720干预后的小胶质细胞对OPCs分化成熟的影响(Mean±SEM,%)
注:与Control组比较,*P<0.01;与LPS+IFN-γ组比较,▲P<0.01
3 讨 论
神经炎症被认为是慢性脑灌注不足动物模型中白质损伤的关键病理生理学[22],小胶质细胞在脑白质损伤中是一把双刃剑,在中枢神经系统中调节免疫和炎症反应。小胶质细胞存在两种极化状态[3-4],即经典(促炎,M1)型及替代(抗炎,M2)型,通过产生促炎/抗炎因子而发挥神经损伤/保护作用。
有研究表明芬戈莫德(FTY720)通过防止淋巴细胞从淋巴结中排出而减少循环淋巴细胞的数量,并且可能有助于防止淋巴细胞早期浸润到脑中以及抑制小胶质细胞和巨噬细胞的局部活化。
本研究通过体外培养原代小胶质细胞和少突胶质前体细胞(OPCs),再通过LPS+IFN-γ刺激纯化后的小胶质细胞促使小胶质细胞活化为经典的M1型,用FTY720干预后通过RT-PCR技术检测小胶质细胞表型标记物显示FTY720干预后小胶质细胞的M1型标志物减少而M2型标志物增多,表明FTY720促使小胶质细胞向M2型转化。采用ELISA法检测小胶质细胞上清液中的炎性因子的表达水平,结果显示FTY720干预后炎性因子TNF-α,IL-1β的分泌减少,而TGF-β,IL-13的分泌增多。说明FTY720可以减少炎性因子的释放,增多抗炎性因子的释放,减轻了神经炎症反应。将小胶质细胞上清液加到纯化后的少突胶质前体细胞(OPCs)中干预3 d后采用免疫荧光染色方法探讨FTY720干预后小胶质细胞对OPCs的影响,结果显示FTY720干预后的小胶质细胞上清液促进OPCs的分化成熟,从而减轻脑白质的损伤。以上研究结果表明小胶质细胞的表型转化对少突胶质前体细胞(OPCs)的分化成熟有影响。但是关于影响小胶质细胞表型转化进而影响少突胶质细胞的机制尚不清晰,所以还需要进一步实验探讨。
[1] Hu,X,Liou,et al.Neurobiology of microglial action in CNS injuries:receptor-mediated signaling mechanisms and functional roles[Z],2014:60-84.
[2] Prinz MM,Brain Macrophages in the Molecular Age:From Origin to Neuropsychiatric Disease.Nat[J].Rev Neurosci,2014,15(5):300-312.
[3] Hu X,Leak RK,Shi Y,et al.Microglial and macrophage polarization-new prospects for brain repair[J].Nat Rev Neurol,2015,11(1):56-64.
[4] Murray PJ,Allen JE,Biswas SK,et al.Macrophage activation and polarization: nomenclature and experimental guidelines[J].Immunity,2014,41(1):14-20.
[5] Porta C,Rimoldi M,Raes G,et al.Tolerance and M2 (alternative) macrophage polarization are related processes orchestrated by p50 nuclear factor kappa B[J].Proc Natl Acad Sci U S A,2009,106(35):14978-14983.
[6] Ajmone-Cat MA,Mancini M,Simone RD,et al.Microglial polarization and plasticity:evidence from organotypic hippocampal slice cultures[J].Glia,2013,61(10):1698-1711.
[7] David S,Kroner A.Repertoire of microglial and macrophage responses after spinal cord injury[J].Nat Rev Neurosci,2011,12(7):388-399.
[8] Kettenmann H,Hanisch UK,Noda MA.Physiology of microglia[J].Physiol Rev,2011,91(2):461-553.
[9] MacMicking,J,Xie,et al.Nitric oxide and macrophage function[J].Annu Rev Immunol,1997,15:323-350.
[10] Saijo K,Glass CK.Microglial cell origin and phenotypes in health and disease[J].Nat Rev Immunol,2011,11(11):775-787.
[11] Varnum MM,Ikezu T.The classification of microglial activation phenotypes on neurodegeneration and regeneration in Alzheimer's disease brain[J].Arch Immunol Ther Exp (Warsz),2012,60(4):251-266.
[12] Yenari,M A,Kauppinen,et al. Microglial activation in stroke: therapeutic targets. Neurotherapeutics [J]. Neurotherapeutics,2010,7(4):378-391.
[13] Cherry,D J,Olschowka,et al.Neuroinflammation and M2 microglia:the good,the bad[Z],2014:98.
[14] Latta CH,Sudduth TL,Weekman EM,et al.Determining the role of IL-4 induced neuroinflammation in microglial activity and amyloid-beta using BV2 microglial cells and APP/PS1 transgenic mice[J].J Neuroinflammation,2015,4(12):41.
[15] Mecha M,Feliú A,Carrillo-Salinas FJ,et al.Endocannabinoids drive the acquisition of an alternative phenotype in microglia[J].Brain Behav Immun,2015,10(49):233-245.
[16] Brinkmann V,Billich A,Baumruker T,et al.Fingolimod[J].Reactions Weekly,2014,1520(1):108-108.
[17] Miron VE,Ludwin SK,Darlington PJ,et al.Fingolimod (FTY720) enhances remyelination following demyelination of organotypic cerebellar slices[J].Am J Pathol,2010,176(6):2682-2694.
[18] Ying F,Hao JW,Zhang NN,et al.Fingolimod for the treatment of Intracerebral hemorrhage A 2-Arm Proof-of-Concept Study[Z],2014:1065.
[19] Fu Y,Zhang N,Ren L,et al.Impact of an immune modulator fingolimod on acute ischemic stroke[J].Proc Natl Acad Sci U S A,2014,111(51):18315-18320.
[20] Nayak D,Huo Y,Kwang WX,et al.Sphingosine kinase 1 regulates the expression of proinflammatory cytokines and nitric oxide in activated microglia[J].Neuroscience,2010,166(1):132-144.
[21] Hu X,Li P,Guo Y,et al.Microglia/macrophage polarization dynamics reveal novel mechanism of injury expansion after focal cerebral ischemia[J].Stroke,2012,43(11):3063-3070.
[22] Xu Y,Qian L,Zong G,et al.Class a scavenger receptor promotes cerebral ischemic injury by pivoting microglia/macrophage polarization[J].Neuroscience,2012,30(218):35-48.
[23] Kobayashi K,Imagama S,Ohgomori T,et al.Minocycline selectively inhibits M1 polarization of microglia[Z],2013:e525.
[24] Hu X,Zhang D,Pang H,et al.Macrophage antigen complex-1 mediates reactive microgliosis and progressive dopaminergic neurodegeneration in the MPTP model of Parkinson's disease[J].J Immunol,2008,181(10):7194-7204.
[25] Fu P,Tang R,Yu Z,et al.Bumetanide-induced NKCC1 inhibition attenuates oxygen-glucose deprivation-induced decrease in proliferative activity and cell cycle progression arrest in cultured OPCs via p-38 MAPKs[J].Brain Res,2015,1613(1):110-119.
[26] Li CY,Xiao L,Liu SF,et al.Inhibition of mTOR pathway restrains astrocyte proliferation,migration and production of in ammatory mediators after Oxygen-glucose deprivation and reoxygenation[Z],2015:9-18.
[27] Chomczynski P,N.Sacchi[J]. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction,Analytical Biochemistry,1987,162(1):156-159.
[28] Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method[J].Methods,2001,25(4):402-408.
TheeffectofFingolimod-mediatedmicroglialpolarizationonoligodendrocyteprecursorcells
LiJin,FanWenhui,YangYuan,etal.
DepartmentofNeurology,TongjiHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430030
ObjectiveTo investigate the effect of S1P receptor agonist Fingolimod (FTY720) on microglial polarization and the effect of FTY720-mediated microglia polarization on maturation of oligodendrocyte precursor cells.MethodsRT-PCR was used to examine the polarization of microglia in vitro. ELISA was used to detect the supernatant of microglial cells in order to measure the levels of TNF-α, TGF-β, IL-1β and IL-13. The supernatant of microglial cells was added to the purified oligodendrocyte precursor cells, and then the differentiation of oligodendrocyte precursor cells was detected by immunofluorescence staining.ResultsFTY720 promoted the microglia toward M2 polarization, promotes differentiation of oligodendrocyte.ConclusionFTY720 promoted the differentiation of oligodendrocyte precursor cells by promoting the microglia toward M2 polarization.
FTY720 Microglial polarization Oligodendrocyte precursor cells
R742
A
1007-0478(2017)05-0383-06
10.3969/j.issn.1007-0478.2017.05.001
(2017-02-05收稿)
