毛竹PePGIP基因的克隆及表达分析
2017-11-04董南松廖美振娄永峰肖复明
董南松 廖美振 娄永峰 肖复明
(1江西省植物生物技术重点实验室 南昌 330013;2安福县陈山林场 江西安福 360830;3江西省林业科学院 南昌 330013)
毛竹PePGIP基因的克隆及表达分析
董南松1,2廖美振1,2娄永峰1,3肖复明1,3
(1江西省植物生物技术重点实验室 南昌 330013;2安福县陈山林场 江西安福 360830;3江西省林业科学院 南昌 330013)
多聚半乳糖醛酸酶抑制蛋白是一种重要的植物防御蛋白,在植物对真菌防御中发挥着重要作用。利用同源序列比对方法从毛竹 (Phyllostachys edulis)全长cDNA文库中获得1个PGIP同源基因序列(FP100022),命名为PePGIP。该基因序列全长1370 bp,开放阅读框1008 bp,编码335个氨基酸,分子量为36.0 kDa。蛋白序列分析表明,该序列包含8个典型的亮氨酸重复序列,属于植物胞外蛋白eLRR超家族。PePGIP与其他禾本科植物的PGIP均具有较高的同源性,聚类分析与来自二穗短柄草和水稻的PGIP聚在较近的分支。半定量RT-PCR分析结果表明,PePGIP在毛竹的根、茎、叶中均表达,且根中表达量最高。构建pEASY-PePGIP原核表达载体,转化大肠杆菌BL21(DE3),经IPTG诱导获得了重组蛋白,分子量约为42 kDa。本研究为深入了解PePGIP的基因功能奠定了基础。
毛竹;PGIP;克隆;表达分析
细胞壁是植物细胞防御病原真菌侵染的第1道防线,植物病原真菌在早期侵染中可分泌一系列酶来降解植物细胞壁[1]。多聚半乳糖醛酸酶 (PGs)是植物病原真菌侵染寄主时所分泌的第1个细胞壁降解酶,它可分解植物多聚半乳糖醛酸,降解植物细胞壁,这不仅使其他细胞壁降解酶对其底物的攻击更容易,同时为病原真菌的生长和发育提供糖源[1-3]。研究表明,PGs是多种病原真菌的关键致病因子,而多聚半乳糖醛酸酶抑制蛋白 (PGIPs)是植物中普遍存在的一种抗病蛋白,其能与病原真菌PGs特异性结合,从而部分抑制PGs的水解活性,阻止病原真菌的侵入和发展,同时可诱导植物体内寡聚半乳糖醛酸的积累,激发特定的防御系统,增强植物的抗病性[4-6]。此外,PGIPs还参与植物的其他生理过程,例如花和果实的发育,抗冻性等[5,7-9]。 因此,PGIPs基因受到国内外研究者的高度重视,并成为目前抗病虫害基因工程及果实耐贮藏基因工程研究的焦点。
PGIPs属于LRR蛋白家族,因为其一般由10个左右的不完整的富含亮氨酸重复序列 (LRR)组成,每个LRR由20~30个残基组成,氨基酸序列通常为xxLxLxxNxLxGxIPxxLxxLxxL。LRR基序是与蛋白质间相互作用的区域,PGIPs通过暴露于外表面的LRR基序残基与PGs活性位点处的氨基酸残基相互作用,从而抑制PGs的活性。此外,PGIPs分子中一般包含由24~29个氨基酸组成的信号肽,其参与PGIPs分子由内质网向细胞间隙的转运[1,10]。
迄今为止, 已在水稻[6-7]、 小麦[9]、 苹果[11]、黄瓜[12]、青花菜[13]等植物中克隆获得了PGIPs基因,并在表达调控及转基因等方面进行了大量研究,但是在竹子中尚未见相关报道。竹子属于禾本科(Poaceae)竹亚科 (Bambusoideae)植物,具有生长快、产量高、竹材强度大、纤维性能好等特性,在人类经济和生活环境中发挥着重要作用[14]。随着对竹子价值的不断开发,其应用范围越来越广泛。然而,在栽培生产中,竹子因其生殖特性,一般容易形成大面积的竹子纯林,加上温暖、阴湿的生长环境,使得竹子容易遭受多种病虫害的侵袭,其中由病原真菌诱发的竹秆锈病、竹煤污病等尤为严重,使竹子的生产受到很大威胁。因此,需要对竹子有关抗病性进行研究。本研究以毛竹 (Phyllostachys edulis)为材料,获得毛竹PGIP同源基因PePGIP,在充分分析该基因结构特点的基础上,研究其组织表达特异性及其原核表达,以期为今后基因功能的研究和通过转基因技术培育抗病竹子新品种奠定基础。
1 材料与方法
1.1 植物材料
毛竹新生的根、茎、叶等材料采自江西省林科院竹种园。材料置于-70℃保存,以备毛竹DNA及总RNA的提取。
1.2 DNA、RNA提取及cDNA合成
利用 CTAB法提取毛竹叶片 DNA[15]。利用Invitrogen公司的Trizol reagent提取毛竹新鲜材料的总RNA,并根据大连TaKaRa公司的反转录试剂盒方法合成cDNA,于-20℃保存备用。
1.3 基因克隆和序列分析
根据水稻OsPGIP1序列(AM180652)在毛竹全长cDNA文库中查找同源基因序列。根据开放阅读框 ORF区域设计特异引物 PGIP-F:5'-ATGGCGTCGACCACCTCCTC-3'和 PGIP-R:5'-TCACAGCTGGTGGCACCCCT-3'。分别以毛竹基因组DNA和cDNA为模板进行PCR扩增,PCR反应体系为20 μL:10 × LA Buffer 2.0 μL, dNTPs Mixture(2.5 mM each)2.0 μL, 上下游引物 (10 μM) 各1.0 μL, 模板 1.0 μL, LA Taq DNA 聚合酶 (5 U/μL)0.2 μL, 加水至总体积 20 μL。 PCR 扩增反应条件为:94℃预变性5 min;94℃ 1 min,60℃1 min,72℃ 2 min,35个循环;72℃延伸10 min。PCR产物经琼脂糖凝胶电泳检测后用Promega公司的胶回收试剂盒回收,回收产物与pMD19-T载体连接,转化大肠杆菌(Escherichia coli)DH5α菌株。筛选阳性克隆,送上海生工进行测序。最终获得pMD19-PePGPI质粒。
通过 DNAstar软件对获得的 cDNA序列进行ORF的查找和蛋白质翻译等初步分析。在NCBI上对获得的cDNA序列进行Blast分析,将其推导的氨基酸序列与已知的PGIP蛋白在DNAMAN中进行同源性比对分析,并通过MEGA 6.0软件的Neighbor-Joining(N-J)方法进行基于PGIP氨基酸序列的系统进化树构建。
1.4 PePGIP表达检测
根据PePGIP基因的非保守区域设计引物PGIPRT-F:5′-GTGGTAACAGCTCAAAGCTAGAAGG-3′和PGIP-RT-R:5′-GTCGGTAATCCAGGTACCATGTT-3′。以毛竹根、茎、叶的cDNA为模板,采用半定量RTPCR分析PePGIP基因的组织表达特异性。反应体系如下:10 × PCR Buffer(Mg2+plus)2.0 mL, dNTP Mixture(2.5 mM each)2.0 μL, PGIP-RT-F(10 μM)1.0 μL,PGIP-RT-R(10 μM)1.0 μL, cDNA 2.0 μL, rTaq(5 U/μL)0.2 μL,H2O 11.8 μL。 反应过程:95℃预变性5 min;95℃变性30 s,61℃退火30 s,72℃延伸1 min,25个循环;72℃延伸,10 min。
1.5 PePGIP原核表达
利用PGIP-F和PGIP-R引物,以pMD19-PeGPIG质粒为模板,用高保真酶进行PCR扩增。获得PCR产物与北京全式金生物公司的pEASY-Blunt E1表达载体连接,转化大肠杆菌DH5α菌株,利用T7 promoter引物和PGIP-R引物筛选正确表达方向的阳性克隆,然后经测序确认。将构建的重组质粒pEASY-PePGIP转化到表达菌种BL21(DE3)菌株中,通过菌液PCR筛选获得阳性克隆。然后将其按1∶100的比例接种到新的LB培养基中,培养至OD600为0.6~1.0时,加入0.4 mM IPTG诱导。诱导培养6 h后,离心收集少量菌体2 mL,加入200 μL的PSB缓冲液,沸水加热5 min,裂解细胞。然后加入SDS-PAGE上样缓冲液,进行SDS-PAGE电泳分析。
2 结果和分析
2.1 PePGIP基因克隆及序列分析
通过同源序列查找,在毛竹基因组数据库获得了与水稻OsPGIP1基因同源序列FP100022,该序列全长1 370 bp,其中5′UTR长64 bp,3′UTR长298 bp,ORF长1 008 bp,拟命名为PePGIP。分别以毛竹cDNA和基因组DNA为模板,PGIP-F和PGIP-R为引物进行扩增,结果各获得1条约1 000 bp的特异性条带(图1)。测序结果表明,获得的2个片段大小均为1 008 bp,与FP100022的ORF区域完全一致,表明PePGIP基因没有内含子。
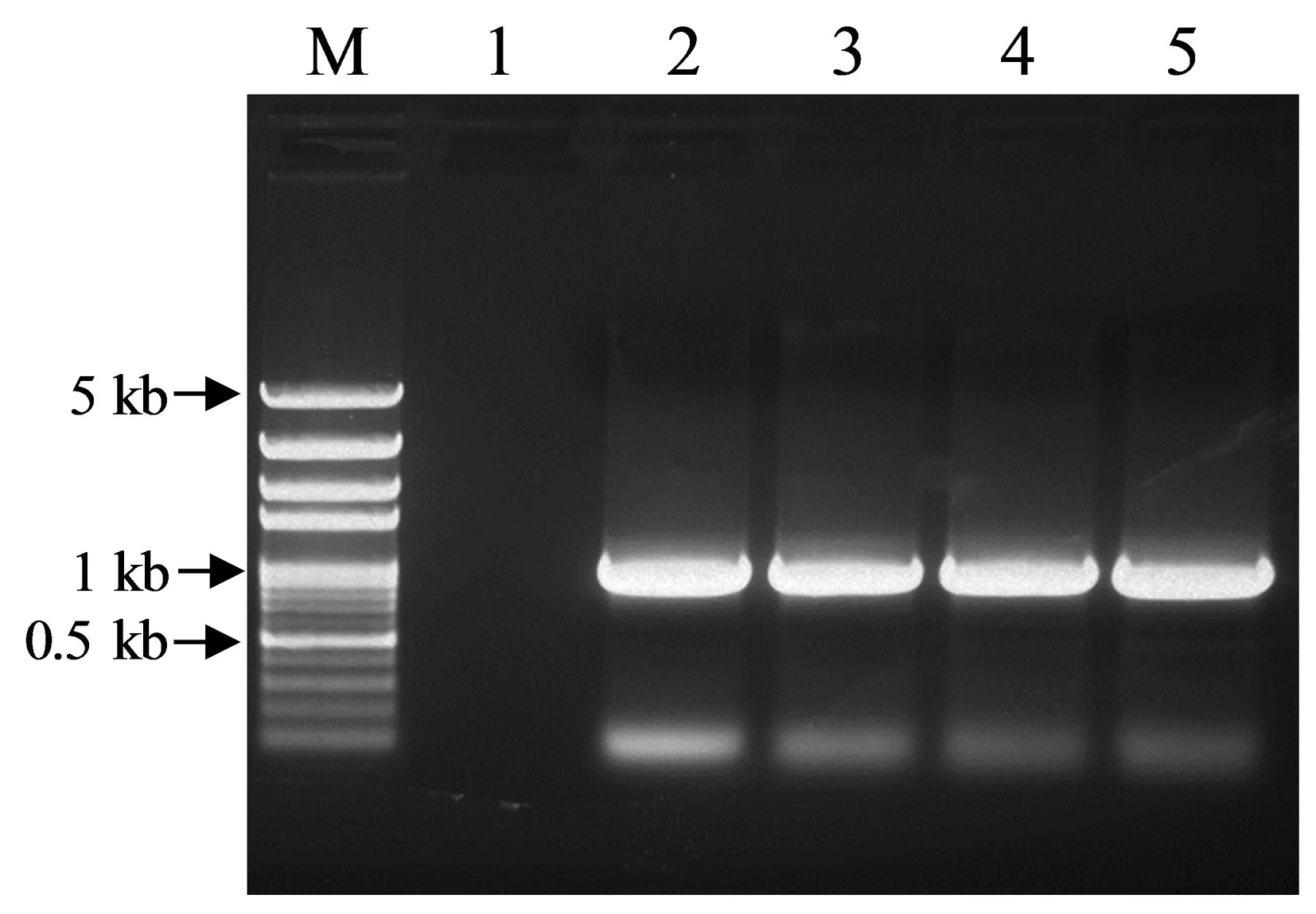
图1 毛竹PGIP基因PCR扩增
序列分析表明,PePGIP预测编码含335个氨基酸的蛋白,蛋白质分子量为36.01 kD,等电点6.79。BlastP分析结果表明,毛竹PePGIP基因所编码的PePGIP蛋白序列与二穗短柄草和水稻的序列同源性较高,分别为62%和59%。保守结构域分析结果显示,PePGIP包含8个典型的LRR结构域 (图2)。
2.2 PGIP系统进化分析
从NCBI网站下载水稻、小麦、拟南芥等不同物种的PGIP基因编码的氨基酸序列,利用Clustal X进行同源性比对,结果输入,用N-J法构建系统进化树 (图3)。从图3中可知,不同物种间PGIP序列保守性较强,同科同属的植物相似度较高,单子叶植物与双子叶植物分别聚在一起,分成2个大组。毛竹和二穗短柄草分成一组,同源关系最近。
2.3 PePGIP基因的表达分析
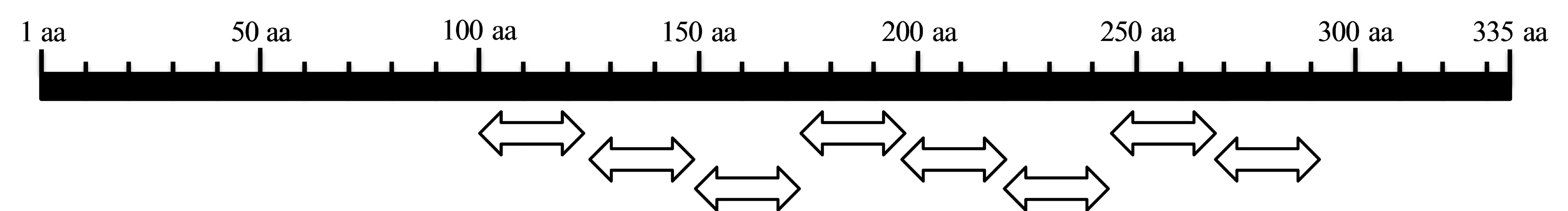
图2 PePGIP中的LRR结构域 (双向箭头)
以毛竹PeActin基因为内参基因,以克隆的毛竹PePGIP基因序列特异性设计引物,对该基因在毛竹根、茎、叶等不同组织中的表达情况进行半定量RT-PCR分析。结果发现,该基因在根、茎、叶中均有表达,在根中表达量最高,茎中表达较低,说明该基因表达具有组织特异性(图4)。
2.4 PePGIP基因原核表达分析
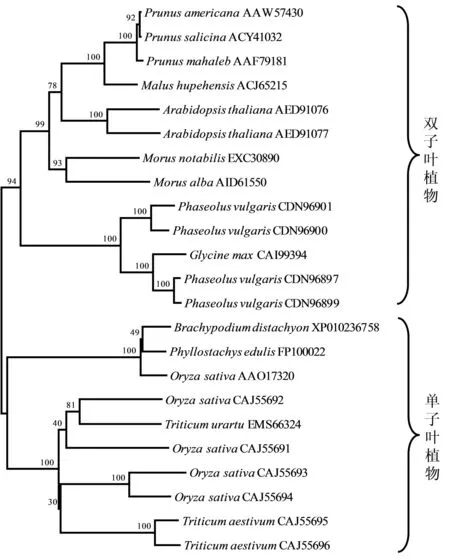
图3 基于PGIP基因编码氨基酸序列构建的系统进化树
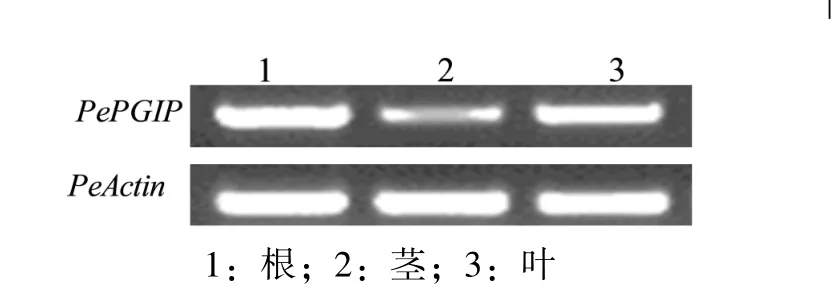
图4 PePGIP在毛竹根、茎、叶中的RT-PCR分析
利用北京全式金生物公司的pEASY-Blunt E1 Expression Kit构建了PePGIP的原核表达载体pEASY-PePGIP,并将其转化在BL21(DE3)中进行了重组蛋白表达。结果表明,经0.4 mM IPTG诱导后,含有载体pEASY-PePGIP的表达产物约在42 kDa处有一个明显的蛋白条带,包括载体自身表达蛋白约5.08 kDa和目的基因编码蛋白约36.0 kDa,这与预测的PePGIP表达融合蛋白分子量大小一致,而转化空载体的菌株未见相应蛋白表达。然而PePGIP在原核表达系统中的表达产物主要包涵体的形式出现,可溶性蛋白很少(图5)。
3 讨论
本研究从毛竹中克隆了1个新的PGIP基因,即PePGIP,该基因ORF全长为1 008 bp,没有内含子,与黄瓜[12]等物种的PGIP基因相似。PePGIP基因编码含335个氨基酸的蛋白质,蛋白序列分析结果显示,PePGIP具有8个保守的LRR结构域,属于LRR蛋白家族。同源分析表明,PePGIP与来自禾本科植物二穗短柄草和水稻PGIP序列具有较高的同源性。
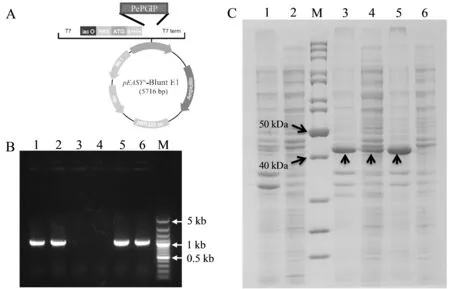
图5 PePGIP原核表达载体构建和原核表达产物SDS-PAGE分析
研究表明,PGIP基因在不同组织中的表达存在较大差异。在水稻不同组织或器官中,7个PGIP基因的表达模式各不相同,OsPGIP1和OsPGIP4在根、叶、花序中表达量较高表达,而OsPGIP3在这3个组织中表达量均很低,OsPGIP2主要在幼穗期的叶片以及根和叶鞘中表达,此外OsPGIP7在所有检测的组织中表达量都很低[16]。在黄瓜的各器官中均发现有CsPGIP的表达,在嫩叶中表达量最高,在茎中表达量最低[12]。但在种子中表达量最低,在营养芽和花中最高。白菜BnPGIP1在花蕾中表达丰度高,在根中相对较低。在本研究中毛竹PePGIP基因在根、茎、叶中均表达,但在茎中表达量最低,在根中的表达最高。这可能与土壤中含有大量的病原真菌,毛竹根系容易受到其侵染有关。
研究认为,通过体外表达获得的PGIP蛋白对黑曲霉、灰霉菌等的PGs具有抑制作用[17]。本研究通过原核表达系统获得了PePGIP重组蛋白,这有利于后续体外活性分析。然而,PePGIP体外重组蛋白主要以包涵体形式出现,可溶性蛋白很少。这不利于后续蛋白纯化等工作开展,因此需要进一步优化探索合适的PePGIP表达系统。
已有研究表明,梨PGIP基因在番茄、葡萄等植物中过量表达,能有效抑制由灰霉菌等病原菌引起的侵染[18];同时,大豆PGIP基因可以提高玉米对玉米穗腐病菌 (Stenocarpella maydis)的抗性;而葡萄的VvPGIP1、辣椒的CaPGIP1等基因的过量表达能有效降低转基因烟草对灰霉菌、炭疽菌等病菌的敏感性;牛心草的CkPGIP1基因能有效提高拟南芥对灰霉菌的抵抗力[3]。为了更好地了解PePGIP基因功能,本研究的后续试验将构建该基因正义过量表达载体,将其转入拟南芥中,研究该基因和不同病原菌间的互作关系。
[1]Matteo A D,Bonivento D,Tsernoglou D,et al.Polygalacturonaseinhibiting protein(PGIP)in plant defence:a structural view[J].Phytochemistry, 2006, 67(6):528-533.
[2]王晓红,朱攀攀,梁燕梅,等.桑树多聚半乳糖醛酸酶抑制蛋白基因MaPGIP1的克隆及功能分析[J].作物学报,2015,41(9):1361-1371.
[3]Liu N, Ma X, Zhou S,et al.Molecular and functional characterization of a polygalacturonase-inhibiting protein fromCynanchum komaroviithat confers fungal resistance in Arabidopsis[J].Plos One, 2016, 11(1):e0146959.
[4]陈瑞,李金晶,关瑞攀,等.三七多聚半乳糖醛酸酶抑制蛋白基因的克隆及表达分析[J].中草药,2016,47(24):4420-4427.
[5]Li H,Smigocki A C.Wound inducedBeta vulgaris, polygalacturonaseinhibiting protein genes encode a longer leucine-rich repeat domain and inhibit fungal polygalacturonases[J].Physiological&Molecular Plant Pathology, 2016(96):8-18.
[6]Wang R,Lu L, Pan X,et al.Functional analysis ofOsPGIP1, in rice sheath blight resistance[J].Plant Molecular Biology, 2015,87(1/2):181-191.
[7]Jang S, Lee B, Kim C,et al.TheOsFOR1 gene encodes a polygalacturonase-inhibiting protein(PGIP)that regulates floral organ number in rice[J].Plant Molecular Biology, 2003, 53(3):357-372.
[8]Mehli L,Schaart J G,Kjellsen T D,et al.A gene encoding a polygalacturonase-inhibiting protein(PGIP)shows developmental regulation and pathogen-induced expression in Strawberry[J].New Phytologist, 2004, 163(1):99-110.
[9]Janni M,Bozzini T,Moscetti I,et al.Functional characterisation of wheatPgipgenes reveals their involvement in the local response to wounding[J].Plant Biology, 2013, 15(6):1019-1024.
[10]Di Matteo A,Federici L,Mattei B,et al.The crystal structure of polygalacturonase-inhibiting protein(PGIP),a leucine-rich repeat protein involved in plant defense[J].Proceedings of the National Academy of Sciences in USA,2003,100(17):10124-10128.
[11]熊帅,张军科,谌悦.苹果PGIP基因的克隆及其在大肠杆菌中的表达[J].西北农林科技大学学报(自然科学版),2010, 38(2):123-128.
[12]贾庆利,巩振辉,李大伟,等.黄瓜CsPGIP基因的克隆及表达分析[J].西北植物学报,2012,32(1):11-16.
[13]张弢.青花菜BoPGIP1基因的分子克隆及其生物信息学分析[J].华北农学报,2009,24(4):26-30.
[14]江泽慧.世界竹藤[M].沈阳:辽宁科学技术出版社,2002:3-10.
[15]高志民,范少辉,高健,等.基于CTAB法提取毛竹基因组DNA的探讨[J].林业科学研究,2006,19(6):725-728.
[16]Lu L,Zhou F,Zhou Y,et al.Expression profile analysis of the polygalacturonase-inhibiting protein genes in rice and their responses to phytohormones and fungal infection[J].Plant Cell Reports, 2012, 31(7):1173-1187.
[17]Prabhu S A,Singh R,Kolkenbrock S,et al.Experimental and bioinformatic characterization of a recombinant polygalacturonase-inhibitor protein from pearl millet and its interaction with fungalpolygalacturonases[J].Journalof Experimental Botany, 2014, 65(17):5033-5047.
[18]Powell A L T,Kan J V, Have A T, et al.Transgenic expression of pearPGIPin tomato limits fungal colonization[J].Molecular Plant-microbe Interactions.2000, 13(9):942-950.
Cloning and Expression Analysis of PePGIP from Phyllostachys edulis
Dong Nansong1,2Liao Meizhen1,2Lou Yongfeng1,3Xiao Fuming1,3
(1 Jiangxi Provincial Key Lab for Plant Biotechnology, Nanchang 330013, Jiangxi, China;2 Chenshan Forest Farm, Anfu 360830, Jiangxi, China;3 Jiangxi Academy of Forestry, Nanchang 330013, Jiangxi, China)
Polygalacturonase inhibiting protein(PGIP)is one of important plant defense proteins,which plays an important role in the defense of fungi.Based on the sequence alignment method,a homologous gene ofPGIPwas obtained from the full length cDNA database ofPhyllostachys edulisand named asPePGIP(FP100022).The full length of cDNA ofPePGIPis 1370 bp including an open reading frame(ORF)of 1008 bp,which encodes a predicted protein of 335 amino acids with a calculated molecular weight of 36.0 kDa.Sequence analysis showed that there were 8 conserved leucine-rich repeats, indicating that it belongs to the eLRR superfamily.PePGIP had higher homology as PGIPs from other gramineous plants did,which was clustered in the clade with those ofBrachypodium distachyumandOryza sativa.RT-PCR analysis showed thatPePGIPwas expressed in roots, culms and leaves ofP.edulis, with the highest level in roots.The prokaryotic expression vector plasmid of pEASY-PePGIP was constructed and then transformed intoEscherichia colistrain BL21(DE3).The analysis of SDS-PAGE showed that the recombinant protein was around 42 kDa after being induced by IPTG.This study lays a foundation for an in-depth understanding ofPePGIPfunction.
Phyllostachys edulis,PGIP, cloning, expression analysis
10.13640/j.cnki.wbr.2017.05.002
江西省自然科学基金 (编号:20171BAB214033)。
董南松,男,主要从事林木遗传育种研究。
娄永峰,男,主要从事林木遗传育种研究。E-mail:330403612@qq.com。
