桉树杂交种对桉树枝瘿姬小蜂的抗性变异分析
2017-11-03李晓琼刘亚珍梁水清温远光周晓果朱宏光郭文锋
李晓琼,刘亚珍,梁水清,温远光,周晓果,朱宏光,熊 涛,郭文锋
1 广西大学林学院,南宁 530001 2 广西农科院广西作物遗传改良生物技术重点开放实验室,南宁 530007 3 广西友谊关森林生态系统定位观测研究站,凭祥 532600 4 广西国有东门林场,扶绥 532100
桉树杂交种对桉树枝瘿姬小蜂的抗性变异分析
李晓琼1,3,刘亚珍1,3,梁水清1,3,温远光1,3,周晓果1,3,朱宏光1,3,熊 涛4,郭文锋2,*
1 广西大学林学院,南宁 530001 2 广西农科院广西作物遗传改良生物技术重点开放实验室,南宁 530007 3 广西友谊关森林生态系统定位观测研究站,凭祥 532600 4 广西国有东门林场,扶绥 532100
植物种间杂交是一种普遍自然现象,杂交往往造成植物表型及生理变异,从而改变杂种抗虫性。与亲本种相比,杂种抗虫性可能增强或减弱,也有可能处于与亲本相似水平。初生、次生代谢物的质变与量变是引起杂种抗虫性变异的重要原因。近年来,桉树杂交育种已在世界范围内广泛应用并取得了显著成效,桉树杂交种间抗虫性表现参差不齐,因此,桉树是研究杂交种抗虫性变异机制的理想材料。以2个桉树杂交种巨细桉DH201- 2、巨尾桉G9及桉树重要害虫桉树枝瘿姬小蜂为研究对象,比较了2个杂交种与其纯亲本种[(巨桉×细叶桉),(巨桉×尾叶桉)]间的抗虫性差异;同时,综合比较了品系间叶片性状(叶片厚度、含水率、比叶面积)、初生化合物(C、N、可溶性糖、可溶性蛋白)及次生化合物(总酚、单宁)差异,以研究桉树杂交种抗虫性变异的理化机制。结果表明:DH201- 2感染桉树枝瘿姬小蜂的虫瘿数目显著高于其双亲本种,而G9上虫瘿数目显著低于其双亲本种。DH201- 2与G9的叶片厚度与巨桉相近,而显著薄于另一亲本种。DH201- 2叶片含水率显著高于细叶桉、与巨桉相近;G9叶片含水率则显著低于其双亲本种。相似的是,DH201- 2和G9的比叶面积均显著高于其双亲本种。初生化合物方面,DH201- 2叶片可溶性糖和可溶性蛋白含量均显著高于其亲本种,N含量则仅高于细叶桉;而G9叶片可溶性蛋白含量虽高于其双亲本种,可溶性糖含量则无显著差异,N含量显著低于其双亲本种。次生化合物方面,DH201- 2叶片总酚和单宁含量显著低于其双亲本种,而G9则显著高于其双亲本种。因此,与其亲本种相比,DH201- 2感虫性增加,而G9抗虫性增加;与桉树枝瘿姬小蜂发育相关的营养指标(如含水率、可溶性糖、N含量)及次生防御物质(如总酚、缩合单宁)在桉树杂交种组织内的含量差异影响了桉树杂交种对桉树枝瘿姬小蜂的抗性。在全球推行桉树杂交育种且桉树害虫数量逐年增加的大背景下,应加强对桉树杂交种抗虫性机制研究,为选育高抗品系及桉树产业可持续发展提供理论指导。
杂交育种;桉树;桉树枝瘿姬小蜂;抗虫性;初生化合物;次生化合物
杂交普遍存在于天然植物种群中,是植物遗传改良的一种重要方式。杂交种由于组合了两个亲本的优良基因,在生长势、生活力、繁殖力、抗逆性和品质上往往表现得比双亲更优越[1]。人工杂交育种在农、林业也得到广泛运用[2-4]。杂交通过基因种间融合和遗传重组形成新等位基因及表型,增加了杂种遗传多样性,从而影响植食性昆虫的多度及丰度[5]。与其亲本种相比,杂种抗虫性可能增强或减弱,也有可能处于中间水平或与双亲相似水平[6]。杂交是促使植物物理、化学抗性进化的重要原因之一,有研究表明杂交能使植物次生代谢物质发生量变和质变[5,7-8],从而影响杂交种抗虫性。然而,目前关于杂交种抗虫性及变异机制的研究相对较少[9-12]。
桉树(Eucalyptusspp.)种类繁多,具有广阔的遗传基础,加之桉树种间亲合力极强,极易通过人工授粉实现种间杂交产生杂种优势,因此,桉树杂交育种在世界范围内一直备受关注,且已取得了显著成效[3,13-14]。近年来,我国华南地区大力发展桉树杂交育种,筛选的多种优良杂交无性系已用于大规模造林,并取得了较好经济效益。这些桉树优良杂种品系在速生性、萌芽率、浆产率等方面表现出显著的性状优势[3]。桉树杂种品系间抗虫性差异也很大[15-16],大多数昆虫更倾向于感染桉树杂种[4],通过杂交育种筛选出高抗品系具有广阔前景。在全球推行桉树杂交育种且桉树害虫数量逐年增加的大背景下[17],研究桉树杂交种抗虫性变异的理化机制,将能为研究桉树抗虫、筛选高抗优良品种提供理论指导。
桉树枝瘿姬小蜂(LeptocybeinvasaFisher et La Salle)是一种起源于澳洲的重要桉树害虫,至今已在欧洲、亚洲、非洲等20多个国家和地区均有分布[18]。由于该害虫能危害多种桉树品系,并在植物嫩枝、叶柄及叶脉上形成虫瘿,后期能导致植株枝叶变形、矮化、甚至死亡,每年给全球桉树产业造成巨大经济损失[18-19]。杂交种巨细桉DH201- 2(E.grandis×E.tereticornis)、巨尾桉G9(E.grandis×E.urophylla)是两种优良杂交无性系,由于长势快,近年来在我国南方地区被用于大规模造林种植。但实践发现,DH201- 2特别容易感染桉树枝瘿姬小蜂,而G9对桉树枝瘿姬小蜂的抗性较强。因此,本文选用DH201- 2和G9为研究对象,比较了2个杂交种与其纯亲本种[(巨桉E.grandis、细叶桉E.tereticornis),(巨桉E.grandis、尾叶桉E.urophylla)]对桉树枝瘿姬小蜂的抗性差异;同时,系统比较了品系间叶片性状(叶片厚度、含水率、比叶面积)、初生化合物(C、N、可溶性糖、可溶性蛋白)及次生化合物(总酚、单宁)差异,以研究桉树杂交种抗虫性变异的理化机制,为筛选桉树抗虫品系及杂交育种提供理论指导。
1 实验方法
1.1 供试苗木
桉树纯种品系巨桉E.grandis、尾叶桉E.urophylla、细叶桉E.tereticornis由广西国有东门林场提供,杂交种DH201- 2、G9由广西壮族自治区林业科学研究院提供。苗木高度约为40 cm左右,并于2015年4月份在广西大学林学院苗圃内进行试验。将供试苗木植入20 cm×15 cm塑料盆中,基质为壤土:草炭土1∶1混合。每天浇水,以保证苗木正常生长。
1.2 杂交种与亲本种间抗虫性差异比较
每种桉树品系各80盆,随机摆放。将其中40盆苗木置于开放条件下,并每隔1周轮换苗木位置,以让其均匀感染虫瘿。剩余40盆用100目网罩罩上,避免感染虫瘿。2个月后,平均苗木高度达到了1—1.2 m左右。从笼罩外每株桉树品系树冠中部东、南、西、北4个方位分别剪取一枝长度为35 cm的枝条,用自封袋封装,做上标记,迅速带回室内。统计每个枝条上的虫瘿数(包括枝条、叶片、叶脉、叶柄上的虫瘿),计算样枝平均虫瘿数。
1.3 叶片性状比较
从笼罩内未感染虫瘿的植株上选择完全伸展的第4至第5片叶,将叶片用剪刀剪下,并置于两片湿润滤纸之间,用自封袋封装。叶片储藏于冰盒内,迅速带回实验室。剪去叶柄,在万分之一电子天平上称重(g)。采用美国LI-COR公司生产的LI- 3000C便携式叶面积仪测定叶面积(cm2),采用游标卡尺测定叶片厚度(mm)。最后将叶片放入60℃烘箱内烘干至恒重称重(g)。叶片含水率、比叶面积计算公式分别为:


1.4 化学分析
测定项目为不同品系叶片C含量、N含量、可溶性糖、可溶性蛋白、总酚和缩合单宁含量。从笼罩内未感染虫瘿的植株上选择完全伸展的第4至第5片叶,将叶片置于50℃烘箱内烘干,5d之后取出,用粉碎机将叶片磨成粉末后进行化学物质测定。其中,C、N含量(%)由德国ELEMENTAR元素分析仪测定,并计算C/N比;采用蒽酮比色法测定可溶性糖含量(%)[20];采用考马斯亮蓝G- 250比色法测定可溶性蛋白含量(%)[21]。总酚和单宁含量则采用Folin-Ciocalteu法进行测定(%)[22]。
1.5 数据统计
为了分别比较杂交种DH201- 2、G9与其双亲本种[(巨桉、细叶桉)、(巨桉、尾叶桉)]间抗虫性差异,采用单因素方差分析比较品系间样枝平均虫瘿数差异。采用单因素方差分析比较杂交种DH201- 2、G9与其亲本种间叶片性状(含水率、叶片厚度,比叶面积)、初生化合物(可溶性糖、可溶性蛋白、C、N、C/N比)、次生化合物(总酚、单宁)含量差异。差异显著水平为P=0.05。对差异显著的因变量,采用S-N-K多重比较法分析品系间同一指标差异。所有数据均采用SPSS 18.0进行统计分析,并用Sigmaplot 12.5绘图。
2 结果与分析
2.1 杂交种与亲本种间抗虫性比较
DH201- 2、G9的样枝平均虫瘿数与其双亲本种相比均差异显著。桉树枝瘿姬小蜂能在巨桉、尾叶桉、细叶桉、DH201- 2上形成明显虫瘿,但并不能在G9上产生虫瘿。DH201- 2上平均每枝虫瘿数显著高于其亲本种巨桉和细叶桉(F2,117=12.088,P<0.001),因此,DH201- 2感虫性显著增强(图1);与此相反,姬小蜂在G9上并不能产生虫瘿,而其双亲本种巨桉和尾叶桉平均每枝虫瘿数分别为10.2个/枝和3.4个/枝,与其双亲本种相比,G9抗虫性显著增强(F2,117=35.276,P<0.001)(图1)。
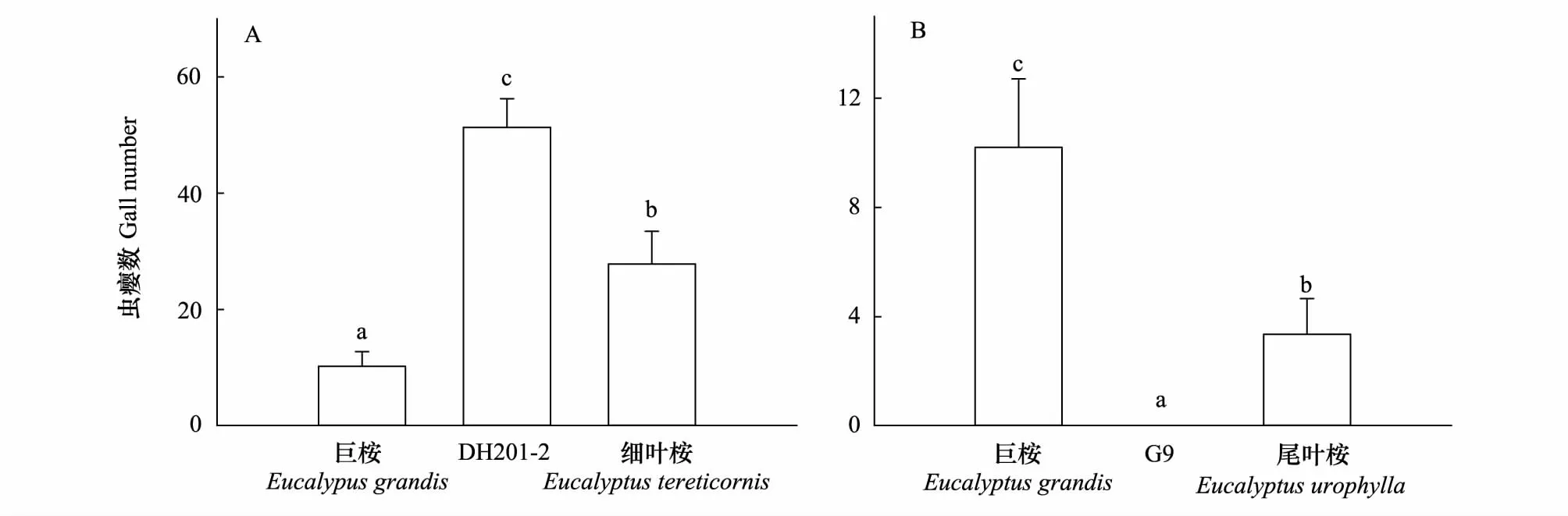
图1 桉树杂交种DH201- 2、G9及其双亲本种平均每枝虫瘿数比较Fig.1 Comparisons of the mean gall numbers per branch among hybrids DH201- 2, G9 and their two parental species数值代表平均值±标准误(n=200),不同字母表示多重比较结果在P<0.05水平差异显著
2.2 杂交种与亲本种间叶片性状比较
DH201- 2叶片厚度与巨桉相近,而显著薄于细叶桉(F2,117=12.088,P<0.001)(图2);叶片含水率也与巨桉相近,但显著低于细叶桉(F2,117=113.639,P<0.001)(图2)。G9叶片厚度与其亲本种之一巨桉相近,而显著薄于尾叶桉(F2,117=35.276,P<0.001)(图2);叶片含水率则显著低于巨桉和尾叶桉(F2,117=72.316,P<0.001)(图2)。相似的是,DH201- 2和G9叶片比叶面积均显著高于其双亲本种(DH201- 2:F2,117=9.314,P<0.001;G9:F2,117=7.192,P=0.001);巨桉与尾叶桉、巨桉与细叶桉叶片比叶面积则无显著差异(图2)。
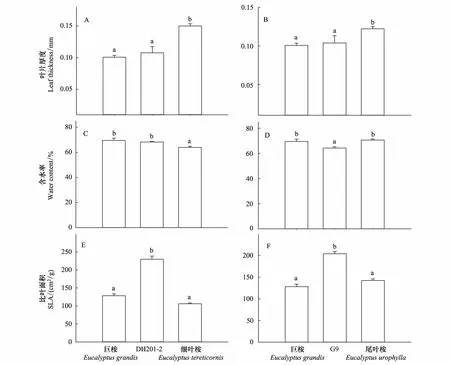
图2 桉树杂交种DH201- 2、G9与其双亲本种叶片性状比较Fig. 2 Comparisons of leaf traits among hybrids DH201- 2, G9 and their two parental species数值代表平均值±标准误(n=200),不同字母表示多重比较结果在P<0.05水平差异显著
2.3 杂交种与亲本种间初生化合物含量比较
DH201- 2叶片可溶性糖(F2,117=33.652,P<0.001)和可溶性蛋白含量(F2,117=135.602,P<0.001)均显著高于其两个亲本种,而巨桉和细叶桉叶片中两种化合物含量则处于相似水平(图3)。G9叶片可溶性蛋白含量显著高于其两个亲本种(F2,117=17.500,P<0.001),但可溶性蛋白含量在巨桉和尾叶桉叶片中无显著差异(图3);G9叶片可溶性糖含量与巨桉和尾叶桉处于相近水平,但尾叶桉叶片可溶性糖含量要显著高于巨桉(F2,117=4.592,P=0.019)(图3)。
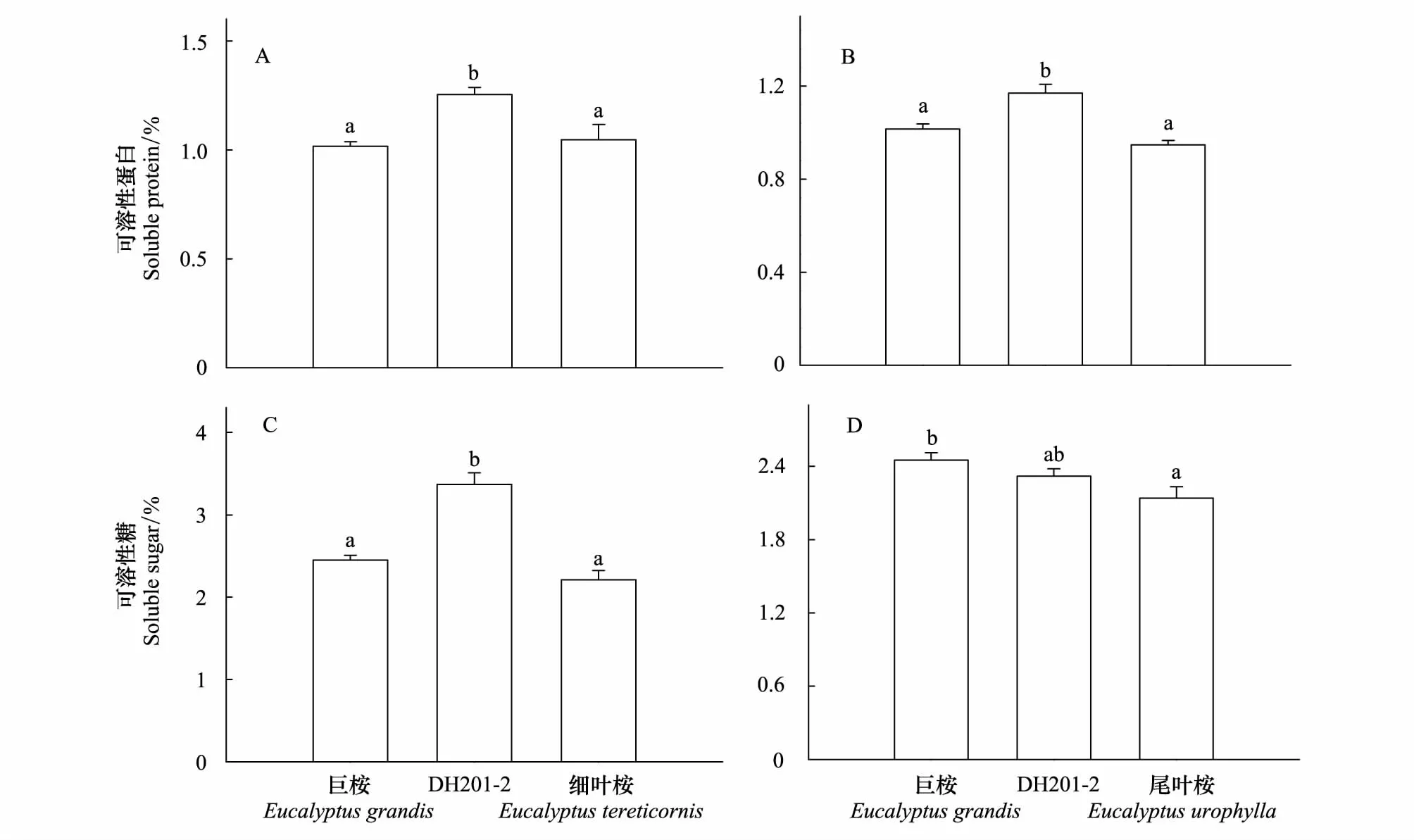
图3 桉树杂交种DH201- 2、G9与其双亲本种间叶片可溶性糖、可溶性蛋白含量比较Fig.3 Comparisons of the soluble sugar and soluble protein concentrations in leaves among hybrids DH201- 2, G9 and their two parental species数值代表平均值±标准误(n=200),不同字母表示多重比较结果在P<0.05水平差异显著
DH201- 2叶片N含量显著高于细叶桉(F2,117=443.068,P<0.001)、C/N比则显著低于细叶桉(F2,117=281.134,P<0.001),N含量及C/N比与另一个亲本种巨桉则处于相似水平(图4)。与此相反,G9叶片N含量显著低于两个亲本种(F2,117=652.38,P=0.001)、C/N比则显著高于双亲本种(F2,117=429.485,P<0.001);巨桉与尾叶桉叶片内N含量及C/N比则无显著差异(图4)。DH201- 2和G9叶片C含量与其双亲本种相比均无显著差异(DH201- 2:F2,117=4.771,P=0.10;G9:F2,117=14.354,P=0.46)。
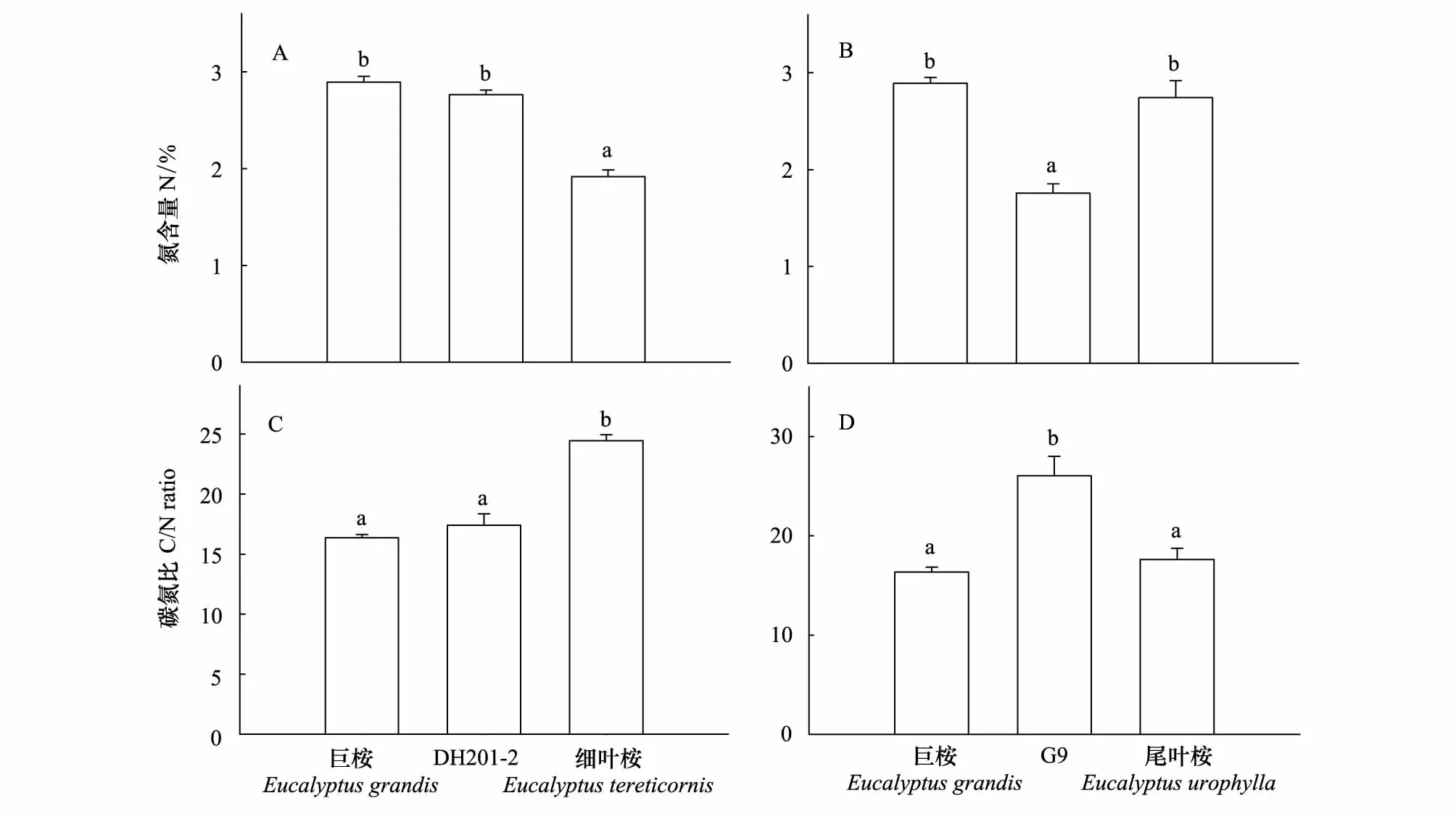
图4 桉树杂交种DH201- 2、G9与其双亲本种叶片N含量及C/N比值比较Fig.4 Comparisons of the nitrogen content and the C/N ratio in leaves among hybrids DH201- 2, G9 and their two parental species数值代表平均值±标准误(n=200),不同字母表示多重比较结果在P<0.05水平差异显著
2.4 杂交种与亲本种间次生化合物含量比较
DH201- 2叶片总酚和缩合单宁含量显著低于其双亲本种(总酚F2,117=48.926,P<0.001;单宁F2,117=7.529,P=0.001)(图5);而G9叶片总酚和缩合单宁含量则显著高于其两个亲本种(总酚F2,117=28.605,P<0.001;单宁F2,117=42.428,P<0.001)(图5);缩合单宁、总酚含量在巨桉与细叶桉、巨桉与尾叶桉间则无显著差异(图5)。
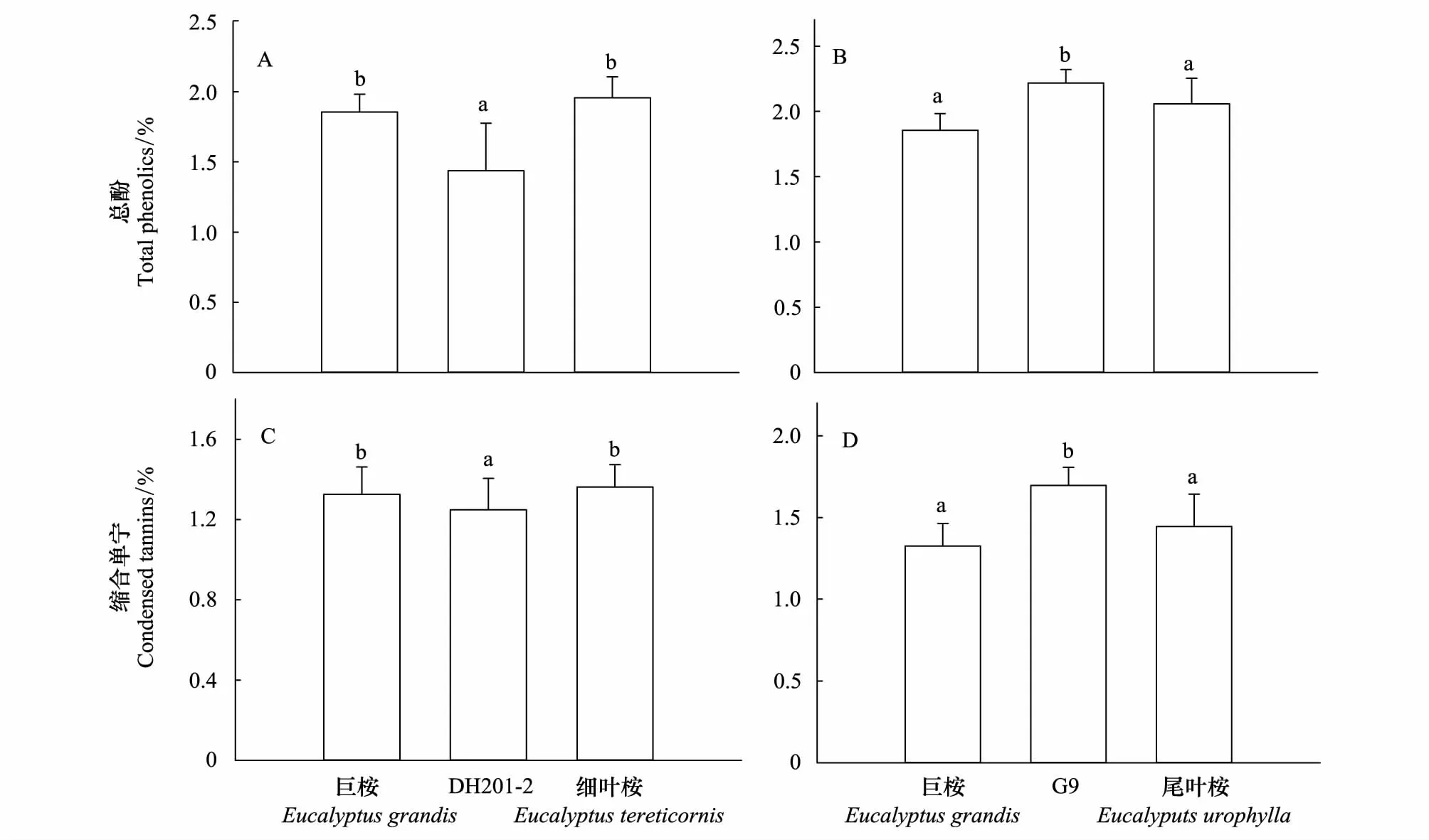
图5 桉树杂交种DH201- 2、G9与亲本种叶片总酚、缩合单宁含量比较Fig.5 Comparisons of the concentrations of leaf total phenolics and condensed tannins among hybrids DH201- 2, G9 and their parental species数值代表平均值±标准误(n=200),不同字母表示多重比较结果在P<0.05水平差异显著
3 讨论
杂种品系由于结合了双亲本性状而在抗虫性强弱方面表现出很大差异。与亲本种相比,杂种抗虫性可能增强(R型),也可能感虫性增强(S型),也可能因抗性加性遗传而使杂种抗虫性处于双亲中间水平(A型)。在有些情况下,杂种抗虫性还可能与亲本之一(D型)或双亲相似(N型)[6, 9-10]。有研究表明杂交种抗性水平表现出N型(22%)、A型(21.7%)、S型(22.4%)的比例要远远高于R型[7]。本文中,杂交种DH201- 2每枝平均虫瘿数显著高于其双亲本,属于杂交感虫性(S型)(图1A);而桉树枝瘿姬小蜂不能在G9上产生虫瘿,与双亲本种相比抗虫性增强,属于杂交抗虫性(R型)(图1)。以往研究也发现,相对于桉树纯种品系,大部分昆虫更易感染杂种品系[5]。1994年,Dungey等人[23]发现天然桉树杂交种感染植食性昆虫的种类、数量均显著高于纯亲本种。总体说来,桉树纯种及杂交种品系间对桉树枝瘿姬小蜂的抗性差异很大,主要表现在是否能产生虫瘿及产生虫瘿数量多少等方面[24-26]。因此,通过杂交育种选育出对桉树枝瘿姬小蜂高抗的优良品系具有广阔前景。
杂交被认为是使植物化学抗性进化的重要原因之一。杂交能使植物次生代谢物质发生质和量的变化[7-8]。Orians等对31篇文章中涉及的80种杂种次生化合物进行比较发现60%杂种至少有一种次生代谢物质消失,40%杂种产生了至少一种新次生代谢物质[8]。次生防御物质种类和含量变化是桉树杂交种抗虫性发生变异的重要原因[27]。Dungey等通过同质园调查表明30种节肢动物在桉树杂交种E.amygdalina×E.risdonii上的多样性表现为F1>F2>亲本[5]。Dungey和Potts[27]发现桉象(Gonipterusscutellatus)在E.amygdalina×E.risdoniiF1代上的感虫率、产卵率均显著高于其亲本,但在F1与F2代间则没有显著差异,认为杂种F1感虫性增强是由于杂交改变了桉树防御水平。单宁和总酚是桉树中两种重要的次生防御性物质[16,28]。在本研究中,DH201- 2叶片内单宁、总酚含量显著低于其双亲本巨桉和细叶桉(图5),而G9叶片内单宁、总酚含量显著高于其双亲本巨桉和尾叶桉(图5)。王伟等[28]、张华峰等[16]均发现桉树抗虫品系中黄酮、单宁、总酚等次生代谢物质含量要显著高于高感品系。因此,次生代谢物质含量变化会影响桉树对桉树枝瘿姬小蜂的抗性强弱。
除了次生防御,初生代谢物质如可溶性糖、可溶性蛋白质、氨基酸等也能影响寄主植物的营养水平和适口性,从而影响昆虫取食发育[29-30]。有研究认为,植物低水平的营养状况本身也构成一种防御[30]。本文中,杂交种DH201- 2叶片可溶性糖和可溶性蛋白含量均显著高于其双亲本种(图3),N含量则仅高于细叶桉、与巨桉处于相似水平(图4);而G9叶片可溶性蛋白含量虽高于其双亲本种(图3),可溶性糖含量则无显著差异(图3),N含量显著低于其双亲本种(图4),C/N比显著高于其双亲本种(图4)。由此说明,与昆虫发育密切相关的初生代谢物如可溶性糖、可溶性蛋白、N含量及C/N比在杂交后代中的表达量也是影响杂交种抗虫性变化的重要因素。由于DH201- 2叶片营养特性更适合桉树枝瘿姬小蜂寄生和发育,使得其感虫性增强。王伟等[28]指出桉树叶营养物质及次生代谢物质含量与对桉树枝瘿姬小蜂的抗性有关。张华峰等[16]认为多糖对桉树枝瘿姬小蜂生长发育影响较大,单宁则影响到桉树抗虫性强弱。因此,营养物质与次生防御物质种类和数量综合变化影响了桉树对桉树枝瘿姬小蜂的抗性。
叶片特征如叶片厚度、腊质、绒毛及叶片结构生理特征也能影响植物抗虫性[31]。赵杰军等发现白蜡虫容易取食叶片光滑肥厚、叶脉发达的寄主植物[32]。常金华等[33]发现高粱叶片上单位面积的茸毛密度及长度与高粱对蚜虫的抗性相关。张觉晚等[34]发现茶树叶片栅栏组织和海绵组织、厚角组织层数越多,茶树对假眼小绿蝉的抗性越强。本文中,DH201- 2和G9叶片厚度均与其亲本之一巨桉相近,而显著薄于另一个亲本细叶桉或尾叶桉(图2)。相似的是,DH201- 2和G9叶片比叶面积均显著高于其双亲本种(图2),说明叶片厚度及比叶面积并不是影响桉树对桉树枝瘿姬小蜂抗性变化的关键因素。植物比叶面积大小直接反应了叶片截获光源的能力以及在强光下的自我保护能力。同时,比叶面积也反映了单位干物质量下的叶面积大小,比叶面积越大,单位干物质量下的叶面积也越大,因此叶片也越薄,叶片密度就越低[35]。有研究表明,植物抗虫性与叶片比叶面积成负相关关系[36]。此外,植物组织水分含量对昆虫取食发育也能产生极大影响[37],张华峰等[38]认为桉树枝瘿姬小蜂寄生在叶柄部位多于叶片,说明桉树枝瘿姬小蜂喜寄生于含水率相对较高的部位。陈汉章等[39]通过测定不同桉树品系叶片和叶柄结构特征发现含水率与对桉树枝瘿姬小蜂的抗性成反比。本文发现感虫品系DH201- 2叶片含水率显著高于其亲本种之一细叶桉,而抗虫品系G9叶片含水率显著低于两亲本种(图2),说明因含水率引起的植物适口性差异也是影响桉树杂交种对桉树枝瘿姬小蜂抗性变异的重要原因。
受昆虫诱导后植物品系间生理生化差异响应也与植物抗虫性强弱有关[40]。桉树在遭受桉树枝瘿姬小蜂危害后,会使桉树组织结构、生理生化发生一系列变化。桉树枝瘿姬小蜂成虫寄生会使虫瘿组织内营养成分(如可溶性总糖、游离氨基酸、叶绿素等)、次生化合物(如类黄酮、单宁、缩合单宁等)含量发生变化[41-42],并改变过氧化氢酶(CAT)、过氧化物酶(POD)、超氧化物歧化酶(SOD)等活性[30]。桉树枝瘿姬小蜂寄生还能诱导桉树产生3 种挥发性物质,其中以萜品油烯含量最高[43]。这一系列生理生化变化在感虫品系与抗虫品系间也存在极大差异。吴耀军等[42]发现感虫品系叶片缩合单宁含量能在感虫后大幅升高,达到与抗虫品系相近水平。陈汉章等[39]发现感虫品系受害后叶柄和叶片蜡质含量会降低。因此,尚需要进一步比较感虫与抗虫桉树杂交品系被桉树枝瘿姬小蜂寄生后的理化诱导响应,以便深入阐明桉树杂交种抗虫性变异机制。
4 结论
本文通过比较2个桉树杂交种巨细桉DH201- 2、巨尾桉G9与其纯亲本种对桉树枝瘿姬小蜂的抗性差异,并综合比较了品系间几种有代表性的叶片性状、初生化合物及次生化合物含量差异,以研究桉树杂交种抗虫性变异的理化机制。通过方差分析和多重比较结果表明,与其亲本种相比,DH201- 2感虫性增加,而G9抗虫性增加;与桉树枝瘿姬小蜂发育密切相关的营养物质(如含水率、可溶性糖、N含量)及次生防御物质(如总酚、缩合单宁)在桉树杂交种组织内含量差异影响了桉树杂交种对桉树枝瘿姬小蜂的抗性。目前,桉树枝瘿姬小蜂在全球分布范围已越来越广[16, 18, 44],给桉树产业带来严重威胁[19, 45]。因此,在未来我们应加强对桉树杂交种抗虫性机制研究,为选育高抗品系及桉树产业可持续发展提供理论指导。
[1] 崔会会, 项超, 石英尧, 王文生, 高用明. 杂种优势形成的表观遗传学研究进展. 植物遗传资源学报, 2015, 16(5): 933- 939.
[2] 李善文, 张志毅, 何承忠, 安新民. 中国杨树杂交育种研究进展. 世界林业研究, 2004, 17(2): 37- 41.
[3] 申文辉. 东门桉树人工杂交育种研究. 桉树科技, 2000, (1): 34- 39.
[4] 杨章旗. 我国南方松树杂交育种研究进展及发展趋势. 广西林业科学, 2001, 30(4): 183- 185.
[5] Dungey H S, Potts B M, Whitham T G, Li H F. Plant genetics affects arthropod community richness and composition: evidence from a synthetic eucalypt hybrid population. Evolution, 2000, 54(6): 1938- 1946.
[6] Fritz R S. Resistance of hybrid plants to herbivores: genes, environment, or both? Ecology, 1999, 80(2): 382- 391.
[7] Cheng D D, Vrieling K, Klinkhamer P G L. The effect of hybridization on secondary metabolites and herbivore resistance: implications for the evolution of chemical diversity in plants. Phytochemistry Reviews, 2011, 10(1): 107- 117.
[8] Orians C M. The effects of hybridization in plants on secondary chemistry: implications for the ecology and evolution of plant-herbivore interactions. American Journal of Botany, 2000, 87(12): 1749- 1756.
[9] Fritz R S, Moulia C, Newcombe G. Resistance of hybrid plants and animals to herbivores, pathogens, and parasites. Annual Review of Ecology and Systematics, 1999, 30: 565- 591.
[10] Fritz R S, Nichols-Orians C M, Brunsfeld S J. Interspecific hybridization of plants and resistance to herbivores: hypotheses, genetics, and variable responses in a diverse herbivore community. Oecologia, 1994, 97(1): 106- 117.
[11] 王亦学, 郝曜山, 杜建中, 张欢欢, 吴家和, 秦永军, 孙毅. 转人工改造的Bt Cry1Ac基因中林美荷杨的获得及其抗虫性分析. 中国农学通报, 2014, 30(28): 23- 28.
[12] 张文辉, 刘光杰. 水稻抗虫性遗传与育种研究应用. 中国农学通报, 2001, 17(3): 53- 57.
[13] 谢耀坚. 中国桉树育种研究进展及宏观策略. 世界林业研究, 2011, 24(4): 50- 54.
[14] Potts B M, Dungey H S. Interspecific hybridization ofEucalyptus: key issues for breeders and geneticists. New Forests, 2004, 27(2): 115- 138.
[15] 刘慧清. 不同桉树种质对桉树枝瘿姬小蜂的抗性研究[D]. 海南: 海南大学, 2012.
[16] 张华峰. 桉树枝瘿姬小蜂侵害机理及寄主桉树化学防御研究[D]. 福州: 福建农林大学, 2013.
[17] Wingfield M J, Slippers B, Hurley B P, Coutinho A, Wingfield B D, Roux J. Eucalypt pests and diseases: growing threats to plantation productivity. Southern Forests: A Journal of Forest Science, 2008, 70(2): 139- 144.
[18] Mendel Z, Protasov A, Fisher N, Salle J L. Taxonomy and biology ofLeptocybeinvasagen. & sp. n. (Hymenoptera: Eulophidae), an invasive gall inducer onEucalyptus. Australian Journal of Entomology, 2004, 43(2): 101- 113.
[19] 常润磊, 周旭东. 桉树枝瘿姬小蜂国外研究现状. 中国森林病虫, 2010, 29(1): 22- 25.
[20] 李合生. 植物生理生化实验原理和技术. 北京: 高等教育出版社, 2000.
[21] 曲春香, 沈颂东, 王雪峰, 崔永华, 宋卫平. 用考马斯亮蓝测定植物粗提液中可溶性蛋白质含量方法的研究. 苏州大学学报: 医学版, 2006, 22(2): 82- 85.
[22] Makkar H P S. Quantification of tannins in tree and shrub foliage: a laboratory manual. Netherlands: Springer, 2003.
[23] Whitham T G, Morrow P A, Potts B M. Plant hybrid zones as centers of biodiversity: the herbivore community of two endemic Tasmanian eucalypts. Oecologia, 1994, 97(4): 481- 490.
[24] Thua P Q, Dellb B, Burgess T I. Susceptibility of 18 eucalypt species to the gall waspLeptocybeinvasain the nursery and young plantations in Vietnam. Science Asia, 2009, 35: 113- 117.
[25] Nyeko P, Mutitu E K, Day R K. Eucalyptus infestation byLeptocybeinvasain Uganda. African Journal of Ecology, 2009, 47(3): 299- 307.
[26] Nyeko P, Mutitu K E, Otieno B O, Ngae G N, Day R K. Variations inLeptocybeinvasa(Hymenoptera: Eulophidae) population intensity and infestation on eucalyptus germplasms in Uganda and Kenya. International Journal of Pest Management, 2010, 56(2): 137- 144.
[27] Dungey H S, Potts B M. Eucalypt hybrid susceptibility toGonipterusscutellatus(Coleoptera: Curculionidae). Austral Ecology, 2003, 28(1): 70- 74.
[28] 王伟, 徐建民, 李光友, 韩超, 吴世军, 陆钊华. 桉树枝瘿姬小蜂危害对桉树次生代谢产物含量的影响. 热带亚热带植物学报, 2013, 21(6): 521- 528.
[29] 陈建明, 俞晓平, 程家安, 郑许松, 徐红星, 吕仲贤, 张珏锋, 陈列忠. 植物耐虫性研究进展. 昆虫学报, 2005, 48(2): 262- 272.
[30] 王梦军, 宛新荣, 钟文勤. 食草动物与植物的相互关系. 生态学杂志, 2001, 20(5): 39- 43.
[31] 张风娟, 陈凤新, 徐东生, 霍志梅. 植物组织结构与抗虫性的关系(综述). 河北科技师范学院学报, 2006, 20(2): 71- 76.
[32] 赵杰军, 陈晓鸣, 王自力. 白蜡虫7种寄主植物叶片解剖结构与寄主选择性的关系. 热带亚热带植物学报, 2012, 20(3): 247- 255.
[33] 常金华, 张丽, 夏雪岩, 李荣改, 罗耀武, 刘国庆. 不同基因型高粱植株的物理性状与抗蚜性的关系. 河北农业大学学报, 2004, 27(2): 5- 7.
[34] 张觉晚, 王沅江, 黄亚辉. 茶树抗虫品种资源调查及抗性机制研究——I. 茶树品种对假眼小绿叶蝉抗性的筛选、鉴定. 茶叶通讯, 1994, (1): 2- 5.
[35] Hassan A M J, Nawab K, Ali A. Response of specific leaf area (SLA), leaf area index (LAI) and leaf area ratio (LAR) of maize (ZeamaysL.) to plant density, rate and timing of nitrogen application. World Applied Sciences Journal, 2007, 2(3): 235- 243.
[36] Krebs C, Gerber E, Matthies D, Schaffner U. Herbivore resistance of invasiveFallopiaspecies and their hybrids. Oecologia, 2011, 167(4): 1041- 1052.
[37] 刘志国, 蔡永立, 李恺, 孙灿. 鹿角杜鹃展叶期叶片发育与虫食动态. 生态环境学报, 2009, 18(4): 1443- 1448.
[38] 张华峰, 康文通, 陈顺立, 汤行昊, 林秀琴. 不同桉树品系与桉树枝瘿姬小蜂危害关系的研究. 福建林学院学报, 2012, 32(4): 345- 349.
[39] 陈汉章, 方晓敏, 陈德兰, 郑宏, 陈顺立. 桉树叶片特征与桉树枝瘿姬小蜂的抗性关系. 山东农业大学学报: 自然科学版, 2015, 46(2): 198- 203.
[40] Karban R, Baldwin I T. Induced Responses to Herbivory. Chicago: University of Chicago Press, 1997.
[41] 吴耀军, 常明山, 李德伟, 秦元丽, 盛双. 桉树枝瘿姬小蜂危害对桉树类黄酮、花色素苷含量的影响. 广西林业科学, 2010, 39(3): 119- 123.
[42] 吴耀军, 常明山, 李德伟, 罗基同, 秦元丽, 黄华艳, 叶建仁. 桉树枝瘿姬小蜂危害对桉树缩合单宁含量的影响. 南京林业大学学报: 自然科学版, 2010, 36(6): 1- 4.
[43] 吕文玲, 李诺, 杨振德, 玉舒中, 徐丽, 赵岩岩. 桉树枝瘿姬小蜂危害对桉树化学成分的影响. 安徽农业科学, 2012, 40(12): 7137- 7139.
[44] Hurley B P, Garnas J, Wingfield M J, Branco M, Richardson D M, Slippers B. Increasing numbers and intercontinental spread of invasive insects on eucalypts. Biological Invasions, 2016, 18(4): 921- 933.
[45] Petro R, Madoffe S S, Iddi S, Mugasha W A. Impact of Eucalyptus gall wasp,Leptocybeinvasainfestation on growth and biomass production ofEucalyptusgrandisandE.salignaseedlings in Tanzania. International Journal of Pest Management, 2015, 61(3): 220- 227.
AnalysisofvariableresistanceinEucalyptushybridstoLeptocybeinvasa
LI Xiaoqiong1,3, LIU Yazhen1,3, LIANG Shuiqing1,3, WEN Yuanguang1,3, ZHOU Xiaoguo1,3, ZHU Hongguang1,3, XIONG Tao4, GUO Wenfeng2,*
1CollegeofForestry,GuangxiUniversity,Nanning530001,China2GuangxiCropGeneticImprovementandBiotechnologyLaboratoryGuangxiAcademyofAgriculturalSciences,Nanning530007,China3GuangxiYouyiguanForestEcosystemResearchStation,Pingxiang532600,China4DongmenStateForestFarmofGuangxi,Fusui532100,China
Interspecific hybridization is a common phenomenon in plants, and it often causes substantial changes in phenotypic and physiological traits, resulting in various resistance abilities to herbivores and pathogens among hybrids. Compared to their parents, hybrids exhibit lower resistance, higher resistance, or intermediate resistance. Qualitative or quantitative changes in primary and secondary compounds in hybrids are important factors affecting their herbivore resistance. Hybrid breeding technology has been widely applied in theEucalyptusindustry, and achieved remarkable success worldwide in recent years. AsEucalyptushybrids vary in their ability to resist herbivores, they provide an ideal system to investigate the mechanisms underlying herbivore resistance in hybrids. To elucidate the herbivore resistance variance mechanisms, twoEucalyptushybrids, DH201- 2 (E.grandis×E.tereticornis) and G9 (E.grandis×E.urophylla), and an importantEucalyptuspest,Leptocybeinvasa, were chosen for study. The resistance of DH201- 2, G9, and their pure parental species (E.grandisandE.urophylla,E.grandisandE.tereticornis, respectively) againstL.invasawere compared. In parallel, comprehensive measurements were taken to assess differences in leaf traits (leaf thickness, water content, and specific leaf area), primary compounds (C, N, soluble sugar, and soluble protein), and secondary compounds (total phenolics and condensed tannins) among the two hybrids and their parental species. The results showed that gall number on DH201- 2 was significantly more than on its two paternal species, while gall number on G9 was significantly less than on its two parental species. Leaf thickness of DH201- 2 and G9 were similar toE.grandis, but their leaves were thinner than those of the other parental species. Leaf water content in DH201- 2 was significantly higher than that inE.tereticornisbut similar to that inE.grandis, whereas G9 contained significantly lower water content than its two parental species. Similarly, both the specific leaf area of DH201- 2 and G9 were significantly larger than their parental species. Considering the primary compounds, DH201- 2 contained significantly more soluble sugar and soluble protein than its parental species, and more N thanE.tereticornis. Although the content of soluble protein was significantly higher in G9, soluble sugar and N content were similar and lower than those in its two parental species, respectively. Both total phenolics and condensed tannins in DH201- 2 were significantly lower than those in its parental species; however, they were significantly higher in G9 than in its two parental species. Therefore, we conclude that compared with the respective parental species, DH201- 2 is more susceptible and G9 is more resistant toL.invasa. Different expressions of nutritional substances that are closely related to the development ofL.invasa(i.e., water content, soluble sugar, and N content), and secondary defensive substances such as total phenolics and condensed tannins inEucalyptushybrids, together generate variable resistance abilities toL.invasa. In the context of the wide development ofEucalyptushybrid breeding and the gradual increase inEucalyptuspests over the years, more research focusing on the resistance variance mechanisms underlyingEucalyptushybrids is required. These studies could provide valuable scientific guidance not only for screening herbivore-resistant hybrids through crossbreeding but also for the sustainable development of futureEucalyptusplantations.
hybrid breeding;Eucalyptus;Leptocybeinvasa; herbivore resistance; primary compounds; secondary compounds
国家自然科学基金(31360458,31460115,31660087);广西农科院科技发展基金(2014YP10,2015YT97);中国博士后基金(2014M552286)
2016- 06- 19; < class="emphasis_bold">网络出版日期
日期:2017- 04- 25
*通讯作者Corresponding author.E-mail: wenfeng_guo@126.com
10.5846/stxb201606191192
李晓琼,刘亚珍,梁水清,温远光,周晓果,朱宏光,熊涛,郭文锋.桉树杂交种对桉树枝瘿姬小蜂的抗性变异分析.生态学报,2017,37(18):6157- 6166.
Li X Q, Liu Y Z, Liang S Q, Wen Y G, Zhou X G, Zhu H G, Xiong T, Guo W F.Analysis of variable resistance inEucalyptushybrids toLeptocybeinvasa.ActaEcologicaSinica,2017,37(18):6157- 6166.
