不同光照强度对入侵植物薇甘菊(Mikania micrantha)和飞机草(Chromolaena odorata)生长及生物量分配的影响
2017-11-03侯玉平彭少麟陈鹏东梁希平
魏 巍,侯玉平,,*,彭少麟,陈鹏东,梁希平,张 静
1 鲁东大学生命科学学院, 烟台 264025 2 中山大学有害生物控制与资源利用国家重点实验室, 广州 510006
不同光照强度对入侵植物薇甘菊(Mikaniamicrantha)和飞机草(Chromolaenaodorata)生长及生物量分配的影响
魏 巍1,侯玉平1,2,*,彭少麟2,陈鹏东1,梁希平1,张 静2
1 鲁东大学生命科学学院, 烟台 264025 2 中山大学有害生物控制与资源利用国家重点实验室, 广州 510006
外来植物入侵严重威胁着当地生物多样性和生态系统功能,引发巨大经济损失,已成为日益严重的全球性问题。光是热带和亚热带森林生态系统植物生长最重要的限制性资源之一,对光的捕获和利用直接影响植物在自然生态系统中的生存和适合度。本研究以华南地区危害严重的入侵植物薇甘菊(Mikaniamicrantha)和飞机草(Chromolaenaodorata)为研究对象,对比二者生长、生物量分配及叶片特征对光照强度变化的响应,从而验证假设:外来植物入侵力受有效光辐射的限制,光照是影响不同演替阶段林型具有不同可入侵性的重要原因之一。研究结果表明,3%—60%全光照下两种外来植物均可存活,并显示较灵活的生物量分配策略,可见其对光照具有广适性,为其广泛分布提供生态学基础。低光严重抑制了两种外来植物的生物量积累,这可能是导致演替后期季风林入侵现象少的主要原因之一。对比两种植物叶片特征对光照强度变化的响应,高光下薇甘菊SLA降低,LAR、LARMR减小,叶片变小变厚,有利于植株保持强光下的水分平衡;低光下薇甘菊增加SLA和LAR,叶片变薄变大,增大对光的截获面积,以实现对光强减弱的适应。相比薇甘菊,3种光照处理对飞机草的SLA、LAR、LARMR无显著影响。以上结果提示:(1)光照影响所在群落对外来植物入侵的抵抗力;(2)攀援植物薇甘菊较丛生型草本飞机草对变化的光环境在叶片水平上具有更高的形态可塑性,有效寻觅光资源。
群落演替;入侵植物;比叶面积;生物量分配;光强;群落可入侵性
外来物种入侵在全球范围内严重威胁了入侵地生态系统功能、农业生产和人类健康,造成了巨大的经济损失[1- 2]。群落可入侵性一直是入侵生态学的重要议题之一[3],一般认为不受干扰的郁闭度高的森林,特别是演替后期的森林,群落可入侵性低,对植物入侵有着高抵抗力[4- 5]。对中国最早成立的国家级自然保护区鼎湖山森林群落的调查也显示,外来植物对不同的生境具有不同的入侵力,处于演替后期的群落外来种的比例较小,而处于演替阶段早期和中期的群落,外来种比例则较高[6]。那么,是什么生态因子对群落的可入侵性做出了贡献,增加了群落的入侵抵抗力?
加强入侵生态学与演替生态学之间的整合研究,将会促进对入侵生态学的进一步的理解[3,7]。对演替生态学与入侵生态学的整合研究,是国内外环境科学和生态学研究的重要科学命题。我们前期研究发现,不同演替阶段森林群落土壤残存化感物质[8]及其优势种化感作用[9]是影响其群落可入侵性的重要因素之一。除此以外,入侵地的其他生态因子也可能会对外来植物的入侵造成较大影响,影响所在群落的可入侵性[10]。光是植物必需的资源之一,是热带、亚热带森林植物生长最重要的生态限制因子[11],对光的捕获和利用直接影响植物在自然生态系统中的生存和适合度[12- 13]。在自然环境中光环境随着群落发育发生变化,如光照强度、光照时间和光谱成分的改变,这些将对植物产生深刻的影响[14-15]。例如,随演替进展,群落光照强度发生变化:植物群落演替早期由于缺乏植被的覆盖和缓冲作用,生境具有开放性和光照充足等特点;演替后期的生境由于植被的缓冲作用,一般较为封闭和稳定,光照往往成为限制林下层植物生长的生态因子[16-17]。
鉴于光的重要生态作用以及在演替不同时期光照强度差别大的特点,本研究将通过模拟鼎湖山不同演替阶段森林光照强度,以在华南地区造成严重危害的菊科外来入侵植物薇甘菊(Mikaniamicrantha)和飞机草(Chromolaenaodorata)为研究对象,通过比较二者在不同光强环境下的生长、生物量分配及叶片特征,探讨形态可塑性与其入侵的关系,揭示光强在影响群落的可入侵性中的作用,验证假设“外来植物入侵力受有效光辐射的限制,光照是影响不同演替阶段林型具有不同可入侵性的重要原因之一”。本研究将深化对群落可入侵性形成机制的认识,同时也为实践上林木管理提供重要的科学依据。
1 材料和方法
1.1 植物材料
本研究选取两种在华南地区危害严重的菊科入侵植物薇甘菊和飞机草为研究对象。
薇甘菊是菊科假泽兰属被称为"植物杀手"的草质藤本杂草。原产中南美洲,现在已经扩散到整个东南亚、太平洋地区和新几内亚等地区[18-19]。已对入侵地区的森林、草地、农田等生态系统的健康和生物多样性造成了严重威胁,是世界十大重要害草之一[20]。薇甘菊在中国的传播始于19世纪末香港动植物公园引种栽培,迄今已蔓延到华南沿海一带,并有进一步蔓延的趋势,造成重大经济损失和环境破坏[21]。
飞机草又名香泽兰,丛生型的多年生草本或者亚灌木,为菊科泽兰属植物,原产中南美洲。飞机草在20世纪20年代早期曾作为一种香料植物引到泰国栽培。现已广布于越南、柬埔寨、泰国、菲律宾、马来西亚、印度、澳大利亚、南非、墨西哥和巴拿马等地,已成为一种世界性的恶性杂草[22-23]。在我国,飞机草1934年在云南南部被发现,现主要分布在我国台湾、广东、香港、海南、广西、云南、贵州(西南部),危害多种作物,并侵犯牧场[24]。2003年国家环境保护局公布危害我国最严重的16种外来入侵物种中,飞机草危害程度名列第七位[25]。
1.2 样地概况
鼎湖山生物圈保护区是我国最早成立的国家级自然保护区,建立于1956年,也是我国首批加入联合国教科文组织“人与生物圈”保护区网的成员之一。鼎湖山生物圈保护区位于中国华南地区广东省肇庆市东北部,东经112°33′,北纬23°10′,总面积约为1200 ha,属低山丘陵地貌。本地区属亚热带季风气候,年平均降雨量为1927 mm,年平均相对湿度为80%,年平均温度为21.4 ℃。鼎湖山的土壤主要有发育于砂岩母质上的赤红壤和黄壤两大类。
本研究选取鼎湖山生物圈保护区内演替序列上3个较有代表性的森林类型为光强模拟对象。这3种林型为演替早期的马尾松(Pinusmassoniana)林、演替中期的针叶阔叶混交林(简称混交林)和演替后期的季风常绿阔叶林(简称季风林)。演替系列的先锋群落马尾松林(P.massonianaforest, PMF)位于保护区东南角过渡区,分布于地带性植被季风常绿阔叶林的边缘,为人工种植于1930年左右[26]。混交林(PBMF),位于保护区南部二宝峰山腰的过渡区,是天然阔叶树种自然入侵马尾松种群而形成的,阔叶树种以荷木(Schimasuperba)、锥栗(Castanopsischinensis)、藜蒴(Castanopsisfissa)等为主。在鼎湖山森林演替系列中,该群落是处于演替的中间阶段[16,26]。季风林(Monsoon evergreen broadleaf forest, MEBF)分布在保护区的核心区,保存较完好,已有400多年的保护历史。群落外貌终年常绿,层次结构复杂,上层乔木种中以黄果厚壳桂(Cryptocaryaconcinna)、锥栗、厚壳桂(Cryptocaryachinensis)和荷木为最优势[16]。该群落是我国南亚热带季风常绿阔叶林(或称亚热带雨林)的典型代表类群,处于演替的后期阶段,也是本地带接近气候顶极群落的类型[27]。
1.3 实验设置
本实验在鼎湖山自然保护区试验荫棚中进行。通过用黑色遮阳网遮荫,建立相对光强(Relative irradiance, RI)分别为3%、25%和60%的荫棚3 个,分别模拟季风林、混交林和马尾松林3个演替阶段群落光照情况。
分别将采自野外的薇甘菊种子和飞机草种子播种在RI 25%的荫棚内的苗床中。两种植物幼苗株高均为10cm左右时,选择大小一致的幼苗移栽到花盆中(直径19cm, 高17cm),每盆定植3株,栽培基质由等体积的荫棚周边空旷地10cm以上表土组成。
在整个实验期间,将花盆放置在鼎湖山树木园3个试验荫棚内,每种植物每种光照处理下放置6盆重复。每天早晚各浇水一次,供应充足的水分。
1.4 植物测定
植株生长4个月后,以水冲刷的方式将根部小心提取出来,尽量减少细根的损失,收获全株。根茎叶分开,测定总叶面积和总茎长,之后60℃条件下烘干至恒重,分别称根茎叶干重。总茎长用皮尺(精确度1mm)测定。叶面积用Li- 3000型叶面积仪测。称重部分用电子天平(精确度0. 001g)称量。
求出如下参数:叶生物量比(LMR, 叶重/植株总重);茎生物量比(SMR, 茎重/植株总重);根生物量比(RMR, 根重/植株总重);根冠比(R/C,根重/地上部分植株重);比叶面积(SLA, 总叶面积/总叶重);叶重分数(LMF, 叶重/地上部分植株重);叶面积比(LAR, 总叶面积/植株总重);叶根比(LARMR, 总叶面积/总根重)。
1.5 数据统计
采用统计软件SPSS for windows 11.5(SPSS Inc., USA)中单因素方差分析(One way ANOVA)和Student-Newman-Keul多重比较(Student-Newman-Keul multiple range test)检验不同处理间的差异。绘图制作工具采用SigmaPlot10.0。
2 结果
2.1 不同光强对外来植物生长的影响
不同光强处理对薇甘菊幼苗生长的影响见图1。在3种光强条件下,薇甘菊的总茎长和总叶面积都是以25%全光照下最大,60%次之,3%最小(F=10.971,P=0.001;F=17.944,P<0.001)。薇甘菊幼苗的总生物量,25%与60%两种处理差异不显著,3%全光照下显著低于前面两种处理(F=16.387,P<0.001),仅为二者的10%左右。

图1 不同光强对薇甘菊生长的影响Fig.1 Effects of different light intensity on growth of Mikania micranthaHigh light=60%全光照;Middle light=25%全光照;Low light=3%全光照;数据表示平均值±标准误;不同字母表示差异性显著(单因素方差分析,P<0.05)
对飞机草的研究表明,光强太强和光强太弱时,都对这种入侵植物的生长产生了显著抑制作用。在3种光照条件下,飞机草的总茎长、总叶面积和总生物量都是以25%全光照下最大,60%和3%全光照处理时飞机草各生长指标显著降低(F=8.818,P=0.008;F=13.629,P=0.002;F=6.784,P=0.016, 图2)。

图2 不同光强对飞机草生长的影响Fig.2 Effects of different light intensity on growth of Chromolaena odorataHigh light=60%全光照;Middle light=25%全光照;Low light=3%全光照;数据表示平均值±标准误;不同字母表示差异性显著(单因素方差分析,P<0.05)
2.2 不同光强对薇甘菊和飞机草幼苗生物量分配的影响
不同光强处理对薇甘菊和飞机草幼苗生物量分配的影响见表1。随着光强的减弱,薇甘菊根生物量比RMR、根冠比R/C明显减小(F=4.015,P=0.040;F=4.053,P=0.039),飞机草的RMR和R/C也显示同样趋势(F=6.496,P=0.018;F=5.495,P=0.028)。

表1 不同光强对薇甘菊和飞机草幼苗生物量分配的影响
表中数值为平均值±标准误,n=6, 同一物种同一列中不同字母表示在5%水平上差异显著(SNK test)
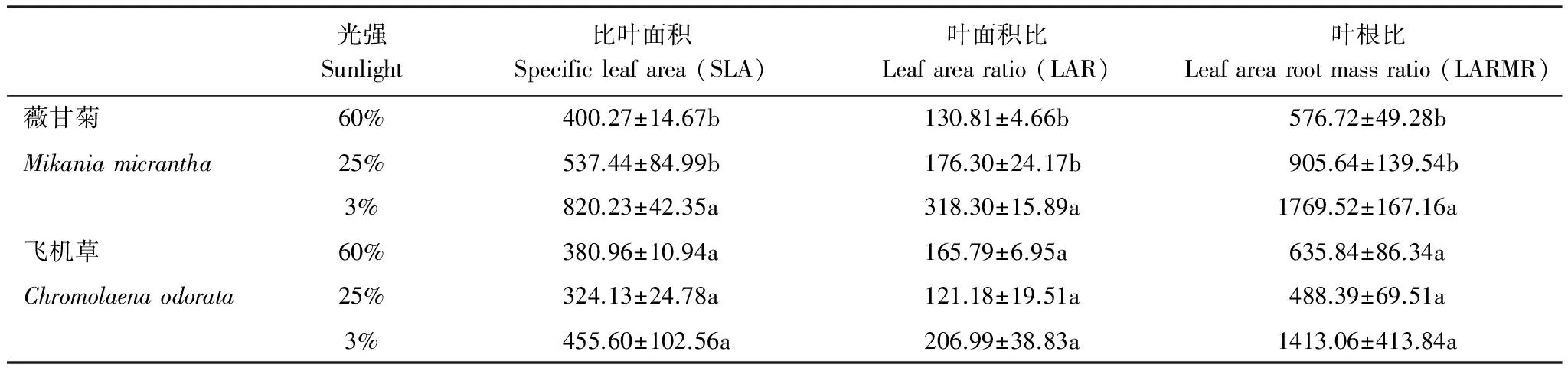
2.3 不同光强对薇甘菊和飞机草幼苗 SLA、LAR、LARMR 的影响
不同光强处理对薇甘菊和飞机草幼苗比叶面积SLA、叶面积比LAR、叶根比LARMR的影响见表2。研究结果显示,薇甘菊幼苗SLA、LAR、LARMR均是以3%全光照下为最大,显著高于60%和25%全光照处理(F=14.901,P<0.001;F=33.439,P<0.001;F=22.843,P<0.001)。3种光照处理下,飞机草幼苗SLA、LAR、LARMR无显著差异(P>0.05)。
表2不同光强对薇甘菊和飞机草幼苗比叶面积、叶面积比、叶根比的影响
Table2Effectsofdifferentlightintensityonspecificleafarea,leafarearatio,leafarearootmassratioofMikaniamicranthaandChromolaenaodorataseedlings
光强Sunlight比叶面积Specificleafarea(SLA)叶面积比Leafarearatio(LAR)叶根比Leafarearootmassratio(LARMR)薇甘菊60%400.27±14.67b130.81±4.66b576.72±49.28bMikaniamicrantha25%537.44±84.99b176.30±24.17b905.64±139.54b3%820.23±42.35a318.30±15.89a1769.52±167.16a飞机草60%380.96±10.94a165.79±6.95a635.84±86.34aChromolaenaodorata25%324.13±24.78a121.18±19.51a488.39±69.51a3%455.60±102.56a206.99±38.83a1413.06±413.84a
表中数值为平均值±标准误,n=6, 同一物种同一列中不同字母表示在5%水平上差异显著(SNK test)
3 讨论
3.1 光强对外来植物生长和生物量分配的影响
光是生境中最主要的环境因子,植物对光能的捕获和利用效率高低是其能否适应环境并很好的生存下去的决定性因素[11-13]。薇甘菊和飞机草幼苗在低至3%至更高的光强范围内都能够生存,体现了二者对光环境变化具有较强的适应能力。地上和地下部分生物量分配格局及其变化是植物对环境适应策略的重要表征[28]。生物量分配研究发现,随着光强的升高,薇甘菊和飞机草倾向于提高地下根生物量投入,以汲取更多水分;而低光条件下,薇甘菊和飞机草吸收器官生物量分配显著减少,植株将更多的生物量投入到碳素同化器官增加,提高了植株对光能的捕获和竞争能力。对光照具有高的表型可塑性是影响两种植物入侵成功的特征之一,灵活的生物量分配策略为两种植物入侵多种生境提供了生态学基础。
与强光相比,本研究显示,受试的两种入侵植物在模拟季风林的光照时,植株物质积累减小,植物生长受到显著抑制。有研究表明,在光线充足的条件下,薇甘菊生长良好,发育迅速,产生较多的花,结实率提高,产生较多的种子;而在荫蔽的条件下生长受抑制,分配较少的干物质用于有性生殖,产生较少的花和种子[29]。对飞机草的研究也发现,飞机草在低光下最大净光合速率下降[30-31],不能正常开花结果[32]。群落的林冠层透光率的强弱,影响植物外来种的生存。较演替前期的马尾松林和演替中期的混交林,处于演替后期的季风林群落结构更加复杂,郁闭度更高,林内的光照相对最弱。薇甘菊和飞机草两种外来入侵植物在模拟季风林光照时,由于光照强度太弱,供光合利用的能量不足,个体生长受到抑制,表明它们对光强均有较高要求。而季风林低光环境将影响它们在该群落中的种群建立,进而影响其入侵潜力。
3.2 光强对薇甘菊和飞机草幼苗 SLA、LAR、LARMR 的影响
叶片是植物进化过程中对环境变化较敏感且可塑性较大的器官,叶片通过多种途径改变其外在的特征,以适应异质光环境的变化,是区别不同生境中植物的最为明显的特征[33- 34]。本文研究发现,随着光强的升高,薇甘菊SLA降低,即它们的叶片变厚、变小;LAR、LARMR减小,即单位总生物量和单位根生物量所承载的叶面积明显减少,而飞机草叶片特征变化不明显。SLA、LAR等代表重要的植物形态特征[35- 36],它们在调节和控制植物功能,例如碳同化和碳分配方面,特别重要[37]。强光下厚的叶片光合能力强[38],小叶散热快、蒸腾失水少[39],这有利于植株保持强光下的水分平衡。薇甘菊生物量在60%全光照下和在25%全光照下均较高,而对飞机草的研究发现,飞机草在60%全光照下比在25%全光照下生物量有显著下降。薇甘菊和飞机草两种入侵植物在强光下的生长表现和叶片特征比较体现了薇甘菊对较强光照的适应,而飞机草要求有一定遮荫的环境,这与已有研究结果一致[32,37]。
弱光照条件下,相比飞机草,薇甘菊幼苗增加SLA和LAR,叶片变薄变大,增大对光的截获面积,以此来实现对光强减弱的适应,积累更多的光合产物,增强竞争力,提高耐荫性。与我们的研究结果一致,有研究表明光改变生物量的分配,从而影响到攀援植物的生长行为,并证实了草本攀援植物在变化的光环境中具有更高的形态可塑性,能够有效地寻觅高光条件[40]。不同外来种之间的比较对确定与入侵性有关的特性也很重要,但这种比较尚不多见[41-42]。薇甘菊和飞机草两种入侵植物的叶片特征变化比较,体现了薇甘菊形态上对光照变化具有更高的可塑性和适应性,特别是弱光下的长期忍耐是外来植物表现入侵性的重要原因[43]。
当然,本研究仅关注了形态可塑性变化,而生理可塑性方面的变化也影响着植物对光环境变化的适应。对飞机草,尽管叶片形态可塑性相比薇甘菊为弱,但已有研究证明,它对光照强度的变化能够在一些生理特性上(如调节光合能力、光保护能力和呼吸速率等)做出积极调整和响应[30,37],而生理可塑性相比形态可塑性可能是一种成本更低反应更快的可塑性形式[44- 45]。这在一定程度上为野外调查发现飞机草入侵多种生境提供了解释。
4 结论
对不同光强下薇甘菊和飞机草生长及生物量分配的研究表明,两种入侵植物对光强均具有较强的适应性,这为其扩散到多种生境提供了生态学基础。对比两种植物,草质藤本薇甘菊对强光及遮荫环境比丛生型的多年生草本或者亚灌木飞机草在叶片水平上具有更高的形态可塑性,利于其有效寻觅光资源。同时,我们的研究结果提示,光照的减弱可能是导致野外调查发现季风林入侵现象明显少于马尾松林和混交林的重要原因之一,季风林的低光照环境有效提高了该群落对喜光的非本地植物入侵的抵抗力。因此在今后的群落改造中,应利用演替规律,加快对群落的抚育,使其向结构复杂的地带性成熟林演进,提高群落郁闭度和物种多样性,加强群落入侵抵抗力,以减少外来植物入侵。
[1] Pimentel D, Lach L, Zuniga R, Morrison D. Environmental and economic costs of nonindigenous species in the United States. Bioscience, 2000, 50(1): 53- 65.
[2] Dostálek T, Münzbergová Z, Kladivová A, Macel M. Plant-soil feedback in native vs. invasive populations of a range expanding plant. Plant and Soil, 2016, 399(1): 209- 220.
[3] Richardson D M, Pyšek P. Plant invasions: merging the concepts of species invasiveness and community invisibility. Progress in Physical Geography, 2006, 30(3): 409- 431.
[4] Crawley M J. What makes a community invasible? In: Gray A J, Crawley M J, Edwards P J eds. Colonization, Succession, and Stability. Blackwell, Oxford, 1987: 429- 453.
[5] Domenech R, Vila M. The role of successional stage, vegetation type and soil disturbance in the invasion of the alien grassCortaderiaselloana. Journal of Vegetation Science, 2006, 17(5): 591- 598.
[6] 贺握权, 黄忠良. 外来植物种对鼎湖山自然保护区的入侵及其影响. 广东林业科技, 2004, 20(3): 42- 45.
[7] Davis M A, Pergl J, Truscott A M, Kollmann J, Bakker J P, Domenech R, Prach K, Prieur-Richard A H, Veeneklaas R M, Pyšek P, del Moral R, Hobbs R J, Collins S L, Pickett S T A, Reich P B. Vegetation change: a reunifying concept in plant ecology. Perspectives in Plant Ecology, Evolution and Systematics, 2005, 7(1): 69- 76.
[8] Hou Y P, Peng S L, Chen B M, Ni G Y. Inhibition of an invasive plant (MikaniamicranthaH.B.K.) by soils of three different forests in lower subtropical China. Biological Invasions, 2011, 13(2): 381- 391.
[9] Hou Y P, Peng S L, Ni G Y, Chen L Y. Inhibition of an invasive species (MikaniamicranthaH. B. K.) by native dominant trees of three different forests in lower subtropical China. Allelopathy Journal, 2012, 29(2): 307- 314.
[10] 彭少麟, 向言词. 植物外来种入侵及其对生态系统的影响. 生态学报, 1999, 19(4): 560- 568.
[11] Durand L Z, Goldstein G. Photosynthesis, photoinhibition, and nitrogen use efficiency in native and invasive tree ferns in Hawaii. Oecologia, 2001, 126(3): 345- 354.
[12] Dutilleul P, Han L W, Valladares F, Messier C. Crown traits of coniferous trees and their relation to shade tolerance can differ with leaf type: A biophysical demonstration using computed tomography scanning data. Frontiers in Plant Science, 2015, 6: 172- 184.
[13] Liu S L, Luo Y M, Yang R J, He C X, Cheng Q S, Tao J J, Ren B, Wang M H, Ma M D. High resource-capture and -use efficiency, and effective antioxidant protection contribute to the invasiveness ofAlnusformosanaplants. Plant Physiology and Biochemistry, 2015, 96: 436- 447.
[14] Pearcy R W. Photosynthetic utilization of light flecks by understory plants. Australian Journal of Plant Physiology, 1988, 15(2): 223- 238.
[15] Pearcy R W. Sunflecks and photosynthesis in plant canopies. Annual Review of Plant Physiology, 1990, 41(41), 421- 453.
[16] 彭少麟. 南亚热带森林群落动态学. 北京: 科学出版社, 1996.
[17] 李庆康, 马克平. 植物群落演替过程中植物生理生态学特性及其主要环境因子的变化. 植物生态学报, 2002, 26 (增刊): 9- 19.
[18] Waterhouse D F. Biological Control of Weeds: Southeast Asian Prospects. Canberra, Australia: ACIAR, 1994: 125.
[19] 昝启杰, 王勇军, 王伯荪, 廖文波, 李鸣光. 外来杂草薇甘菊的分布及危害. 生态学杂志, 2000, 19(06): 58- 61.
[20] Holm L G, Plucknett D L, Pancho J V, Herberger J P eds. The World′s Worst Weeds: Distribution and Biology. Honolulu, USA: University Press of Hawaii, 1977.
[21] Zhang L Y, Ye W H, Cao H L, Feng H L.MikaniamicranthaH.B.K. in China-an overview. Weed Research, 2004, 44: 42- 49.
[22] 中国科学院中国植物志编辑委员会. 中国植物志: 第74卷. 北京: 科学出版社, 1984, 56- 58.
[23] 丁智慧, 张学镅, 刘吉开, 丁靖垲, 古昆. 飞机草中的化学成分. 天然产物研究与开发, 2001, 13(5): 22- 24.
[24] 李振宇, 解焱. 中国外来入侵种. 北京: 林业出版社, 2002.
[25] 袁经权, 杨峻山, 缪剑华. 飞机草化学成分研究. 中草药, 2005, 36(12): 1771- 1773.
[26] Mo J M, Brown S, Peng S L, Kong G H. Nitrogen availability in disturbed, rehabilitated and mature forests of tropical China. Forest Ecology and Management, 2003, 175 (1/3): 573- 583.
[27] 中国植被编委会. 中国植被. 北京: 科学出版社, 1980.
[28] Swift C C, Jacobs S M, Esler K J. Drought induced xylem embolism in four riparian trees from the Western Cape Province: Insights and implications for planning and evaluation of restoration. South African Journal of Botany, 2008, 74(3): 508- 516.
[29] 张炜银, 李鸣光, 王伯荪, 昝启杰, 王勇军. 外来杂草薇甘菊在不同群落中的种子生产特征. 武汉植物学研究, 2003, 21(2): 143- 147.
[30] 王俊峰, 冯玉龙, 李志. 飞机草和兰花菊三七光合作用对生长光强的适应. 植物生理与分子生物学学报, 2003, 29(6): 542- 548.
[31] Zhang L L, Wen D Z. Structural and physiological responses of two invasive weeds,MikaniamicranthaandChromolaenaodorata, to contrasting light and soil water conditions. Journal of Plant Research, 2009, 122(1): 69- 79.
[32] 张建华, 范志伟, 沈奕德, 刘丽珍. 不同光照率对飞机草生长的影响. 安徽农业科学, 2009, 37(21): 9967- 9968, 9975.
[33] Poorter L, Bongers F. Leaf traits are good predictors of plant performance across 53 rain forest species. Ecology, 2006, 87(7): 1733- 1743.
[34] 殷东生, 沈海龙. 森林植物耐荫性及其形态和生理适应性研究进展. 应用生态学报, 2016, 27(8): 2687- 2698.
[35] Niinemets U. A review of light interception in plantstands from leaf to canopy in different plant functional types and in species with varying shade tolerance. Ecological Research, 2010, 25(4): 693- 714.
[36] Legner N, Fleck S, Leuschner C. Low light acclimation in five temperate broad-leaved tree species of different successional status: The significance of a shade canopy. Annals of Forest Science, 2013, 70(6): 557- 570.
[37] Feng YL, Wang JF, Sang WG. Biomass allocation, morphology and photosynthesis of invasive and noninvasive exotic species grown at four irradiance levels. Acta Oecologica, 2007, 31(1): 40- 47.
[38] 冯玉龙, 曹坤芳, 冯志立, 马玲. 四种热带雨林树种幼苗比叶重,光合特性和暗呼吸对生长光环境的适应. 生态学报, 2002, 22 (6): 901- 910.
[39] Gibson A C. Photosynthetic organs of desert plants: Structural designs of nonsucculent desert plants cast doubt on the popular view that saving water is the key strategy. Bioscience, 1998, 48(11): 911- 920.
[40] den Dubbelden K C, Oosterbeek B. The availability of external support affects allocation patterns and morphology of herbaceous climbing plants. Functional Ecology, 1995, 9(4): 628- 634.
[41] Smith M D, Knapp A K. Physiological and morphological traits of exotic, invasive exotic, and native plant species in tallgrass prairie. International Journal of Plant Sciences, 2001, 162(4): 785- 792.
[42] Medina-Villar S, Castro-Díez P, Alonso A, Cabra-Rivas I, Parker I M, Pérez-Corona E. Do the invasive trees,AilanthusaltissimaandRobiniapseudoacacia, alter litterfall dynamics and soil properties of riparian ecosystems in Central Spain? Plant and Soil, 2015, 396(1): 311- 324.
[43] 王俊峰, 冯玉龙. 人工群落中苗期紫茎泽兰的化感作用和对光环境的适应. 生态学报, 2006, 26(6): 1809- 1817.
[44] Grime J P, Mackey J M L. The role of plasticity in resource capture by plants. Evolutionary Ecology, 2002, 16(3): 299- 307.
[45] Hou Y P, Peng S L, Lin Z G, Huang Q Q, Ni G Y, Na Z. Fast-growing and poorly shade-tolerant invasive species may exhibit higher physiological but not morphological plasticity compared with non-invasive species, Biological Invasions, 2015, 17(5): 1555- 1567.
EffectsoflightintensityongrowthandbiomassallocationofinvasiveplantsMikaniamicranthaandChromolaenaodorata
WEI Wei1, HOU Yuping1,2,*, PENG Shaolin2, CHEN Pengdong1, LIANG Xiping1, ZHANG Jing2
1CollegeofLifeSciences,LudongUniversityYantai264025,China2StateKeyLaboratoryofBiocontrol,SunYat-SenUniversityGuangzhou510006,China
As an important component of global environmental change, the invasion of exotic species represents one of the most serious threats to native biodiversity and ecosystem function worldwide and causes huge economic losses. Light is one of the most important limiting resources for plant growth in subtropical and tropical forests, wherein the plant abilities of capturing and utilizing light becomes a determinant for their establishment and fitness. In this study, we compared plant growth, biomass allocation and leaf-level traits in response to variations in light intensity inMikaniamicranthaandChromolaenaodorata, which have invaded many habitats in South China causing significant damage. We hypothesized that the invasion potential of exotic species will be restricted by the effective optical radiation they can capture, and light intensity may play an important role in determining the community resistance to invasion. Our results showed that the two exotic species both could survive under 3%—60% of full solar irradiance and display a relatively flexible biomass allocation strategy. It indicated that they have acclimated to a wide range of variation in light resources, which supplies ecological foundation for their widely spread. Low light significantly decreased the biomass accumulation of the two exotic species and might contribute to the low invasibility in monsoon evergreen broadleaf forest (MEBF) to plant invasions. In addition, we found that high light resulted in smaller and thicker leaves (low SLA, LAR and LARMR) inM.micrantha, which is advantageous to maintain the water balance under high light. When growing under low light conditions,M.micranthaincreased its SLA and LAR. Its leaves turned to bigger and thinner, which is helpful to capture more light in adapting to the decreasing light. By contrast,C.odoratademonstrated no significant change in its leave-level traits across the light treatments. Collectively, the vineM.micranthahad higher morphological plasticity than herbC.odoratain leave-level traits, and higher morphological plasticity is helpful forM.micranthato search light resources more effectively in variant light environments. And our results support the assumption that light may play an important role in determining the community invasion resistance.
community succession; invasive plants; specific leaf area; biomass allocation; light intensity; community invasibility
国家自然科学基金项目(31300465);山东省自然科学基金项目(ZR2012CQ020);山东省高等学校科技计划项目(J13LE08);有害生物控制与资源利用国家重点实验室开放课题(SKLBC14KF03)
2016- 06- 30; < class="emphasis_bold">网络出版日期
日期:2017- 04- 25
*通讯作者Corresponding author.E-mail: hou_yuping@163.com
10.5846/stxb201606301343
魏巍,侯玉平,彭少麟,陈鹏东,梁希平,张静.不同光照强度对入侵植物薇甘菊(Mikaniamicrantha)和飞机草(Chromolaenaodorata)生长及生物量分配的影响.生态学报,2017,37(18):6021- 6028.
Wei W, Hou Y P, Peng S L, Chen P D, Liang X P, Zhang J.Effects of light intensity on growth and biomass allocation of invasive plantsMikaniamicranthaandChromolaenaodorata.Acta Ecologica Sinica,2017,37(18):6021- 6028.
