毛竹根际与非根际土壤重金属、理化性质及酶活性特征
2017-11-03陈俊任吴家森何丽芝叶正钱
郭 华,陈俊任,钟 斌,刘 晨,吴家森,何丽芝,叶正钱,柳 丹
省部共建亚热带森林培育国家重点实验室,浙江省土壤污染生物修复重点实验室,浙江农林大学, 临安 311300
毛竹根际与非根际土壤重金属、理化性质及酶活性特征
郭 华,陈俊任,钟 斌,刘 晨,吴家森,何丽芝,叶正钱,柳 丹*
省部共建亚热带森林培育国家重点实验室,浙江省土壤污染生物修复重点实验室,浙江农林大学, 临安 311300
于2014年2月至2015年1月在浙江省衢州市铅锌矿附近毛竹林地采集土样,对土壤重金属含量、pH以及土壤酶活性等的动态变化特征进行了研究。结果表明:根际土与非根际土的pH在1a中变化均不明显,且变化范围都处在4.50—4.85之间;非根际土的土壤含水率大于根际土,两者的变化幅度较大,最低值均出现在6月和10月;根际土中Zn和Cd的有效态含量远高于非根际土,而Pb的有效态含量则表现出非根际土大于根际土的特点;过氧化氢酶、磷酸酶、脲酶和脱氢酶在根际土中的活性明显高于非根际土;从土壤重金属有效态与土壤酶活性相关性来看,根际土中,除有效态Pb与过氧化氢酶呈显著负相关外,其余重金属元素有效态与土壤酶活性相关性均没有显著相关性,而在非根际土壤中,有效态Cd与过氧化氢酶呈极显著负相关,与脲酶呈显著负相关,Zn和Cd则与土壤酶活性之间没有显著相关性。综合研究结果表明,毛竹根际土壤质量总体上明显优于非根际土,这为毛竹今后作为植物修复的材料提供了一定的理论依据。
毛竹;根际土;非根际土;重金属有效态;土壤酶活性
根际是研究植物、土壤、微生物之间相互联系的重要生态领域[1],很多学者在园林绿化、土壤退化[2-3]、人造林[4-5]、土壤修复[6]等相关领域已经开展了植物根际相关研究,而且根际土壤与非根际土壤之间土壤特性的差异性研究得到关注较多。
植物根围区域是指与植物根系发生紧密联系并相互作用的土壤区域,是植物生长过程中形成的物理、化学、生物学性质不同于非根围区的小型生态系统[7]。有研究表明,植物根围尤其是根际小区域,由于植物根系的分泌作用,其酸碱性、氧化还原电位及微生物种群与一般土层土壤具有较大差异[8],因此,近年来围绕根际环境在土壤污染及植物修复中的地位与作用的相关研究已成为国内外环境学和生态学研究的一大热点[9]。
毛竹是我国面积最大,分布最广的经济竹种。据第八次全国森林资源清查报告显示,我国当前共有毛竹林386 万hm2,占竹林资源的70%左右。毛竹具有极强的环境适应性,同其他类型的无性系植物一样,毛竹无性系种群具有强烈的生理整合能力,能够集群抵御不良环境的影响[10]。对于土壤的选择,毛竹适宜生长在疏松、肥沃、湿润、板岩或页岩发育的黄红壤[11],其最适pH 为4.5—7.0[12],同时具有一定的耐盐碱性[13]。如果毛竹可以作为修复应用材料投入使用,其具备较强的环境适宜性[14]。因此,为了筛选出毛竹根系活性最强的时间,在其对重金属活化能力最大的时候添加强化剂以加强植物修复的能力,本文以重金属污染区毛竹林为研究对象,探讨了毛竹的根际与非根际土壤重金属有效态含量、酶活性以及土壤理化性质在1年内的动态变化特征,以期为毛竹作为土壤重金属污染“生物修复型”树种提供参考。
1 实验材料与方法
1.1 样品采集
调查研究区域位于衢州市上方镇,该地区是典型的铅锌矿区,其开采历史有300多年可以追溯到明末清初时期,铅锌矿山分布在河流源头周围存在居民区和农田耕地,并且是浙江省主要的毛竹产地和食用竹笋出产的地区;区域属于亚热带气候年平均气温度为16.8℃,平均年降雨量1632.5 mm。
经测定分析,该地区背景土壤中Pb、Zn和Cd的浓度分别为:542.02 mg/kg和405.29 mg/kg和1.04 mg/kg[15],这3种重金属浓度都均超过了浙江省土壤背景值[16]。Pb的最大值(3237.6 mg/kg)是最大允许值(250.00 mg/kg)的13倍,Zn的最大值(2792.5 mg/kg)是最大允许值(200.0 mg/kg)的大约14倍,Cd的平均含量(1.0 mg/kg)是最大允许值(0.3 mg/kg)的3倍多。结果表明,土壤Zn、Pb和Cd的含量可能对土壤环境造成严重风险[15]。
为保证数据的可靠性,选取矿山口附近适当距离并具有代表性的毛竹9株,挖出细根,采用抖落法采集根际土壤样品,并将土壤样品进行混合得到样品数1个。在各样地内距离毛竹一定距离的地方沿“S”形采集0—20 cm的非根际土,将所采集土样混合为1个样品。采样时间为2014年2月—2015年1月,时间长度为12个月份,在每个月同一时间进行采样,每月采集样品2个,总共采集样品24个。
1.2 土壤样品预处理及测定方法
将采集的土壤样品置于背光通风处自然风干,剔除夹杂其中的石头、根及枝叶等,研磨后过10目尼龙筛,密封存储于封口袋中备用。土壤分析项目包括土壤基本性质和重金属有效态,其中,(1)土壤基本性质:PH用水土比(2.5∶1)电极法测定;土壤含水率用烘干法测定(105℃);土壤呼吸强度用碱液吸收法测定;土壤微生物量碳采用氯仿熏蒸-K2SO4提取法(FE)测定;(2)土壤酶:脲酶用活性用尿素在柠檬酸缓冲液(pH=6.7)水解生成的方法测定;过氧化氢酶活性运用注入土壤中的过氧化氢在反应后剩余量的方法测定;磷酸酶用磷酸苯二钠比色法测定;脱氢酶用TTC分光光度法测定;土壤重金属有效态Pb、Zn、Cu、Cd以0.1mol/LCaCl2浸提,取上清液,采用美国PE公司ICP-OES7000DV电感耦合等离子体发射光谱仪测定。
2 结果
2.1 土壤PH和含水率
土壤PH及含水率的动态变化特征见图1。从中可以看出,根际土壤pH值在不同时间变化明显,其中3月份最低,6月份最高,而非根际土壤变化幅度较小,但两者变化范围均在4.50—4.85之间浮动,说明根系吸收能力对根际土pH值并没有显著影响。根际与非根际土壤的含水率变化趋势基本相同,其中最低值均出现在6月份和10月份,但由于毛竹生长需要吸收水分,非根际土壤的含水率普遍高于根际土。
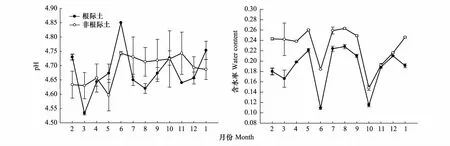
图1 毛竹根际与非根际土壤pH和含水率动态变化Fig.1 Dynamic change of pH and moisture content of rhizosphere and non-rhizosphere soil in Moso bamboo
2.2 土壤呼吸作用和微生物量碳动态变化特征
对厂区无组织排放废气,根据风向在厂界周围处布点监测,上风向设1对照点(○4),下风向设3个监控点(○1~○3),共布设4个监测点,监测项目为颗粒物。监测结果及监测期间的气象条件见表3。
由图2所示结果可知,与非根际土相比,根际土的土壤呼吸强度有显著提高,其在1年中的变化值是非根际土壤呼吸强度的0.7—2.2倍,说明毛竹根系对土壤呼吸有明显的影响作用。土壤中微生物碳含量无论是在根际土还是非根际土中,均表现出在7月份到次年1月份含量较高的特点,并且与非根际土相比,根际土的微生物量碳都有不同程度的提高。
2.3 重金属有效态含量动态变化特征
通过对采集的24个土样进行测定,毛竹林地中土壤重金属有效态含量及其变化规律如图3所示。结果表明,Zn和Cd在毛竹根际土壤中的含量明显高于非根际土壤,且在根际土中两种重金属的含量表现出明显的动态变化趋势,6、7、8月3个月份明显高于其他时间。Pb则表现出非根际土含量高于根际土的特征。相对于非根际土来说,根际土的重金属有效态含量变化幅度更大,这可能是由于不同季节毛竹的生长状况受土壤温度、湿度等因素的影响,其根系活动程度的不同所造成的结果。

图2 毛竹根际与非根际土壤呼吸及微生物量碳动态变化Fig.2 Dynamic change of respiration and microbial biomass carbo of rhizosphere and non-rhizosphere soil in Moso bamboo

图3 毛竹林根际与非根际土壤重金属有效态含量动态变化Fig.3 Dynamic change of absorbable metals of rhizosphere and non-rhizosphere soil in Moso bamboo
2.4 土壤酶活性变化特征
从图4可知,由于一年四季气候不同,土壤的湿度、有机质供应状况等性质在变化,土壤酶活性也在变化,并且根际土中过氧化氢酶、磷酸酶及脲酶的活性显著高于非根际土。另外,除个别点外,非根际土的4种酶的活性值在一年内均表现出基本相同的发展趋势,并且变化范围较小,而根际土的酶活性在不同时间内变化幅度较大,但基本上都呈现出2—6月份先升高,7—10月有所下降,继而升高的趋势。

图4 毛竹根际与非根际土壤酶活性动态变化Fig.4 Dynamic change of enzymatic activity of rhizosphere and non-rhizosphere soil in Moso bamboo
2.5 土壤重金属有效态与土壤酶活性相关关系
表1是土壤重金属有效态与土壤酶活性的相关系数矩阵。分析结果表明,在根际土中,有效态Pb与过氧化氢酶的活性表现出显著负相关性,其余各重金属元素与土壤酶活性之间的关系都不显著。而在非根际土中,除有效态Cd与过氧化氢酶和脲酶表现出显著负相关性之外,其余重金属有效态与酶活性之间也并不存在明显的相关性。
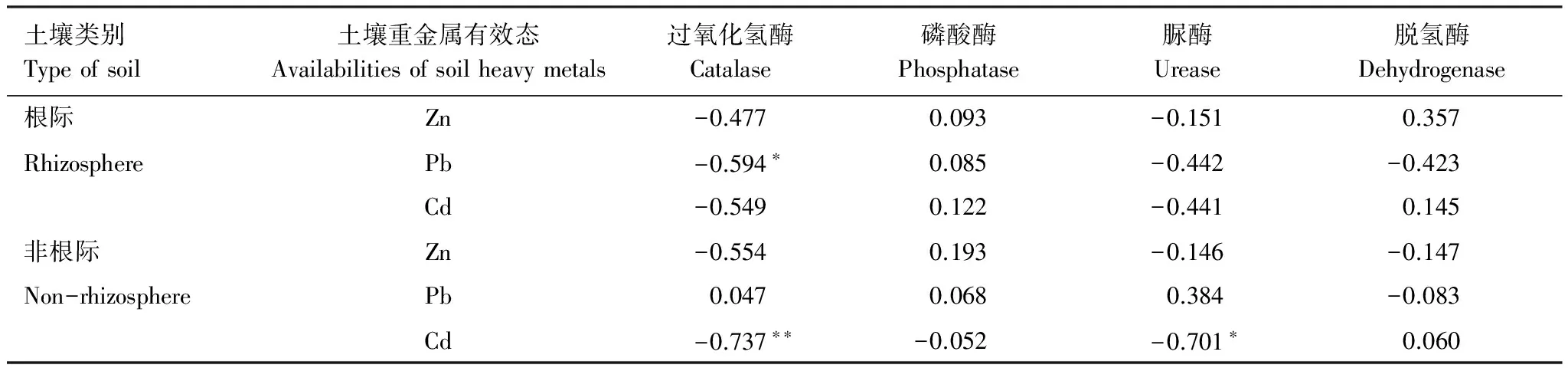
表1 土壤重金属有效态与土壤酶的相关系数矩阵
**表示相关极显著(P≤0.01), *表示相关显著(P≤0.05)
3 分析与讨论
土壤酸碱度是土壤重要的基本性质之一,也是土壤形成过程和熟化培肥过程的一个指标,对土壤中养分存在的形态和有效性,土壤的理化性质、微生物活动以及植物生长发育都有很大的影响[17]。公庆党等[18]研究发现,根系活力与根际土pH值变化的相关性不明显,这与本实验得出结果一致,虽然根际土的pH值在不同时间有所波动,但与非根际土相比,两者变化范围均处于4.50—4.85之间,说明毛竹根系吸收能力对根际土pH无明显影响。
土壤呼吸是表征土壤质量和肥力的重要生物学指标,它反映了土壤生物活性和土壤物质代谢的强度,而根系分解速率与根系呼吸对土壤呼吸的贡献率有强相关性[19]。韩广轩等[20]通过对玉米农田土壤呼吸作用的空间异质性及其根系呼吸作用的贡献研究发现,较高的土壤呼吸速率通常出现在靠近玉米植株的地方。从本实验结果也可以看出,由于受到土壤温度、水分等因素的季节变化,土壤呼吸速率有所波动,但毛竹根系土壤呼吸速率明显高于非根际土,尤其是在5月、7月和8月份,根际土的呼吸速率均达到非根际土呼吸速率的3倍以上。
土壤微生物量碳是土壤有机碳的重要组成部分,参与土壤发生发育的全过程[21-22]。土壤微生物量碳的任何变化,都会对土壤碳、氮、磷等的植物有效性及陆地生态系统的物质循环产生深远影响[23-24]。土壤微生物量碳对所生存的环境十分敏感,被公认是土壤生态系统变化的预警和敏感指标,可作为土壤质量和土壤总有机质变化的早期预测指标[25-27]。本研究中,土壤微生物量碳随着时间的变化呈现出上升的趋势,尤其是在7—10月份,无论是根际土还是非根际土,其微生物量碳都明显高于其他时间的微生物量碳含量。另外,除6月份外,其余时间根际土壤微生物碳含量均表现出高于非根际土的特征,这可能是由于根系分泌物为土壤微生物提供了大量的营养和能源物质,因而根际微生物不仅种类和数量远高于非根际土壤,其代谢活动也比非根际微生物高。所以根际是微生物代谢活动特别旺盛的场所,而微生物活动能加快土壤中碳、氮、磷的分解及其他矿质元素的活化[28]。
重金属在土壤中的形态分为水溶态、离子交换态、碳酸盐结合态、铁锰氧化物结合态、有机结合态、残留态等,其中水溶态、离子交换态统称为有效态[29]。土壤中有效态的重金属元素易于转化和迁移,最容易被农作物吸收利用而进入食物链,从而其带来的生物有效性及环境风险程度最高[30]。本实验研究可知,Pb、Zn、Cd 3种重金属在根际与非根际土中的有效态含量表现为Pb>Zn>Cd,并且Pb的有效态含量显著大于其它两种重金属元素。其中,Zn和Cd两种重金属元素在根际土中的有效态含量明显高于非根际土,且在根际土中表现出明显的季节变化规律,在6—9月份即夏季时间段有效态含量达到最高,这可能是由于该时间内土壤温度和水分含量较高等造成根系活动旺盛,从而对土壤中重金属的活化能力变强。而Pb则表现出与Zn和Cd相反的特征,不论是在根际还是非根际土中,其含量均没有明显的季节性变化,且其在非根际土中的有效态含量是根际土中的3—5倍,这可能是由于根系分泌物与Pb结合形成沉淀,从而导致其在根际土中有效态含量较低。
土壤酶参与了土壤中所发生的所有生化反应,推动了营养物质碳、氮、磷和其他元素循环转化、能量代谢和污染物质净化等,并成为土壤生态系统的核心[31-33]。根际内微生物数总是比根际外要高得多,当微生物受到环境因素刺激时,便不断向周围介质分泌酶,致使根际内外酶活性存在很大差异[34]。本实验结果显示,根际土中过氧化氢酶、磷酸酶、脱氢酶和脲酶四种土壤酶的活性均高于非根际土。过氧化氢酶的活性表征土壤腐殖质化强度大小和有机质积累程度,与有机质含量有关,所以过氧化氢酶的活性是人们很早就建议用来作为土壤肥力的指标[35]。由图4可知,根际土中过氧化氢酶的活性随着时间的变化呈现出上升趋势,而在非根际土中则没有表现出明显的规律性。磷酸酶是有机磷转化的关键性酶[36],土壤中有机磷是在它的作用下才能转化成可供植物吸收的无机磷。本实验中,根际土壤的磷酸酶活性显著大于非根际土,尤其是在6—9月份期间,其活性是非根际土壤的3—4倍。脲酶所参与的酶促反应是植物氮源之一,其活性反应土壤有机氮向有效态氮的转化能力和土壤无机氮的供应能力。由图4显示可以发现,相对于过氧化氢酶和磷酸酶,脲酶活性较低,但除2月份以外,根际土中的脲酶活性也表现出大于非根际土的特征。脱氢酶属于氧化还原酶系,它自一定的基质中析出氢或氢的供体而进行氧化作用,反映土壤微生物新陈代谢的整体活性,可以作为微生物氧化还原能力指标。由于受到土壤温度及水分含量的影响,毛竹根际土中脱氢酶活性在2—5月份较低,从6月份开始呈现出上升的趋势。而在非根际土中,脲酶活性变化正好同根际土中脲酶活性变化规律相反。
4 结论
(1)毛竹林根际土与非根际土相比,pH和含水率均没有显著差异,且变化趋势基本一致。
(2)根际土中重金属Zn和Cd的有效态含量显著高于非根际土,说明毛竹根系对土壤重金属Zn和Cd的活化能力较强,而有效态Pb在非根际土中的含量明显高于根际土。
(3)过氧化氢酶、磷酸酶、脲酶等在根际土壤中的活性明显高于非根际土,这说明毛竹林生长能够有效改善根际土壤环境,提高有关土壤酶活性。
(4)根际土中,有效态Pb与过氧化氢酶呈显著负相关,非根际土中,有效态Cd与过氧化氢酶、脲酶分别呈极显著负相关和显著负相关,其余重金属元素与土壤酶活性之间均没有显著相关性。
[1] Lynch J P. Root architecture and plant productivity. Plant Physiology, 1995, 109(1): 7- 13.
[2] 白世红, 马风云, 李树生, 姚秀粉. 黄河三角洲不同退化程度人工刺槐林土壤酶活性、养分和微生物相关性研究. 中国生态农业学报, 2012, 20(11):1478- 1483.
[3] 王笛, 马风云, 姚秀粉, 辛贺, 宋雪, 张钟心. 黄河三角洲退化湿地土壤养分、微生物与土壤酶特性及其关系分析. 中国水土保持科学, 2012, 10(5):94- 98.
[4] 许景伟, 王卫东, 李成. 不同类型黑松混交林土壤微生物、酶及其与土壤养分关系的研究. 北京林业大学学报, 2000, 22(1):51- 55.
[5] Jiao R Z, Yang C D. The changes of the soil microorganism in rhizosphere and outside in different developing stages of the Chinese fir plantation. Scientia Silvae Sinicae, 1999, 35(1): 53- 59.
[6] Nie M, Zhang X D, Wang J Q, Jiang J Q, Yang J, Quan Z X, Cui X H, Fang C M, Li B. Rhizosphere effects on soil bacterial abundance and diversity in the Yellow River Deltaic ecosystem as influenced by petroleum contamination and soil salinization. Soil Biology and Biochemistry, 2009, 41(12): 2535- 2542.
[7] 苏文会, 封焕英,范少辉, 李兴军, 许庆标. 铅锌矿区毛竹林土壤重金属的分布特征. 光谱学与光谱分析, 2013, 33(7): 1877- 1880.
[8] 孙琴, 王晓蓉, 丁士明. 超积累植物吸收重金属的根际效应研究进展. 生态学杂志, 2005, 24(1): 30- 36.
[9] Anderson T A, Kruger E L, Goat J R. Enhanced degradation of a mixture of three herbicides in the rhizosphere of a herbicide-tolerant plant. Chemosphere, 1994, 28(8): 1551- 1557.
[10] 邹跃国. 毛竹林种群结构特征变化的海拔效应研究. 竹子研究汇刊, 2012, 31(4): 17- 21.
[11] 张春生, 陈建华, 朱凡. 毛竹生长发育规律的调查分析. 经济林研究, 2007, 25(4): 74- 76.
[12] 徐家琦, 秦海清. 毛竹北移和引种栽培制约因素研究. 世界竹藤通讯, 2003, 1(2): 27- 31.
[13] 孟昱, 张钢, 李雪平, 高志民. NaCl 胁迫对毛竹叶片的电阻抗图谱参数及膜透性的影响. 武汉植物学研究, 2010, 28(3): 341- 346.
[14] 陈俊任, 柳丹, 吴家森, 李松, 晏闻博, 彭丹莉, 叶正钱, 王海龙. 我国典型植物修复材料研究及毛竹修复应用可行性分析. 竹子研究汇刊, 2015, 34(2): 61- 66.
[15] 晏闻博. 矿区多维度土壤重金属污染分布研究及其风险评价[D]. 杭州: 浙江农林大学, 2015.
[16] Brereton R G. Chemometrics: Data Analysis For The Laboratory And Chemical Plant. Chichester: John Wiley & Sons, 2003.
[17] 李福燕, 李许明, 吴鹏飞, 陈柳燕, 郭彬, 漆智平. 海南省农用地土壤重金属含量与土壤有机质及pH的相关性. 土壤, 2009, 41(1): 49- 53.
[18] 公庆党, 黄景云, 束怀瑞, 顾曼如. 苹果根际土pH值和有效养分的研究. 经济林研究, 1995, 13(3): 12- 15.
[19] 卢华正. 西双版纳热带季节雨林和橡胶林根系呼吸对土壤呼吸的贡献率[D]. 景洪: 中国科学院研究生院, 2009.
[20] 韩广轩, 周广胜, 许振柱, 杨扬, 刘景利, 史奎桥. 玉米农田土壤呼吸作用的空间异质性及其根系呼吸作用的贡献. 生态学报, 2007, 27(12): 5254- 5261.
[21] 吴金水, 林启美, 黄巧云, 肖和艾. 土壤微生物生物量测定方法及其应用. 北京: 气象出版社, 2006: 71- 126.
[22] Van Bruggen A H C, Semenov A M. In search of biological indicators for soil health and disease suppression. Applied Soil Ecology, 2000, 15(1): 13- 24.
[23] 杨小波, 张桃林, 吴庆书. 海南琼北地区不同植被类型物种多样性与土壤肥力的关系. 生态学报, 2002, 22(2): 190- 196.
[24] Roy S, Singh J S. Consequences of habitat heterogeneity for availability of nutrients in a dry tropical forest. Journal of Ecology, 1994, 82(3): 503- 509.
[25] 任天志. 持续农业中的土壤生物指标研究. 中国农业科学, 2000, 33(1): 68- 75.
[26] 邵玉琴, 赵吉, 包青海. 库布齐固定沙丘土壤微生物生物量的垂直分布研究. 中国沙漠, 2001, 21(1): 88- 92.
[27] Dalal R C, Henderson P A, Guasby J M. Organic matter and microbial biomass in a vertisol after 20 yr of zero-tillage. Soil Biology and Biochemistry, 1991, 23(5): 435- 441.
[28] 殷博. 几种作物根系分泌物对土壤微生物的影响[D]. 哈尔滨: 黑龙江大学, 2009.
[29] 雷鸣, 廖柏寒, 曾清如, 周细红, 刘丽. 两种污染土壤中重金属Pb Cd Zn的EDTA萃取及形态变化. 农业环境科学学报, 2005, 24(6): 1233- 1237.
[30] 滕曼, 付强. 重金属有效态在土壤质量管理中的研究与应用. 环境科学与技术, 2009, 32(6C): 418- 424.
[31] Angle J S, Baker A J, Whiting S N, Chaney R L. Soil moisture effects on uptake of metals byThlaspi,Alyssum, andBerkheya. Plant and soil, 2003, 256(2): 325- 332.
[32] Caldwell B A. Enzyme activities as a component of soil biodiversity: A review. Pedobiologia, 2005, 49(6): 637- 644.
[33] Tabatabal M A, Dick W A. Enzymes in soil: research and developments in measuring activities // Burns R G, Dick R P, ed. Enzymes in the Environment: Activity, Ecology, and Applications. New York: Marcel Dekker, Inc, 2002: 567- 595.
[34] 杨玉盛, 何宗明, 邹双全, 俞新妥. 格氏栲天然林与人工林根际土壤微生物及其生化特性的研究. 生态学报, 1998, 8(2): 198- 202.
[35] 吉艳芝, 冯万忠, 陈立新, 段文标, 张笑归. 落叶松混交林根际与非根际土壤养分、微生物和酶活性特征. 生态环境, 2008, 17(1): 339- 343.
[36] Pant H K, Warman P R. Enzymatic hydrolysis of soil organic phosphorus by immobilized phosphatases. Biology and Fertility of Soils, 2000, 30(4): 306- 311.
Heavymetalconcentration,enzymeactivity,andphysicalandchemicalpropertiesofrhizosphereandnon-rhizospheresoilscontainingMosobamboo
GUO Hua, CHEN Junren, ZHONG Bin, LIU Chen, WU Jiasen, HE Lizhi, YE Zhengqian, LIU Dan*
StateKeyLaboratoryofSuropicalSilviculture,KeyLaboratoryofSoilContaminationBioremediationofZhejiangProvince,ZhejiangAgricultureandForestryUniversity,Lin′an311300,China
The rhizosphere is an important ecological region that is utilized to study the relationships among plant communities, soil, and microbial communities. In the plant rhizosphere area, particularly in the small region near the root of the plant, there are great differences in acid-base properties, redox potential, and microbial populations than in the general soil because of root secretions. Phytoremediation is a new technology that employs hyperaccumulator plants to remove pollutants from the environment or to render them harmless. Therefore, research focusing on the status and function of the rhizospheric environment in relation to soil contamination has become important in recent years. Moso bamboo is an economic bamboo species that occupies the largest area and is the most widespread species in China. Because of its strong environmental suitability, it is believed that Moso bamboo could be utilized to repair future environmental pollution. To establish the time during which the activity of the root system is optimum, the dynamic changes in soil heavy metal concentration, pH, and soil enzymes were analyzed in the present study. Soil samples were collected from the Moso bamboo forestry near a lead/zinc mine in Quzhou, Zhejiang province, from February 2014 to January 2015. We collected one rhizosphere soil sample and one non-rhizosphere sample during each sampling period. All of the soil samples were a mixture from several sites, with 24 samples in total. The results demonstrated that the pH of the rhizosphere and non-rhizosphere soil for Moso bamboo remained constant during the sampling period, with numbers ranging from 4.50 to 4.85. Water content in the rhizosphere soil was greater than that in the non-rhizosphere, and there was great variation between them, with minimum values measured in June and October. The available Cd and Zn contents of rhizosphere soil were significantly higher than those of non-rhizosphere soil, with the converse occurring for available Pb. The activities of catalase, phosphatase, urease, and dehydrogenase in rhizosphere soils were significantly higher than those in non-rhizosphere soils. There was no significant correlation between soil enzyme activities and absorbable heavy metal concentrations. In rhizosphere soil, only available Pb was significantly negatively correlated with catalase. However, there were highly significant correlations between available Cd and catalase, while the correlation between Cd and urease was negatively significant in non-rhizosphere soil. Our results showed synthetically that the quality of rhizosphere soil was better than that of the non-rhizosphere soil, which could provide some foundation for the application of Moso bamboo as a plant material for renovation.
Moso bamboo; rhizosphere; non-rhizosphere; heavy metal; enzyme activity
国家自然科学基金(No. 31670617);浙江省科技厅重点研发项目(2015C03G 4010004)
2016- 06- 20; < class="emphasis_bold">网络出版日期
日期:2017- 04- 25
*通讯作者Corresponding author.E-mail: liudan7812@aliyun.com
10.5846/stxb201606201199
郭华,陈俊任,钟斌,刘晨,吴家森,何丽芝,叶正钱,柳丹.毛竹根际与非根际土壤重金属、理化性质及酶活性特征.生态学报,2017,37(18):6149- 6156.
Guo H, Chen J R, Zhong B, Liu C, Wu J S, He L Z, Ye Z Q, Liu D.Heavy metal concentration, enzyme activity, and physical and chemical properties of rhizosphere and non-rhizosphere soils containing Moso bamboo.Acta Ecologica Sinica,2017,37(18):6149- 6156.
