基于单克隆抗体的玉米赤霉烯酮检测方法研究
2017-11-03刘琦生威李志李诗洁张燕王硕
刘琦,生威,李志,李诗洁,张燕,王硕
(天津科技大学食品工程与生物技术学院,教育部食品营养与安全重点实验室,天津300457)
基于单克隆抗体的玉米赤霉烯酮检测方法研究
刘琦,生威,李志,李诗洁,张燕,王硕*
(天津科技大学食品工程与生物技术学院,教育部食品营养与安全重点实验室,天津300457)
建立一种检测谷物样品中玉米赤霉烯酮的酶联免疫分析方法。将玉米赤霉烯酮修饰羧基制得半抗原,再与钥孔嘁血蓝蛋白偶联,免疫BALB/c小鼠,经过细胞融合与筛选,得到3株具有高亲和力和特异性的杂交瘤细胞,分别为2E8、2C7、6E11,重链类型均为IgG1,轻链类型均为Kappa。细胞株2E8分泌的抗体特异性较好,制备腹水得到单克隆抗体用于后续实验。建立检测玉米赤霉烯酮的间接竞争酶联免疫吸附(Enzyme-Linked Immunosorbent Assay,ELISA)方法,方法的灵敏度(IC50)为(0.13±0.02)ng/mL,检测限(IC15)为(0.02±0.01)ng/mL,在玉米和燕麦中的检出限分别为2.4 μg/kg,4.0 μg/kg。加标回收率为82.80%~109.20%,变异系数为3.27%~15.38%。经高效液相色谱串联质谱仪验证(R2=0.996 3)二者具有良好的相关性。
玉米赤霉烯酮;单克隆抗体;间接竞争酶联免疫吸附法;高效液相色谱-串联质谱法
玉米赤霉烯酮(Zearalenone,ZEN)是由禾谷镰刀菌、黄色镰刀菌、木贼镰刀菌、粉红镰刀菌等产生的一种真菌毒素[1]。ZEN具有雌激素活性,造成动物体内生殖激素紊乱,严重影响动物的繁殖机能[2-5]。我国GB 2761-2011《食品安全国家标准食品中真菌毒素限量》规定[6]:谷物及其制品中,ZEN限量为60 μg/kg。
目前,检测ZEN的方法主要有色谱法和免疫分析法[7]。基于色谱检测的方法如高效液相色谱(High performance liquid chromatography,HPLC)[8-9]以及高效液相色谱-质谱联用(High performance liquid chromatography-Mass sepectrum,HPLC-MS)[10-11]等方法具有准确度好,灵敏度高、重复性好等优点,是目前应用于食品中有害小分子物质检测的实验室确证方法。免疫分析法主要包括酶联免疫吸附法[12]、胶体金免疫层析法[13-14]以及免疫生物传感器技术[15-18],具有高特异性、灵敏性,不需要贵重仪器,可以大大简化前处理过程,在现场检验以及批量筛选中具有重要意义[19]。王元凯等[20]制备ZEN单克隆抗体并建立一种间接竞争酶联免疫吸附(Enzyme-Linked Immunosorbent Assay,ELISA)方法。方法的灵敏度为1.90μg/kg,检测限为0.051μg/kg。祭芳等[21]制备ZEN单克隆抗体,腹水效价大于1×10-6,抗体灵敏度为225 ng/mL。Sun等[22]经过细胞融合,得到四株特异识别玉米赤霉烯酮的单克隆抗体。选择最为灵敏的细胞株4A3-F9(IC50=1.115 ng/mL)进行ELISA方法的建立,方法回收率为91.30~97.07%。Pei等[23]通过高通量酶联免疫分析对杂交瘤细胞进行筛选,制备的抗玉米赤霉烯酮单克隆抗体灵敏度IC50=1.79 ng/g,检测限为IC15=0.1 ng/g,对玉米样品进行了测定,方法回收率为80%~128%。
本研究使用单克隆抗体技术,得到抗玉米赤霉烯酮的单克隆抗体,并建立一种用于检测谷物中玉米赤霉烯酮的间接竞争ELISA方法。
1 材料与方法
1.1 材料与试剂
玉米赤霉烯酮(Zearalenone,ZEN)标准品、钥孔嘁血蓝蛋白(Keyhole limpet hemocyanin,KLH)、弗氏完全佐剂(Freund's complete adjuvant)、弗氏不完全佐剂(Freund's incomplete adjuvant)、N,N-二甲基甲酰胺(N,N-Dimethylformamide,DMF)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺(1-(3-Dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride,EDC):美国 Sigma公司;羧甲基羟胺、无水吡啶:法国阿法埃莎公司;Free DMEM培养基、胎牛血清、HAT、HT:美国GIBCO公司;MycoSep 226净化柱:美国Romer公司;甲醇(色谱纯):德国Merck公司;其他所有试剂均为国产分析纯。
玉米、燕麦样品购自天津某超市,经高效液相色谱串联质谱分析为阴性样品。
1.2 仪器与设备
Mycosep226净化柱:美国Romer公司;酶标仪、CO2细胞培养箱:美国Thermo公司;倒置显微镜:日本NIKON公司;液相色谱串联三重四级杆质谱仪(配有电喷雾离子源(ESI)和Agilent MassHunter工作站):美国安捷伦公司。
1.3 实验动物与细胞株
实验动物为健康雌性BALB/c小鼠:北京军事医学科学院;骨髓瘤细胞为Sp2/0细胞:天津科技大学教育部食品营养与安全重点实验室保存。
1.4 方法
1.4.1 人工抗原的合成
玉米赤霉烯酮半抗原的制备方法参照文献[24]并改进,步骤如下:称取10 mg玉米赤霉烯酮于圆底烧瓶中,加入200 μL甲醇使其溶解。加入20 mg羧甲基羟胺(Carboxymethoxylamine,CMO),1 mL无水吡啶,氩气保护下室温搅拌反应24 h,反应结束后50℃真空干燥除去吡啶,4℃保存待用。
免疫抗原的制备参照方法[12]并改进,步骤如下:称取上述所得半抗原9.78 mg和EDC 14 mg,加入1 mL DMF溶液,搅拌并4℃活化过夜。将10 mg KLH溶于2 mL碳酸氢钠缓冲液(130 mmol/L,pH=8.1),在冰浴中逐滴加入活化产物,室温下反应2 h后在4℃下反应过夜。将产物用磷酸盐缓冲液(phosphate buffercd saline,PBS)溶液透析72 h,测定其浓度并分装,冻存于-20℃。包被抗原(Zearalenone-ovalbumin,ZEN-OVA)的制备方法同免疫原。
1.4.2 单克隆抗体的制备
将免疫原100 μg与等体积的弗式完全佐剂混合均匀(加强免疫使用弗氏不完全佐剂)免疫动物。分别于第2、3、4次免疫后8 d~10 d在小鼠尾动脉处取血,采用间接竞争ELISA进行检测。冲刺免疫后取脾细胞与Sp2/0融合,采用有限稀释法3次克隆化,得到能够稳定分泌抗体的杂交瘤细胞株。采用辛酸-硫酸铵法纯化单克隆抗体腹水,并使用亚型鉴定试剂盒对所产抗体的亚型进行鉴定。
1.4.3 间接竞争ELISA方法
在 37℃下,将 100 μL 的包被抗原(1 μg/孔)加入到聚苯乙烯酶标板上,孵育3 h。弃去孔中液体,用0.05%吐温20-磷酸盐缓冲液(phosphate bufferad sahne mith 0.05%tween 20,PBST) 洗液洗板 3 次 (250 μL/孔),拍干;使用 0.5%脱脂乳粉溶液(200 μL/孔)对微孔进行封闭1 h,PBST洗液洗板3次;实验孔加入标准品(50 μL/孔),对照孔加入等量的 PBS,同时加入用PBS缓冲液梯度稀释的抗血清(50 μL/孔),孵育1 h,PBST洗液洗板4次;加入用PBS缓冲液稀释10 000倍的羊抗鼠酶标二抗(100 μL/孔),孵育30 min,PBST 洗液洗板 5次;加入底物液(100 μL/孔),反应 15 min~20 min;加入终止液(50 μL/孔)终止反应;用酶标仪在双波长(450、650nm)下,读取吸光值。
1.4.4 间接竞争ELISA方法标准曲线的绘制
设定 ZEN标准品浓度值分别为10、3.33、1.11、0.37、0.123、0.041、0.013 7、0.004 6、0 ng/mL。标准品浓度为0时的吸光值设为B0,不同浓度标准品的吸光值设为B,空白对照的吸光值设为B空白,抑制率计算公式为:1-[(B-B空白)/(B0-B空白)]×100%。以标准品浓度为横坐标,抑制率为纵坐标,绘制标准抑制曲线。
1.4.5 抗体特异性的测定
选择几种常见的真菌毒素以及玉米赤霉烯酮结构类似物测定交叉反应来评价抗体特异性。交叉反应率(cross-reactivity,CR%)计算公式如下:

1.4.6 甲醇含量对ELISA反应体系的影响
谷物样品的提取需要使用甲醇作为提取液。配制浓度为0%、1%、5%、10%、20%、40%的甲醇/PBS溶液作为样品稀释液进行间接竞争ELISA,考察有机试剂含量对ELISA体系的影响。
1.4.7 高效液相色谱串联质谱法的验证
1.4.7.1 色谱条件
色谱柱:Agilent ZORBAX Eclipse Plus C18液相色谱柱(50 mm×2.1 mm,1.8 μm);流动相:甲醇 ∶0.05%氨水=50∶50(体积比);载气流速 0.2 mL/min,进样量 1 μL;柱温箱温度:25℃。
1.4.7.2 质谱条件
电喷雾电离源(ESI-);碰撞能量25 V;毛细管电压140 V;母离子m/z 317.36;子离子m/z 131.1;干燥气温度:350℃;干燥气流速:10 L/min。
1.4.8 实际样品测定
间接竞争ELISA方法谷物样品处理方法:
样品处理方法参照文献[25]并改进,方法如下:准确称取5 g谷物样品,粉碎后加入20 mL70%甲醇-水溶液,剧烈震荡2 min,10 000 r/min离心15 min,取上清用PBS稀释后测定。向玉米样品中分别添加玉米赤霉烯酮标准品5、10、20 μg/kg,向燕麦样品中分别添加15、25、50 μg/kg,计算回收率以及变异系数。
高效液相色谱串联质谱法谷物样品处理方法:
样品处理方法参照文献[26]并改进,方法如下:准确称取2 g谷物样品,粉碎后加入10 mL70%甲醇-水溶液,剧烈震荡2 min,10 000 r/min离心15 min,使用MycoSep 226多功能净化柱进行净化。氮气吹干有机溶剂,取1 mL甲醇复溶试管底部残渣,溶液经0.22 μm有机相滤膜过滤后进行分析。加标回收方法同间接竞争ELISA方法谷物样品处理方法,并比较两种方法的相关性。
2 结果与分析
2.1 细胞筛选及亚型鉴定
对4只小鼠进行免疫,经测定均有免疫应答。小鼠4经免疫后效价达到1∶128 000,对100 ng/mL的ZEN标准品抑制率达到83.2%,因此选择小鼠4进行细胞融合。本次细胞融合获得3株杂交瘤细胞。经测定重链类型均为IgG1;轻链类型均为Kappa。纯化腹水并进行特异性测定,结果见表1。

表1 单克隆抗体特异性及亚型测定Table 1 The sensitivity and isotype of monoclonal antibody
2.2 间接竞争ELISA方法标准曲线
选择细胞株2E8分泌的单克隆抗体建立间接竞争ELISA方法。ELISA方法工作条件为:包被抗原包被量为0.01 μg/孔,抗体稀释4万倍,采用0.01 mol/L pH 7.4的PBS缓冲液来稀释标准品,得到玉米赤霉烯酮的间接竞争标准曲线如图1所示。方法灵敏度IC50=(0.13±0.02)ng/mL,检测限 IC15=(0.02±0.01)ng/mL。

图1 ZEN间接竞争ELISA标准曲线Fig.1 Standard curve of ZEN by ic-ELISA
2.3 抗体特异性测定
交叉反应测定结果见表2。制备的玉米赤霉烯酮单克隆抗体与其他真菌毒素几乎无交叉,说明抗体的特异性较好。与4种结构类似物均有交叉,与玉米赤霉酮交叉较小。由于此结构类似物是由玉米赤霉烯酮代谢产生,且均有毒性,因此,本次制备的抗体可实现对这4种结构类似物的检出。
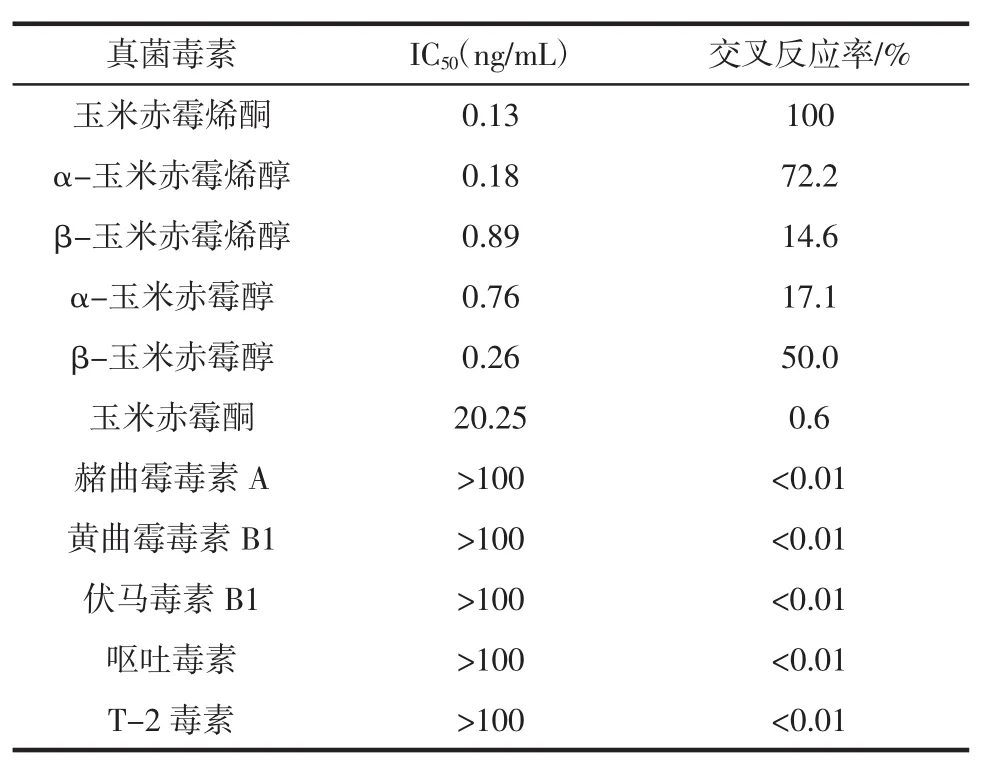
表2 抗玉米赤霉烯酮单克隆抗体与其他真菌毒素的交叉反应Table 2 Cross-reactivity of anti-ZEN monoclonal antibody with mycotoxin
2.4 甲醇含量对间接竞争ELISA的影响
甲醇含量对间接竞争ELISA的影响结果见图2。
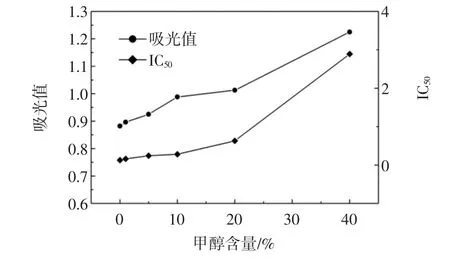
图2 甲醇含量对间接ELISA的影响Fig.2 The influence of methanol on ic-ELISA
当甲醇含量低于5%时,对ELISA反应影响较小。甲醇含量大于5%时影响抗原抗体反应,降低ELISA反应的灵敏度。尤其是当甲醇超过20%时,灵敏性显著降低。因此,当甲醇含量低于5%时,可认为对ELISA体系影响较小。
2.5 样品基质影响及消除
对样品提取液进行不同倍数的稀释,绘制标准曲线,以确定能够消除基质影响的最适稀释倍数,结果见图3。
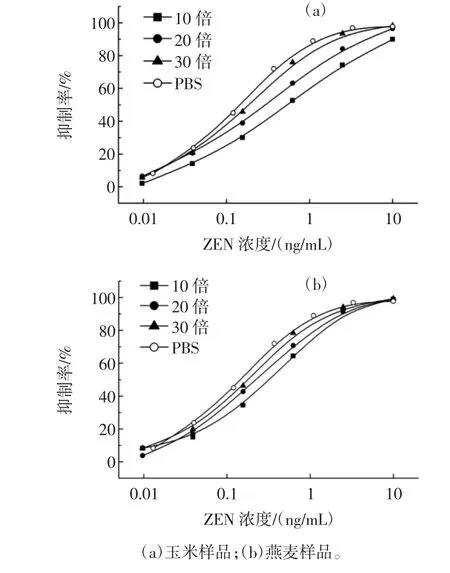
图3 样品提取液稀释倍数对ELISA反应的影响Fig.3 The influence of dilution multiple of sample extraction buffer on ic-ELISA
由图3可知,玉米样品提取液稀释30倍,燕麦样品提取液稀释50倍后进行测定可以基本消除基质影响,且此时甲醇含量不超过5%。
2.6 实际样品测定结果
样品测定结果见表3。
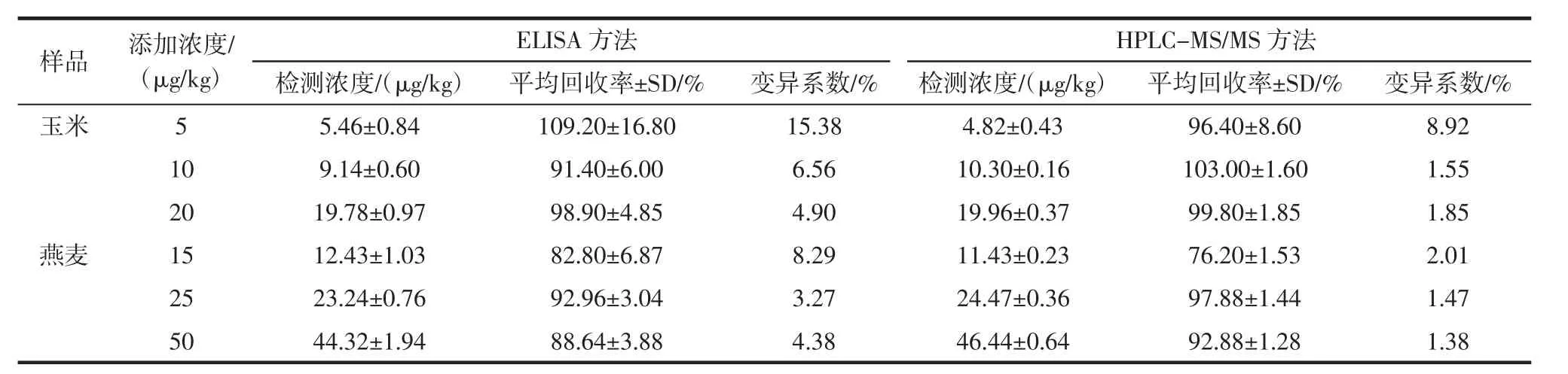
表3 样品添加回收试验(n=3)Table 3 Recovery test in samples(n=3)
可知间接竞争ELISA方法的加标回收率在82.80%~109.20%之间,液相色谱串联质谱方法的加标回收率在76.20%~103.00%。经过比较二者线性相关系数值R2为0.996 3,两种方法检测的结果较为一致,说明ELISA方法较为准确。根据样品的稀释倍数可以得出间接竞争ELISA方法在玉米和燕麦中的检出限分别为 2.4 μg/kg,4.0 μg/kg。
3 结论
本研究经过细胞融合与筛选得到3株能够特异性分泌抗体的杂交瘤细胞,对玉米赤霉烯酮均具有高度特异性。选择最优细胞株建立检测玉米赤霉烯酮的间接竞争酶联免疫吸附(ELISA)方法。方法的灵敏度(IC50)为(0.13±0.02)ng/mL,检测限(IC15)为(0.02±0.01)ng/mL,在玉米和燕麦中的检出限分别为 2.4 μg/kg,4.0 μg/kg。经液相色谱串联质谱法验证二者相关性良好,方法操作简单且灵敏,可用于检测多种谷物中的玉米赤霉烯酮含量。
[1]RICHARD J L.Some major mycotoxins and their mycotoxicoses--an overview[J].International Journal of Food Microbiology,2007,119(1/2):3-10
[2]MOLTÓ J C.Review on the toxicity,occurrence,metabolism,detoxification,regulations and intake of zearalenone:an oestrogenic mycotoxin[J].Food&ChemicalToxicology,2007,45(1):1-18
[3]YANG J,ZHANG Y,WANG Y,et al.Toxic effects of zearalenone and alpha-zearalenol on the regulation of steroidogenesis and testosterone production in mouse Leydig cells[J].Toxicology in Vitro,2007,21(4):558-565
[4]单妹,许梓荣,冯建蕾.玉米赤霉烯酮对家畜繁殖性能和人体健康的影响[J].中国畜牧兽医,2006,33(1):37-39
[5]MARIN D E,TARANU I,BURLACU R,et al.Effects of zearalenone and its derivatives on porcine immune response[J].Toxicology in Vitro An International Journal Published in Association with Bibra,2011,25(8):1981-1988
[6]中华人民共和国卫生部.GB 2761-2011食品中真菌毒素限量[S].北京:中国标准出版社,2011
[7]马惠蕊,王玉坤,刘淑艳,等.食源性真菌毒素检测技术研究进展[J].福建分析测试,2011,20(1):40-43
[8]罗小虎,包清彬,杨潇,等.高效液相色谱法测定玉米赤霉烯酮的方法研究[J].食品科技,2010(1):266-270
[9]尹青岗,王锋,周洪杰,等.高效液相色谱法对玉米中玉米赤霉烯酮的测定[J].中国粮油学报,2009,24(7):138-141
[10]LI M,KONG W,LI Y,et al.High-throughput determination of multi-mycotoxins in Chinese yam and related products by ultra fast liquid chromatography coupled with tandem mass spectrometry after one-step extraction.[J].Journal of Chromatography B Analytical Technologies in the Biomedical&Life Sciences,2016,1022:118-125
[11]TRUCKSESS M W,FU W S,OLES C J,et al.Determination of zearalenone in botanical dietary supplements,soybeans,grains,and grain products by immunoaffinity column cleanup and liquid chromatography:single-laboratory validation.[J].Journal of Aoac International,2011,94(2):589-595
[12]王硕,张鸿雁,王俊平.酶联免疫吸附分析方法:基本原理及其在食品化学污染物检测中的应用[M].北京:科学出版社,2011:178-179
[13]WANG Y,DENG R,ZHANG G,et al.Rapid and sensitive detection of the food allergen glycinin in powdered milk using a lateral flow colloidal gold immunoassay strip test.[J].Journal of Agricultural&Food Chemistry,2015,63(8):2172-2178
[14 KIM K Y,SHIM W B,KIM J S,et al.Development of a simultaneous lateral flow strip test for the rapid and simple detection of deoxynivalenol and zearalenone.[J].Journal of Food Science,2014,79(10):2048-2055
[15]LIN X,GUO X.Advances in Biosensors,Chemosensors and Assays for the Determination of Fusarium Mycotoxins.[J].Toxins,2016,8(6):161
[16]ZHAN S,HUANG X,CHEN R,et al.Novel fluorescent ELISA for the sensitive detection of zearalenone based on H2O2-sensitive quantum dots for signal transduction.[J].Talanta,2016,158:51-56
[17]HERVÁS M,LÓPEZ M Á,ESCARPA A.Electrochemical immunoassay using magnetic beads for the determination of zearalenone in baby food:An anticipated analytical tool for food safety[J].Analytica Chimica Acta,2009,653(2):167-172
[18]CHOI S W,CHANG H J,LEE N,et al.Detection of mycoestrogen zearalenone by a molecularly imprinted polypyrrole-based surface plasmon resonance(SPR)sensor.[J].Journal of Agricultural&Food Chemistry,2009,57(4):926-932
[19]朱慧莉,黎锡流,许喜林.酶联免疫吸附法及其在食品分析中的应用[J].食品工业科技,2001(2):80-82
[20]王元凯,王君,王雨晨,等.玉米赤霉烯酮单克隆抗体的制备及间接竞争ELISA检测方法的建立[J].微生物学通报,2011,38(12):1793-1800
[21]祭芳,曹欢,徐剑宏,等.抗玉米赤霉烯酮单克隆抗体的制备[J].江苏农业学报,2014,30(2):417-422
[22]SUN Y,HU X,ZHANG Y,et al.Development of an immunochromatographic strip test for the rapid detection of zearalenone in corn[J].Journal of Agricultural&Food Chemistry,2014,62(46):11116-21
[23]PEI S C,LEE W J,ZHANG G P,et al.Development of anti-zearalenone monoclonal antibody and detection of zearalenone in corn products from China by ELISA[J].Food Control,2013,31(1):65-70
[24]Thouvenot D,Morfin R F.Radioimmunoassay for zearalenone and zearalanol in human serum:production,properties,and use of porcine antibodies[J].Applied&Environmental Microbiology,1983,45(1):16-23
[25]LIU N,NIE D,ZHAO Z,et al.Ultrasensitive immunoassays based on biotin–streptavidin amplified system for quantitative determination offamilyzearalenones[J].FoodControl,2015,57:202-209
[26]郑翠梅,张艳,王松雪,等.液相色谱-飞行时间质谱同时测定粮食中13种真菌毒素[J].分析测试学报,2012,31(4):383-389
Study on Immunoassay for the Detection of Zearaleone Based on Monoclonal Antibody
LIU Qi,SHENG Wei,LI Zhi,LI Shi-jie,ZHANG Yan,WANG Shuo*
(Key Laboratory of Food Nutrition and Safety,Ministry of Education of China,College of Food Engineering and Biotechnology,Tianjin University of Science and Technology,Tianjin 300457,China)
The aim of this research was to develop an enzyme linked immunosorbent assay to detect zearalenone in grain samples.Three hybridoma cells named 2E8,2C7,6E11 were obtained after cell fusion and filtering by immunizing Balb/c mouses with conjugate of ZEN and keyhole limpet hemocyanin.The subtypes of three monoclonal antibody were identified with IgG1 for heavy chain and Kappa for light chain.The cell 2E8 was chosen for subsequent experiments.An indirect-competitive Enzyme-Linked Immunosorbent Assay(ELISA)was developed for the detection of zearalenone with high specificity and affinity after optimizing.The half maximal inhibitory concentration(IC50)was(0.13±0.02)ng/mL,the limit of detection(IC15)was(0.02±0.01)ng/mL while the the limits of detection are 2.4 μg/kg,4.0 μg/kg for corn and oat with the recoveries from 82.80%to 109.20%and the coefficients of variation was between 3.27%and 15.38%.The method was confirmed by high performance liquid chromatography tandem mass spectrometry with a good correlation.
zearalenone;monoclonal antibody;indirect-competitive enzyme linked immunosorbent assay (ic-ELISA);high performance liquid chromatography-tandem mass spectrometry(HPLC-MS/MS)
10.3969/j.issn.1005-6521.2017.21.022
“十二五”国家科技支撑计划(2013BAD18B11);国家国际科技合作专项项目(2014DFR30350)
刘琦(1992—),女(汉),硕士,研究方向:食品安全检测。
*通信作者:王硕(1969—),男,教授,博士生导师,研究方向:食品安全和免疫学检测。
2017-02-20
