利用咖啡豆渣酶法制备甘露低聚糖的研究
2017-11-03郭跃平徐广伟韦何雯章银军沈雪亮
郭跃平,徐广伟,韦何雯,章银军,沈雪亮
(1.金华市食品药品检验检测研究院,浙江金华321000;2.浙江工业大学生物工程学院,浙江杭州310014)
利用咖啡豆渣酶法制备甘露低聚糖的研究
郭跃平1,徐广伟1,韦何雯1,章银军2,*,沈雪亮2
(1.金华市食品药品检验检测研究院,浙江金华321000;2.浙江工业大学生物工程学院,浙江杭州310014)
充分利用水提绿原酸所剩的咖啡豆渣,酶法制备高附加值的产品甘露低聚糖(mannan-oligosaccharides,MOS),并对其成分进行分析研究。利用市场上现有的两种不同来源的β-甘露聚糖酶(来源于枯草芽孢杆菌的酶,称为酶A;来源于黑曲霉的酶,称为酶B)对咖啡豆渣酶解处理制备甘露低聚糖,通过单因素试验以及正交试验,对加酶量、酶解温度、酶解pH值和酶解时间进行优化,得出最佳工艺条件。利用酶A制备MOS得率为(52.76±0.11)%,利用酶B制备MOS得率为(61.01±0.12)%,测得酶A和酶B处理后的酶解液平均聚合度(DP值)分别为7.52和7.46。酶B处理的酶解液经1-苯基-3-甲基-5-吡唑啉酮(PMP)衍生化后进行液相色谱(HPLC)分析,确定甘露低聚糖的组成成分为:甘露糖为42.78%,半乳糖为42.58%,阿拉伯糖14.64%。DP值为7.46符合功能性低聚糖的制备要求,分析低聚糖成分中甘露糖含量较高,符合功能性低聚糖为甘露低聚糖的要求,为利用咖啡豆渣制备高附加值产品提供了技术支持。
咖啡豆渣;甘露低聚糖;β-甘露聚糖酶A;β-甘露聚糖酶B;平均聚合度
甘露低聚糖又称甘露寡聚糖、低聚甘露糖,广泛存在于魔芋粉、瓜儿豆胶、田菁胶及多种微生物细胞壁内,其作为双歧杆菌增殖因子,具有甜味,所以往往被用作糖替代剂,而且对肠道保护和免疫力的提高等作用,已被广泛地用作食品和饲料添加剂[1-5]。酶法水解魔芋、瓜尔胶、椰子、刺槐豆胶等原料制备甘露低聚糖,是现今生产常用的方法,而且研究表明不同来源的β-甘露聚糖酶对β-甘露多糖具有不同的水解能力。对于瓜胶半乳甘露聚糖,枯草杆菌K-50所产的β-甘露聚糖酶的水解率为5%,而源于黑曲霉的β-甘露聚糖酶水解率为12%;对于咖啡豆半乳甘露聚糖,它们的水解率分别为36%和58%[6-12]。
研究表明,魔芋中葡甘聚糖的含量在40.77%~72.84%[13],椰子壳中甘露聚糖含量为51.8%[14],咖啡豆渣中甘露聚糖含量为24.12%[15]。β-甘露聚糖酶酶解咖啡豆渣多糖中主要成分半乳甘露聚糖时,只对主链上的β-1,4-糖苷键进行酶切,而对α-1,6-糖苷键不起作用,因此酶解产物是带有D-半乳糖侧链的小分子甘露低聚糖。柱层析法[16-17]和膜分离法均可分离得到2~10聚合度的甘露低聚糖,但膜分离法具有节能、环保、高效且保留生物活性成分等特点[18],尤其适用于工业化大生产。咖啡豆渣中存在含量丰富的多糖物质,酶法制备甘露低聚糖,在低聚糖成分分析时,由于单糖极性强,且结果相近和缺乏光学活性,所以人们常用柱前或柱后衍生化的方法处理水解后的多糖,来进行色谱分离和检测。这样的方法具有分离选择性好和检测灵敏度高等优点[19-20]。
本文以水提法提取绿咖啡豆中绿原酸后所剩的咖啡豆渣为原料,用市场上现有的两种不同来源的β-甘露聚糖酶水解咖啡豆渣制备甘露低聚糖,通过单因素试验及L9(34)正交试验进行条件优化,确定甘露低聚糖制备的最佳工艺,采用膜分离法对甘露低聚糖进行分离纯化,为利用咖啡豆渣制备甘露低聚糖工业化生产提供技术支持。
1 材料与方法
1.1 材料与设备
绿咖啡豆(Coffee arabica):由浙江天草生物科技有限公司提供;单糖标准品(L-鼠李糖、D-葡萄糖、D-木糖、L-阿拉伯糖、D-半乳糖、D-甘露糖、D-半乳糖醛酸)、标准分子量葡聚糖:Aladdin公司;咖啡豆渣:绿咖啡豆中绿原酸提取后所剩的废渣;枯草芽孢杆菌所产的β-甘露聚糖酶(5 000 U/g,酶A)、黑曲霉所产的β-甘露聚糖酶(10 000 U/g,酶B):湖北远成赛创科技有限公司;氯仿、甲醇、冰醋酸、无水硫酸钠、三氟乙酸、盐酸、氢氧化钠、乙醇、十二水合磷酸氢二钠、一水合柠檬酸、浓硫酸、1-苯基-3-甲基-5-吡唑啉酮(PMP):均为国产分析纯;液相色谱仪、Waters1525泵、Waters2414示差检测器、Waters2487紫外检测器:美国Waters公司;Welch C18色谱柱:上海月旭科技股份有限公司;UV-2450紫外可见分光光度计:日本SHIMADZU公司;CT14RD高速冷冻离心机:日本日立公司;Hei-VAP旋转蒸发器:德国Heidolph公司。
1.2 方法
1.2.1 甘露糖标准曲线绘制
准确称取甘露糖0.1 g,溶解于蒸馏水中,振荡摇匀,定容于100 mL容量瓶中,配制成1 mg/mL甘露糖溶液,稀释成 0.1、0.2、0.3、0.4、0.5、0.6 mg/mL 等梯度浓度的甘露糖溶液6个标准品溶液,分别取1 mL甘露糖溶液,加1 mL蒸馏水,再加2 mL DNS缓冲液,沸水浴5 min后,定容至10 mL,振荡摇匀,在λ=520 nm条件下,检测不同甘露糖浓度的OD值,绘制甘露糖标准曲线。
1.2.2 咖啡豆渣的酶解工艺
工艺流程:缓冲液中咖啡豆渣酶解→过滤→酶解液→测酶解液还原糖→酶解液水解→测总糖含量
1.2.3 单因素试验设计
采用酶A和酶B对咖啡豆渣水解制备甘露低聚糖,通过对料液比(1 ∶50、2 ∶50、3 ∶50、4 ∶50、5 ∶50、6 ∶50 g/mL),酶解温度(40、45、50、55、60 ℃),酶解 pH值(4、5、6、7、8),酶解时间(2、4、6、8、10 h),加 酶量(100、150、200、250、300 U/g)等条件的优化,确定酶 A和酶B制备甘露低聚糖得率最高时的条件范围。
1.2.4 酶A和酶B制备甘露低聚糖正交试验
用正交试验对加酶量、酶解温度、酶解pH值和酶解时间等四因素进行条件优化,设计正交因素水平表1和表2,分别通过L9(34)正交试验表,9组试验,确定酶A和酶B水解咖啡豆渣制备甘露低聚糖的最佳工艺条件组合。
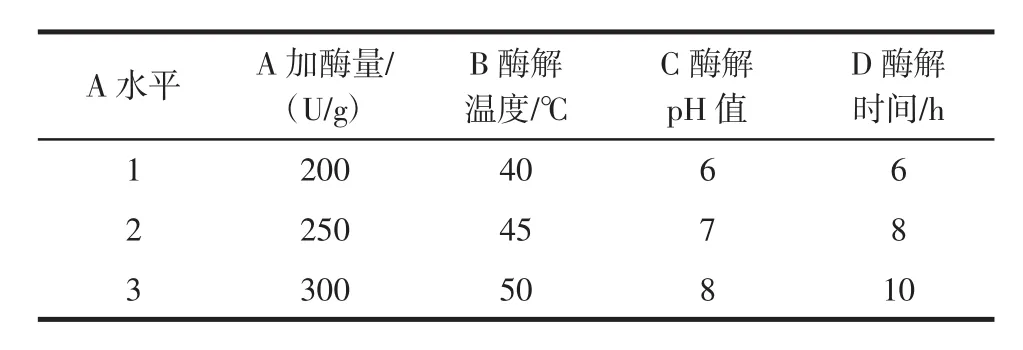
表1 正交试验设计因素及水平Table 1 Factors and levels of orthogonal experiment
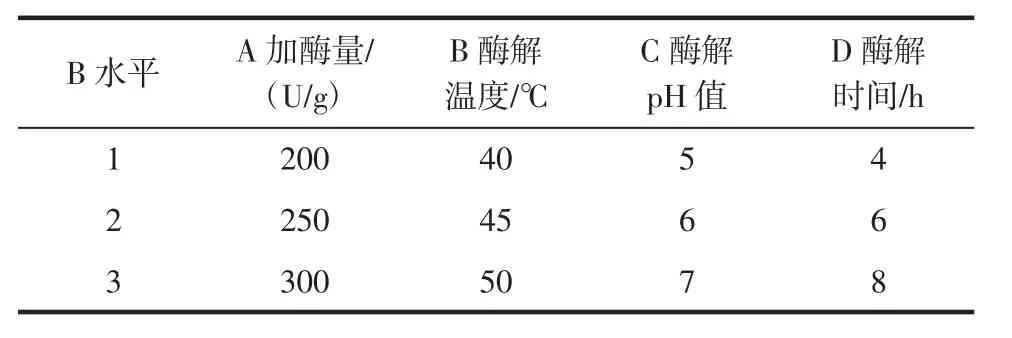
表2 正交试验设计因素及水平Table 2 Factors and levels of orthogonal experiment
1.2.5 酶解液中总糖的测定及得率和平均聚合度的计算
酶法处理咖啡豆渣制备甘露低聚糖,酶解液中总糖含量的测定方法:准确量取过滤后的咖啡豆渣酶解液5 mL,于20 mL具塞试管内,加5 mL超纯水和0.4 mL浓硫酸,振荡摇匀,100℃水浴水解2 h,室温冷却后,用NaOH中和。将中和溶液倒入100 mL容量瓶中定容,振荡摇匀,后取1.0 mL溶液,加1.0 mLDNS缓冲液,沸水浴5 min显色反应,之后迅速冷却至室温,加蒸馏水定容至10 mL刻度处。以空白为对照,用紫外-可见分光光度计检测测其在520 nm下的OD值,依据甘露糖标准曲线,计算单位体积总糖量,计算总糖和DP(平均聚合度)值,公式如下:
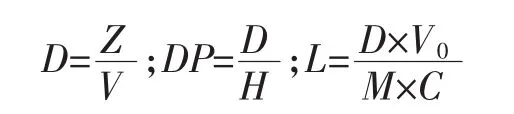
式中:D为1 mL为酶解液中总糖量,mg/mL;Z为量取酶解液中总糖量,mg;V为量取酶解液体积,mL;H为1 mL酶解液测定相应的还原糖含量,mg/mL;DP为甘露低聚糖平均聚合度,重复单数;V0为酶解液总体积,mL;M为咖啡豆渣质量,mg;C为咖啡豆渣中甘露聚糖含量,24.12%;L为低聚糖得率,%。
1.2.6 甘露低聚糖膜分离法
咖啡豆渣水解后的酶解液,通过12 000 r/min离心10 min除去咖啡豆渣和蛋白等杂质后,用超滤膜过滤浓缩甘露低聚糖溶液,然后再用1 kDa和3 kDa反渗透膜分离,收集过滤液,测定过滤液的平均聚合度DP值。
1.2.7 1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP)衍生化法检测多糖组分
酶解液过滤后,12 000 r/min离心10 min,吸取离心后的酶解上清液400 μL,于10 mL具塞试管中,加入400 μL 4 mol/L三氟乙酸,封口后置于110℃烘箱中水解2 h得水解液,定容至800 μL,振荡摇匀,后取200 μL,加 400 μL 0.3 mol/L NaOH 溶液,再加配制好的PMP衍生剂,旋转摇匀,后70℃水浴加热30 min,冷却后,加400 μL 0.3 mol/L的盐酸溶液和1.0 mL氯仿萃取,于离心机在12 000 r/min下离心6 min,每组样品都重复3次上述操作,且每次都除去下层溶液,之后取上清液待进样检测。
1.2.8 PMP衍生化法HPLC检测
采用高效液相色谱法(High performance liquid chromatography,HPLC)检测经PMP衍生化的糖含量。检测条件:色谱柱为 Welchrom Cloumn(4.6 mm×250 mm)C18柱;流动相为乙腈:乙酸铵(0.10 mol/L,pH=5.5,用冰醋酸调节其pH值)=22∶78;流速为1 mL/min;柱温为30℃;进样量为10 μL;检测波长为250 nm。
取7种单糖标准品(L-鼠李糖、D-葡萄糖、D-木糖、L-阿拉伯糖、D-半乳糖、D-甘露糖、D-半乳糖醛酸),分别称取少量的单糖标准品,通过PMP衍生化,检测单糖标准品。分别称取1 mol的7种单糖标,混合溶解稀释后,配制成 0.2、0.4、0.6、0.8、1.0 mmol/L 等梯度的5个混糖标,衍生化后检测混糖标准品。
2 结果与讨论
2.1 甘露糖标准曲线
不同梯度浓度的甘露糖溶液,对应的标准曲线公式:y=1.596 29x-0.098 87,R2=0.999 1,结果如图 1。
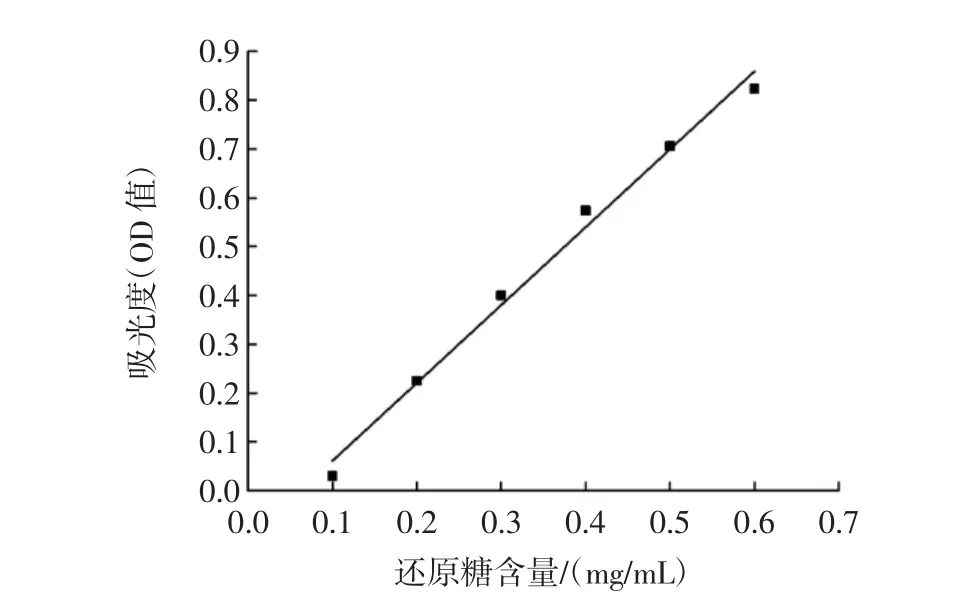
图1 甘露糖标准曲线Fig.1 The standard curve of mannose
2.2 酶解工艺条件对两种酶法制备甘露低聚糖得率的影响
2.2.1 不同料液比对两种酶法制备甘露低聚糖得率的影响
料液比优化试验结果见图2,酶A水解咖啡豆渣(法A)制备甘露低聚糖最佳水解料液比为3∶50(g/mL),而酶B水解咖啡豆渣(法B)制备甘露低聚糖最佳水解料液比为4∶50(g/mL),使获得甘露低聚糖得率最高。
2.2.2 酶解温度对两种酶法制备甘露低聚糖得率的影响
法A和法B的酶解温度试验结果见图3。
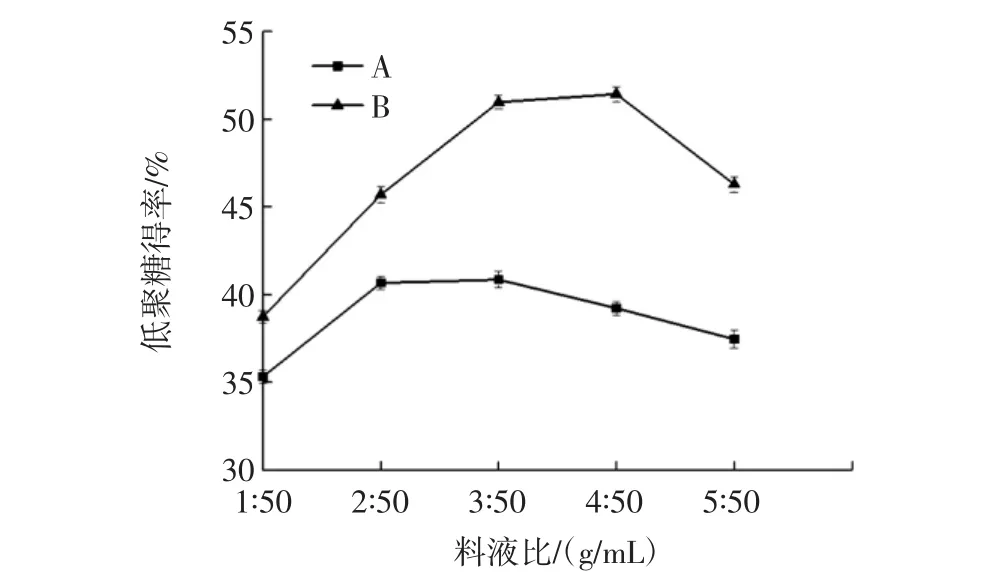
图2 料液比对甘露低聚糖得率的影响Fig.2 Effect of solid to liquid ratio on yield of mannan oligosaccharides
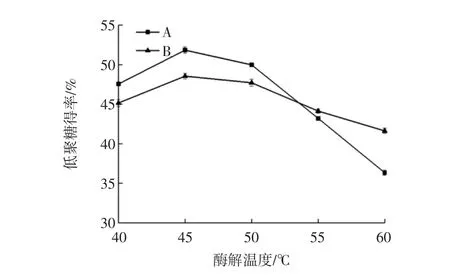
图3 酶解温度对甘露低聚糖得率的影响Fig.3 Temperature on yield of mannan oligosaccharides
法A的最佳酶解温度范围为40℃~50℃,法B的最佳酶解温度范围为40℃~50℃,此时制备甘露低聚糖得率最高。
2.2.3 酶解pH值对两种酶法制备甘露低聚糖得率的影响
法A和法B酶解时不同pH值试验结果见图4,法A最佳酶解pH值范围为5~7,法B最佳酶解pH值范围为 6~8。
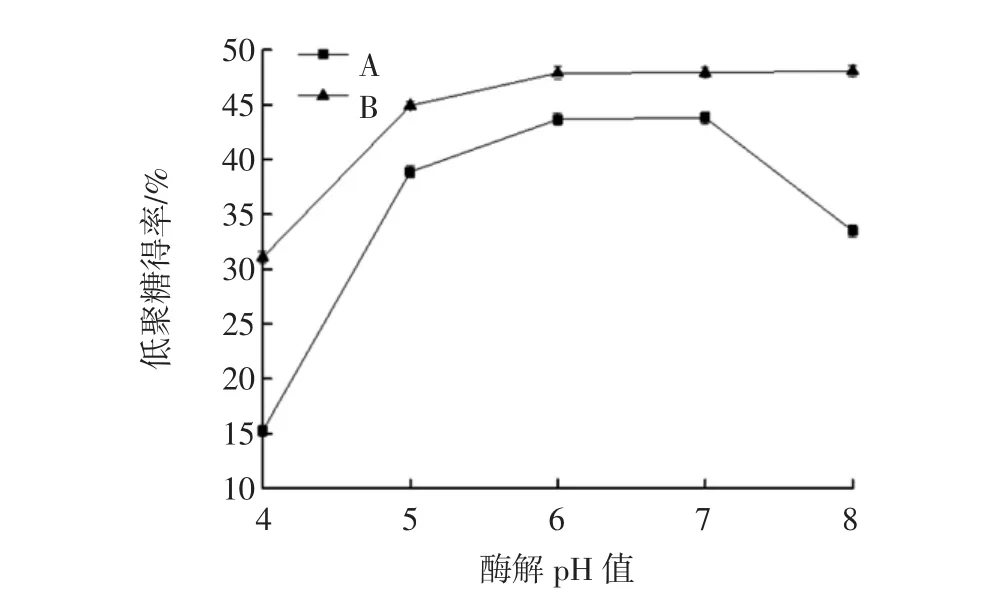
图4 酶解pH值对甘露低聚糖得率的影响Fig.4 pH value on yield of mannan oligosaccharides
2.2.4 酶解时间对两种酶法制备甘露低聚糖得率的影响
法A和法B酶解咖啡豆渣不同时间对比试验结果见图5,为获得较高的甘露低聚糖得率,法A的最佳酶解时间范围为6 h~10 h,而法B的最佳酶解时间范围为 4 h~8 h。

图5 酶解时间对甘露低聚糖得率的影响Fig.5 Time and enzyme amount on yield of mannan oligosaccharides
2.2.5 加酶量对两种酶法制备甘露低聚糖得率的影响
法A和法B酶解咖啡豆渣不同加酶量结果见图6,为获得较高的甘露低聚糖得率,法A的最佳加酶量范围为200 U/g~300 U/g,法B的最佳加酶量范围为200 U/g~300 U/g。
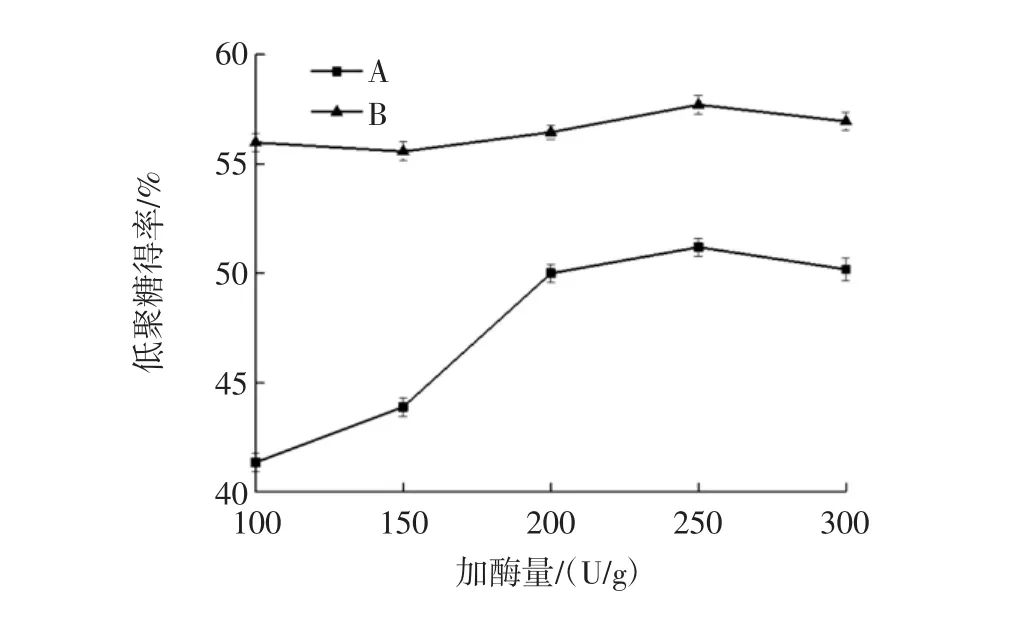
图6 加酶量对甘露低聚糖得率的影响Fig.6 Enzyme amount on yield of mannan oligosaccharides
2.3 法A和法B的正交对比试验
通过单因素试验显著性分析,确定加酶量、酶解温度、酶解pH值和酶解时间影响显著的四因素进行正交试验。
2.3.1 法A制备甘露低聚糖正交试验
法A制备甘露低聚糖正交试验见表3。
结果如表3所示,法A制备甘露低聚糖,正交试验得出最优组合:A3B3C1D2时,检测得率最大。最佳组合条件为:酶A加酶量300 U/g、酶解反应温度50℃、酶解液中pH值6和酶解反应时间8 h。依据得出的最优组合进行3次重复验证试验,计算MOS得率为(52.76±0.11)%。

表3 正交试验设计Table 3 Orthogonal design of experiments
2.3.2 法B制备甘露低聚糖正交试验
法B制备甘露低聚糖正交试验见表4。
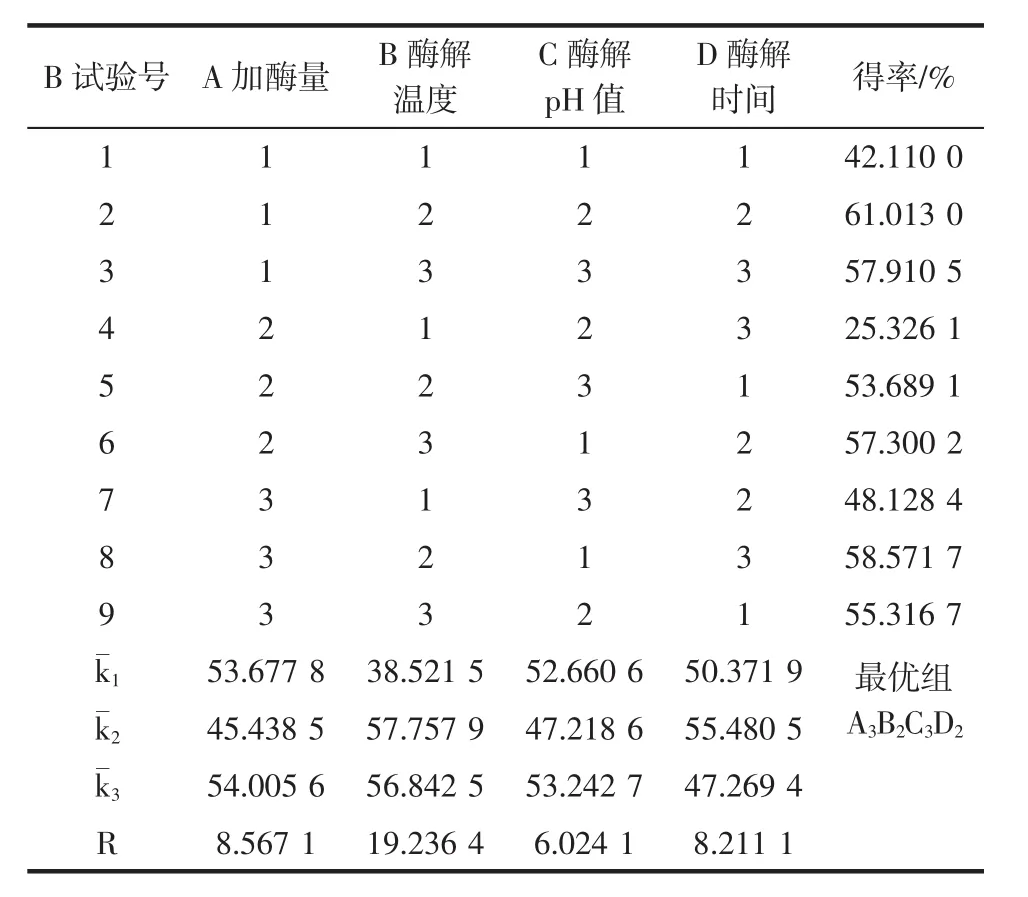
表4 正交试验设计Table 4 Orthogonal design of experiments
2.4 甘露低聚糖膜分离
结果如表4所示,法B制备甘露低聚糖,正交试验出最优组合:A3B2C3D2时,得率值最大。最佳组合条件为:加酶量300 U/g、酶解温度45℃、酶解pH值7和酶解时间6 h。依据得出的最优组合进行3次重复验证试验,计算MOS得率为(61.01±0.12)%。
法A和法B制备甘露低聚糖,酶解液通过12 000 r/min离心10 min,去除咖啡豆渣和其它杂质,之后用1 kDa和3 kDa反渗透膜分离,分离之后,检测甘露低聚糖的DP值,用DNS法检测滤液得总糖和还原糖含量,计算DP值。结果显示,法A和法B测得的滤液(1 kDa~3 kDa)DP值分别为7.52和7.46。
2.5 PMP衍生化多糖组分分析
7种单糖混标HPLC检测结果见图7,根据混糖标准品浓度和对应的峰面积,分别计算出7种单糖的标准曲线,结果如表5。

图7 混糖PMP衍生化液相色谱图Fig.7 Mixed sugar PMP derivatization HPLC

表5 7种单糖PMP衍生化标准曲线Table 5 The standard curve of seven kinds of PMP derivatized monosaccharide standard curve
上述单糖和混糖标,计算单糖PMP衍生化公式,用法B制备甘露低聚糖,酶解液过滤和离心后,取上清液进行PMP衍生化,HPLC检测显示,酶解液中甘露低聚糖组成成分为:甘露糖为42.78%,半乳糖为42.58%,阿拉伯糖14.64%。
3 结论
法A和法B水解咖啡豆渣后酶解液的DP值分别为7.52和7.46,但酶B制备MOS得率为(61.01±0.12)%,比酶A制备MOS得率更高,而且酶B酶解所得酶解液,经PMP衍生化后HPLC分析,分子量及单糖组成测定结果符合功能性低聚糖组成成分要求,为处理水提绿原酸后所剩的咖啡豆渣充分利用生产高附加值产品提供了数据支持,确定了利用咖啡豆渣酶法制备甘露低聚糖高附加值产品的最佳工艺,实现咖啡豆渣的充分利用。
[1]Nakashima Y,Ørskov E R,Hotten P M,et al.Rumen degradation of straw 6.Effect of polysaccharidase enzymes on degradation characteristics of ensiled rice straw[J].Animal Production,1988,47(3):421-427
[2]Savvage T F,Zakrzewska E I,Andreasin J R.Effect of MOS(BioMos)added to poultry starter in performance and health[J].Poultry Sci,1996,70:139
[3]Sims M D,Dawson K A,Newman K E,et al.Effects of dietary mannan oligosaccharide,bacitracin methylene disalicylate,or both on the live performance and intestinal microbiology of turkeys[J].Poultry Science,2004,83(7):1148-1154
[4]Zdunczyk Z,Juskiewicz J,Jankowski J,et al.Metabolic response of the gastrointestinal tract of turkeys to diets with different levels of mannan-oligosaccharide[J].Poultry science,2005,84(6):903-909
[5]Spring P,Wenk C,Dawson K A,et al.The effects of dietary mannaoligosaccharides on cecal parameters and the concentrations of enteric bacteria in the ceca of salmonella-challenged broiler chicks[J].Poultry Science,2000,79(2):205-211
[6]吴长菲,董岩岩,李俊俊,等.魔芋葡甘露低聚糖的酶法制备工艺的初步研究[J].生物技术通报,2010(1):118-122
[7]Kurakake M,Sumida T,Masuda D,et al.Production of galactomanno-oligosaccharides from guar gum by β-mannanase from Penicillium oxalicum SO[J].Journal of agricultural and food chemistry,2006,54(20):7885-7889
[8]Sudathip Titapoka,Suttipun Keawsompong,Dietmar Haltrich,et al.Selection and characterization of mannanase-producing bacteria useful for the formation of prebiotic manno-oligosaccharides from copra meal[J].World J Microbiol Biotechnol,2008,24:1425-1433
[9]Monia Blibech,Fatma Chaari,Fatma Bhiri,et al.Production of manno-oligosaccharides from locust bean gum using immobilized Penicillium occitanis mannanase[J].Journal of Molecular Catalysis B:Enzymatic,2011,73:111-115
[10]Cristóbal Cara,Encarnación Ruiz,Florbela Carvalheiro,et al.Production,purification and characterisation of oligosaccharides from olive tree pruning autohydrol ysis[J].Industrial Crops and Products,2012,40:225-231
[11]Hong-Lei Jian,Li-Wei Zhu,Wei-Ming Zhang,et al.Enzymatic production and characterization of manno-oligosaccharides from Gleditsia sinensis galactomannan gum[J].International Journal of Biological Macromolecules,2013,55:282-288
[12]Masahiro K,Takuya S,Daisuke M,et al.Production of Galactomanno-oligosaccharides from Guar Gum by β-Mannanase from Penicillium oxalicum SO[J].J Agric Food Chem,2006,54:7885-7889
[13]喻玲玲,邹坤.鄂产魔芋中葡甘露聚糖的含量测定[J].时珍国医国药,2008(3):680-682
[14]黄广民,陈祎,符刘冰,等.椰子壳中甘露聚糖含量的测定[J].广西化工,2001(2):33-36
[15]黄广民,陈祎平,杨雪蕊,等.脱脂咖啡渣中甘露聚糖含量的测定[J].海南大学学报(自然科学版),1999(4):317-321
[16]许牡丹,汤木红,王小燕.硅胶柱层析法分离纯化甘露低聚糖[J].食品工业科技,2008(9):188-190
[17]许牡丹,姚甲玉,毛跟年,等.离子交换法分离纯化甘露低聚糖[J].食品科技,2008(8):150-152
[18]史劲松,郭鸿飞,孙达峰,等.半乳甘露寡糖的膜法精制工艺研究[J].中国野生植物资源,2009(4):45-47
[19]林钦恒,郑家概,蔡大川,等.柱前衍生化HPLC法测定酵母细胞壁中的甘露聚糖与β-葡聚糖[J].分析测试学报,2015(1):106-110
[20]林雪.糖类物质的PMP(1-苯基-3-甲基-5-吡唑啉酮)衍生化及HPLC和MALDI-TOF分析[D].西安:西北大学,2006:6-14
Study on Preparation of Manno-oligosaccharides by Enzymatic Process of Coffee Bean Dregs
GUO Yue-ping1,XU Guang-wei1,WEI He-wen1,ZHANG Yin-jun2,*,SHEN Xue-liang2
(1.Insititute for Food and Drug Inspection and Testing of Jinhua,Jinhua 321000,Zhejiang,China;2.College of Biotechnology and Bioengineering,Zhejiang University of Technology,Hangzhou 310014,Zhejiang,China)
This study took the full use of the coffee bean dregs after water extraction using chlorogenic acid,made high value-added mannan-oligosaccharides(MOS)using enzymatic preparation method and analyzed its composition.Coffee bean dregs were hydrolyzed by enzyme to mannan oligosaccharides usig two market-available beta mannase from different sources:enzyme A from Bacillus subtilis,enzyme B from Aspergillus niger.The optimum process conditions(the optium enzyme amount,hydrolysis temperature,pH and enzymolysis time)were obtained through single-factor and orthogonal experiments.The yield of MOS prepared was(52.76±0.11)%by enzyme A and(61.01 ± 0.12)%by enzyme B.The average degree of polymerization(DP)of enzymatic hydrolysate treated with enzyme A and B was about 7.52 and 7.46 respectively.The hydrolysate solution treated with enzyme B was derivative reacted with 1-phenyl-3-methyl-5-pyrazolone(PMP)before liquid chromatography(HPLC)analysis.The composition of mannan oligosaccharides was determined:galactose 42.78%,mannose 42.58%,Arabia sugar 14.64%.The DP of 7.46 satisfied the requirements for preparing functional oligosaccharides.The content of manoligosaccharides was highest,satisfing the requirement that the functional oligosaccharides should be manoligosaccharides.This study will provide technical support for making high value added products from coffee bean dregs.
coffee bean dregs;mannan-oligosaccharides;β-mannanase A;β-mannanase B;average degree of polymerization
10.3969/j.issn.1005-6521.2017.21.012
金华市科学技术局农业类重点项目(2016-2-006)
郭跃平(1984—),男(汉),工程师,硕士研究生,研究方向:食品研究及质量安全。
*通信作者:章银军(1978—),男,高级工程师,研究方向:生物催化。
2017-02-28
