miR-148a对食管癌细胞迁移及侵袭的影响及潜在分子机制研究
2017-11-02李张维李涛
李张维,李涛
(西南医科大学 临床医学院,四川 泸州 646000)
临床研究·论著
miR-148a对食管癌细胞迁移及侵袭的影响及潜在分子机制研究
李张维,李涛
(西南医科大学 临床医学院,四川 泸州 646000)
目的探究微小核糖核酸148a(miR-148a)在食管鳞状细胞癌(ESCC)中的表达及对食管癌TE-1细胞迁移和侵袭能力的影响。方法收集48例食管癌患者肿瘤及癌旁组织的RNA标本,逆转录PCR合成互补脱氧核糖核酸(cDNA),实时荧光定量聚合酶链反应PCR检测miR-148a在肿瘤及癌旁组织中的表达情况,分析肿瘤组织中miR-148a表达差异的临床意义。将人工合成的miR-148a模拟物(miR-148a mimics)转染入食管癌细胞TE-1中,划痕愈合实验检测过表达miR-148a对TE-1细胞迁移的影响,Transwell小室模型检测miR-148a对TE-1侵袭的影响。Western blot检测miR-148a过表达对TE-1细胞中原癌基因(c-myc)及基质金属蛋白酶9(MMP-9)蛋白表达的影响。结果MiR-148a在食管癌组织中表达水平下调(P=0.031);过表达miR-148a能够抑制 TE-1 细胞迁移(P=0.021)及侵袭(P=0.018)并下调细胞内 c-myc(P=0.037)及 MMP-9(P=0.026)的表达水平。结论miR-148a在食管癌中低表达,miR-148a可能通过抑制c-myc/MMP-9通路的表达来发挥抑制食管癌细胞迁移及侵袭。
MiR-148a;食管癌;迁移;侵袭;原癌基因(c-myc);基质金属蛋白酶9
食管癌是我国常见的上消化道恶性肿瘤之一[1],对于食管癌发生、发展机制的研究对于提高食管癌患者的诊断及预后评价效果具有重要意义。MicroRNAs是一类长度在25个核苷酸以内的单链、短序列RNA。MicroRNAs不具有编码蛋白质的功能,而是通过结合与靶基因mRNA的3’-端非编码区(three prime untranslated region,3’-UTR)来抑制靶基因表达[2]。研究发现,MicroRNA 148a(miR-148a)的异常表达与卵巢癌[3]、肺癌[4]等多种肿瘤的发生、发展密切相关,因而,miR-148a被认为是一种具有潜在应用价值的肿瘤评估指标。但是miR-148a在食管癌中的表达及生物作用尚不完全清楚。本研究通过检测miR-148a在食管癌及对应癌旁组织中的表达情况及其对细胞迁移侵袭的效应,为食管癌的诊治提供新的分子靶点。
1 材料与方法
1.1 材料
选取2014年3月-2015年4月于四川省肿瘤医院收治的48例食管鳞状细胞癌及对应癌旁组织患者。其中,年龄45~68岁;男性34例,女性14例。所有入组患者均签署研究知情同意书。人食管癌细胞系TE-1(购自中国科学院上海生物化学与细胞生物研究所),细胞液体培养基 DMEM(11965-084)、胎牛血清(16000044)(购自美国 Gibco公司),Trizol试剂(15596026)及LipofectamineTM3000转染试剂(L3000015)、一步法转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)试剂盒(10928042)(购自美国 Invitrogen公司),miR-148a mimics、阴性对照 mimics、miR-148a 实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR) 引物试剂盒及 RNU6B qRT-PCR引物试剂盒(购自广州复能基因有限公司),兔抗人原癌基因(c-myc)(#5605)及基质金属蛋白 酶 9 (matrix metalloproteinases 9,MMP-9)(#13667)多克隆抗体和小鼠抗人β-actin(#3700)单克隆抗体(购自美国Cell Signaling Technology公司),ECL化学发光试剂盒(WBKLS0050)(购自美国密理博公司),8.0μm 孔径 Transwell小室(#3458)(购自美国Corning公司),基质胶(货号:354230)(购自美国BD公司)。
1.2 方法
1.2.1 qRT-PCR 按Trizol试剂说明书提取组织或细胞总RNA,按试剂盒说明书配制逆转录及PCR扩增体系。设置逆转录条件:50℃ 30min,94℃ 2min,循环 1 次;94℃ 15s,60℃ 30s,68℃ 3min,循环次数40;72℃ 10min。以 RNU6B 作为内参,采用 2-△△Ct法计算miR-148a的相对表达量。每个样本独立重复实验3次。
1.2.2 细胞培养及mimics转染 TE-1细胞在含10%胎牛血清的DMEM培养基中培养至稳定传代2、3代。按过夜增殖至愈合度达70%之密度接种6孔细胞培养板。达到预定培养密度后移除培养基,1×PBS溶液充分洗涤细胞。转染分组:miR-148a组每孔加入100 pmol miR-148a mimics及5 μl转染试剂;对照组每孔加入100 pmol的阴性对照mimics及5 μl转染试剂。添加无血清DMEM培养液至终体积1 ml/孔。4 h后更换完全培养基继续培养。
1.2.3 细胞划痕愈合实验 转染24 h后的TE-1细胞接种于6孔板中,接种密度以过夜铺满为准。无血清DMEM培养基饥饿细胞4 h已减弱细胞间连接。100 μl的枪头由每孔中线划过,PBS清洗6孔板内残余悬浮细胞,每孔加入2ml无血清DMEM培养基。培养48 h后在显微镜下观察细胞迁移情况并拍照。
1.2.4 Transwell侵袭小室检测 按1∶8比例采用DMEM培养液稀释基质胶后,每孔100μl包被Transwell小室膜的上室面,取转染72h后的TE-1细胞,使用无血清培养基重悬细胞至5×105个/ml,上层小室每室加入250 μl细胞悬液,下层小室中加入含10%FBS的培养基,置于37℃、5%二氧化碳CO2孵箱中培养12 h。用棉签擦净上室面细胞,4%多聚甲醛固定下室面细胞,Giemsa染液染色。×100光镜下随机选择10个视野计数下室面的细胞个数。以每个小室的平均细胞数为最终计数。
1.2.5 蛋白免疫印迹检测 提取转染72 h后的TE-1细胞总蛋白。SDS-PAGE胶垂直电泳分离蛋白,采用BIO-RAD湿转系统,70 V恒压转膜150 min,5%BSA室温封闭1 h;用3%浓度的脱脂奶粉溶液按1∶1 000比例稀释的c-myc、MMP-9及β-actin抗体。在4℃下孵育相应条带过夜。洗去残余一抗后采用1∶5 000稀释的HRP标记山羊抗兔或抗鼠二抗室温孵育条带1 h。于暗室内,ECL法发光观察蛋白表达。
1.3 统计学方法
数据分析采用SPSS 13.0统计软件,计量资料以均数±标准差(±s)表示,计数资料以率(%)表示,用χ2检验,用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 miR-148a在食管癌组织中的表达
在对48组食管癌癌及癌旁组织中进行PCR定量检测发现,miR-148a在食管癌组织中的相对表达量为(0.475±0.013)。结果表明,其表达水平较癌旁组织(1.136±0.011)降低(t=2.307,P=0.031)。以 48例食管癌组织中miR-148a的平均表达量为界值,将患者分为miR-148a高表达组(≥0.475,n=35)及miR-148a低表达组(<0.475,n=13)。对两组患者的临床病理特征进行分析表明,食管癌组织中miR-148a阳性表达与肿瘤淋巴结转移(χ2=6.553,P=0.019)关系密切。见附表。
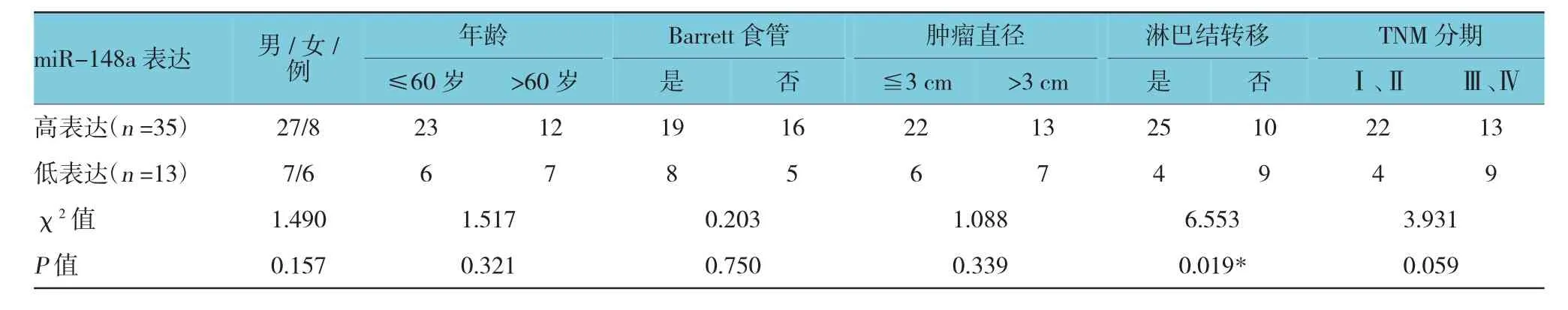
附表 食管癌患者miR-148a与临床特征表达的关系
2.2 过表达miR-148a表达对TE-1迁移及侵袭的影响
为探究miR-148a的生物学功能,笔者首先通过mimics转染在TE-1细胞内成功过表达miR-148a(t=17.291,P=0.003)(见图 1A)。细胞划痕愈合实验结果显示,与转染阴性对照mimics组(33.430±4.356)比较,过表达miR-148a能抑制TE-1细胞迁移(51.283±7.201)(t=6.833,P=0.021)(见图 1B)。Transwell侵袭小室检测结果表明,与阴性对照mimics比较(89.685±9.375),miR-148a对 TE-1细胞的侵袭能力(27.094±6.281)同样具有抑制效果(t=7.124,P=0.018),见图 1C。

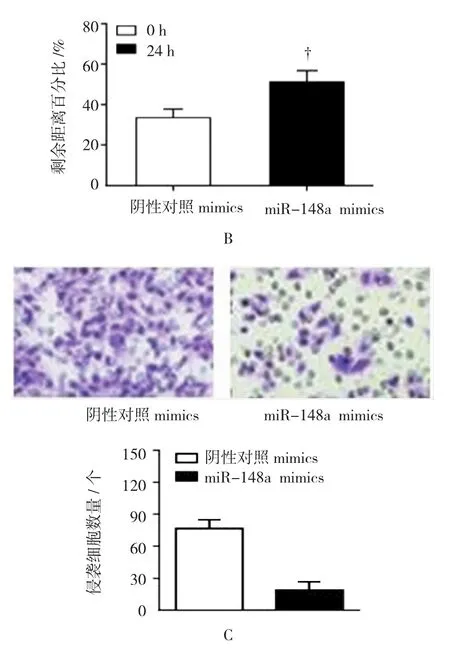
图1 过表达miR-148a抑制TE-1细胞迁移及侵袭
2.3 过表达miR-148a抑制TE-1细胞内c-myc及MMP-9的表达
生物信息学检索表明,癌性转录因子c-myc是miR-148a的下游潜在作用靶点(见图2A)。笔者在TE细胞内过表达miR-148a后,通过蛋白免疫印迹检测发现细胞内c-myc蛋白的表达下调(0.623±0.074 vs 0.466±0.101,t=5.307,P=0.037)(见图 2B)。同时,对细胞迁移和侵袭具有重要促进作用的基质金属蛋白酶MMP-9的表达量也降低(0.760±0.111 vs 0.512±0.109,t=6.113,P=0.026)。
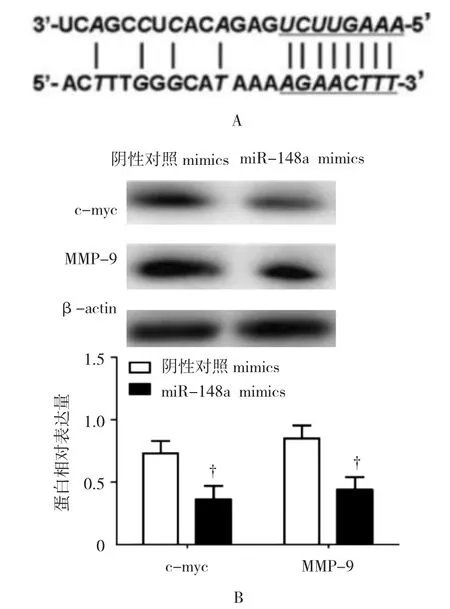
图2 过表达miR-148a抑制TE-1细胞内c-myc及MMP-9表达
3 讨论
目前,在临床上有实际应用价值的食管癌的生物学诊断标志物及治疗靶极少[5]。因而,研究新的食管癌生物治疗靶点靶标具有重要的临床应用价值。miR-148a由位于染色体7p15.2上的基因编码[6]。研究确认,miR-148a在生理和病理生理过程中发挥重要作用。例如,前B淋巴细胞激活后能诱导miR-148的表达,miR-148a进而诱导活化的B淋巴细胞进一步分化成浆细胞,即效应B淋巴细胞[7]。除此之外,miR-148a在骨骼肌细胞分化的过程中同样具有诱导作用[8]。近年来对miR-148a功能的研究多集中于肿瘤学领域。在胃癌组织及多种胃癌细胞系中均检测到miR-148a的表达下调[9]。低表达的miR-148a与患者肿瘤体积增大、肿瘤淋巴结转移、高TNM临床分期[10]及不良预后均密切相关[11]。提示miR-148a在癌组织中的低表达,并具有相当的临床意义。在本研究中,笔者通过对食管癌及癌旁组织检测发现,miR-148a在食管癌组织中的表达明显降低,并且与肿瘤淋巴结转移等与肿瘤侵袭、转移相关的恶性表型关系密切,提示miR-148a可能通过抑制食管癌细胞侵袭而抑制肿瘤发展。
本研究中,笔者通过基因转染技术提高食管癌TE-1细胞中miR-148a的表达,通过细胞划痕愈合试验和Transwell侵袭小室模型发现,过表达miR-148a能够明显抑制TE-1细胞的迁移和侵袭能力。该研究结果与国内外学者在肾癌[12]、乳腺癌[13]及卵巢癌[14]中的研究结论相一致。为探讨miR-148a的作用机制,通过生物信息学检索发现,癌性转录因子c-myc可能是miR-148a的作用靶点之一。通过蛋白免疫印迹检测,证实miR-148a对c-myc表达的负调控作用。并且c-myc转录靶标MMP-9的表达水平也受到明显的抑制。MMP-9是参与分解细胞外机制而促进细胞迁移侵袭的蛋白酶之一[15],其表达改变从分子水平解释了过表达miR-148a后细胞迁移及侵袭能力变化的原因。
综上所述,miR-148a在食管癌中表达下调并与食管癌侵袭转移相关表型关系密切。在体外,miR-148a够通过抑制c-myc/MMP-9的表达来抑制食管癌细胞的迁移侵袭能力,最终抑制食管癌进展。
[1]王志敏,杜云翔,山顺林,等.2009-2011年淮安市食管癌流行病学与治疗现状分析[J].中华肿瘤防治杂志,2013,20(5):334-337.
[2]TU K,ZHENG X,DOU C,et al.MicroRNA-130b promotes cell aggressiveness by inhibiting peroxisome proliferator-activated receptor gamma in human hepatocellular carcinoma[J].Int J Mol Sci,2014,15(11):20486-20499.
[3]ZHAO M,SU Z,ZHANG S,et al.Suppressive role of microRNA-148a in cell proliferation and invasion in ovarian cancer through targeting transforming growth factor-β-induced 2[J].Oncol Res,2016,24(5):353-360.
[4]XU X,ZHANG Y,JASPER J,et al.miR-148a functions to suppressmetastasis and servesas a prognostic indicatorin triple-negative breast cancer[J].Oncotarget,2016,7(15):20381-20394.
[5]SHAIB W L,NAMMOUR J P,GILL H,etal.The future prospects of immune therapy in gastric and esophageal adenocarcinoma[J].J Clin Med,2016,5(11):E100.
[6]CALIN G A,SEVIGNANI C,DUMITRU C D,et al.Human microRNA genes are frequently located at fragile sites and genomic regions involved in cancers[J].Proc Natl Acad Sci USA,2004,101(9):2999-3004.
[7]PORSTNER M,WINKELMANN R,DAUM P,et al.miR-148a promotes plasma cell differentiation and targets the germinal center transcription factors mitf and bach2[J].Eur J Immunol,2015,45(4):1206-1215.
[8]ZHANG J,YING Z Z,TANG Z L,et al.microRNA-148a promotes myogenic differentiation by targeting the ROCK1 gene[J].J Biol Chem,2012,287(25):21093-21101.
[9]YU B,LV X,SU L,et al.miR-148a functions as a tumor suppressor by targeting CCK-BR via inactivating STAT3 and Akt in human gastric cancer[J].PLoS One,2016,11(8):e0158961.
[10]ZHANG W,LI Y.miR-148a downregulates the expression of transforming growth factor-β2 and SMAD2 in gastric cancer[J].Int J Oncol,2016,48(5):1877-1885.
[11]LIU L,YE J X,QIN Y Z,et al.Evaluation of miR-29c,miR-124,miR-135a 段落 rue-148a 14 a in predi lymph node metastasis and tumor stage of gastric cancer[J].Int J Clin Exp Med,2015,8(12):22227-22236.
[12]CAO H,LIU Z,WANG R,et al.miR-148a suppresses human renal cell carcinoma malignancy by targeting AKT2[J].Oncol Rep,2017,37(1):147-154.
[13]XU X,ZHANG Y,JASPER J,et al.miR-148a functions to suppress metastasis and serves as a prognostic indicatorin triple-negative breast cancer[J].Oncotarget,2016,7(15):20381-20394.
[14]WEN Z,ZHAO S,LIU S,et al.microRNA-148a inhibits migration and invasion of ovarian cancer cells via targeting sphingosine-1-phosphate receptor 1[J].Mol Med Rep,2015,12(3):3775-3780.
[15]LI W,LING W,TENG X,et al.Effect of advanced glycation end products,extracellular matrix metalloproteinase inducer and matrix metalloproteinases on type-I collagen metabolism[J].Biomed Rep,2016,4(6):691-693.
Role and potential mechanism of miR-148a in migration and invasion of esophageal carcinoma
Zhang-wei Li,Tao Li
(School of Clinical Medicine,Southwest Medical University,Luzhou,Sichuan 646000,China)
ObjectiveTo investigate the expression of miR-148a in esophageal squamous cell carcinoma(ESCC)and its role in cell migration and invasion.MethodsA total of 48 cases of ESCC and tumor adjacent tissue ribonucleic acid (RNA)samples were collected in our hospital.Complementary deoxyribonucleic acid(cDNA)was synthetized by reverse transcription polymerase chain reaction (RT-PCR).The expression level of miR-148a was detected by real-time PCR.MiR-148a mimics were synthesized and transfected into TE-1 cells.Migration and invasion rates were determined by wound-healing assay and Transwell assay,respectively.The expression levels of c-myc and matrix metalloprotein 9(MMP-9)were measured by Western blot.ResultsmiR-148a was down-regulated in ESCC tissue(P=0.031).Over-expression of miR-148a inhibited migration and invasion rates of TE-1 cells(P=0.021 and 0.018,respectively).Moreover,protein levels of c-myc and MMP-9 were decreased with miR-148a over expression(P=0.037 and 0.026,respectively).ConclusionsmiR-148a inhibits cell migration and invasion of ESCC through inhibition of c-myc/MMP-9 signal pathway.
miR-148a;esophageal cancer;migration;invasion;c-myc;matrix metalloproteinases 9
R735.1
A
10.3969/j.issn.1005-8982.2017.24.006
1005-8982(2017)24-0029-05
2017-02-28
李涛,Tel:13709000298
(王荣兵 编辑)
