内镜黏膜下剥离术治疗消化道早期癌及癌前病变长期疗效的单中心回顾性队列分析*
2017-11-02杜静韩勇吴伟权李鹏杨建民
杜静,韩勇,吴伟权,李鹏,杨建民
[浙江省人民医院(杭州医学院附属人民医院) 1.消化内科;2.临床研究所,浙江 杭州 310014]
内镜黏膜下剥离术治疗消化道早期癌及癌前病变长期疗效的单中心回顾性队列分析*
杜静1,韩勇2,吴伟权1,李鹏1,杨建民1
[浙江省人民医院(杭州医学院附属人民医院) 1.消化内科;2.临床研究所,浙江 杭州 310014]
目的研究内镜黏膜下剥离术(ESD)治疗消化道早癌或癌前病变的长期疗效以及术后复发的影响因素。方法收集73例患者的临床及随访资料。采用Kaplan-Meier法,Log-rank和Breslow检验,以及Cox风险比例模型进行统计学分析。结果胃和结直肠ESD术后中位无复发生存时间(DFS)大于该研究最长随访时间(65个月),食管中位生存时间为44.5个月;与胃和结直肠相比,食管ESD术后DFS明显减少(χ2=12.61,P=0.000;χ2=7.09,P=0.008);病灶异型程度(浸润深度)和病灶面积影响 ESD 术后 DFS(P=0.027,OR^=2.38,95%CI:1.10~5.12;P=0.074,OR^=0.90,95%CI:0.80~1.01)。结论ESD术是切除消化道早期癌和癌前病变并维持长期不复发的有效内镜下手术方法;异型程度(浸润深度)是影响ESD术后DFS的独立危险因素;病灶面积在影响ESD术后的DFS方面具有临床意义。
内镜黏膜下剥离术;早期癌;癌前病变;消化道
早期发现和早期治疗是目前降低消化道恶性肿瘤发病率和死亡率的关键途径。国外研究显示,内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)作为一种消化道早期癌或癌前病变的内镜下治疗方法,其住院时间短、费用低、并发症少、恢复快,可明显降低消化道癌的死亡率,阻断消化道癌前病变的进一步发展[1-4]。虽然ESD在中国已开展多年,但是目前尚缺乏其治疗中国人消化道早期癌或癌前病变长期疗效以及术后复发影响因素的分析。本中心对2011年4月3日-2014年12月22日接受治愈性ESD切除的73例消化道早癌或癌前病变患者进行了5年的跟踪随访,并且基于这些随访数据进行了回顾性队列分析研究,旨在评价ESD治疗中国人消化道早期癌或癌前病变的长期疗效以及术后复发的影响因素。
1 资料与方法
1.1 一般资料
2011年4月3日-2014年12月22日因消化道早癌 或癌前病变在我院内镜中心接受ESD切除共91例(病灶96个)。有随访资料且接受治愈性ESD切除的有73例(病灶77个)消化道早癌及癌前病变患者。73例患者中,男53例,女20例,平均年龄(62.77±11.24)岁。随访时间最长者65个月,最短者11个月,平均(37.32±12.97)个月。ESD手术术式、相关并发症,以及追加手术的可能性均在术前进行充分告知。所有患者均签署 手术知情同意书及获取临床资料知情同意书。
1.2 方法
1.2.1 ESD适应证选择经过普通白光内镜、内镜窄带成像(narrow band imaging,NBI)+放大内镜和超声内镜诊断为食管、胃、结直肠早期癌或癌前病变,且符合ESD术绝对及相对适应证的患者;ESD术前胸部和腹部增强CT评估病灶局部或周围未见肿大淋巴结及远处转移灶。
1.2.2 ESD术中和术后并发症评估①出血:ESD术中或术后血红蛋白下降数值达20 g/L;②穿孔:ESD术中经过钛夹等措施不能夹闭的非主动穿孔;术后经胸片或腹部平片/CT证实的迟发性穿孔;③狭窄:ESD术后随访过程中患者出现进行性吞咽困难,普通白光内镜发现食管、胃、结直肠管腔缩窄处内镜无法或只能勉强通过者;④吸入性肺炎:ESD术后48 h内出现发热、血常规升高,同时胸部CT扫查发现新出现的肺炎。
1.2.3 ESD疗效评估①整块切除:病灶被一次性完整切除,获得单块完整标本;②完整切除:整块切除标本的水平切缘和基底切缘均阴性(即水平切缘距离癌灶≥0.5 mm,垂直切缘距离癌灶≥0.05 mm);③治愈性切除:符合ESD手术适应证,结合临床资料显示无或仅具有低淋巴结转移风险的完整切除;④早期复发:指ESD术后第一次随访出现早癌病灶;⑤晚期复发:指ESD术后至少一次内镜随访阴性后出现早癌病灶。
1.3 随访
1.3.1 随访纳入标准成功接受ESD手术,且术后病理和临床资料符合治愈性切除,且签署获取临床资料同意书的患者均进入随访管理。ESD术中中转外科手术治疗,或术后追加外科手术者均不纳入本次随访分析。科室成立ESD术后患者随访档案,所有纳入随访管理患者均由本内镜中心医务人员提前2周电话通知随访日期。对于无法按期随访者,酌情延后或者提前随访。
1.3.2 随访时间及内容①起止时间:自ESD手术后第1天至随访终点日(2016年12月31日);②随访时间:食管和胃ESD术后第1年每3、6和12个月随访一次,第2年开始每年随访一次。结直肠ESD术后第1年每6和12个月随访一次,第2年开始每年随访一次。连续随访少于2年者不纳入本次随访分析(复发病例除外);③随访内容:随访时所有患者均进行NBI电子染色+放大内镜检查,如发现局部复发,则进一步行超声内镜和相应部位增强CT检查。随访内容主要为ESD术后并发症、病灶局部复发情况和生存时间等。
1.4 统计学方法
采用SPSS 19.0统计软件进行统计学分析。Kaplan-Meier法描绘无复发生存时间(disease free survival,DFS)曲线;Log-rank、Breslow 检验比较不同组之间的DFS差异;Cox比例风险模型探讨影响ESD术后DFS的因素,Log-rank以及Breslow检验结果用χ2值表示。P<0.05差异具有统计学意义。P<0.10具有临床意义。
2 结果
2.1 一般情况
91例(病灶96个)中,整块切除83例,完整切除80例,治愈性切除79例。整块切除率、完整切除率以及治愈性切除率分别为91.2%、87.9%以及86.8%。出现并发症共6例,均出现于ESD术后。其中3例消化道出血经内镜下钛夹止血以及质子泵抑制剂使用后停止;2例吸入性肺炎经连续使用抗生素2周后痊愈;1例食管狭窄经多次内镜下临时性支架置入术后通畅。
2.2 治愈性切除患者情况
79例治愈性切除患者按期完成随访共73例,食管病变共13例,其中上段2个,中段8个,下段3个。胃病变共43例,其中胃窦26个,胃角7个,胃体7个,胃底2个,贲门3个。结直肠病变共17例,其中结肠17个,直肠2个,见表1。随访过程中,发现复发5例,其中食管4例,胃1例。最早复发于食管ESD术后11个月,最晚复发于食管ESD术后50个月,其中4例再次行ESD术,达到治愈性切除标准,继续随访至今无复发,其中1例经电子染色和放大内镜判断浸润至黏膜下深层,转外科手术治疗。
2.3 91例中12例非治愈性切除的原因
2.3.1 ESD术未成功病灶局部抬举征阴性,考虑黏膜下深层浸润3例;病灶位置不佳、范围大导致操作困难,预估术后局部残留1例;ESD术中发现病灶与固有肌层黏连紧密,考虑浸润性癌3例。
2.3.2 ESD术成功术后病理提示切缘阳性3例;术后病理提示病灶累及黏膜下层的层次≥SM2,考虑浸润性癌2例。
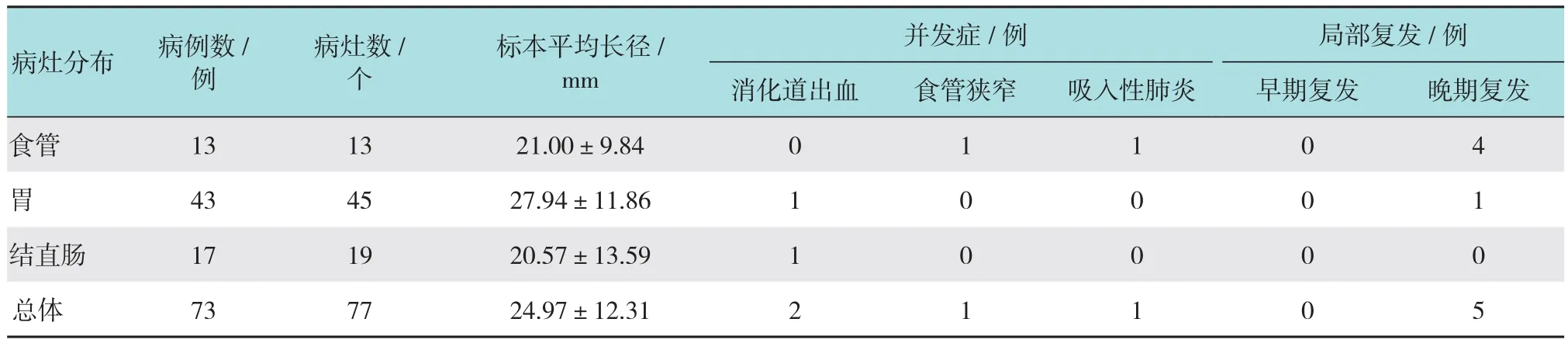
表1 73例治愈性ESD术后随访观察主要数据Table 1 Data of postoperative follow-up curative ESD of 73 cases
2.4 治愈性ESD术后的DFS分析
汇总分析,消化道早癌或癌前病变治愈性ESD术后1、2、3、4和5年总体无复发生存率分别为96.0%、94.0%、94.0%、88.7%、81.3%,见图1。单独分析,结直肠和胃早期癌或癌前病变的治愈性ESD术后中位DFS大于本研究最长随访时间(65个月),且两者比较差异无统计学意义(χ2=0.34,P=0.558),食管早期癌或癌前病变治愈性ESD术后中位DFS为44.5个月,和胃、结直肠相比,明显降低,差异具有统计学意义(食管vs胃,χ2=12.61,P=0.000,食管vs结直肠,χ2=7.09,P=0.008),见图 2。
2.5 病灶异型程度(浸润深度)是否影响治愈性ESD术后的DFS
根据治愈性ESD术后病理报告描述,将组织的异型程度(浸润深度)分为5个等级。第1级:无异型,1例;第2级:低级别上皮内瘤变(病灶局限于上皮层,m1),21例;第3级:高级别上皮内瘤变或原位癌(病灶局限于上皮层,m1),22例;第4级:高级别上皮内瘤变伴癌变(病灶大部分为原位癌,局灶突破基底膜但仅局限于黏膜固有层,m2),15例;第5级:黏膜内癌(病灶累及但未突破黏膜肌层全层,m3),14例。将食管、胃和结直肠汇总分析发现黏膜内癌组、低级别瘤变组以及与高级别瘤变或原位癌组,在ESD术后DFS方面存在明显差异,即异型程度(浸润深度)影响ESD术后的DFS(黏膜内癌组vs高级别瘤变或原位癌组:Bres low检验,χ2=4.82,P=0.042;低级别瘤变组vs高级别瘤变或原位癌组:Log-rank检验,χ2=4.62,P=0.048)。见图 3。
2.6 影响治愈性ESD术后DFS的多因素分析
多因素Cox比例风险模型分析了性别、年龄、病灶面积、病灶部位和异型程度(浸润深度)这5个可能影响ESD术后DFS的因素,结果显示:异型程度(浸润深度)可作为影响ESD术后DFS的独立危险因素(P=0.027,O=2.38,95%CI:1.10~5.12);病灶面积在预测ESD术后DFS具有临床意义(P=0.074,OR^=0.90,95%CI:0.80~1.01)。见表2。
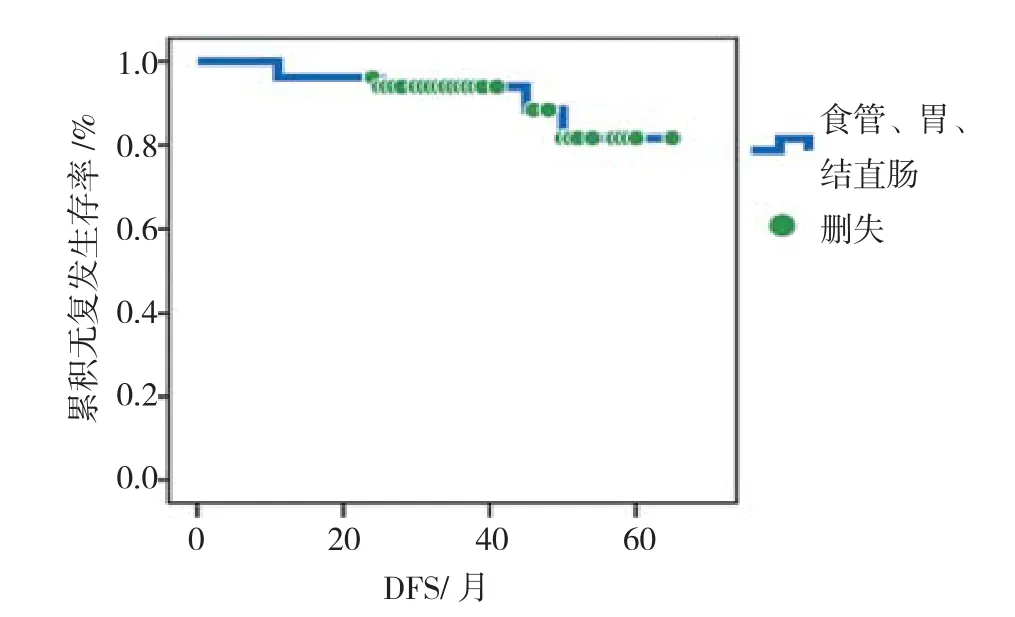
图1 消化道早期癌或癌前病变治愈性ESD术后总体累积无复发生存图Fig.1 The cumulative proportion disease free survival of early gastrointestinal cancer or precancerous lesions after curative ESD
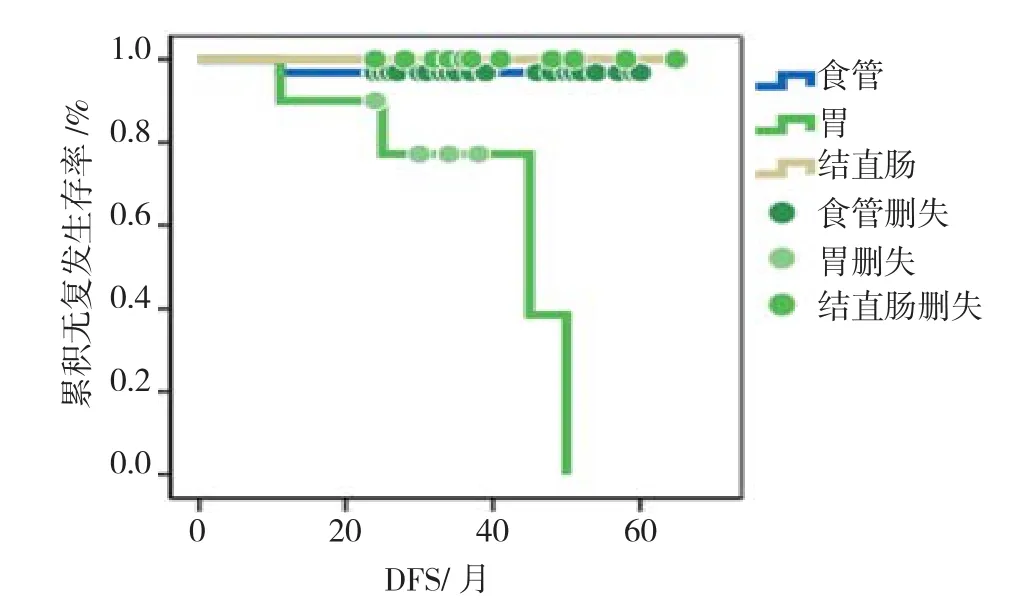
图2 胃、食管、结直肠早期癌或癌前病变治愈性ESD术后累积无复发生存图Fig.2 The cumulative proportion disease free survival among early esophageal/gastric/colo-rectal cancer or precancerous lesions after curative ESD
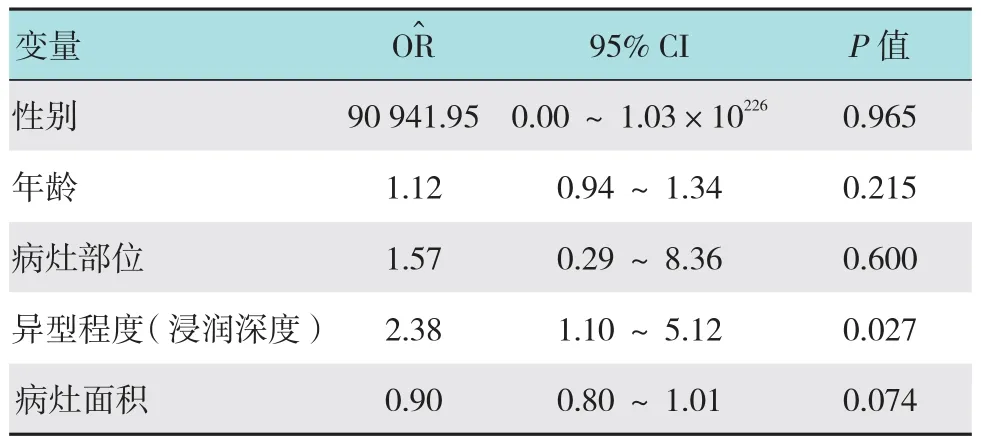
表2 影响ESD术后无复发生存时间的多因素分析Table 2 Multivariate analysis of influencing factors of disease free survival in curative ESD
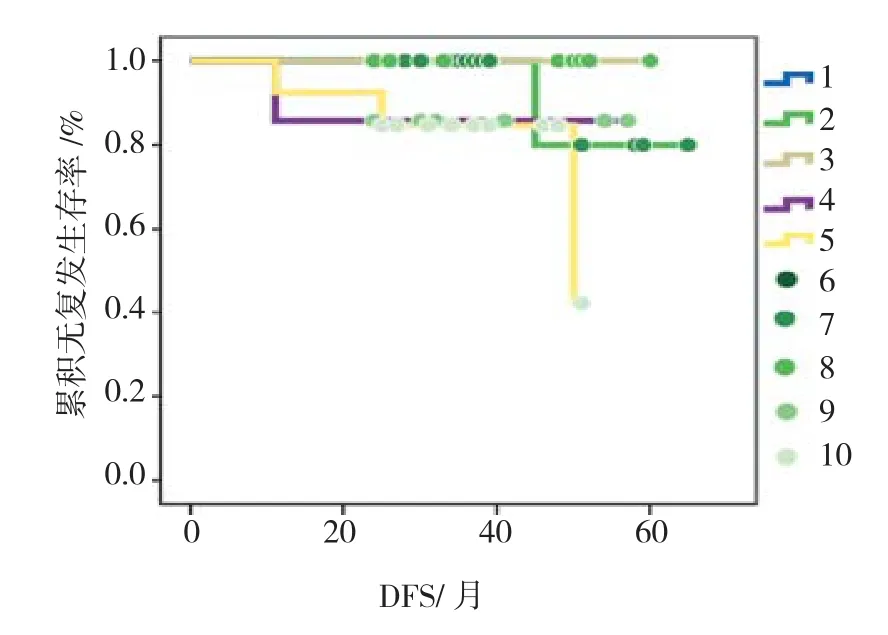
图3 各等级异型程度(浸润深度)病灶治愈性ESD术后累积无复发生存图Fig.3 The cumulative proportion disease free survival among lesions with differential grade of atypia (depth of invasion) after curative ESD
3 讨论
本中心的回顾性队列研究显示:ESD治疗消化道早期癌和癌前病变的完整切除率达87.9%,治愈性切除率达86.8%;并发症发生率6.6%;局部早期复发率为0.0%,局部晚期复发率6.8%;术后无复发生存率高,其中胃和结直肠中位DF S大于本研究最长随访时间(65个月),食管中位生存时间达44.5个月。此结果和TOYONAGA等[5]对1 635例消化道早癌和癌前病变ESD术后的随访分析比较,完整切除率偏低,治愈性切除率相当,并发症发生率偏高,术后3年生存率相当。
随访病例中复发5例,其中食管4例,胃1例,结直肠0例,食管占ESD术后复发病例的80.0%,同时,统计学检验亦显示食管早期癌和癌前病变的ESD术后DFS明显低于胃和结直肠,笔者认为可能与以下几个因素有关:①食管腔空间较胃和结直肠腔小,易受管壁蠕动和壁外心脏搏动的影响,ESD操作难度较高,容易导致病变残留;②食管癌常为多中心起源,并且存在跳跃性生长以及壁内浸润的生长特性,容易导致异时性癌、癌灶残留或复发[6]。结合本研究结果显示病灶的异型程度(浸润深度)是 评估ESD术后DFS的独立危险因素,笔者认为对于食管病变,若能在未出现间质浸润的时机时(即低级别或高级别瘤变、原位癌)即对其实施有效的治愈性ESD术,则能更好地降低食管早期癌的ESD术后复发率,提高患者生存质量。这就要求进一步提升食管的放大内镜精查水平,通过准确的毛细血管袢(intraepithelial papillary capillary loop,IPCL)分型判断,提高食管低级别或高级别瘤变以及原位癌的检出率。
有研究表明[7-8],肿瘤病灶的大小、组织学类型、浸润深度和有无溃疡是决定病灶是否存在淋巴结转移的主要因素,具有淋巴结转移的早癌病灶为ESD术禁忌证。而本研究对这一结论进行了补充,即病灶面积和浸润深度(异型程度)不仅能用于判断ESD术适应证,还能影响ESD术后的DFS。笔者主张在ESD术前,必须常规使用放大内镜、超声内镜和CT检查对早癌病灶的大小、边界、浸润深度以及区域淋巴结进行细致地观察和判断,同时结合术后病理报告,以便安排个体化的ESD术后随访策略。目前指南建议[9-11],胃和食管的随访策略为术后第1年每3、6和12个月随访1次,如无复发,第2年开始每年随访1次;结直肠的随访策略为术后第1年每6个月随访1次,如无复发,第2年开始每年随访1次。通过本研究发现,异型程度(浸润深度)是影响ESD术后复发率的独立危险因素。因此,笔者推荐对于ESD术前或术后判断为黏膜内癌或黏膜下 浅层癌的患者,应增加ESD术后的随访次数,尤其应增加术后第2年的随访频次,以便尽早检出复发病灶,并及时予以二次ESD术,以提高患者后续生活质量,维护完好的器官功能。
本研究尚存在一定局限性,包括:①ESD病例样本含量较少,并非ESD术后远期疗效评价的大数据分析结果;②囊括的ESD病例源自单中心,并且ESD操作并非由同一人完成,可能造成统计结果偏倚;③本研究所囊括的治愈性ESD术病例的浸润深度最深者为黏膜内癌,所以缺乏对黏膜下浅层癌患者的相关疗效指标分析。
本中心将进一步完善消化道内镜精查水平,提高消化道早期癌和癌前病变的检出率,扩大随访观察样本含量,以期为评价ESD术治疗消化道早期癌和癌前病变的长期疗效,以及个体化定制随访策略提供更详实的大数据。
[1]ASGE TECHNOLOGY COMMITTEE, KANTSEVOY S V,ADLER D G, et al. Endoscopic mucosal resection and endoscopic submucosal dissection[J]. Gastrointest Endosc, 2008, 68(1):11-18.
[2]CHO K B, JEON W J, KIM J J. Worldwide experiences of endoscopic submucosal dissection: Not just Eastern acrobatics[J].World J Gastroenterol, 2011, 17(21): 2611-2617.
[3]KAKUSHIMA N, FUJUSHIRO M. Endoscopic submucosal dissection for gastrointestinal neoplasms[J]. World J Gastroenterol,2008, 14(19): 2962-2967
[4]沈陈波, 杨建民, 徐启顺, 等. 内镜黏膜下剥离术和外科手术治疗消化道早癌及癌前病变的比较研究[J]. 中国内镜杂志, 2015,21(6): 571-574.
[4]SHEN C B, YANG J M, XU Q S, et al. A comparative study of endoscopic submucosal dissectionand traditional surgery for early gastrointestinal cancer and precancerous lesions[J]. China Journal of Endoscopy, 2015, 21(6): 571-574. Chinese
[5]TOYONAGA T, MAN-I M, EAST J E, et al. 1,635 Endoscopic submucosal dissection cases in the esophagus, stomach, and colorectum: complication rates and long-term outcomes[J]. Surg Endosc, 2013, 27(3): 1000-1008.
[6]马国伟, 戎铁华, 吴秋良, 等. 食管癌手术适宜切除长度的研究[J]. 中华肿瘤杂志, 2003, 25(5): 472-474.
[6]MA G W, RONG T H, WU Q L, et al. Gaint pathologic section in the study of optimal length of surgical resection for esophageal carcinoma[J]. Chin J Oncol, 2003, 25(5): 472-474. Chinese
[7]KWEE R M, KWEE T C. Predicting lymph node status in early gastric cancer[J]. Gastric Cancer, 2008, 11(3): 134-148.
[8]KIM Y I, KIM H S, KOOK M C, et al. Discrepancy between clinical and fi nal pathological evaluation fi ndings in early gastric cancer patients treated with endoscopic submucosal dissection[J]. J Gastric Cancer, 2016, 16(1): 34-42.
[9]中华医学会消化内镜学分会, 中国抗癌协会肿瘤内镜专业委员会. 中国早期胃癌筛查及内镜诊治共识意见(2014,长沙)[J]. 胃肠病学, 2014, 19(7): 408-427.
[9]Digestive Endoscopy Committee of Chinese Medical Association,Cancer Endoscope Specialized Committee of Chinese Anticancer Association. Consensus on the screening and endoscopic diagnosis and treatment of early gastric cancer in China (2014, Changsha)[J].Chin J Gastroenterol, 2014, 19(7): 408-427. Chinese
[10]中华医学会消化内镜学分会, 中国抗癌协会肿瘤内镜专业委员会. 中国早期结直肠癌筛查及内镜诊治指南(2014,北京)[J].胃肠病学, 2015, 20(6): 345-365.
[10]Digestive Endoscopy Committee of Chinese Medical Association,Cancer Endoscope Specialized Committee of Chinese Anticancer Association. Guideline for early colorectal cancer screening and endoscopic diagnosis and treatment in China (2014, Beijing)[J].Chin J Gastroenterol, 2015, 20(6): 345-365. Chinese
[11]中华医学会消化内镜学分会,中国抗癌协会肿瘤内镜专业委员会. 中国早期食管癌筛查及内镜诊治专家共识意见(2014,北京)[J]. 胃肠病学, 2015, 20(4): 220-240.
[11]Digestive Endoscopy Committee of Chinese Medical Association,Cancer Endoscope Specialized Committee of Chinese Anticancer Association. Expert consensus on screening and endoscopic diagnosis and treatment of early esophageal cancer in China(2014, Beijing)[J]. Chin J Gastroenterol, 2015, 20(4): 220-240.Chinese
A retrospective cohort study of the long-term effects of endoscopic submucosal dissection in treating early gastrointestinal cancer or precancerous lesions*
Jing Du1, Yong Han2, Wei-quan Wu1, Peng Li1, Jian-min Yang1
[1.Department of Gastroenterology; 2.Clinical Research Institute, Zhejiang Provincial People’s Hospital(People’s Hospital of Hangzhou Medical College), Hangzhou, Zhejiang 310014, China]
ObjectiveA retrospective cohort study was carried out to observe the long-term effect of ESD in treating early gastrointestinal cancer or precancerous lesions.MethodsThe clinical and follow-up data of 73 patients were collected. Kaplan-Meier, Log-rank and Breslow test and Cox’s proportional hazards regression model were used to analyze the data.ResultsThe median survival time in the gastric and colo-rectal early cancer or precancerous lesions is longer than 65 months in our study, respectively. For esophagus, the median survival time was 44.5 months; the disease free survival time (DFS) after ESD was signi fi cantly reduced in the esophagus, compared to the stomach and colo-rectum (χ2= 12.61,P= 0.000; χ2= 7.09,P= 0.008); the degree of atypia (or in fi ltration),and lesion size were considered to be two factors to influence the DFS after ESD (P= 0.027, O=2.38, 95%CI:1.10 ~ 5.12,P= 0.074, 95%CI; OR^=0.90, 95%CI: 0.80 ~ 1.01).ConclusionESD is an effective curative treatment in the resection of early upper gastrointestinal cancer and precancerous lesions. The degree of atypia (or in fi ltration)was concluded as an independent risk factor for the DFS post-ESD, and the size of lesion was a valuable parameterwith regard to the recurrence after ESD procedure.
endoscopic submucosal dissection; early cancer; precancerous lesion; gastrointestinal
R735
A
10.3969/j.issn.1007-1989.2017.08.003
1007-1989(2017)08-0013-05
2017-06-07
浙江省科技厅面上社会发展项目(No:2009C33082);浙江省自然科学基金(No:LQ17H160016);浙江省医药卫生科技计划(No:2015KYA029)
杨建民,E-mail:jianminyanghz@163.com;Tel:0571-85893430
(吴静 编辑)
