后腹腔镜肾部分切除术个体化方案治疗微小肾癌的疗效分析
2017-11-02邵四海汤建儿沈悦凡向安平王伟高王荣江
邵四海 汤建儿 沈悦凡 向安平 王伟高 王荣江
后腹腔镜肾部分切除术个体化方案治疗微小肾癌的疗效分析
邵四海 汤建儿 沈悦凡 向安平 王伟高 王荣江
目的 探讨后腹腔镜肾部分切除术(RLPN)个体化方案治疗微小肾癌的疗效。 方法 回顾性分析11例实施RLPN个体化方案治疗的微小肾癌患者,其中4例内生性微小肾癌患者采用腔内超声术中精确探查定位,肾动脉阻断下实施肾部分切除的方案(A组);7例外突性生长的微小肾癌患者采用术中游离肾动脉,套橡皮条备用,试行不阻断肾动脉零缺血的状态下实施肾部分切除的方案(B组)。从术中出血量、手术时间、术中热缺血时间以及术后随访结果等方面分析疗效。 结果 A组患者均手术顺利,术中出血量 35~250(85.2±44.5)ml,手术时间 110~235(174.6±38.6)min,术中热缺血时间 25~40(28.3±6.2)min。B 组患者中有 6 例未阻断肾动脉,1例出血明显;在切除肿瘤过程中,再阻断肾动脉15min,完成肾部分切除,出血量160~380(220.3±40.1)ml,手术时间85~215(142.7±32.5)min。对11例患者术后随访6~48个月,均无复发、转移。 结论 RLPN个体化方案治疗微小肾癌安全、有效。
腹腔镜 肾部分切除术 微小肾癌
随着影像学检查技术的不断发展以及体检普及,微小肾癌检出率明显增高。对于T1a期肾癌,保留肾单位的肾部分切除术是标准的手术方式,可减少或避免热缺血时间、保证肿瘤完整切除,更好地保护肾功能。因此,笔者收集11例行后腹腔镜肾部分切除术(RLPN)个体化方案的微小肾癌患者的临床资料,分析其治疗效果。
1 资料和方法
1.1 一般资料 回顾性分析2012年6月至2016年6月在本院诊断为微小肾癌(直径≤2cm)且实施RLPN个体化方案治疗的11例患者临床资料。其中男6例,女5例;年龄 28~65(50.4±8.1)岁;肿瘤位于左肾 4 例,右肾 7例。其中4例接受腔内超声术中精确探查定位,肾动脉阻断下实施肾部分切除术(A组),肿瘤直径0.8~1.6cm;7例接受试行不阻断肾动脉零缺血的状态下实施肾部分切除术(B组),肿瘤直径 0.9~1.5cm。入组标准:(1)术前均经泌尿系B超、平扫及增强CT或MRI、肾动脉CT血管成像或MRA检查明确诊断,且经胸部X线、腹部B超等检查排除转移;(2)临床分期 T1aN0M0;(3)术后病理报告为肾细胞癌。排除多发肾癌、遗传性肾癌、孤立性肾癌、合并其他重大疾病以及临床资料不全者。
1.2 方法
1.2.1 手术步骤 11例微小肾癌患者均采取后腹腔镜下操作。全身麻醉,健侧卧位,腰部垫高。气囊法扩张腹膜后间隙建立腹膜后腔。第12肋下、腋前线肋缘下、腋中线髂嵴上分别置入套管,置入30°腹腔镜、超声刀及分离钳。充CO2至压力为14mmHg。清除腹膜外脂肪,沿腰大肌表面肾脂肪囊外游离出肾动脉,切开Gerota筋膜。沿肾脂肪囊与肾被膜之间的疏松间隙分离,通过仔细阅读泌尿系CT或MRI片,充分显露肿瘤和周围的肾实质或者肿瘤最可能的区域,切除肿瘤表面及周围的肾脂肪囊然后根据不同情况实施个体化方案。(1)A组:4例患者肿瘤较小,内生性,肾表面仅见正常肾组织;通过仔细阅读泌尿系CT或MRI片,粗略估计肾肿瘤在肾脏表面的投影位置,再将腔内超声探头(BK Pro Focous 2202超声成像系统,丹麦BK公司)置于投影位置表面以明确肿瘤位置;调整探头弯曲度对病变进行扫查,判断肿瘤位置、形态、大小、边界、周围有无微小卫星转移灶及血供等。用电凝钩在肾表面勾勒标志线,形成肾肿瘤边界在肾表面的投影环,见图1a;然后动脉夹阻断、沿标志线切除肿瘤,见图1b,切除深度依据术中肉眼对切除界面的观察结合术前影像学估计为主,必要时再超声实时探查监测,明确切割界面;取1根2-0倒刺线(美国Angiotech公司),如创面破坏集合系统,先用倒刺线进行内层缝合,见图1c;在缝线尾处留置1个Hem-o-lok,第一针从肿瘤床的顶端开始,自肾包膜外进针,穿过肾包膜和肿瘤床,于肿瘤床基底连续缝合肾髓质,关闭肾集合系统,最后于肾缺损底部穿出肾包膜,线尾留置1个Hem-o-lok加强固定;外层缝合同样采用倒刺缝线连续缝合方法,连续穿过两侧肾包膜及肾皮质全层,收紧,最后一针穿出肾包膜后,线尾留置1个Hem-o-lok固定,见图1d;松开阻断,记录阻断时间,观察有无渗血情况,必要时再倒刺线加固缝合;取出标本,放置引流管,关闭穿刺切口。(2)B组:7例患者肿瘤较小,外向生长,肾表面可以看见肾肿瘤轮廓或可见局部隆起,术中游离肾动脉套橡皮条备用,见图1e;试行不阻断肾动脉,零缺血的状态下实施RLPN,距肿瘤边缘0.5cm处用剪刀从正常肾实质开始切割,一边吸引器吸引创面,一边剪刀切割,将肿瘤表层正常肾实质与肿瘤一起切除,见图1f;若术中出血较多、明显影响视野,则牵拉橡皮条,迅速寻及肾动脉并阻断,再继续切除肿瘤。其余步骤同A组。1.2.2 术后随访 首次随访在术后1个月进行,之后每3个月随访1次;3年后每年随访1次。随访内容包括生化(肾功能)、腹部B超或CT、胸部X线片或CT等检查项目。
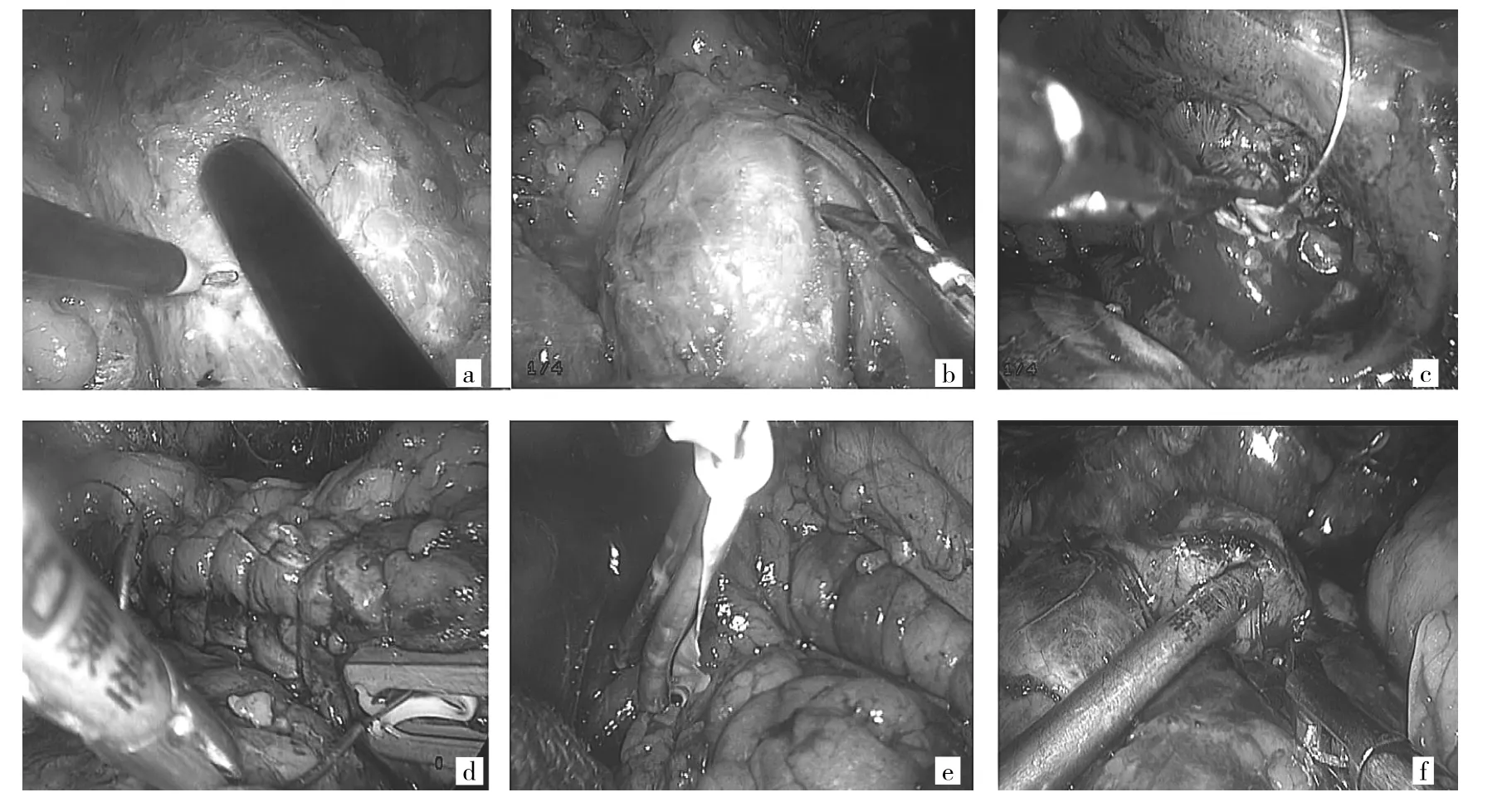
图1 两组患者RLPN个体化方案的手术步骤(a:A组,在腔内超声监测下标记肿瘤范围;b:A组,沿标志线切除肿瘤;c:A组,内层缝合切穿的肾集合系统;d:A组,用倒刺缝线连续外层缝合;e:B组,术中游离肾动脉套橡皮条备用;f:B组,一边用吸引器吸引创面,一边用剪刀将肿瘤表层正常肾实质与肿瘤一起切除)
2 结果
A组4例内生性微小肾癌患者均手术顺利,术中出血量 35~250(85.2±44.5)ml,手术时间 110~235(174.6±38.6)min,术中热缺血时间 25~40(28.3±6.2)min。B 组 7例外突性生长的微小肾癌患者,6例未阻断肾动脉,1例出血明显;在切除肿瘤过程中,再阻断肾动脉15min,完成肾部分切除,出血量 160~380(220.3±40.1)ml,手术时间 85~215(142.7±32.5)min。11 例微小肾癌患者中,术后病理报告为肾透明细胞癌9例,乳头状肾细胞癌1例,嫌色细胞癌1例;术后随访6~48个月,术后肾功能正常,均无复发、转移。
3 讨论
T1a期肾癌是指肿瘤直径≤4cm的肾癌,其中肿瘤直径≤1.5cm的肾癌预后良好,也为微小肾癌;也有学者建议将直径≤2cm的偶发性肾癌称为微小肾癌。随着医学影像学技术的发展,肾脏小肿块、低级别局限性肿瘤越来越多被发现,因此肾癌治疗方案也随之发生改变。肾部分切除术是目前治疗局限性肾癌的金标准,与根治性肾切除术疗效相当[1];其最大优势在于最大限度地保留功能肾单位。随着腹腔镜技术及器械的进步,腹腔镜下保留肾单位肾部分切除术(LNSS)已成为T1a期肾癌的首选治疗方案[1-4]。传统的肾部分切除术需要解剖肾门和阻断肾动、静脉,尤其在一些肿瘤位置比较深或向心性生长的肿瘤切除术中,出血会影响手术视野、肿瘤边界的判断和肾脏重建。本院对肿瘤直径>1.5cm的微小肾癌(A组)仍然采用传统的阻断肾动脉的方法,以保证良好的视野。内生型肿瘤外凸率小,难以判断肿瘤范围,术中完整切除和重建肾脏具有较高的挑战性。完整切除肿瘤需要损伤更多的正常肾组织,术中预计出血更多,因此多选择肾蒂或单纯肾动脉阻断方式[5]。近期研究认为经验丰富的手术医师为内生性或肾门旁肿瘤患者行LNSS是安全、可行的[6]。腔内B超可以较精确地定位肿瘤位置、深度以及与肾脏的解剖关系,通过辨认血流信号,判断是否存在分支血管,以降低术中动脉出血风险,可能发现术前常规影像学检查未发现的肿瘤周围卫星灶。对于极少数术中定位困难的病例,可选择超声造影协助定位[5]。A组患者均通过腔内B超快速找到肿瘤、精准定位并实施切除。笔者体会如下:(1)术前影像学检查与术中超声监测的联合十分重要,术前应仔细阅片影像学资料,估计肾肿瘤在肾脏表面的投影位置、肾动脉支数以及供应肿瘤的动脉;(2)将超声探头置于投影位置表面,请超声科医生协助精准定位,务必做好表面标记;(3)切除深度主要依据术中肉眼对切除界面的观察以及术前影像学估计,必要时再行超声实时探查监测,以完整切除肿瘤且最大限度保留肾单位。由于肿瘤位置深,本组有3例患者切穿集合系统,故先用倒刺线进行内层缝合、关闭集合系统,以防漏尿;术后均无尿漏、出血,切缘均为阴性,可能与患者肿瘤较小有关。
在寻求最佳外科治疗手段的过程中,阻断肾动脉所致的肾缺血对肾部分切除术后肾功能的影响一直存在争议[1]。Lane等[7]对660例接受开放肾部分切除术的孤立肾患者进行随访调查,发现在冷缺血或热缺血时间<20min时,不可变因素(术前肾功能和保留肾实质的百分率)是决定术后肾功能的最主要因素,缺血是导致肾部分切除术后患者肾功能不全的最主要可变因素。曹靖等[8]根据热缺血时间将76例RLPN患者分为<20min、20~30min和>30min组,术中所有患者行单独肾动脉阻断;发现热缺血时间是术后早期肾功能损害的独立危险因子,热缺血时间>30min对术后肾功能损害程度较大,且早期总肾功能恢复缓慢。Smith等[9]报道308例接受开放肾部分切除术的患者,非阻断肾部分切除术组术后1年eGFR减少率更低。Wszolek等[10]发现与冷缺血肾部分切除术比较,阻断肾部分切除术后漏尿率更高。Thompson等[11]研究结果亦表明术中阻断肾动脉的患者术后出血率、漏尿率较高,但差异无统计学意义。可见在保证肿瘤完整切除的基础上,减少热缺血时间、避免术中及术后出血、减少漏尿的发生是LNSS的关键技术。目前主要有低温保护技术、肾蒂血管阻断技术。Shao等[12-13]采用腹腔镜下肾段动脉阻断来减少“缺血再灌注”损伤。与肾动脉主干阻断比较,肾段动脉阻断组的热缺血时间、术中出血量均稍增加,但在术后肾功能恢复方面优势明显。Simone等[14]对肿瘤直径>4.0cm、侵入深度>1.5cm的肾实质内肿瘤及肾门肿瘤,术前通过动脉微导管对3~4级肾动脉分支进行超选择性栓塞,术中不阻断肾动脉,应用切割止血工具进行LNSS手术;这能有效避免热缺血对肾功能的影响,突破缺血时间对手术操作的限制性,并发症发生率较低,疗效满意。Gill等[15]首次报道了肾动脉高级分支阻断的LNSS,术中精细解剖肾动脉至3~4级分支,实施肿瘤供应血管阻断,实现了零缺血LNSS。此外,田晓军等[16]对直径较小、位置浅表的肿瘤尝试实施后腹腔镜创面不缝合的肾部分切除术,以最大限度地缩短热缺血时间、保护肾功能;术中使用双极电凝止血效果良好,肾动脉阻断时间短,术后无出血、漏尿等并发症发生。LNSS若能实现不阻断肾动脉是最理想的。有学者尝试采用各种方法在不阻断肾动脉的情况下切除肿瘤组织以达到理想的“零缺血”[17-18];也有学者采用双向倒刺缝合线贯穿缝合肾脏,实现了在不阻断肾动脉的前提下的肾部分切除,效果与传统手术相当且不增加手术难度[19]。由于肾实质浅表部位无大血管,对于外向生长的浅表肿瘤,笔者采用后腹腔镜不阻断肾动脉的方法实现了肾部分切除术,并做到完全零缺血,避免了对肾脏“缺血再灌注”损伤;但术中出血量明显增加,用吸引器持续吸引创面,以加快气腹气体的流入速度。其中1例因出血影响手术视野、肿瘤边界的判断而及时使用血管阻断钳阻断肾动脉再继续手术,以保证手术安全及肿瘤切除的完整性。由于尚不能完全估计术中出血情况,因此笔者仍然常规游离肾动脉,血管夹备用。尽管出血有所增加,但笔者认为可以减少肾功能损伤,利大于弊。由于肿瘤小、位置浅,该组患者均未切至集合系统,无需内层缝合,减少了操作和出血。
综上所述,内生性微小肾癌采用腔内超声术中精确探查定位的方案可帮助快速定位、精准切除,最大限度保留肾单位;对于外生性微小肾癌,可以试行在后腹腔镜不阻断肾动脉零缺血的状态下实施肾部分切除,避免“缺血再灌注”损伤,能最大限度地保护肾功能,但术中出血量明显增加,需慎重选择。RLPN个体化方案治疗微小肾癌安全、有效,但尚需增加例数和长期随访观察,以明确远期疗效。
[1] 吴旭红,郭宏骞.解剖性零缺血肾部分切除术及术后肾功能[J].东南大学学报(医学版),2014,33(4):527-530.
[2] Zhao P T,Richstone L,Kavoussi L R.Laparoscopic partial nephretomy[J].Int J Surg,2016,36(16):300589.doi:10.1016/j.ijsu.2016.04.028.
[3] Hadjipavlou M,Khan F,Fowler S,et al.partialvs radicalnephrec-tomy for T1renaltumors:an analysis from the British Association of Urological Surgeons Nephrectomy Audit[J].BJU Int,2016,117:62-71.doi:10.111/BJU.13114.
[4] 陈勇辉,吴小荣,陈伟,等.后腹腔镜下肾部分切除术在完全内生性肾肿瘤治疗中的应用[J].中华泌尿外科杂志,2016,37(10):726-729.
[5] 刘茁,孟一森,范宇,等.后腹腔镜下肾部分切除术治疗内生型肾肿瘤的临床分析[J].中华泌尿外科杂志,2015,36(10):726-731.
[6] Di Pierro G B,Tartaglia N,Aresu L,et al.Laparoscopic partial nephrectomy and outcomes[J].Eur j Surg Oncol,2014,40:769-774.
[7] Lane B R,Russo P,Uzzo R G,et al.Comparison of cold and warm ischemia during partial nephrectomy in 660 solitary kidneys reveals predominant role of non-modifiable factors in determining ultimate renalfunction[J].J Urol,2011,185:421-427.
[8] 曹靖,陈文军,文甲明,等.热缺血时间对腹腔镜下肾部分切除术后早期肾功能的影响分析[J].中华泌尿外科杂志,2015,36(6):414-418.
[9] Smith G L,Kenney P A,Lee Y,et al.Non-clamped partial nephrectomy:techniques and surgical outcomes[J].BJU Int,2011,107:1054-1058.
[10] Wszolek M F,Kenney P A,Lee Y,et al.Comparison of hilar clamping and non-hilar clamping partial nephrectomy for tumors involving a solitary kidney[J].BJU Int,2011,107:1886-1892.
[11]Thompson R H,Lane B R,Lohse C M,et al.Comparison of warm ischemia versus no ischemia during partial nephrectomy on a solitary kidney[J].Eur Urol,2010,58:331-336.
[12] Shao P,QIN C,YIN C,et al.Laparoscopic partial nephrectomy with segmental renal artery clamping:technique and clinical outcomes[J].Eur Urol,2011,59:849-855.
[13] Shao P F,Tang LJ,LiP,et al.Application of a vasculature model and standardization of the renal hilar approach in laparoscopic partial nephrectomy for precise segmental artery clamping[J].European Urology,2013,63(6):1072-1081.
[14] Simnone G,Papalia R,Guaglianune S,et al.Zero ischemia laparoscopic partialnephrectomy after superselective transarterialtumor embolization for tumors with moderate nephrometry score:long-term results of a single center experience[J].J Endourol,2011,25:1443-1446.
[15] Gill I S,Eisenberg M S,Aron M,et al."Zero ischemia"partial nephrectomy:novel laparoscopic and robotic technique[J].Eur Urol,2011,59:128-134.
[16] 田晓军,马潞林,庄申榕,等.后腹腔镜下创面不缝合肾部分切除术的疗效观察[J].中华医学杂志,2014,35(11):807-810.
[17] 魏辉,黄英,翁潭潭,等.采用2μm激光不阻断肾动脉行腹腔镜肾部分切除术[J].中国微创外科杂志,2013,13(8):749-750.
[18] 马文松,江文生,毕学成.腹腔镜下不阻断肾动脉的肾部分切除术20例[J].中国现代医生,2014,52(6):132-133.
[19] 刘清学,高飞,彭洪,等.双向倒刺缝合线在不阻断肾动脉的后腹腔镜肾部分切除术中的应用[J].四川医学,2015,36(10):1407-1410.
2017-02-08)
(本文编辑:陈丹)
10.12056/j.issn.1006-2785.2017.39.18.2017-226
313000 湖州市第一人民医院(湖州师范学院附属第一医院)泌尿外科
邵四海,E-mail:kpling21@sina.com
