地诺单抗与唑来膦酸治疗恶性肿瘤伴骨转移安全性和有效性的Meta分析
2017-11-02陈皖京王蓓高秀飞徐小宏张硕胡袁媛
陈皖京 王蓓 高秀飞 徐小宏 张硕 胡袁媛
地诺单抗与唑来膦酸治疗恶性肿瘤伴骨转移安全性和有效性的Meta分析
陈皖京 王蓓 高秀飞 徐小宏 张硕 胡袁媛
目的 系统评价地诺单抗与唑来膦酸治疗恶性肿瘤伴骨转移的有效性和安全性。方法 利用Cochrane library、Pub Med、OVID、Springer Linker、Science Direct、EBSCO等数据库检索文献,按Cochrane风险偏倚评估工具评价纳入文献质量并提取文献数据,应用Rev Man 5.3软件进行Meta分析。结果 纳入4项临床随机对照试验,共6 029例患者,包含7篇相关文献。Meta分析结果显示,与唑来膦酸比较,地诺单抗能明显延缓骨相关事件(SREs)发生的时间,降低骨转移标志物Ⅰ型胶原交联氨基末端肽/肌酐(uNTx/Cr)、骨源性碱性磷酸酶(S-BALP)浓度,预防骨放疗,延缓疼痛加剧和干预,同时治疗后贫血、急性期反应和肾毒性的发生率更低,差异均有统计学意义(均P<0.01);两组患者总生存(OS)时间、疾病进展时间、预防病理性骨折、预防骨手术、预防脊髓压迫、不良事件(AEs,包括恶心、疲劳、背痛、下颌骨坏死等)的发生率等指标比较,差异均无统计学意义(均PP>0.05)。结论 地诺单抗在临床有效性和安全性方面优于唑来膦酸,为恶性实体瘤伴骨转移患者的临床预防与治疗提供了新的方案。
地诺单抗 唑来膦酸 骨相关事件 骨转移 恶性肿瘤
骨是恶性实体肿瘤(尤其是乳腺癌、前列腺癌和肺癌等)常见的转移部位,恶性实体瘤伴骨转移常引起严重的骨相关事件(SREs),包括病理性骨折、脊髓压迫综合征、为缓解骨痛的放疗、为预防或治疗病理性骨折或脊髓压迫综合征的骨手术等[1]。SREs的出现预示着患者住院风险增加,住院时间延长,生存质量下降等[2-6]。目前主要采取全身综合治疗恶性实体瘤伴骨转移,包括化疗、放疗、内分泌治疗、生物靶向治疗、双磷酸盐治疗、手术和康复等。唑来膦酸是第三代双磷酸盐药物,目前广泛应用于临床,可有效预防和延迟SREs的发生[7],但仍有部分患者在用药后发生SREs[8-9]。此外,唑来膦酸具有肾毒性,临床上禁用于严重肾功能不全(内生肌酐清除率<30ml/min)的患者。地诺单抗是一种靶向人源性RANKL的单克隆抗体。RANKL是破骨细胞的关键激活因子,地诺单抗与RANKL特异性结合并阻断RANKL介导的破骨细胞活化,从而阻断恶性实体瘤伴骨转移机制中破骨细胞激活环节。地诺单抗依靠非特异性内皮网状系统而非肾脏代谢,因此可用于肾功能不全患者或可能造成肾损伤的治疗方案。现有多篇文献表明地诺单抗能有效延迟SREs的发生并提高晚期肿瘤患者的生活质量[1,10-15]。在精准医学的大背景下,生存质量较生存时间更为重要;因此,有效改善晚期肿瘤患者的生存质量、减轻骨转移患者疼痛以及对止痛药物的依赖,是当前医疗研究的热点。本研究搜索相关文献,就地诺单抗与唑来膦酸治疗恶性实体瘤伴骨转移的有效性和安全性作一Meta分析。
1 对象和方法
1.1 对象 利用Cochranelibrary、PubMed、OVID、Springer Linker、Science Direct、EBSCO等数据库检索文献。检索词:cancers or tumour or tumours or neoplasms or neoplasm、bone metastasis or bone metastases、skeletal-related events、SREs、zoledronic acid、denosumab。纳入标准:(1)年龄≥18岁;(2)组织学或细胞学证实为恶性实体瘤或多发性骨髓瘤,X线、CT或MRI等影像学检查提示存在至少1处骨转移;(3)美国东部肿瘤协作组(ECOG)体能状况评分0~2分。排除标准:(1)内生肌酐清除率<30ml/min;(2)既往接受过双磷酸盐治疗骨转移;(3)口腔手术后未愈合;(4)3年内罹患过第2种恶性肿瘤;(5)有骨病手术或放疗计划;(6)预计患者生存时间<6个月;(7)恶性肿瘤累及器官的功能良好。按照上述检索策略,按照纳入与排除标准,最终纳入4项临床随机对照试验(RCT),共6 029例患者,包含7篇相关文献[1,10-15](其中3篇文献[13-15]为相关RCT不同随访项目的后续报道)。
1.2 方法
1.2.1 文献筛选 由2位研究者独立阅读文献题目及摘要,对可能纳入的研究阅读全文,相互核对纳入结果,若意见不同则通过讨论或由第3人裁定。
1.2.2 文献质量评价 纳入研究的文献质量评价采用Cochrane风险偏倚评估工具,偏倚风险评估方法的内容包括:(1)随机分配方案的产生,(2)隐蔽分组,(3)对患者和医生实施盲法,(4)对结果评价实施盲法,(5)不完整的结果数据,(6)选择性的结果,(7)其他偏倚。根据低偏倚风险、高偏倚风险和文献对偏倚评估未提供足够或不确定的信息等三方面进行评估;同时采用Jadad质量评价标准评价纳入研究的文献质量(包括随机方法、盲法、退出与失访等3项内容),Jadad量表满分为5分,≤2分为低质量研究,>2分为质量较高[16]。
1.3 统计学处理 应用Rev Man 5.3统计软件进行Meta分析。计算结果用危险比(HR)或OR值及其95%CI表示。异质性检验采用χ2检验,当PP>0.05且I2<50%时,采用固定效应模型进行分析;当P<0.05且I2>50%时,采用随机效应模型进行分析。用漏斗图检测潜在的表达偏倚。
2 结果
2.1 文献评估结果及基本特征 Cochrane风险偏倚评估显示低偏倚风险,见图1。Jadad量表评分均为5分。7篇文献的基本特征,见表1。
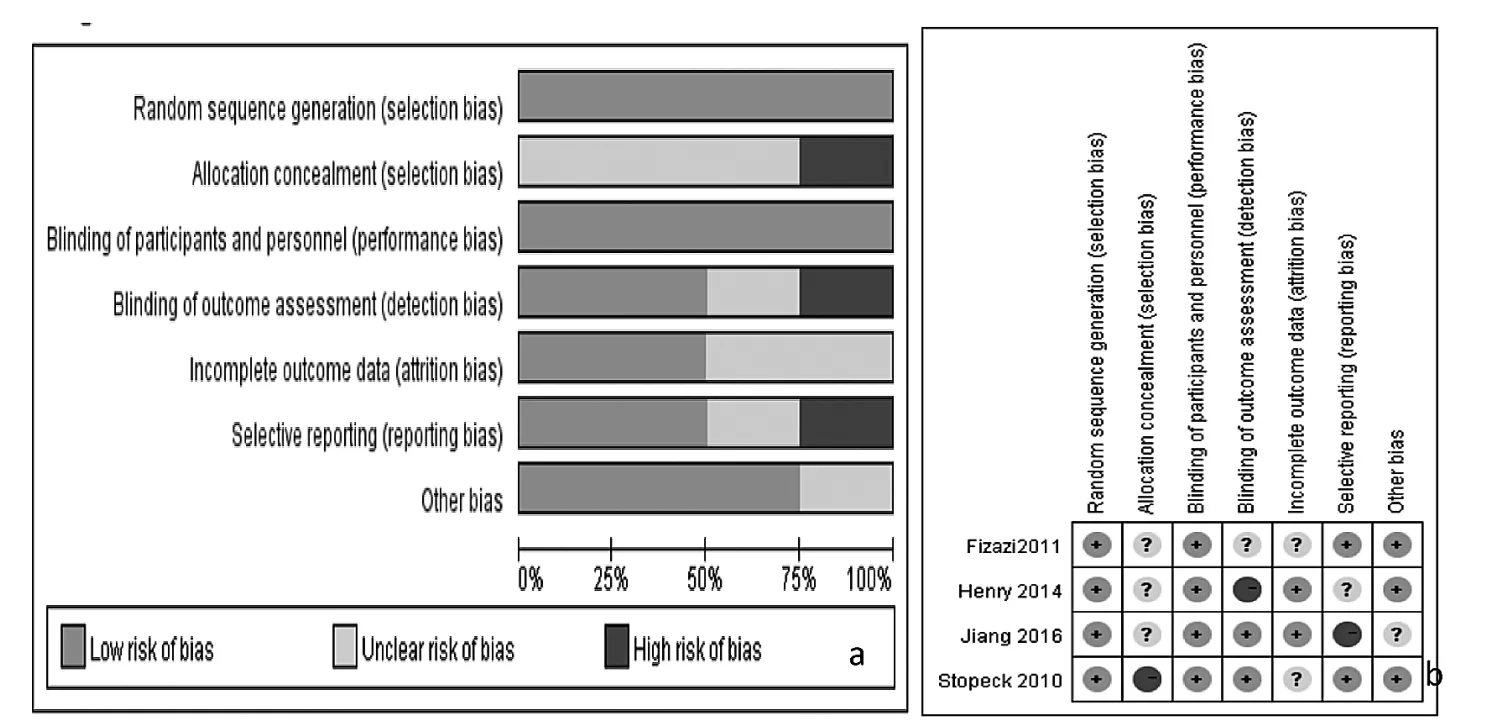
图1 纳入文献的偏倚风险评估结果(a:偏倚风险百分图;b:偏倚风险总结图)
2.2 Meta分析结果 与唑来膦酸比较,地诺单抗能明显延迟首次SREs发生的时间、首次及随后SREs发生的时间,降低骨转移标志物Ⅰ型胶原交联氨基末端肽/肌酐(uNTx/Cr)、骨源性碱性磷酸酶(S-BALP)的浓度,预防骨放疗,延缓疼痛加剧和干预,降低治疗后贫血、急性期反应和肾毒性等的发生率,差异均有统计学意义(均P<0.01),见表2和图2。两组患者总生存(OS)时间、疾病进展时间、预防病理性骨折、预防骨手术、预防脊髓压迫、不良事件(AEs,包括恶心、疲劳、背痛、下颌骨坏死等)的发生率等指标比较,差异均无统计学意义(均 P >0.05),见表 2。

表1 纳入文献的基本特征
2.3 发表偏倚分析 使用漏斗图对纳入的主要4篇研究进行测量,发现各指标的样本相对集中的分布于图形中部,两侧较对称,说明发表偏倚存在的可能性较小,见图3。
3 讨论
随着精准医学理念的提出以及抗肿瘤药物、手术技巧的不断更新,恶性肿瘤患者的生存时间不断延长,与此同时发生骨转移的风险也随之增加。骨转移诱发的SREs及骨痛严重影响着患者的生活质量和生存时间,患者往往需要应用止痛剂甚至阿片类药物才能缓解疼痛,但这些药物对消化、神经、呼吸等系统具有不良反应及成瘾性[17]。一项回顾性研究结果显示,骨转移或SREs的发生与乳腺癌的预后密切相关,无骨转移、有骨转移、同时伴有骨转移和SREs患者的5年OS率分别为76%、8%和3%[18]。因此,关于预防或延缓SREs的治疗在恶性实体肿瘤伴骨转移患者中至关重要。唑来膦酸是
临床上常用的双磷酸盐,广泛用于恶性实体肿瘤伴骨转移患者,其作用机制主要包括:(1)抑制破骨细胞的成熟及破骨细胞在骨质吸收部位的聚集;(2)减少肿瘤刺激诱导的生长因子分泌,进而调控骨的微环境[19];(3)抑制血管内皮生长因子诱导的内皮细胞增殖,进而明显抑制血管生成[20];(4)调节免疫系统而抑制肿瘤增殖[21];(5)经甲羟戊酸途径抑制肿瘤细胞的生长、黏附、入侵[22]。唑来膦酸主要以原型经肾脏排泄,而恶性肿瘤的多种化疗药物具有肾毒性,长期使用会损害肾功能甚至出现中毒性急性肾小管坏死[23];因此,静脉注射唑来膦酸所致急性反应发生率较高,从而限制了唑来膦酸的应用。地诺单抗是人源性单克隆抗体(IgG2单抗),可以阻止NF-κB受体活化因子配体RANK-L与其受体结合,抑制破骨细胞活化和发展,减少骨吸收,增加皮质骨和骨小梁的强度和硬度,抑制骨局部侵蚀和骨质溶解,最终发挥预防或治疗SREs功能[23]。地诺单抗通过非特异性网状内皮系统代谢[24],无肾毒性,其皮下注射的给药方式较唑来膦酸的静脉注射更为安全、方便,依从性更好,且无需因肾损伤而调节剂量或停药,可能在疗效、依从性方面具有更大的优势。

表2 地诺单抗与唑来膦酸有效性和安全性的比较
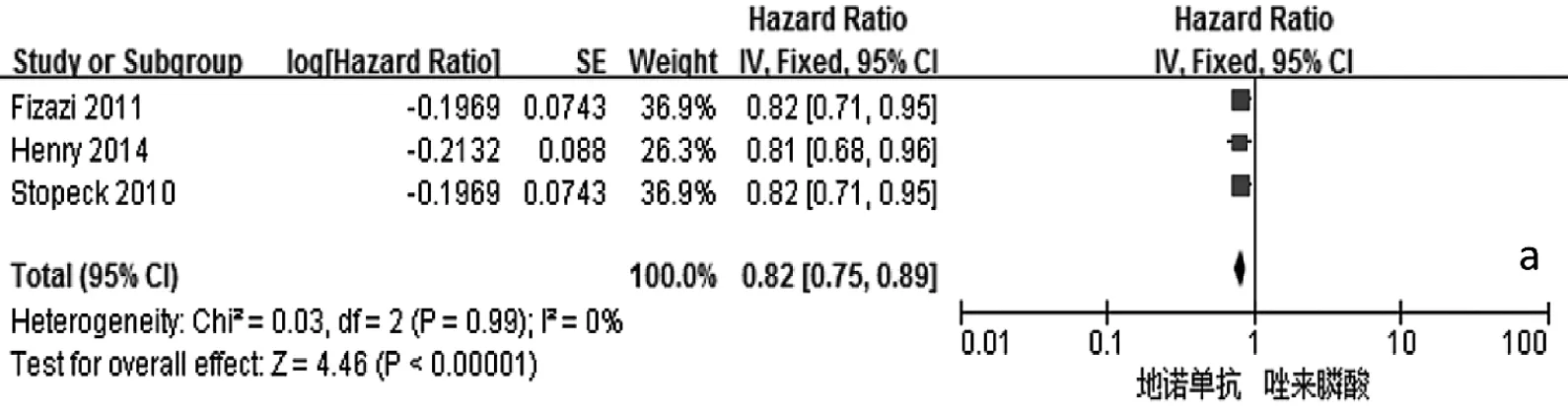
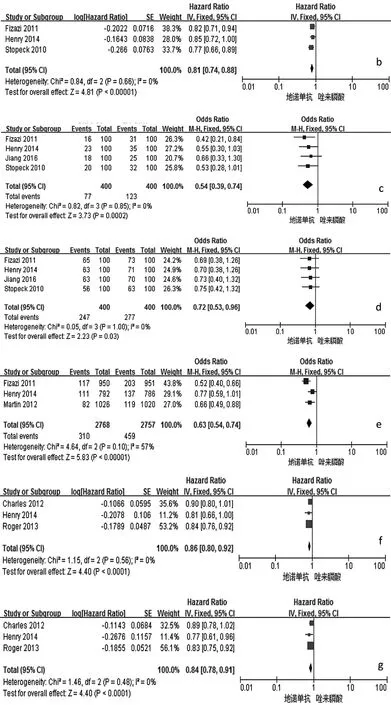
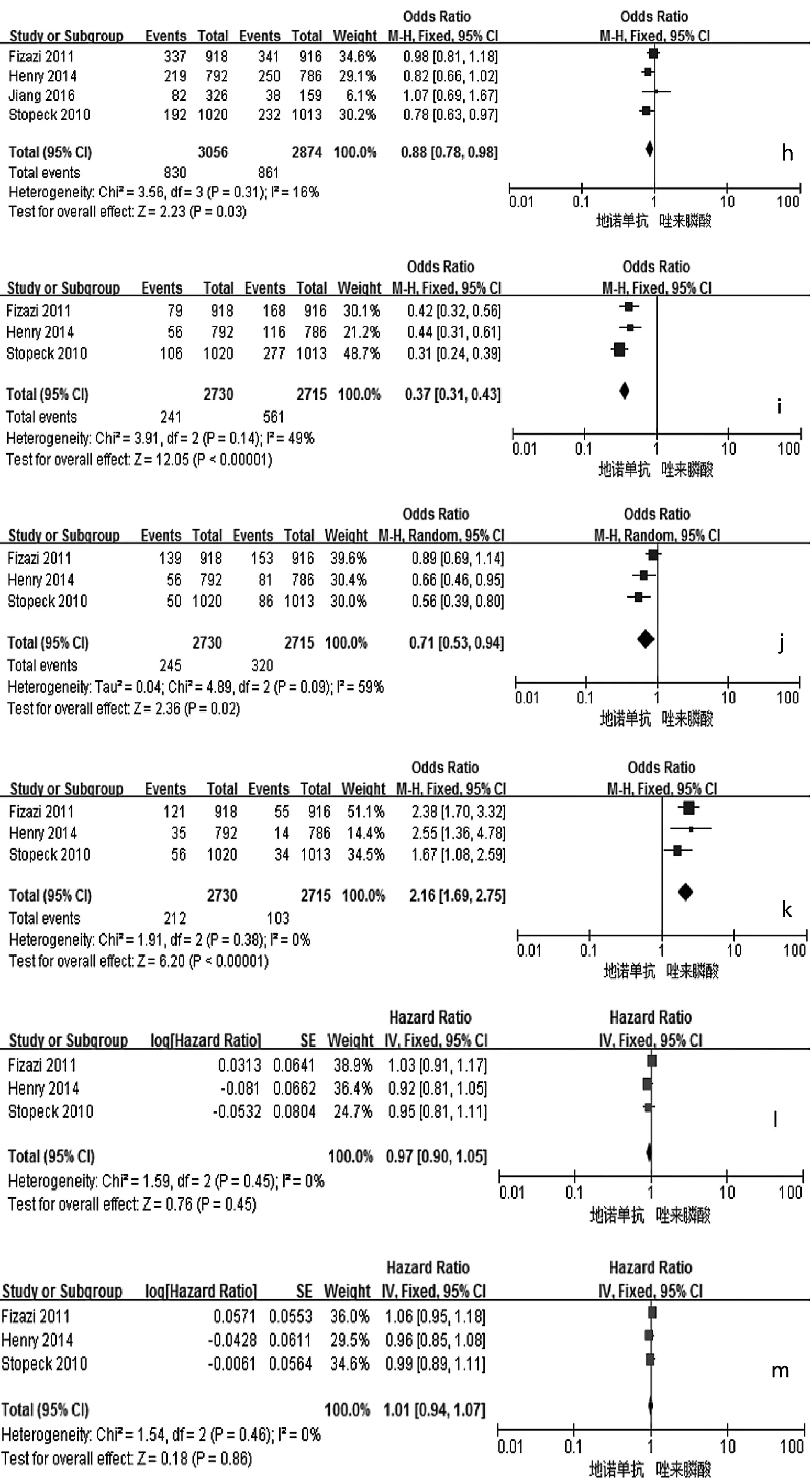
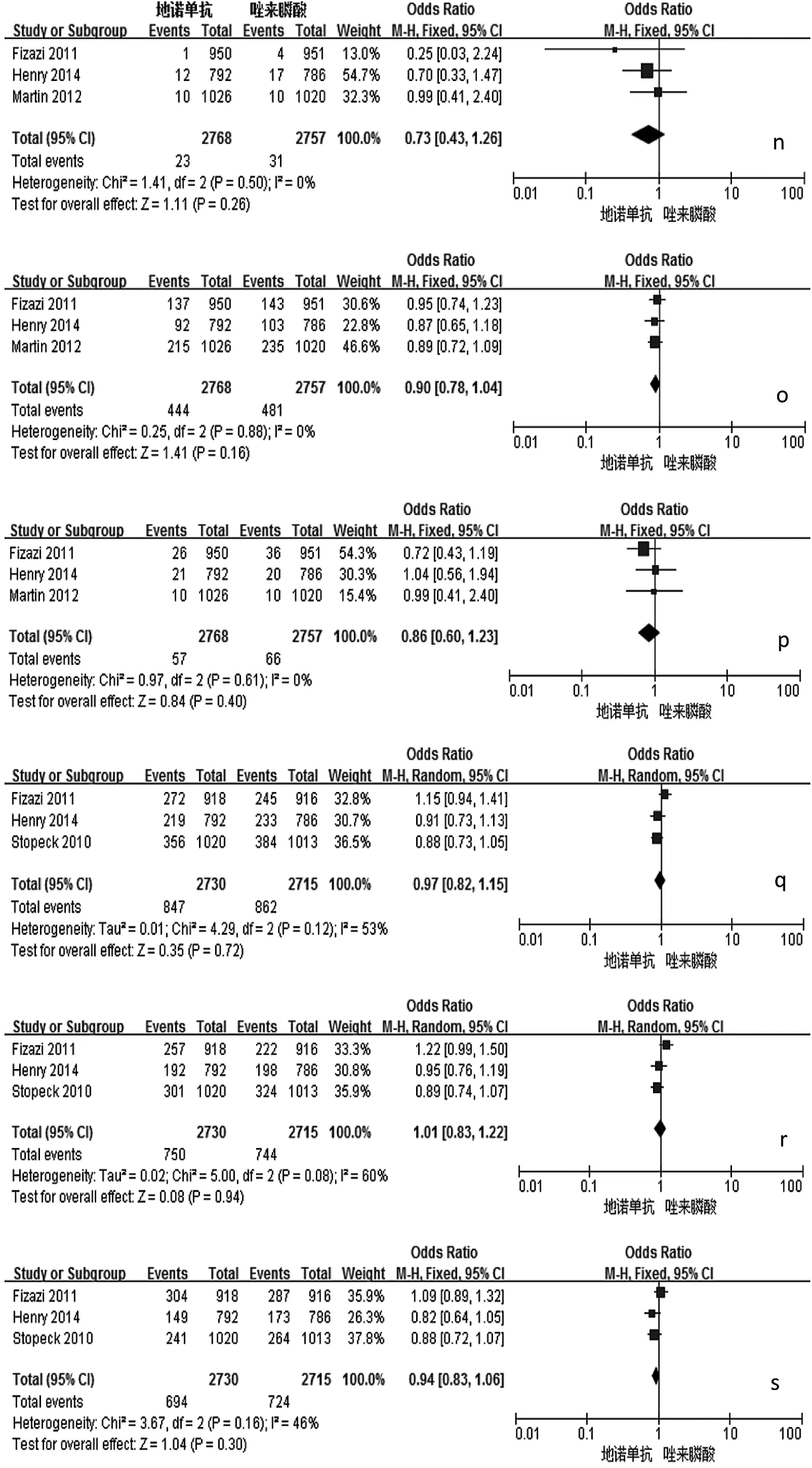
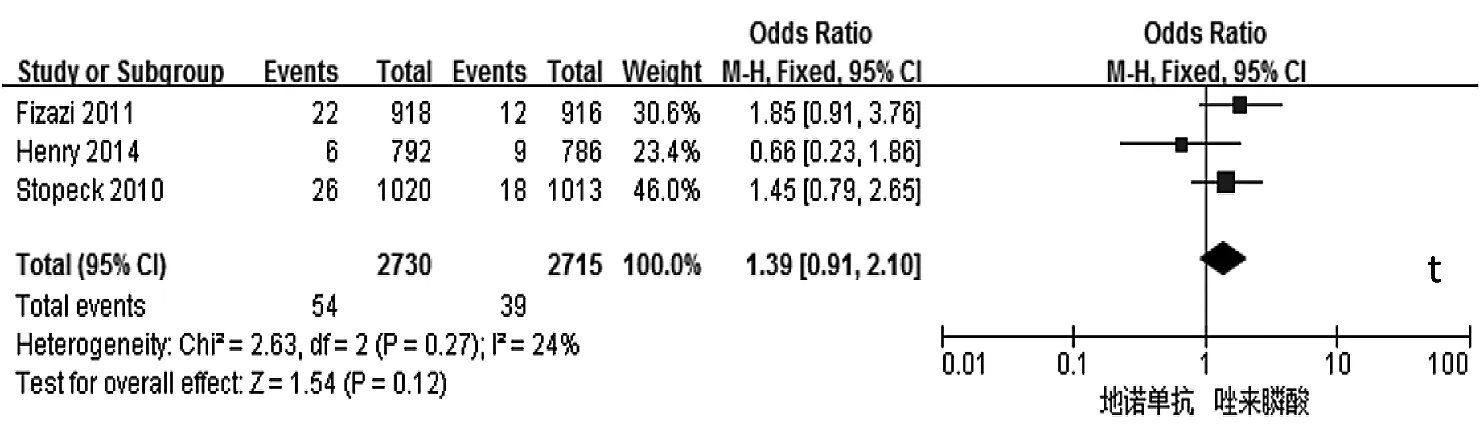
图2 地诺单抗与唑来膦酸有效性和安全性比较的森林图(a:首次发生SREs时间;b:首次及随后发生SREs时间;c:降低uNTx/Cr浓度;d:降低 S-BALP 浓度;e:预防骨放疗;f:延缓疼痛加剧;g:延缓疼痛干预;h:贫血发生率;i:急性期反应发生率;j:肾毒性发生率;k:低钙血症发生的比较;l:OS 时间;m:疾病进展时间;n:预防病理性骨折;o:预防骨手术;p:预防脊髓压迫;q:恶心发生率;r:疲劳发生率;s:背痛发生率;t:下颌骨坏死发生率;a-k:P<0.05;l-t:PP>0.05)
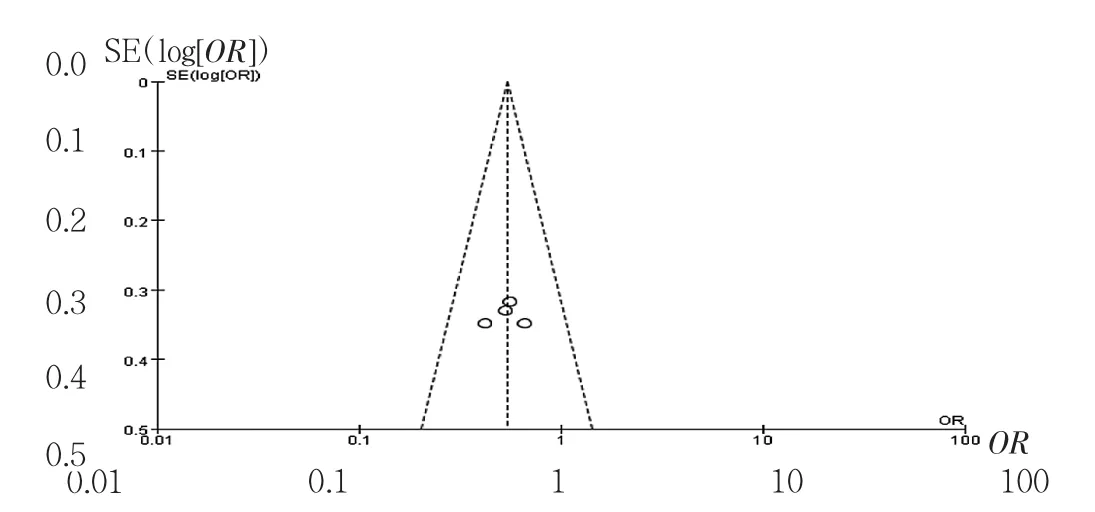
图3 Meta分析漏斗图
I型胶原是骨组织中唯一的胶原,其氨基端通过脱氧吡啶啉、吡啶啉与另一胶原分子的930位氨基酸形成NTX[25],NTX在骨吸收时释放入血,若未降解或代谢则可随尿液排出。运动与饮食对NTX的影响极小,尽管多处组织中存在NTX,但未经破骨细胞代谢,尿中NTX浓度不受影响。BALP是成骨细胞膜上的一种四聚体蛋白[26],是成骨细胞合成的特异性细胞外酶,主要位于骨化部位,多见于骨基质成熟期。恶性肿瘤发生骨转移时,因骨内磷酸钙沉积,成骨细胞代谢旺盛,最终导致BALP浓度升高。多项研究表明uNTx/Cr、S-BALP与恶性肿瘤骨转移密切相关,可为预测恶性实体瘤骨转移提供有效参考;因此,本研究纳入uNTx/Cr、S-BALP作为评价地诺单抗与唑来膦酸疗效的指标[27-28]。本文Meta分析结果显示,与唑来膦酸比较,地诺单抗可明显延迟首次发生SREs的时间、首次及随后发生SREs的时间,明显降低与骨转移密切相关的uNTx/Cr、S-BALP浓度,预防骨放疗,延缓疼痛加剧和干预;因此,患者生活质量得到明显改善,且避免了疼痛造成的困扰及经济负担。同时,地诺单抗组患者的贫血、急性期反应和肾毒性等发生率均较低,提示更为安全可靠;但低钙血症发生率较高,可能与地诺单抗较强的抑制骨吸收作用有关,但在研究中低钙血症多无明显症状,易通过口服钙剂和维生素D纠正,故地诺单抗治疗期间强烈建议同时补充维生素D(≥400IU)和钙剂(≥500mg),以免低钙症状的发生。
综上所述,与唑来膦酸比较,地诺单抗治疗恶性肿瘤伴骨转移更为安全、有效。本研究纳入的7篇文献偏倚风险较低,纳入文献的质量较高,可信度较强。另外,本研究纳入了一篇来自中国Ⅲ期临床随机对照双盲研究,研究对象主要针对中国患者,研究结果为了解地诺单抗治疗中国实体恶性肿瘤伴骨转移是否优于唑来膦酸提供了可靠、实际的依据。Snedecor等[29]报道地诺单抗的治疗费用/疗效比高于唑来膦酸,这也是患者在选择药物时需要考虑的问题。在经济条件允许的前提下,本研究结果支持优先选用地诺单抗预防与治疗恶性肿瘤伴骨转移,但仍需要更大样本、多中心的RCT来证实并指导药物方案的选择。
[1] Stopeck A T,Lipton A,Body J J,et al.Denosumab compared with zoledronic acid for the treatment of bone metastases in patients with advanced breast cancer:a randomized,double-blind study[J].J Clin Oncol,2010,28(35):5132-5139.
[2] Costa L,Badia X,Chow E,et al.Impact of skeletal complications on patients'quality of life,mobility,and functional independence[J].Support Care Cancer,2008,16(8):879-889.
[3] Weinfurt K P,Castel L D,Li Y,et al.Health-related quality of life among patients with breast cancer receiving zoledronic acid orpamidronate disodium for metastatic bone lesions[J].Med Care,2004,42(2):164-175.
[4] Pockett R D,Castellano D,McEwan P,et al.The hospital burden of disease associated with bone metastases and skeletal-related events in patients with breast cancer,lung cancer or prostate cancer in Spain[J].Eur J Cancer Care(Engl),2010,19(6):755-760.
[5] Wardley A,Davidson N,Barrett-Lee P,et al.Zoledronic acid significantly improves pain scores and quality of life in breast cancer patients with bone metastases:a randomised,crossover study of community vs hospital bisphosphonate administration[J].Br J Cancer,2005,92(10):1869-1876.
[6] Body J J,Diel I J,Bell R,et al.Oral ibandronate improves bone pain and preserves quality of life in patients with skeletal metastases due to breast cancer[J].Pain,2004,111(3):306-312.
[7] Katherine A.Zoledronic acid[J].Drugs,2008,68(18):2661-2682.[8] Rosen L S,Gordon D,Kaminski M,et al.Zoledronic acid versus pamidronate in the treatment of skeletal metastases in patients with breast cancer or osteolytic lesions of multiple myeloma:A phaseⅢ,double-blind,comparative trial[J].Cancer J,2001,7(5):377-387.
[9] Rosen L S,Gordon D,Kaminski M,et al.Long-term efficacy and safety of zoledronic acid compared with pamidronate disodium in the treatment of skeletal complications in patients with advancedmultiple myeloma or breast carcinoma:A randomized,double-blind,multicenter,comparative trial[J].Cancer,2004,100(12):2613-2621.
[10] Fizazi K,Carducci M,Smith M,et al.Denosumab versus zoledronic acid for treatment of bone metastases in men with castrationresistant prostate cancer:a randomised,doubleblind study[J].Lancet,2011,377(9768):813-822.
[11] Henry D,Vadhan-RajS,Hirsh V,et al.Delaying skeletal-related events in a randomized phase 3 study of denosumab versus zoledronic acid in patients with advanced cancer:An analysis of data from patients with solid tumors[J].Supportive Care in Cancer,2014,22(3):679-687.
[12] Jiang Z F,Shao Z M,Zhang Q Y,et al.Efficacy and safety of denosumab from a phaseⅢ,randomized,active-controlled study compared with zoledronic acid in patients of Asian ancestry with bone metastases from solid tumors[J].J Clin Oncol,2016,34(suppl):10116.
[13] Rogervon M,Jean-Jacques B,Blair E,et al.Pain and health-related quality of life in patients with advanced solid tumours and bone metastases:integrated results from three randomized,double-blind studies of denosumab and zoledronic acid[J].Support Care Cancer,2013,21(12):3497-3507.
[14] Charles S C,Jean-Jacques B,Alison S,et al.Pain outcomes in patients with advanced breast cancer and bone metastases results from a randomized,double-blind study of denosumab and zoledronic acid[J].Cancer,2013,119(4):823-828.
[15] Miguel M,Richard B,Hugues B,et al.Bone-related complications and quality of life in advanced denosumab versus zoledronic acid breast cancer:Results from a randomized phaseⅢtrial of denosumab versus zoledronic acid[J].Clin Cancer Res,2012,18(17):4841-4849.
[16]Schulz K F,Ahman D G,Moher D,et al.CONSORT 2010 statement:updated guidelines for reporting parallel group randomized trials[J].Ann Intern Med,2010,152(11):726-732.
[17]Azevedo S,Leao F K,Kimura M,et al.The WHO analgesic ladder for cancer pain control,twenty years of use.How much pain relief does one get from using it?[J].Support Care Cancer,2006,14(11):1086-1093.
[18] Yong M,Jensen A O,Jacobsen J B,et al.Survival in breast cancer patients with bone metastases and skeletal-related events:a population-based cohort study in Denmark(1999-2007)[J].Breast Cancer Res Treat,2011,129(2):495-503.
[19] Coleman R E.Adjuvant bisphosphonates in breast cancer:are we witnessing the emergence of a new therapeutic strategy?[J].Eur J Cancer,2009,45(11):1909-1915.
[20] Fournier P,Boissier S,Filleur S,et al.Bisphosphonates inhibit angiogenesis in vitro and testosterone-stimulated vascular regrowth in the ventral prostate in castrated rats[J].Cancer Res,2002,62(22):6538-6344.
[21] Rogers T L,Holen I.Tumour macrophages as potential targets of bisphosphonates[J].J TranslMed,2011,9:177.
[22] Raikkonen J,Monkkonen H,Auriola S,et al.Mevalonate pathway intermediates downregulate zoledronic aicd-induced isopenteny pyrophosphate and ATP analog formation in human breast cancer cells[J].Biochem Pharmacol,2010,79(5):777-783.
[23] Iranikhah M,Wilborn T W,Wensel T M,et al.Denosumab for the prevention of skeletal-relate eventsin patientswith bone metastasis from solid tumor[J].Pharmaco therapy,2012,32(3):274-284.
[24] Jamal S A,Ljunggren O,Stenham B C,et al.Effects of denosumab on fracture and bone mineral density by level of kidney function[J].J Bone Miner Res,2011,26(8):1829-1835.
[25] Szulc P,Seeman E,Delmas P D.Biochemical measurements of bone turnover in children and adolescents[J].Osteoporosis International,2000,11(4):281-294.
[26] Bayat V,Jaiswal M,Bellen H J.The BMP signaling pathway atthe drosophila neuromuscular junctioin and its links to neurodegenerative disease[J].Current opinion in neurobiology,2011,21(1):182-188.
[27] 王波,杨欢,庞琴霞,等.骨转移性癌患者血清PINP、BALP检测的临床意义[J].中国血液流变学杂志,2010,20(2):256-258.
[28] 佟仲生,王晓蕊,王忱,等.骨胶原代谢指标在乳腺癌骨转移诊断中的应用[J].中华骨外科杂志,2010,30(5):497-500.
[29] Snedecor S J,Carter J A,Kaura,et al.Costeffectiveness of denosumab versus zoledronic acid in the management of skeletal metastases secondary to breast cancer[J].Clin Ther,2012,34(6):1334-1349.
Efficacy and safety of denosumab versus zoledronic acid in treatment of bone metastasis:a meta-analysis
CHEN Wanjing,WANG
Bei,GAO Xiufei,et al.Department of Mastology,Zhejiang Provincial TCM Hospital,Hangzhou 310006,China
Objective To evaluate the effectiveness and safety of denosumab versus zoledronic acid in treatment of bone metastasis in cancer patients. Methods Clinical studies of denosumab and zoledronic acid in treating bone metastasis were searched from Cochrane Library,PubMed,OVID,Springer Linker,Science Direct,EBSCO and other databases.The quality of literature were evaluated with Cochrane risk of bias assessment tools.The meta-analysis was performed with software Rev Man 5.3. Results Four RCTs reported in 7 papers and involving 6029 patients were included in the meta-analysis.Meta-analysis showed that denosumab was superior to zoledronic acid in delaying the time to skeleton-related events (SREs),decreasing the concentration of bone metastasis markers uNTx/Cr and S-BALP,prolonging the time to radiotherapy,reducing the pain severity and pain interference.The denosumab group had lower incidence rate of anemia,acute phase reactions and renal toxicity.There were no significant differences in overall survival,disease progression,pathologic fractures,surgery to bone,spinal cord compression and incidence rates of nausea,fatigue,back pain,osteonecrosis of the jaw between two groups. Conclusion Denosumab is superior to zoledronic acid in clinical efficacy and safety for treatment of bone metastasis in cancer patients.
Denosumab Zoledronic acid Skeletal-related events Bone metastasis Neoplasms
2017-01-16)
(本文编辑:陈丹)
10.12056/j.issn.1006-2785.2017.39.18.2017-134
310006 杭州,浙江省中医院乳腺科
王蓓,E-mail:JHWbei@126.com
