山茱萸炮制过程中美拉德反应底物的含量变化
2017-11-01杨光明张玉玲蔡宝昌
杨光明 , 张玉玲 , 李 萌 , 潘 扬 *, 蔡宝昌
(1.南京中医药大学,江苏省中药炮制重点实验室,江苏 南京 210023;2.国家中医药管理局中药炮制标准重点研究室,江苏 南京210023;3.国家教育部中药炮制规范化及标准化工程研究中心,江苏 南京 210023;4.南京中医药大学,药用菌与中药生物技术研究所,江苏 南京 210023)
山茱萸炮制过程中美拉德反应底物的含量变化
杨光明1,2,3, 张玉玲4, 李 萌4, 潘 扬*4, 蔡宝昌1,2,3
(1.南京中医药大学,江苏省中药炮制重点实验室,江苏 南京 210023;2.国家中医药管理局中药炮制标准重点研究室,江苏 南京210023;3.国家教育部中药炮制规范化及标准化工程研究中心,江苏 南京 210023;4.南京中医药大学,药用菌与中药生物技术研究所,江苏 南京 210023)
采用UPLC-MS/MS法检测游离氨基酸含量,色谱柱以键合相C18硅胶为基质,流动相为水-乙腈,梯度洗脱,流速0.8 mL/min;采用3,5-二硝基水杨酸(DNS)比色法测定还原糖含量,研究山茱萸炮制过程中参与美拉德反应的底物游离氨基酸和还原糖质量分数的变化规律。山茱萸中共检测出15种游离氨基酸。各游离氨基酸的质量分数随着炮制时间的延长逐渐降低;还原糖质量分数在炮制中趋势不同于氨基酸,在炮制0~24 h逐渐降低,24~36 h还原糖质量分数有所上升,36 h后其质量分数变化趋于稳定。山茱萸中游离氨基酸和还原糖质量分数的变化与炮制中的美拉德反应密切相关,美拉德反应达到平衡时间与传统的炮制时间基本一致,这为炮制终点的判定提供了科学依据。
山茱萸;炮制;美拉德反应;游离氨基酸;还原糖
美拉德反应(Maillard reaction)[1-2]是一种非酶褐变反应,由法国化学家Maillard于1912年发现,反应指的是含游离氨基的化合物和羰基化合物在常温或加热时,初始阶段经过羰氨缩合及分子重排,生成一些香味物质的前体成分;中间阶段前体成分通过进一步脱水,缩合或分解生成呈色呈香类物质;最终阶段主要是一些复杂高分子色素的形成过程,最终生成类黑精,此阶段反应复杂,机制尚不清楚。中药富含氨基酸、还原糖等美拉德反应底物,因此美拉德反应广泛存在于中药炮制和制剂的过程中[3]。有研究者利用还原糖与氨基酸进行了模式美拉德反应的研究[4-6]。也有对中药红参中美拉德反应进行研究的报道[7]。
卫生部公布《关于进一步规范保健食品原料管理的通知》中,对药食同源物品、可用于保健食品的物品和保健食品禁用物品做出具体规定。山茱萸作为常用中药就列在 “可用于保健食品的物品名单”中。山茱萸为山茱萸科植物山茱萸Cornus officinalis Sieb.et Zucc.的干燥成熟果肉[8],临床上多以酒蒸品入药,具有补益肝肾、涩精固脱的功能。研究表明,山茱萸炮制过程中发生了美拉德反应,炮制后其滋阴补肾的功效有所增强。美拉德反应的进行需要底物氨基酸、还原糖的参与。反应进行的程度与底物的含量密切相关。目前已报道了竹笋、猕猴桃等食品[9-13]和地黄、番荔枝等中药中氨基酸的测定[14-16],以及山楂片、瓜蒌等食品和中药中还原糖的测定[17-21];对于山茱萸中的氨基酸[22]、多糖也分别有所研究[23-25],但对于氨基酸含测须经过衍生化处理,过程繁琐,损耗较大;而还原糖的测定尚未见报道。本实验中采用UPLC-MS/MS方法观察山茱萸炮制过程中15种游离氨基酸的含量变化,同时采用
1 材料与方法
1.1 仪器与材料
JA1103N型电子天平:上海民桥精密科学仪器有限公司产品;202型电热恒温箱:上海索普公司产品;台式高速离心机:无锡瑞江分析仪器有限公司产品;UV-2401PC紫外检测器:日本岛津公司产品;Ultimate3000液相色谱仪:美国戴安公司产品;API 3200 Q-TRAP质谱仪:美国AB公司产品;纯水机:南京易普易达科技发展有限公司产品。
氨基酸检测试剂盒,包含15种氨基酸:天门冬酰胺 (Asn),丝 胺 酸 (Ser),精 氨 酸 (Arg),甘 氨 酸(Gly),天 门冬 氨酸 (Asp),谷氨 酸(Glu),苏氨 酸(Thr),脯氨酸(Pro),赖氨酸(Lys),酪氨酸(Tyr),缬氨酸(Val),亮氨酸(Leu),苯丙氨酸(Phe),丙氨酸(Ala)和异亮氨酸 (Ile)(液相色谱串联质谱联用仪):北京质谱医学研究有限公司产品;乙腈为质谱纯,其他试剂均为分析纯。
山茱萸(生品)由安徽丰原铜陵中药饮片有限公司提供,经南京中医药大学药用菌与中药生物技术研究所潘扬教授鉴定为山茱萸科植物山茱萸Cornus officinalis Sieb.et Zucc的干燥成熟果肉。
1.2 酒蒸山茱萸样品的制备
取净山萸肉,按2010版《中国药典》酒蒸法加20%黄酒拌匀、润透,置于蒸锅中,常压蒸制,分别于0、2、4、8、12、18、24、36 h 和 48 h 取出,50 ℃干燥,3,5-二硝基水杨酸(DNS)比色法测定还原糖含量,从新的角度理解山茱萸的炮制过程,研究山茱萸炮制中的美拉德反应与炮制前后成分变化的关系,为判定山茱萸的炮制终点提供了科学依据。也为炮制机理研究提供了新的思路。作为不同炮制时间的酒蒸山茱萸样品。
1.3 游离氨基酸的质量分数测定
1.3.1 供试品溶液的制备 称取各酒蒸山茱萸样品粉末约50 mg,精密称定,加2 mL水充分溶解,4℃静置过夜提取。取0.5 mL静提液14 000 r/min冷冻离心30min,取上清液作为游离氨基酸检测标本[13]。
1.3.2 色谱条件 色谱柱:MS Lab HP-C18(150mm×4.6 mm,5 μm);流动相:水(A)-乙腈(B)梯度洗脱:0~1 min,5%B;1~9 min,5→70%B;9~9.1 min,70% ~100%B;9.1 ~10 min,100%B;10 ~10.1 min,100%~5%B;10.1~15 min,5%B;柱温:40 ℃;流速:0.8 mL/min;进样量:20 μL。
1.3.3 质谱条件 离子源:ESI电喷雾离子源,正离子模式;扫描方式:MRM多反应监测;CUR:20 psi(气帘气);CAD:Medium(碰撞气);IS:+5 500 V(喷雾电压);TEM:500 ℃(雾化温度);GS1:55 psi(雾化气);GS2:60 psi (辅助气);EP:10 V (射入电压);CXP:2.0 V(碰撞室射出电压)。
1.4 还原糖的质量分数测定
1.4.1 溶液配制 葡萄糖标准液:精密称取80℃烘至恒重的葡萄糖100 mg,配制成1 mg/mL的葡萄糖标准液。
3,5-二硝基水杨酸(DNS)试剂:将 6.3 g DNS和 262 mL 2 mol/L NaOH(40 g)溶液,加到 500 mL含有182 g酒石酸钾钠的热水溶液中,再加5 g结晶酚和5 g亚硫酸钠,搅拌溶解,冷却后加蒸馏水定容至1 000 mL,贮存于棕色瓶中备用[17]。
1.4.2 样品中还原糖的提取 精密称取各酒蒸山茱萸样品粉末1.0 g,放入100 mL烧杯中,先用少量蒸馏水调成糊状,再加入50 mL蒸馏水,搅匀,置于50℃恒温水浴中保温20 min,使还原糖浸出。将浸出液(含沉淀)转移到离心管中,于4 000 r/min离心10 min,沉淀用50 mL蒸馏水洗一次,离心,将两次离心的上清液合并,定容至100 mL,混匀,作为样品还原糖待测液。
1.4.3 标准曲线 取5 mL具塞刻度试管,编号,分别加入 0.2、0.4、0.6、0.8、1 mL 质量浓度为 1 mg/mL的葡萄糖标准液、加蒸馏水补至1 mL,再加入DNS试剂2 mL,配制成不同质量浓度的葡萄糖反应液,混合均匀,置沸水浴反应10 min,取出,流水冷却,定容至40 mL,在540 nm波长下测定吸光度。
1.4.4 样品测定 另取5 mL具塞刻度试管,分别加入上述提取得到的样品还原糖待测液1 mL,加入显色剂DNS试剂2 mL,按上述方法进行实验。测定各样品的吸光度,根据标准曲线计算出相应的葡萄糖含量,按下式计算出样品中还原糖的质量百分含量(以葡萄糖计)。
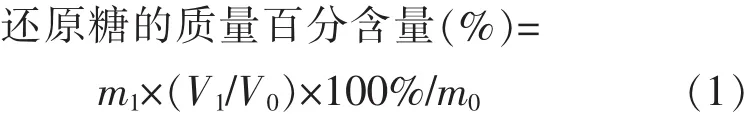
式(1)中:m1为根据标准曲线计算所得葡萄糖的质量,mg;V1为提取液总体积,mL;V0为测定时取用的体积,mL;m0为样品的质量,mg。
2 结果
2.1 游离氨基酸质量分数变化
山茱萸炮制过程中各氨基酸的质量分数变化见表1、图1和图2。共检测出山茱萸中15种游离氨基酸,随着炮制时间的延长,各游离氨基酸的质量分数及游离氨基酸总质量分数逐渐降低。炮制前期的12 h下降速率较快,12~24 h速率较慢,24 h后趋于平稳,与本研究前期检测的美拉德反应理化参数(酸碱度,褐变程度,5-羟甲基糠醛含量)的变化趋势一致[26]。

表1 山茱萸美拉德反应进程中游离氨基酸质量分数的变化Table 1 Contents of free amino acids in Maillard reaction of fructus corni μg/g
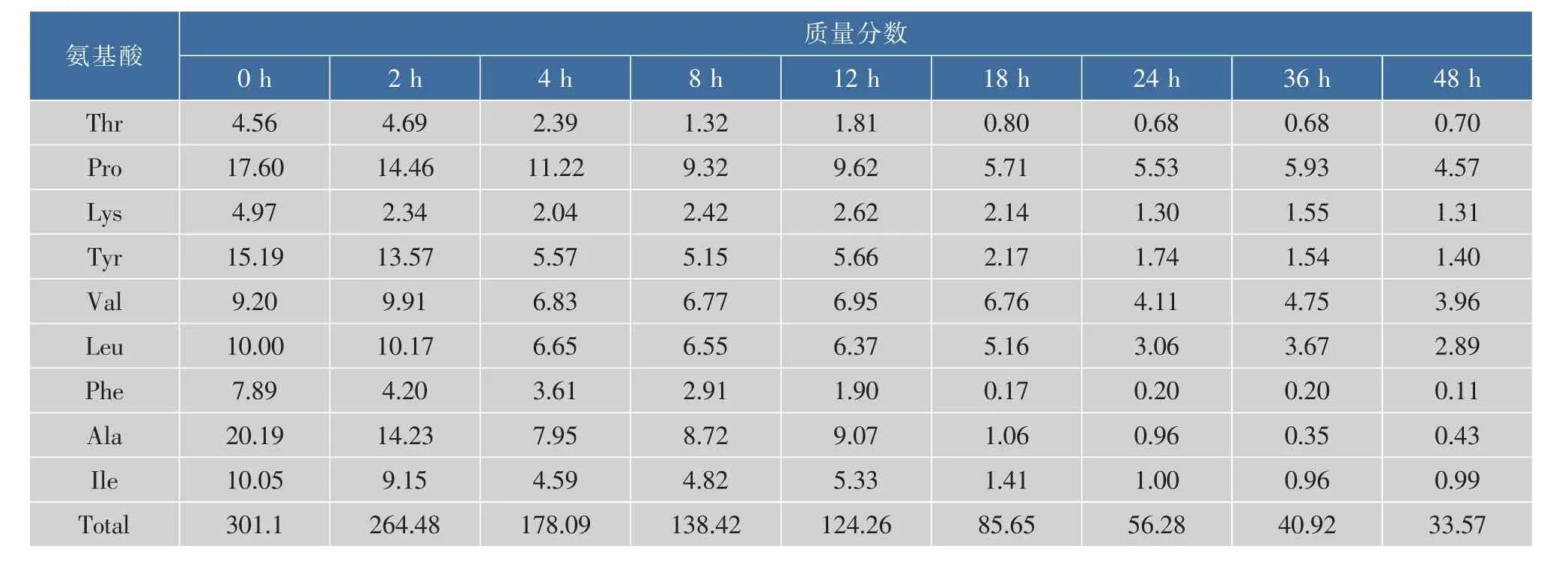
续表
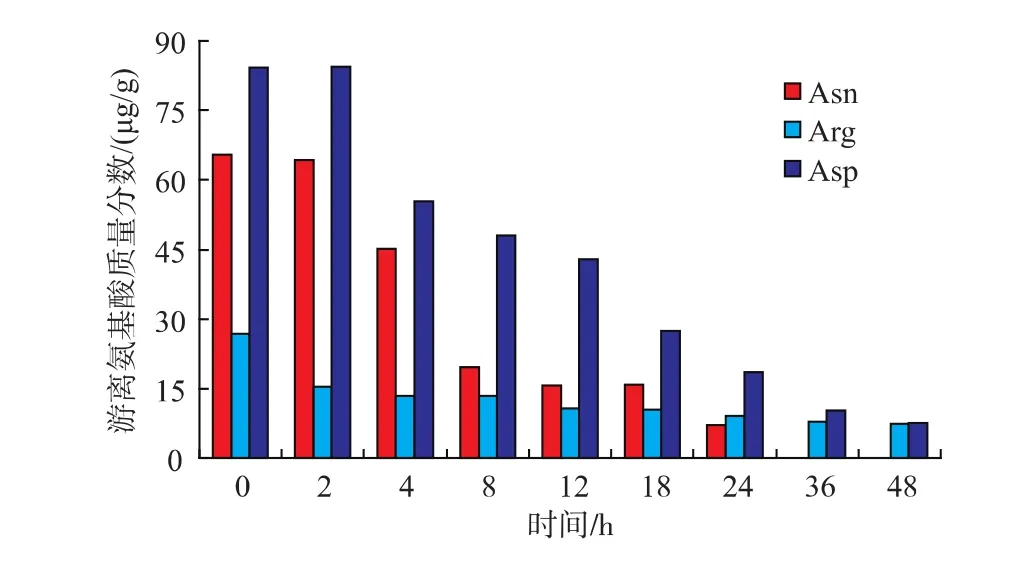
图1 山茱萸美拉德反应中含量最高的3种游离氨基酸的质量分数变化Fig.1 Three most high contents of free amino acids in Maillard reaction of fructus corni

图2 山茱萸美拉德反应中游离氨基酸总质量分数变化Fig.2 Total contents of free amino acids in Maillard reaction of fructus corni
2.2 还原糖质量分数变化
2.2.1 葡萄糖标准曲线的制备 结果显示,以吸光度(A)对葡萄糖质量X(mg)做线性回归,得到回归方程:Y=0.850 5X-0.031 1,相关系数 R=0.999 9,表明线性良好。
2.2.2 精密度实验 取同一葡萄糖标准液连续测定10次,其吸光度平均值为0.483,相对标准偏差RSD为0.21%,说明仪器精确度良好。
2.2.3 重复性实验 取同一批样品3份,按照1.4.4项下方法进行重复实验,结果RSD为0.63%,表明该实验的重复性良好。
2.2.4 样品检测 结果如图3所示,0~24 h,随着炮制时间的延长,还原糖质量分数逐渐降低,炮制24h时还原糖质量分数由6.61%降低到5.65%。24 h后随炮制继续进行,还原糖质量分数有所上升,36 h后其质量分数变化趋于稳定。
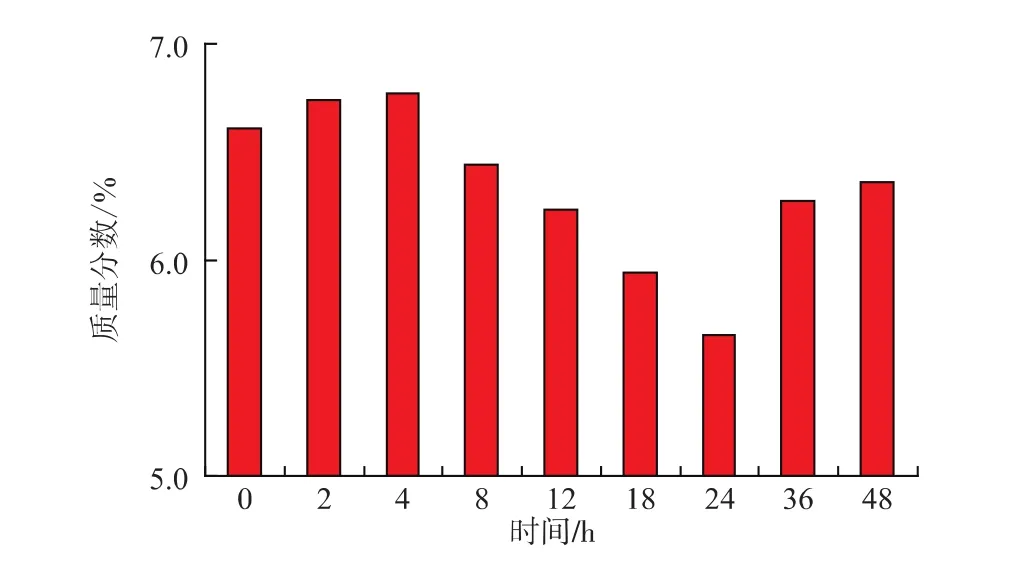
图3 山茱萸美拉德反应中还原糖的质量分数变化Fig.3 Contents of reducing sugars in Maillard reaction of fructus corni
3 讨 论
山茱萸富含氨基酸和糖类,是美拉德反应必不可少的反应底物。本研究中采用UPLC-MS/MS法检测了炮制前后山茱萸游离氨基酸的质量分数,并采用经典的DNS比色法测定了还原糖的质量分数。结果发现,随着山茱萸炮制时间的延长,美拉德反应不断进行,在最初的12 h里,作为反应底物的游离氨基酸和还原糖质量分数较高,美拉德反应速率较快,随着反应进行底物被大量消耗,质量分数随之迅速降低。炮制中期的12~24 h因前期的快速反应导致底物含量降低,美拉德反应速率变缓,底物继续被消耗,质量分数持续降低。炮制24 h时,总游离氨基酸质量分数降低80%以上,部分氨基酸质量分数降低90%以上,还原糖质量分数由6.61%降低到5.65%。炮制后期的24~48 h,游离氨基酸质量分数较低,美拉德反应速度很慢,山茱萸炮制体系基本趋于稳定,游离氨基酸变化幅度很小。与之不同的是,在山茱萸炮制的24~36 h,还原糖又逐渐增加,推测是由于另一反应底物游离氨基酸在24 h内基本消耗结束,美拉德反应达到平衡,不再消耗还原糖;24 h后随着炮制的继续进行,多糖及糖苷类成分水解,生成还原糖,使得还原糖的质量分数有所上升,这一变化趋势在炮制36 h后趋于稳定。
综上所述,在山茱萸炮制过程中,美拉德反应消耗了氨基酸和还原糖,反应0~24 h游离氨基酸和还原糖质量分数降低,24 h之后质量分数稳定,提示山茱萸酒蒸24 h后,美拉德反应趋于平衡,其美拉德反应产物性质和质量分数均比较稳定,对其炮制终点的判定极具参考价值。
[1]HODGE J E.Dehydrated foods,chemistry of browning reactions in model systems[J].J Agric Food Chem,1953,1(15):928-933.
[2]LI Yali,LIU Xiaoxu,ZHENG Peihua,et al.Progress on applications of the Maillard reaction [J].Food Sciences and Technology,2012,37(9):82-87.(in Chinese)
[3]ZHOU Yiqun,HE Fuyuan,YANG Yantao,et al.Research situation of Maillard reaction and its influence on research methods for processing and preparation process of Chinese materia medica[J].Chinese Traditional and Herbal Drugs,2014,45(1):125-129.(in Chinese)
[4]ZHANG Xiaoxi,ZENG Yan,ZHANG Zesheng,et al.Study on Maillard reaction of D-fructose and amino acids and antioxidant activity of their products[J].Science and Technology of Food Industry,2011,32(6):175-178,240.(in Chinese)
[5]SUN Qian,YIN Zi,JING Hao.Color characteristics and radical scavenging activity of four model systems of Maillard reaction between amino acids and monosaccharides[J].Food Sciences,2009,30(11):118-123.(in Chinese)
[6]ZHOU Xiangjun,ZHOU Jian,FENG Jinbing,et al.Reaction conditions of four kinds of Maillard reactions and the products’antioxidant activities[J].Food and Fermentation Industries,2014,40(6):27-36.(in Chinese)
[7]CHU Hongmei,QU Guiwu,DAI Shengjun,et al.Study on Maillard reaction products from Chinese red Ginseng[J].Chinese Journal of Experimental Traditional Medical Formulae,2014,20(9):86-89.(in Chinese)
[8]国家药典委员会.中华人民共和国药典(一部)[S].北京:中国医药科技出版社,2010.
[9]MO Runhong,TANG Fubing,DING Ming,et al.Determination of free amino acids in bamboo shoot by amino acids analyzer[J].Chemical Bulletin,2012,75(12):1126-1131.(in Chinese)
[10]XUE Min,GAO Guitian,ZHAO Jinmei,et al.Principal component analysis and comprehensive evaluation of free amino acids in different varieties of kiwi fruit[J].Science and Technology of Food Industry,2014,35(5):294-298.(in Chinese)
[11]WU Junrui,YUE Xiqing,ZHANG Miao,et al.Analysis and comprehensive evaluation of free amino acids in traditional fermented soybean paste from northeast of China[J].Journal of Food Science and Biotechnology,2015,34 (2) :158-164.(in Chinese)
[12]SHI Wenxiang,CHEN Xinhua.Simultaneous determination of free amino acids in three edible Russula fungi by stable isotope isobaric tage quantitation labeled-LC MS/MS[J].Food and Fermentation Industries,2015,41(2):179-183.(in Chinese)
[13]LIU Xiaoxiao,LI Shulin,LU Ruili,et al.Simultaneous analysis of 16 free amino acids in mycelia of entomogeneous fungi by LC-ESI-TOF-MS[J].Food and Fermentation Industries,2013,39(1):181-186.(in Chinese)
[14]GAO Guanzhen,ZHOU Jianwu,WANG Huiqin,et al.Analysis of amino acids in Rehmannia glutinosa Libosch.during heating Process[J].Amino Acids&Biotic Resources,2010,34(3):52-54.(in Chinese)
[15]EGYDIO A P M,CATARINA C S,FLOH E I S,et al.Free amino acid composition of Annona (Annonaceae) fruit species of economic interest[J].Industrial Crops and Products,2013,45:373-376.
[16]LIAN Ying,ZHONG Ping.Determination and evaluation of amino acids in protein hydrolysate injection[J].Chinese Journal of Pharmaceutical Analysis,2012,32(1):61-66.(in Chinese)
[17]LI Huan,LU Jiaping,WANG Dengjin.Study on determination of reducing sugar from Haw Flakes with DNS colorimetry method[J].Science and Technology of Food Industry,2013,34(18):75-77.(in Chinese)
[18]YANG Junhui,ZHENG Lan,MA Yaohong,et al.Comparison of different determination of reducing sugar in potato[J].Food Research and Development,2011,32(6):104-108.(in Chinese)
[19]YAN Fanhe,ZHOU Jinmei,WU Ruchun.Colorimetric determination of reducing sugar by methanoic acid pretreatment bagasse with 3,5-dinitrosalicylic acid[J].Food Research and Development,2015,36(2):126-128.(in Chinese)
[20]SUN Wen,CHAO Zhimao,WANG Chun,et al.Determination of total sugar and reducing sugar in processed Fructus Trichosanthis[J].China Journal of Experimental Traditional Medical Formulae,2013,19(9):96-99.(in Chinese)
[21]WOOD I P,ELLISTON A,RYDEN P,et al.Rapid quantification of reducing sugars in biomass hydrolysates:Improving the speed and precision of the dinitrosalicylic acid assay[J].Biomass and Bioenergy,2012,44:117-121.
[22]DING Xia,ZHU Fangshi,YU Zongliang,et al.Comparative study on contents of amino acid and major and trace elements in Cornus officinalis before and after being Processed[J].Journal of Chinese Medicinal Materials,2007,30 (4):396-399.(in Chinese)
[23]LIANG Xiaojuan,DU Weifeng,CAI Baochang,et al.Studies on the change of the content of polysaccharides in crude and processed Fructus corni[J].Traditional Chinese Drug Research&Clinical Pharmacology,2009,20 (5):460-462.(in Chinese)
[24]DAI Yanpeng,DING Xia,FU Ziqin,et al.Chemical studies on polysaccharide in crude and processed Fructus corni[J].Chinese Archives of Traditional Chinese Medicine,2008,26(5):950-952.(in Chinese)
[25]SHI Juan.Extraction of polysaccharide of Fructus corni and its effects of scavenging oxygen free radicals[J].Jiangsu Agricultural Sciences,2012,40(12):289-291.(in Chinese)
[26]张玉玲.基于美拉德反应的山茱萸炮制机理研究[D].南京:南京中医药大学,2015.
欧盟发布果胶等作为食品添加剂的安全风险评估报告
2017年7月6日,欧盟委员会发布果胶(E 440i)和酰胺化果胶(E 440ii)作为食品添加剂的安全风险评估报告,食品添加剂和营养来源(ANS)评估小组认为:
1.两种果胶不太可能被完整吸收,而是被肠道微生物群发酵形成与果胶衍生物酸性寡糖(pAOS)相似的物质;
2.对果胶和酰胺化果胶没有遗传毒性的迹象;
3.在人体内6周的剂量为36 g/d(相当于515 mg/kgbw/d)没有不利影响,对于95%幼儿来说暴露量每天可达442 mg/kg bw/d。
小组得出结论:对于使用两种果胶作为一般人群的食品添加剂,无需指定每日摄入量(ADI),对于所报道的果胶的使用水平,不存在安全问题。
[信息来源]厦门WTO工作站.欧盟发布果胶等作为食品添加剂的安全风险评估报告[EB/OL].(2017-7-10).http://www.xmtbt-sps.gov.cn/detail.asp?id=54815
Content Changes of Substrates of Maillard Reaction during Processing of Fructus Corni
YANG Guangming1,2,3, ZHANG Yuling4, LI Meng4, PAN Yang*4, CAI Baochang1,2,3
(1.Jiangsu Key Laboratory of Chinese Medicine Processing,Nanjing University of Chinese Medicine,Nanjing 210023,China;2.Key Laboratory of State Administration of Traditional Chinese Medicine for Standardization of Chinese Medicine Processing,Nanjing 210023,China;3.Engineering Center of State Ministry of Education for Standardization of Chinese Medicine Processing ,Nanjing 210023,China;4.Laboratory of Medical Fungi and Phyto-Biotech,Nanjing University of Chinese Medicine,Nanjing 210023,China)
To study content changes of free amino acids and reducing sugars of Maillard reaction during processing of fructus corni,UPLC/MS/MS was adopted to detect the contents of free amino acids.Chromatographic column of MS Lab HP-C18was used for analysis,with water-acetonitrile asgradient elution mobile phase,and flow rate at 0.8 mL/min.DNS method was used in determination of reducing sugars.Totally 15 kinds of free amino acids were detected in fructus corni.The content of free amino acids reduced gradually with processing time.While the content of reducing sugars changed differently from those of free amino acids,which reduced gradually in 0~24 h,increased slightly in 24~36 h and then became to be stable.The content changes of free amino acids and reducing sugars have close relationship with Maillard reaction during processing of fructus corni.The time of Maillard reaction for fructus corni to reach its equilibrium is in accordance with that of traditional processing,which provides a scientific base for determining processing end.
fructus corni,processing,maillard reaction,free amino acid,reducing sugar
R 284.1
A
1673—1689(2017)08—0884—06
10.3969/j.issn. 1673-1689.2017.08.015
2015-09-08
江苏省高校自然科学研究重大项目(12KJA360001);江苏高校优势学科建设工程资助项目(PAPD),江苏高校品牌专业建设工程一期项目(PPZY2015A068)。
杨光明(1974—),女,江苏南京人,药学博士,副研究员,主要从事中药炮制及质量标准研究。E-mail:ygmm0901@hotmail.com
*通信作者:潘 扬(1964—),男,江苏扬州人,药学博士,教授,博士研究生导师,主要从事中药化学与生物技术方向研究。E-mail:y.pan2006@163.com
杨光明,张玉玲,李萌,等.山茱萸炮制过程中美拉德反应底物的含量变化[J].食品与生物技术学报,2017,36(08):884-889.
