重组大肠杆菌产双乙酰还原酶的发酵条件优化
2017-11-01边雅倩许国超
边雅倩, 许国超, 倪 晔
(江南大学 教育部工业生物技术重点实验室,江苏 无锡 214122)
重组大肠杆菌产双乙酰还原酶的发酵条件优化
边雅倩, 许国超, 倪 晔*
(江南大学 教育部工业生物技术重点实验室,江苏 无锡 214122)
光学纯2,3-丁二醇是重要的手性合成砌块。采用双乙酰还原酶催化还原双乙酰底物是一种合成光学纯2,3-丁二醇的绿色方法。作者在摇瓶中对产双乙酰还原酶重组大肠杆菌的发酵培养基及诱导条件进行了优化。优化后的发酵培养基组成为:甘油5 g/L,酵母浸膏10 g/L,鱼粉蛋白胨 5 g/L,(NH4)2SO41.5 g/L,柠檬酸钠 5 g/L,KH2PO41 g/L,MgSO4·7H2O 0.5 g/L,NaCl 2 g/L;优化后的诱导条件为37℃,IPTG终浓度为0.1 mmol/L。在优化培养基中,37℃和0.1 mmol/L IPTG条件下诱导发酵6 h,单位菌体(干重)产双乙酰还原酶量达13.84 kU/g,产酶水平达33.65 kU/L,分别为基础培养基的2.04和4.23倍,LB培养基的1.16和1.71倍。在此最优条件,在3 L发酵罐中进行了重组大肠杆菌产双乙酰还原酶的验证,发酵8 h时酶活最高,单位菌体产双乙酰还原酶量达14.09 kU/g,产酶水平达64.62 kU/L。本研究为高效制备可用于不对称还原合成光学纯2,3-丁二醇的双乙酰还原酶奠定了基础。
重组大肠杆菌;双乙酰还原酶;发酵培养基优化;诱导条件优化
2,3-丁二醇是一种非常重要的化合物,在防冻剂、油墨、香水和软化剂等的合成中具有广泛的用途,还可作为液体燃料以及用于制备甲乙酮及1,3-丁二烯[1]等化工原料。2,3-丁二醇有两个手性碳原子,因此存在三种立体异构体:(2S,3S)-2,3-丁二醇,(2R,3R)-2,3-丁二醇及 meso-2,3-丁二醇。 三种单一立体构型的2,3-丁二醇由于存在不同手性基团而具有不同的性质,均可作为合成精细化学品、手性药物及手性试剂的重要砌块,例如:(2R,3R)-2,3-丁二醇可用于合成光学活性的2-甲基-1,4-丁二醇,而(2S,3S)-2,3-丁二醇对动物体内腺苷酸环化酶活性具有抑制作用[2]。鉴于其重要的应用价值,近些年国内外许多研究者对其合成进行了研究。据报道许多微生物能够发酵生产2,3-丁二醇,但是产生的2,3-丁二醇一般至少为两种立体异构体的混合物[3],因而其应用具有一定的局限性。利用基因工程改造的微生物细胞进行全细胞生物催化可生产单一立体构型的2,3-丁二醇,因此受到越来越多的关注。其中,将双乙酰还原酶在大肠杆菌中异源过量表达,并以双乙酰为底物,通过连续两步还原生成 (2S,3S)-2,3-丁二醇, 是合成光学纯2,3-丁二醇的绿色、高效方法之一。
李理想等从阴沟肠杆菌Enterobacter cloacae中克隆了一个2,3-丁二醇脱氢酶 (双乙酰还原酶)基因并异源表达于大肠杆菌中,构建了含有双乙酰还原酶的重组大肠杆菌。以双乙酰为底物,经全细胞催化合成了(2S,3S)-2,3-丁二醇,产量达 26.8 g/L[4]。Wang Z等从红平红球菌Rhodococcus erythropolis中克隆了一个双乙酰还原酶基因并在大肠杆菌中进行异源表达,该酶同时具有氧化1-苯乙醇的活力,可通过添加1-苯乙醇实现辅酶NADH的循环。利用该重组酶不对称还原双乙酰生产 (2S,3S)-2,3-丁二醇,产量最高可达5.24 g/L[5]。本课题组从地衣芽孢杆菌Bacillus lincheniformis中克隆了一个具有高活性和选择性的双乙酰还原酶基因,将其成功异源表达于大肠杆菌中。为了实现重组酶在大肠杆菌的大量表达,降低重组酶制备的成本,作者对基因工程菌 Escherichia coli BL21 (DE3)/pET24abdh的发酵培养基及诱导条件进行优化,并在发酵罐中进行了重组大肠杆菌的放大培养。
1 材料与方法
1.1 材料
1.1.1 菌种 E.coli BL21(DE3)/pET24a-bdh,作者所在实验室构建并保存。
1.1.2 培养基 种子培养基为LB培养基(g/L):胰蛋白胨 (OXOID)10, 酵母提取物(OXOID)5,NaCl 10;发酵基础培养基(g/L):葡萄糖 5,酵母浸膏 5,鱼粉蛋白胨5,NaCl 5。使用250 mL摇瓶,装液量为30 mL。将上述基础培养基中碳源、氮源及无机盐替换成不同的成分以进行发酵培养基优化。
1.1.3 试剂 发酵培养基各种成分:购自国药集团药业股份有限公司;IPTG、卡那霉素:购自生工生物工程股份有限公司。
1.2方法
1.2.1 培养方法 将甘油管保藏菌接入LB培养基中,于37℃、200 r/min过夜培养,按体积分数5%转接入发酵(基础)培养基中,于37℃、200 r/min继续培养至OD600约为0.6~0.8时,加入0.2 mmol/L IPTG,于30℃诱导培养6 h。
1.2.2 细胞光密度分析 将菌悬液适当稀释,于分光光度计(600 nm)测定其吸光值。
OD600=读数×稀释倍数。
1.2.3 菌体生物量的测定 取相同体积不同浓度的菌体,测定其OD600后,于8 000 r/min下离心10 min,弃上清液后用去离子水悬浮菌体,再离心,弃上清液后,将菌体放置于70℃烘干至恒质量。菌体质量浓度(g/L)与OD600呈线性关系,结果见图1。
y=0.331x-0.088 7 (R2=0.999 6)
其中 x为 OD600,y为菌体质量浓度(g/L)。
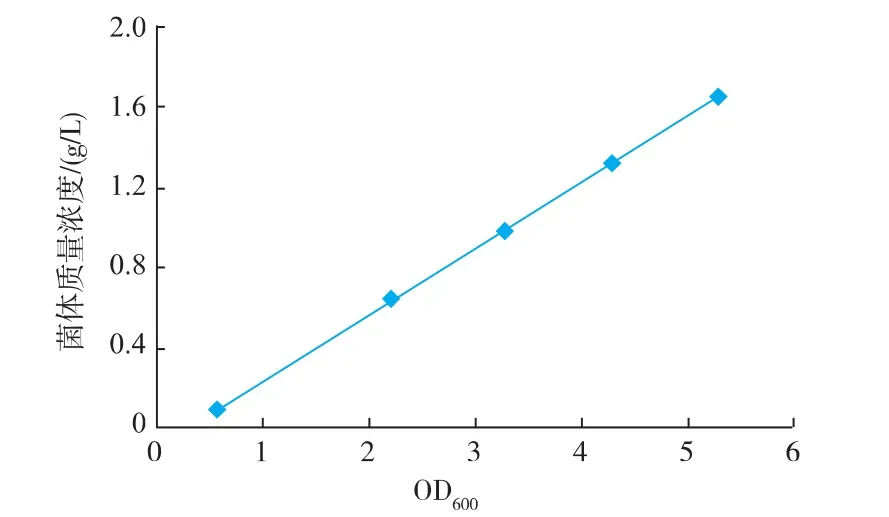
图1 菌体质量浓度与OD600的线性关系Fig.1 Relationship between the dry cell weight and the OD600
1.2.4 菌体破碎 诱导培养结束后,离心收集菌体,用 7 mL 磷酸钾缓冲液(100 mmol/L,pH 6.0)悬浮菌体,使用超声波破碎仪对菌体破碎10 min,结束后于4℃、8 000 r/min离心10 min,取上清液进行酶活测定。
1.2.5 酶活测定 使用酶标仪(美国BioTek)测定双乙酰还原酶的活力,酶活测定体系如下(200 μL):柠檬酸钠缓冲液(100 mmol/L,pH 5.0),NADH 1 mmol/L,双乙酰5 mmol/L,适量上清粗酶液。通过测定340 nm处吸光值的下降来计算双乙酰还原酶的活力。酶活定义如下:在上述条件下,每分钟催化1 μmol NADH氧化所需要的酶量。
2 结果与讨论
2.1 发酵培养基的优化
2.1.1 碳源对菌体生长及产酶的影响 研究了4种较廉价的碳源:葡萄糖、甘油、蔗糖、可溶性淀粉(均5 g/L)对重组大肠杆菌的生长及产酶的影响,结果见表1。并且通过SDS-PAGE观察不同碳源对双乙酰还原酶可溶性表达的影响,结果见图2。
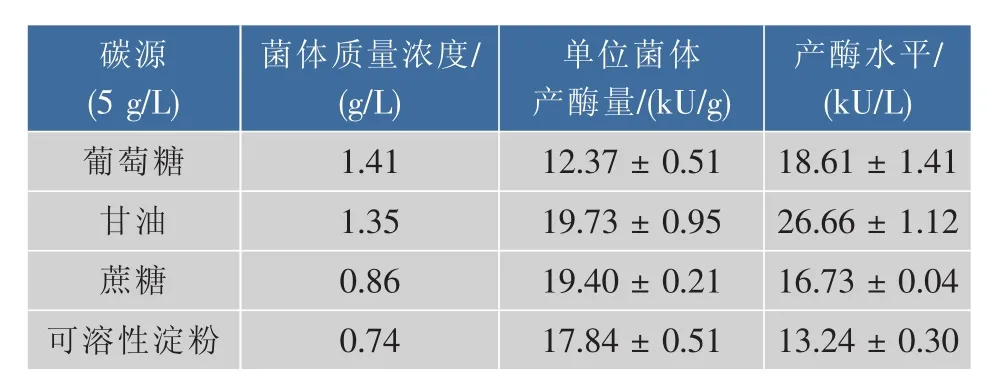
表1 不同碳源对重组大肠杆菌菌体生长及产酶的影响Table 1 Effect of different carbon sources on cell growth and diacetyl reductase production of recombinant E.coli
结果表明:以葡萄糖为碳源时菌体质量浓度最高(1.41 g/L),单位菌体产酶量最低(12.37 kU/g),可见葡萄糖容易被菌体利用进行生长,但不利于产酶;而以蔗糖和可溶性淀粉为碳源时,单位菌体产酶量虽然较高,但是不利于菌体生长(<1.0 g/L);而以甘油为碳源时,菌体产量为1.35 g/L,且单位菌体产酶量及产酶水平均是最高的。同时SDS-PAGE显示,4种碳源对重组蛋白质的可溶性表达没有影响。因此,最终选择甘油为碳源。

图2 不同碳源对重组双乙酰还原酶可溶性表达的影响Fig.2 SDS-PAGE analysis of recombinant enzyme expressed in different carbon sources
通过单因素优化,确定了最佳的甘油添加质量浓度,结果见图3。可知,当甘油质量浓度为5 g/L时,单位菌体产酶量及产酶水平均已达到最高,继续增加甘油对单位菌体产酶量及产酶水平无显著影响,因此确定最适甘油质量浓度为5 g/L。
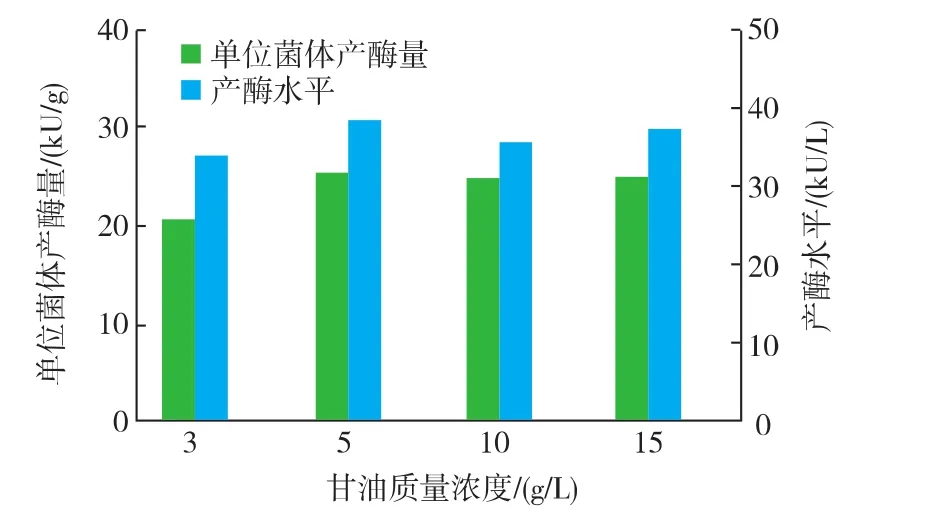
图3 不同质量浓度的甘油对产酶的影响Fig.3 Effectofdifferentglycerolconcentration on diacetyl reductase production
2.1.2 氮源对菌体生长及产酶的影响 无机氮源相比于有机氮源更易于被大肠杆菌所利用,促进菌体的生长和产酶。但是以无机氮源为惟一氮源时菌体的生长缓慢[6-7],因此在含有机氮源培养基(酵母浸膏5 g/L、鱼粉蛋白胨5 g/L)的基础上,研究无机氮源(NH4)2SO4和 NH4Cl(各 1.5 g/L)对菌体的生长及产酶的作用,结果见表2。
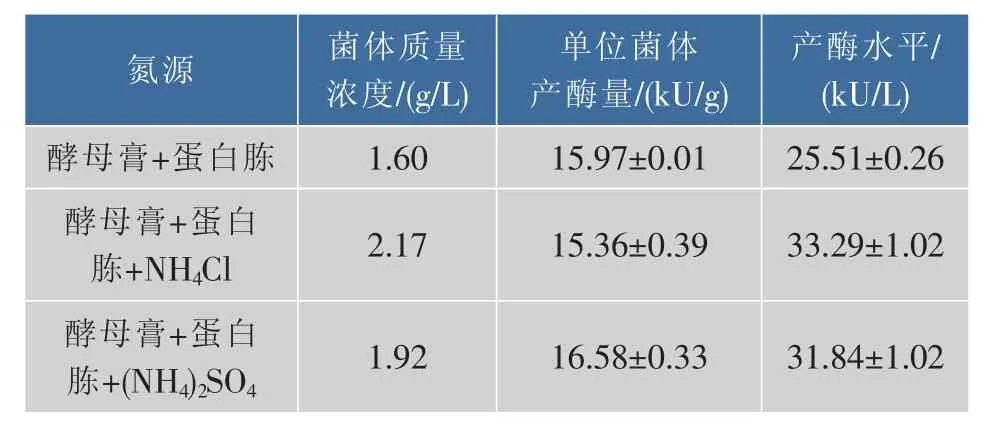
表2 不同无机氮源对菌体生长及产酶的影响Table 2 Effect of inorganic nitrogen sources on cell growth and diacetyl reductase production
表2显示,无机氮源添加后,菌体生长和产酶均有提高,菌体产量由1.60 g/L提高至2.17、1.92 g/L,产酶水平由 25.51 kU/L提高至 33.29、31.84 kU/L,但单位菌体产酶量无明显变化。由此可知,(NH4)2SO4和NH4Cl的添加可以明显地促进大肠杆菌的生长和产酶,可以作为有机氮源的必要补充。与 NH4Cl相比,添加(NH4)2SO4后单位菌体产酶量略微提高,由于重组双乙酰还原酶是胞内酶,单位菌体产酶量的提高对于降低生物催化反应的催化剂用量非常重要,因此最终选择(NH4)2SO4为无机氮源。进一步研究3种有机氮源牛肉膏、酵母浸膏、鱼粉蛋白胨及其组合的影响,结果见表3。
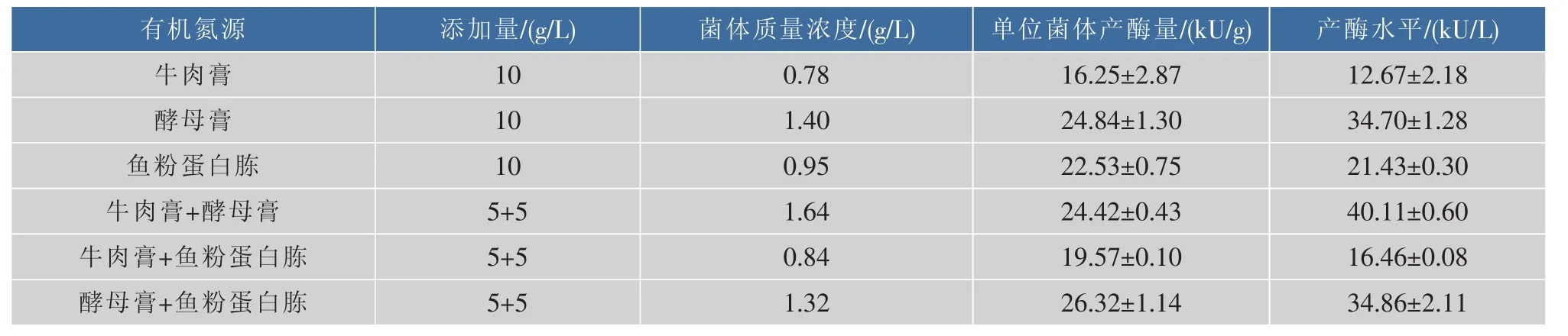
表3 不同有机氮源对菌体生长及产酶的影响Table 3 Effect of organic nitrogen sources on cell growth and diacetyl reductase production
由表3可知,添加单一有机氮源牛肉膏和鱼粉蛋白胨及这两种氮源组合均不利于菌体生长,菌体质量浓度均小于1.0 g/L,而酵母浸膏可明显促进大肠杆菌菌体生长及产双乙酰还原酶,在仅添加酵母浸膏时,菌体质量浓度和单位菌体产酶量分别为1.40 g/L和24.84 kU/g。进一步将酵母浸膏分别与牛肉膏和鱼粉蛋白胨进行组合,在酵母浸膏与鱼粉蛋白胨各为5 g/L时,单位菌体产酶量最高(26.32 kU/g),考虑到双乙酰还原酶是胞内酶,选择酵母浸膏与鱼粉蛋白胨的组合单位菌体产酶量更高,且工业级鱼粉蛋白胨的价格低于牛肉膏,因此最终确定有机氮源为酵母浸膏和鱼粉蛋白胨。另外,通过SDSPAGE观察重组蛋白在不同有机氮源中的可溶性表达情况,见图4。

图4 不同有机氮源对重组蛋白可溶性表达的影响Fig.4 SDS-PAGE analysis of recombinant enzyme expressed in different nitrogen sources
图4显示,不同有机氮源对重组蛋白的可溶性表达没有影响,因此最终确定酵母浸膏与鱼粉蛋白胨的组合作为发酵培养基的有机氮源。参照LB培养基中有机氮源的总质量浓度为15g/L(胰蛋白胨10 g/L,酵母提取物5 g/L),在控制总氮源质量浓度为15 g/L下,进一步研究酵母浸膏与鱼粉蛋白胨的不同比例对菌体生长及产酶的影响,结果见图5。可知,当酵母浸膏与鱼粉蛋白胨的比例为2∶1时,单位菌体产酶量及产酶水平均为最高,因此确定酵母浸膏10 g/L、鱼粉蛋白胨5 g/L作为最佳有机氮源添加量。
2.1.3 无机盐对菌体生长及产酶的影响 在确定碳源及氮源的种类和添加量后,使用正交方法对无机盐种类及质量浓度进行了优化。无机盐对微生物有非常重要的生理功能,例如:渗透压的维持、酶的激活剂、pH的稳定、细胞组成成分等。研究了4种重组大肠杆菌发酵产酶中较常用的无机盐(柠檬酸钠、KH2PO4、MgSO4·7H2O、NaCl)对菌体生长及产双乙酰还原酶的影响,以产酶水平为考察指标,正交实验设计与结果见表4。

图5 酵母浸膏与鱼粉蛋白胨比例对产酶的影响Fig.5 Effect of ratio between yeast extract and peptone on diacetyl reductase production

表4 无机盐优化正交实验设计与结果Table 4 Design and results of orthogonal experiment for optimization of inorganic salts
从正交实验结果看,柠檬酸钠对产酶的影响最显著(R 值为 15.00),其次为 NaCl(R 值为 3.42),MgSO4·7H2O和KH2PO4对产酶的影响最小。柠檬酸是TCA循环的关键物质,因此推测柠檬酸钠的添加可以为细胞生长提供能量,也可促进细胞的产酶[8]。实验结果也显示,细胞干重随柠檬酸钠浓度的增大而增大,产酶水平及单位菌体产酶量也逐渐提高。其中最优组合为 A3B1C1D1,即柠檬酸钠 5 g/L,KH2PO41 g/L,MgSO4·7H2O 0.5 g/L,NaCl 2 g/L。
2.1.4 不同培养基中菌体生长及产酶比较 经过优化,确定了最优发酵培养基的组成:甘油5 g/L,酵母浸膏 10 g/L,鱼粉蛋白胨 5 g/L,(NH4)2SO41.5 g/L,柠檬酸钠 5 g/L,KH2PO41 g/L,MgSO4·7H2O 0.5 g/L,NaCl 2 g/L。进一步比较了重组菌在基础培养基、发酵优化培养基、LB培养基中菌体生长及产酶情况,结果见表5。

表5 不同培养基中菌体生长及产酶比较Table 5 Comparison ofcellgrowth and enzyme production in different medium
表5显示,与基础培养基和LB培养基相比,发酵相同时间优化培养基中菌体生长及产酶均得到了提高,菌体干重2.43 g/L,单位菌体产酶量达13.84 kU/g,产酶水平达33.65 kU/L。虽然单位菌体产酶量的数值低于氮源优化的结果,但是产酶水平相当,主要是由于批次间的操作差异所致。采用该优化的国产培养基后,单位菌体产酶量和产酶水平分别为LB进口培养基的1.16和1.71倍,是基础培养基的2.04和4.23倍。
2.2 诱导条件的优化
2.2.1 诱导温度的优化 在25、30、37℃三个诱导温度下对重组大肠杆菌产双乙酰还原酶的表达进行了优化,结果见图6。37℃下单位菌体产酶量与产酶水平均最高。通过SDS-PAGE观察三个温度下重组蛋白的可溶性表达情况,结果见图7。蛋白质的可溶性表达都较好。由于37℃下发酵时间短,产酶量高,因此最终选定37℃为最适诱导温度。

图6 诱导温度的优化Fig.6 Optimization of inducing temperature
2.2.2 诱导剂IPTG浓度的优化 对4种IPTG浓度 0.1、0.3、0.5、1.0 mmol/L 进行了优化,结果见图8。
结果显示,高浓度的IPTG对菌体产双乙酰还原酶不利,当浓度为0.1 mmol/L时,产酶水平最高(40.29 kU/L),但随着IPTG浓度的逐渐增加,菌体生长受到抑制且产酶水平有所降低。考虑到发酵成本的经济性,最终确定最佳诱导剂浓度为0.1 mmol/L。

图7 不同诱导温度下蛋白质表达情况Fig.7 SDS-PAGEanalysisofrecombinantenzyme expressed under different inducing temperatures

图8 IPTG浓度的优化Fig.8 Optimization of IPTG concentration
2.3 重组大肠杆菌在3 L发酵罐中的发酵培养
发酵培养基及诱导条件优化结束后,在3 L发酵罐上进行重组大肠杆菌产双乙酰还原酶的验证。发酵罐的装液量为1 L,将过夜培养的种子液(OD600=2.16)按体积分数5%接种至发酵罐,37℃下培养。当菌体生长到OD600=3.09(约3 h)时,加入IPTG(终浓度0.1 mmol/L)进行诱导培养。培养过程中,控制溶氧水平在10%~30%之间,pH在7.0左右。在培养过程中通过流加碳源及氮源来保证菌体生长和产酶所需的营养,补加碳源体积分数50%、甘油约20 mL,且加IPTG诱导后即停止。以恒定的速度补加氮源(酵母浸膏30 g/L、鱼粉蛋白胨15 g/L、(NH4)2SO44.5g/L),直至发酵结束。定时取样测定OD600及酶产量(kU/L),结果见图 9。

图9 发酵罐中菌体生长和产酶曲线Fig.9 Cell growth and diacetyl reductase production in the fermenter
图9显示,培养8 h时菌体生长进入稳定期,此时酶活最高,单位菌体产酶量达14.09 kU/g,产酶水平达64.62 kU/L,均高于摇瓶水平。继续延长培养时间后菌体生长缓慢,产酶水平不再继续提高。目前,尚无关于重组大肠杆菌产双乙酰还原酶的培养基及发酵条件优化的报道。作者采用国产培养基替换进口培养基后,仍然可达到比进口培养基更高的酶产量,降低了重组双乙酰还原酶的制备成本。
3 结语
经过优化培养基各组分后,确定重组大肠杆菌产双乙酰还原酶的最适发酵培养基组分为:甘油5 g/L,酵母浸膏 10 g/L,鱼粉蛋白胨 5 g/L,(NH4)2SO41.5 g/L,柠檬酸钠 5 g/L,KH2PO41 g/L,MgSO4·7H2O 0.5 g/L,NaCl 2 g/L;最适诱导温度为 37℃,IPTG 浓度为0.1 mmol/L。在此条件下进行摇瓶发酵,单位菌体产酶量和产酶水平分别为LB进口培养基的1.16和1.71倍,基础培养基的2.04和4.23倍。并在3 L发酵罐对最优发酵培养条件进行了验证。本研究为制备可用于不对称还原法合成光学纯2,3-丁二醇的双乙酰还原酶奠定了基础。
[1]FLORA T,PENKA P,KALOYAN P.2,3-Butanediol production from starch by engineered Klebsiella pneumonia G31-A[J].Applied Microbiology and Biotechnology,2014,98:2441-2451.
[2]SHEN Mengqiu,JI Xiaojun,NIE Zhikui,et al.Biotechnology production of 2,3-butanediol stereoisomers:synthetic mechanism and realized methods[J].Chinese Journal of Catalysis,2013,34:351-360.(in Chinese)
[3]JI X J,HUANG H,OUYANG P K.Microbial 2,3-butanediol production:a state-of-the-art review[J].Biotechnology Advances,2011,29:351-364.
[4]LI L X,WANG Y,ZHANG L J,et al.Biocatalytic production of (2S,3S)-2,3-butanediol from diacetyl using whole cells of engineered Escherichia coli[J].Bioresource Technology,2012,115:111-116.
[5]WANG Z,SONG Q Q,YU M L,et al.Characterization of a stereospecific acetoin (diacetyl) reductase from Rhodococcus erythropolis WZ010 and itsapplication forthe synthesis of(2S,3S)-2,3-butanediol[J].Applied Microbiology and Biotechnology,2014,98:641-650.
[6]CHENG Zhijing,DENG Xu,LU Yinghua,et al.Optimization of recombinant Escherichia coli fermentation medium affecting β1-3,1-4-glucanase production[J].Industrial Microbiology,2006,36:26-30.(in Chinese)
[7]YANG Hailin,WANG Changcheng,ZHANG Ling,et al.Optimization of culture conditions for production of cholesterol oxidase using recombinant E.coli[J].Journal of Food Science and Biotechnology,2009,28:670-674.(in Chinese)
[8]WANG Q F,HOU Y H,XU Z,et al.Optimization of cold-active protease production by the psychrophilic bacterium Colwellia sp.NJ341 with response surface methodology[J].Bioresource Technology,2008,99:1926-1931.
Optimization of Fermentation Conditions for Production of Diacetyl Reductase Using Recombinant Escherichia coli
BIAN Yaqian, XU Guochao, NI Ye*
(Key Laboratory of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China)
Optically pure 2,3-butanediol is one of the important building blocks.Bioreduction of diacetyl using diacetyl reductase is an environmentally friendly method for chiral 2,3-butanediol production.The medium components and induction conditions of diacetyl reductase produced by recombinant Escherichia coli were optimized in flasks.The optimal medium composition for the production of diacetyl reductase was listed as follows:glycerol 5 g/L,yeast extract 10 g/L,peptone 5 g/L,(NH4)2SO41.5 g/L,sodium citrate 5 g/L,KH2PO41 g/L,MgSO4·7H2O 0.5 g/L and NaCl 2 g/L.The optimal induction conditions were listed as follows:37 ℃ and 0.1 mmol/L IPTG.After induced for 6 h under the optimized conditions,the enzyme activities reached to 13.84 kU/g dry cell weight and 33.65 kU/L,which were 2.04 and 4.23 folds of those in basic medium,1.16 and 1.71 folds ofthose in LB medium.In a 3 L fermenter,under the optimized conditions,the maximum enzyme activities achieved at 14.09 kU/g and 64.62 kU/L after cultured for 8 h,which were both higher than those in flasks.This study provides useful guidance on the highly efficient preparation of diacetyl reductase by recombinant Escherichia coli for the preparation of chiral 2,3-butanediol.
recombinantEscherichia coli,diacetylreductase,medium optimization,induction condition
Q 93
A
1673—1689(2017)09—0944—07
2015-03-25
国家自然科学基金项目(21276112);国家973计划项目(2011CB710800)。
*通信作者:倪 晔(1975—),女,江苏无锡人,工学博士,教授,博士研究生导师,主要从事生物催化和酶工程方面研究。
E-mail:yni@jiangnan.edu.cn
边雅倩,许国超,倪晔.重组大肠杆菌产双乙酰还原酶的发酵条件优化[J].食品与生物技术学报,2017,36(09):944-950.
