理性设计定点突变提高Streptomyces kathirae SC-1酪氨酸酶热稳定性
2017-11-01饶志明杨套伟满在伟徐美娟
郭 静 , 饶志明 *, 杨套伟 , 满在伟 , 张 显 , 徐美娟 , 李 星
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122;2.江南大学 生物工程学院,江苏 无锡214122)
理性设计定点突变提高Streptomyces kathirae SC-1酪氨酸酶热稳定性
郭 静1,2, 饶志明*1,2, 杨套伟1,2, 满在伟1,2, 张 显1,2, 徐美娟1,2, 李 星1,2
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122;2.江南大学 生物工程学院,江苏 无锡214122)
利用SWISS-MODEL在线服务器以栗色浑圆链霉菌 (Streptomyces castaneoglobisporus)酪氨酸酶(PDB登录号:2AHL)为模板对S.kathirae酪氨酸酶的3-D结构进行同源模拟。使用在线预测软件PoPMuSiC-2.1计算酪氨酸酶每个突变氨基酸的去折叠自由能变化(ΔΔG)来辅助设计提高酪氨酸酶的稳定性,利用定点突变构建突变体,并且在大肠杆菌中对野生型酪氨酸酶及突变体进行表达,最终获得了两个热稳定性提高的突变体R95Y、G123W。在此基础上进行复合突变,获得了一个热稳定性显著提高的突变体R95Y/G123W。该突变体在60℃的半衰期提高了2.43倍,最适反应温度由45℃提高到50℃,本研究所用的基于蛋白质结构的理性设计提高稳定性的策略也可以应用于其他工业酶类,显示了良好的应用前景。
酪氨酸酶;氢键;定点突变;热稳定性;理性设计;POPMuSiC
酪氨酸酶 (EC 1.14.18.1)是一种典型的3型含双铜离子的金属酶[1],是一种重要的双功能酶,能催化一元酚生成二元酚 (单酚酶活性);催化二元酚生成相应的醌(二元酚酶活性),醌在非酶催化的氧化还原反应中最终生成黑色素[2-3]。酪氨酸酶广泛的存在于动植物及微生物中[4-8],而不同来源的酪氨酸酶的基因结构也有所不同[9],其中链霉菌酪氨酸酶的表达依赖于melC操纵子,melC操纵子包含两个基因:melC1编码酪氨酸酶金属伴侣,作用是帮助酪氨酸酶原成熟、转运铜离子及将成熟的酪氨酸酶分泌至细胞外[10-11];melC2编码酪氨酸酶。
酪氨酸酶作为一种重要的生物酶,被广泛的应用于合成左旋多巴、黑色素、R-亚砜,去除水污染中的酚类化合物以及作为高效的生物传感器[12]。通常酶类在高温下有较高的酶活,而在低温下较稳定,这将不利于获得较高的催化效率,因此,高活性及稳定性的酶将作为工业应用的首选。目前有两种方法获得催化性能优良的工业酶:在极端环境筛选新酶的生产菌株,但是这种方法费时费力,效率低下;另一种方法是通过蛋白质工程改良现有的酶类,这种方法效率高,节省时间,收效明显。目前蛋白质工程与以计算机模拟蛋白质模型为基础的理性设计相结合,已经在很多工业酶类上得到应用,完善了蛋白质工程,使这种方法更加合理、高效[13-15]。蛋白质由氨基酸组成,而氨基酸通过氢键、疏水键、盐键、范德华力等作用力折叠构成蛋白质的高级结构,通常使用蛋白质的去折叠自由能(ΔG)来表征蛋白热动力学稳定性,蛋白质的去折叠自由能越高,破坏蛋白质高级结构所需的能量越多,蛋白质越稳定,而蛋白质的去折叠自由能越低,破坏蛋白质三级结构所需的能量越少,蛋白质越不稳定。POPMuSiC (http://dezyme.com/)在线服务器通过基于突变氨基酸溶剂可及性的线性组合系数,预测出每个突变氨基酸对蛋白质去折叠自由能的影响,进而找到那些对蛋白质稳定性起关键作用的氨基酸,这种方法预测蛋白质稳定性变化十分迅速,可以在1 min之内预测出所有氨基酸突变点的自由能变化,并给出一份突变氨基酸自由能变化的列表,方便选择那些有利的突变点[16]。目前,POPMuSiC已被广泛的应用于提高酶稳定性研究。例如Zhang等利用POPMuSiC计算自由能变化,获得了半衰期提高9.6倍的脂酶突变体[17];而刘龙等通过POPMuSiC计算自由能变化,在碱性淀粉酶中引入了3对二硫键。使突变体在高温下的半衰期提高了6倍,同时使其最适温度提高了5℃[18]。
Streptomyces kathirae SC-1是作者所在实验室前期筛选获得的黑色素高产菌株[19],在发酵产黑色素的过程中,我们发现酪氨酸酶的稳定性差,这将限制黑色素的产量,因此,作者以在线软件预测酪氨酸酶稳定性为基础,采用定点突变技术,获得热稳定性提高的酪氨酸酶突变体。
1 材料与方法
1.1 菌株、质粒和培养基
链霉菌S.kathirae SC-1:作者所在实验室筛选获得的黑色素高产菌株,目前保藏于中国典型培养物保藏中心,保藏编号为M2012432;大肠杆菌E.coli JM109和 E.coli BL21:美国Novagen公司;重组质粒pET-melC1NC2:作者所在实验室前期构建和保存,该质粒共表达酪氨酸酶金属伴侣及酪氨酸酶,酪氨酸酶金属伴侣不含组氨酸标签,酪氨酸酶含组氨酸标签。
LB 培养基 (g/L):Tryptone 10、Yeast Extract 5、NaCl 10、琼脂 20(固体培养基添加)。
1.2 工具酶、引物和试剂
限制性内切酶DpnI、Prime star HS DNA聚合酶、蛋白质Marker:大连Takara公司;SanPrep柱式质粒DNA小量抽提试剂盒、SanPrep柱式DNA胶回收试剂盒:上海生物工程有限公司;其他试剂均为国药有限公司;本研究所用PCR引物均由上海生物工程有限公司合成,见表1。

表1 PCR扩增引物Table 1 Primers for PCR amplification
1.3 主要仪器
核酸电泳系统:北京六一厂;UVP凝胶丞相仪:英国UVP有限公司;大型冷冻离心机3K-15,小型离心机1-14:德国Sigma公司;VC130超声破碎仪:美国SONICS公司;紫外分光光度仪UV-2000:尤尼科(上海)仪器有限公司;隔水式恒温培养箱,立式压力蒸汽灭菌锅:上海博讯实业有限公司;AKTA蛋白质纯化系统:美国GE公司医疗集团。
1.4 同源建模
将S.kathirae酪氨酸酶蛋白序列提交至SWISS-MODEL进行同源建模,同源搜索对比表明,该酪氨酸酶与S.castaneoglobisporus的酪氨酸酶(PDB 登录号:2AHL)同源性最高(84%),以该酪氨酸酶为模板进行同源建模。
1.5 突变位点的选择
将S.kathirae酪氨酸酶3-D结构提交至POPMuSiC在线服务器,预测计算酪氨酸酶每个突变氨基酸的去折叠自由能变化(ΔΔG),选择去折叠自由能变化显著的氨基酸作为突变位点。
1.6 定点突变及构建重组菌株
使用PCR定点突变法即DpnI法进行定点突变[20]。以作者保存的pET-melC1NC2质粒为模板,以相应突变位点上下游引物为引物进行PCR反应(注意模板质粒只能以从E.coli甲基化阳性的菌株中提取)。PCR反应条件为:97℃ 5 min,之后,97℃ 45 s,67 ℃ 45 s,72 ℃ 10 min,共 30 个循环,PCR 产物使用DpnI限制性内切酶消化2 h,回收后直接转化E.coli JM109,抗性平板挑选转化子,将阳性转化子送至上海生物工程有限公司进行测序,将测序正确的质粒转入E.coli BL21中。复合突变的操作步骤同上,将PCR质粒模板替换成其中的一个突变质粒即可。
1.7 酪氨酸酶基因在E.coli BL21(DE3)中的表达
将重组菌株接种于含有卡那霉素 (50 μg/mL)的LB培养基中,37℃、160 r/min振荡培养12 h,按照2%的接种体积分数转接于50 mL的抗性LB培养基中,37℃、160 r/min振荡培养至OD600为0.6~0.8时,添加IPTG至其终浓度为1.0 mmol/L,16℃诱导培养10 h。
1.8 重组酪氨酸酶的纯化
重组酪氨酸酶的纯化均在4℃的环境下进行。将方法1.6所述发酵液10 000 r/min离心10 min去除发酵液,将菌体用上样缓冲液 (50 mmol/L Tris-HCl,500 mmol/L NaCl,80 mmol/L 咪唑,pH 8.0)悬浮,将菌液置于冰浴中并用超声波细胞破碎仪破碎细胞,10 000 r/min离心30 min,所得上清液即为粗酶液。将粗酶液上样到Ni-NTA亲和层析柱(美国通用公司医疗集团),用洗脱缓冲液(50 mmol/L Tris-HCl,500 mmol/L NaCl,500 mmol/L 咪唑,15 μmol/L CuSO4,pH 8.0)洗脱带有组氨酸标记的目的蛋白质,将蛋白液保存于-20℃备用。采用Broadford[21]法测定蛋白质质量。
1.9 酪氨酸酶的酶活测定方法
取适量酶液与5 mL酶活反应液混合试管中,30℃反应10 min,反应结束后在475 nm下测吸光度。 (酶活反应液配制:10 mmol/LL-Dopa,15 μmol/L硫酸铜,0.05 mol/L磷酸盐缓冲液,pH 6.2)
酶活定义:在此条件下,每分钟催化生成1 μmol/L多巴醌的酶量定义为一个酶活单位(U)。多巴醌的测量在475 nm的吸光度下进行。
1.10 突变酪氨酸酶的酶学性质
1.10.1 最适pH 在反应温度为30℃,将酪氨酸酶置于不同的缓冲体系中:柠檬酸缓冲液 (pH 3.0~6.0)、磷酸盐缓冲液(pH 6.0~8.0)、Tris-HCl缓冲液(pH 8.0~9.0),测定酪氨酸酶酶活。酶活最高时作为100%。
1.10.2 pH稳定性 在4℃的条件下,将酪氨酸酶置于不同的缓冲体系中保存1 h,测定酪氨酸酶酶活。柠檬酸缓冲液(pH 3.0~6.0)、磷酸盐缓冲液(pH 6.0~8.0)、Tris-HCl缓冲液(pH 8.0~9.0),0 h 酶活作为100%。
1.10.3 最适温度 在反应pH为6.2的条件下,将反应体系分别置于25~60℃下进行反应,测定酪氨酸酶酶活。酶活最高时作为100%。
1.10.4 半衰期t1/2在pH 7.5的条件下,将酪氨酸酶置于60℃的温度中,在不同时间测定酪氨酸酶酶活,酪氨酸酶酶活为未处理时酶活50%的时间即为酪氨酸酶的半衰期。
1.10.5 耐热性T50将酪氨酸酶置于50~70℃下处理30 min,冰浴10 min,最适反应条件下测定酪氨酸酶酶活,酪氨酸酶酶活为未处理时的酶活50%的温度即为酪氨酸酶的T50值。
1.10.6 酪氨酸酶动力学研究 在最适反应条件下,将酪氨酸酶酶液与底物L-Dopa反应,测酪氨酸酶酶活,根据米氏方程,使用Lineweaver-Burk双倒数作图法,计算出酪氨酸酶动力学常数。
1.11 突变酪氨酸酶三级结构模拟与热稳定性机理研究
将酪氨酸酶突变后的蛋白序列提交至SWISSMODEL网站进行同源建模,以S.castaneoglobisporus的酪氨酸酶为模板进行同源建模,并且利用蛋白质模型对酪氨酸酶热稳定性提高的机理进行探究。
2 结果与分析
2.1 突变位点的选择将S.kathirae酪氨酸
酶晶体结构提交至POPMuSiC在线服务器预测计算酪氨酸酶每个突变氨基酸的去折叠自由能变化 (ΔΔG),最终选择Arg95Tyr (ΔΔG:-2.61 kcal/mol)、Gly123Trp (ΔΔG:-5.55 kcal/mol)作为突变位点。
2.2 突变菌株的构建
将酪氨酸酶基因序列中编码Arg95的密码子CGC突变为编码Tyr的密码子TAC;编码Gly123的密码子GGC突变为编码Trp的密码子TGG,PCR扩增,DpnI消化模板质粒,经回收后直接转化E.coli JM109,测序后显示突变结果正确,将正确突变的质粒转入E.coli BL21。
2.3 重组酪氨酸酶的表达与纯化
IPTG诱导表达重组蛋白10 h后,离心收集重组菌菌体,细胞破碎后,破碎上清液使用Ni NTA分离纯化。SDS-PAGE电泳结果显示,纯化后的酶蛋白呈现单一条带 ,见图1。大小为30 000左右,野生型酪氨酸酶比酶活为1 182.12 U/mg;Arg95Tyr比酶活为1 098.59 U/mg;Gly123Trp比酶活为 1 139.41 U/mg;Arg95Tyr/Gly123Trp 比酶活为 1 113.74 U/mg。

图1 表达上清液及纯化蛋白质的SDS-PAGE分析Fig.1 SDS-PAGE analysis of expressed supernatant and purified enzyme of recombinant strain
2.4 重组酪氨酸酶酶学性质
2.4.1 酪氨酸酶的最适pH及pH稳定性 以LDopa为底物测定酪氨酸酶及其突变体的最适pH及pH稳定性。结果表明,相对于野生型酪氨酸酶,每个突变酶的最适pH及pH稳定性未发生显著变化。
2.4.2 酪氨酸酶的最适温度、t1/2及T50分别测定酪氨酸酶及其突变体的最适温度,结果见图2。野生型酪氨酸酶的最适温度为45℃,Arg95Tyr、Gly123Trp这两个突变体虽然最适温度没有发生变化,但是在高温下的相对酶活提高显著,而组合突变后的突变体展现良好的协同效应,最适温度提高了5℃。

图2 野生型酪氨酸酶及其突变体的最适温度Fig.2 Optimal temperature of tyrosinase and its mutants
酪氨酸酶的热稳定性采用t1/2及T50来进行表征,结果见表2,野生型酪氨酸酶在60℃的半衰期为 7.2 min,Arg95Tyr、Gly123Trp 在 60 ℃的半衰期分别为9.7、13.1 min,较野生型酪氨酸酶的半衰期分别提高了1.35和1.82倍,而组合突变体Arg95Tyr/Gly123T的半衰期较野生型酪氨酸酶提高了2.43倍,有了显著提高。野生型酪氨酸酶的T50为59 ℃,Arg95Tyr、Gly123Trp 及 Arg95Tyr/Gly123T 突变体的T50较野生型酪氨酸酶的T50,分别提高了1、2、4℃,较好地提高了酪氨酸酶的耐热性。
2.4.3 酪氨酸酶的动力学常数 以L-Dopa为底物测定酪氨酸酶及其突变体的动力学常数,结果见表3。相对于野生型酪氨酸酶,3个突变体的Km与kcat值变化不大,没有对酶的催化效率造成严重影响。

表2 野生型酪氨酸酶及其突变体在60℃下的半衰期及T50Table 2 Half-lives (60℃)and T50of tyrosinase and its mutants
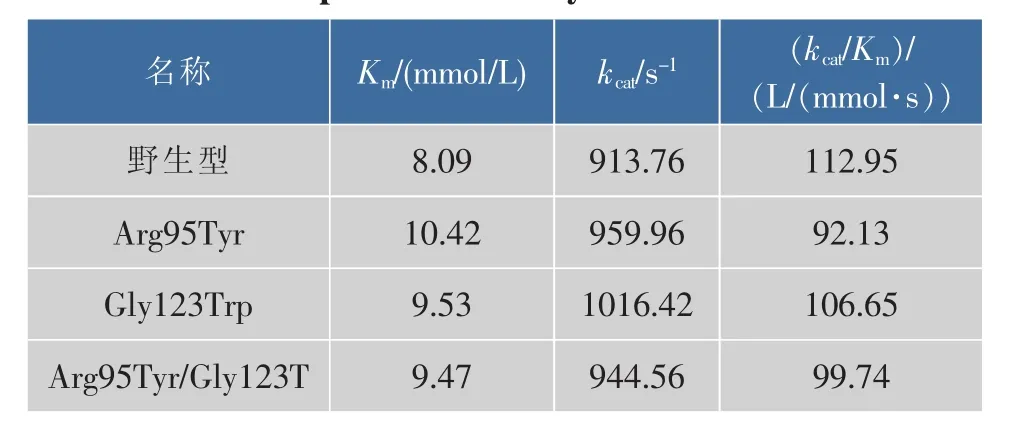
表3 野生型酪氨酸酶及其突变体的动力学参数Table 3 Kinetic parameters of tyrosinase and its mutants
2.5 突变酪氨酸酶的结构模拟与突变位点分析
为研究酪氨酸酶热稳定性提高的机制,分别对野生型酪氨酸酶及Arg95Tyr/Gly123T进行同源建模。野生型酪氨酸酶3-D结构见图3,酪氨酸酶由7个α螺旋和2个β折叠构成,2个β折叠分别位于N-端和C-端,这9个二级结构由8段无规则卷曲连接, 其中 α2、α3、α6、α7 上的 6 个组氨酸形成高级结构结合两个铜离子构成酪氨酸酶的活性中心。95位与123位氨基酸位于酪氨酸酶结构表面,并且远离酶的活性中心,在野生型酪氨酸酶中,Arg95和Gly123没有与周围的氨基酸相互作用,当Arg95和Gly123突变成Tyr95和Trp123时 ,见图4。由于氨基酸结构的变化Tyr95上的氮原子与Thr93上的氧原子足够接近,进而形成了一个新的氢键,而Trp123上的氮原子与Ala121上的氧原子同时也形成了一个新的氢键,两个增加的氢键可能是酪氨酸酶稳定性提高的原因。氢键对蛋白质的稳定起重要的作用,在维持蛋白质的二级、三级结构中起到至关重要的作用。在合理的位置引入氢键将极大地改良蛋白质的耐热性。作者通过利用在线预测软件PoPMuSiC-2.1来辅助设计提高酪氨酸酶的稳定性,根据预测得到的突变位点进行定点突变,获得了稳定性提高的突变体。在进行热稳定性提高的机理分析时发现,定点突变后的酪氨酸酶增加了两个新的氢键,这可能是酪氨酸酶稳定性提高的重要因素,同时突变位点远离活性中心,没有造成活性中心的结构变化,对酪氨酸酶的催化活性影响较小。重组酪氨酸酶在60℃的稳定性提高了2倍以上。

图3 野生型酪氨酸酶的3-D结构Fig.3 Three-dimensional structure model of tyrosinase

图4 酪氨酸酶突变体的3-D结构变化Fig.4 Change in structure (hydrogen bond) of tyrosinase after mutation
3 结 语
利用在线预测软件PoPMuSiC计算酪氨酸酶每个突变氨基酸的去折叠自由能变化(ΔΔG)来辅助设计提高酪氨酸酶的稳定性。对原始酶和突变体的蛋白质结构预测分析可知,突变前后酪氨酸酶的蛋白结构及其酶活性中心基本没有发生改变。95位氨基酸和123位氨基酸突变并没有影响酪氨酸酶的酶活性中心,但是在突变位点引入了两个新的氢键,而氢键的增加使突变体在60℃的半衰期提高了2.43倍,最适反应温度由45℃提高到50℃,本研究结合蛋白质工程与以计算机模拟为基础的理性设计,完善了传统蛋白质工程的不足,展示了良好的应用前景。以计算机模拟为基础的理性设计也为其他工业用酶的稳定性改造提供了思路与方法。
[1]GERDEMANN C,EICKEN C,KREBS B.The crystal stucture of catechol oxidase:new insight into the fuction of type-3 copper proteins[J].Acc Chem Res,2002,35:183-191.
[2]KOHASHI P Y,KUMAGAI T,MATOBA Y,et al.An efficient method for the overexpression and purification of active tyrosinase from Streptomyces castaneoglobisporus[J].Protein Expr and Purif,2004,34:202-207.
[3]MARINO S M,FOGAL S,BISAGLIA M,et al.Investigation of Streptomyces antibioticus tyrosinase reactivity toward chlorophenols[J].Arch Biochem Biophys,2011,505:67-74.
[4]SAXENA D,BEN D E,MANASHEROB R,et al.A UV Tolerant mutantof Bacillus thuringiensis subsp.kurstaki producing melanin[J].Curr Microbiol,2002,44(1):25-30.
[5]SELINHEIMO E,SALOHEIMO M,AHOLA E,et al.Production and characterization of a secreted,C-terminally processed tyrosinase from the filamentous fungus Trichoderma reesei[J].FEBS J,2006,273(18):4322-4335.
[6]EICKEN C,ZIPPEL F,Büldt-Karentzopoulos K,et al.Biochemical and spectroscopic characterization of catechol oxidase from sweet potatoes(Lpomoea batatas) containing a type-3 dicopper center[J].FEBS lett,1998,436(2):293-299.
[7]LERNER A B,FITZPATRICK T B.CALKINS E,et al.Mammalian tyrosinase:the relationship of copper to enzymatic activity[J].J Biol Chem,1950,187:793-802.
[8]YASUMOTO K,YOKOYAMA K,SHIBATA K,et al.Microphthalmia-associated transcription factor as a regulator for melanocyte-specific transcription of the human tyrosinase gene[J].Mol Cell Biol,1994,14(12):8058-8070.
[9]FAIRHEAD M,THONY M L.Bacterial tyrosinases:old enzymes withnew relevance tobiotechnology[J].N Biotechnol,2012,29(2):184-191.
[10]CHEN L Y,LEU W M,WANG K T,et al.Copper transfer and activation of the Streptomyces apotyrosinase are mediated through a complex formation between apotyrosinase and its trans-activator MelC1[J].J Biol Chem,1992,267:20100-20107.
[11]LEU W M,CHEN L Y,LIAW L L,et al.Secretion of the Streptomyces tyrosinase is mediated through its trans-activator protein,MelC1[J].J Biol Chem,1992,267:20108-20113.
[12]OU Z M,WANG P,WANG H,et al.The process of application research of tyrosinase[J].China Biotechnology,2005:165-169.(in Chinese)
[13]LIU B H,ZHANG J,FANG Z,et al.Enhanced thermostability of keratinase by computational design and empirical mutation[J].J Ind Microbiol Biotechnol,2013,40:697-704.
[14]DENG Z M,YANG H Q,LI J H,et al.Structure-based engineering of alkaline α-amylase from alkaliphilic alkalimonas amylolytica for improved thermostability[J].Appl Microbiol Biotechnol,2014,98:3997-4007.
[15]SILVA I R,JERS C,OTTEN H,et al.Design of thermostable rhamnogalacturonan lyase mutants from Bacillus licheniformis by combination of targeted single point mutations[J].Appl Microbiol Biotechnol,2014,98:4521-4531.
[16]DEHOUCK Y,KWASIGROCH J M,GILUS D,et al.PoPMuSiC 2.1:a web server for the estimation of protein stability changes upon mutation and sequence optimality[J].BMC Bioinformatics,2011,12:151.
[17]ZHANG S B,WU Z L.Identification of amino acid residues responsible for increased thermostability of feruloyl esterase A from Aspergillus niger using the PoPMuSiC algorithm[J].Bioresour Technol,2010,102(2):2093-2096.
[18]LIU L,DENG Z M,YANG H Q,et al.In silico rational design and systems engineering of disulfide bridges in the catalytic domain of an alkaline α-amylase from Alkalimonas amylolytica to improve thermostability[J].Appl Environ Microbiol,2014,80(3):798-807.
Enhancement of the Thermostability of Streptomyces kathirae SC-1 Tyrosinase by Rational Sign and Empirical Mutation
GUO Jing1,2, RAO Zhiming*1,2, YANG Taowei1,2, MAN Zaiwei1,2,ZHANG Xian1,2, XU Meijuan1,2, LI Xing1,2
(1.Key Laboratory of Industrial Biotechnology of Ministry of Education,Jiangnan University,Wuxi 214122,China;2.School of Biotechnology,Jiangnan University,Wuxi 214122,China)
Homology modeling of tyrosinase was performed using the SWISS-MODEL based on the known crystal structure of tyrosinase from S.castaneoglobisporus(PDB No.2AHL).The POPMuSiC algorithm was applied to predict the folding free energy change (ΔΔG)of amino acid substitution.Site-directed mutagenesis was used to construct mutants at Arg95Tyr and Gly123Trp.The mutant and wild-type enzymes were expressed in Escherichia coli (DE3).As compared to the wild-typetyrosinase,all the mutant enzymes showed improved thermal properties.The mutant with combined substitution(Arg95Tyr/Gly123Trp) showed the most pronounced shifts in temperature optima,which was about 5℃upward,and the half-life for thermal inactivation at 60℃was increased by 1.5 times.The structure-based rational design strategies in this study may also provide further insight into the thermostability of other industrial enzymes and suggest further potential industrial applications.
tyrosinase,hydrogen bond,site-directed mutagenesis,rational design,POPMuSiC
Q 812
A
1673—1689(2017)09—0906—06
2015-03-10
国家自然科学基金项目(31300028);国家863计划项目(2015AA021004);国家973计划项目(2012CB725202);江苏高校优势学科建设工程资助项目;111引智计划(111-2-06)和江苏省现代发酵工业协同创新中心项目。
郭 静(1987—),女,辽宁本溪人,工学博士,主要从事酶工程方面的研究。E-mail:guojing05031205@163.com
*通信作者:饶志明(1975—),男,江西临川人,农学博士,教授,博士研究生导师,主要从事工业微生物育种和发酵代谢方面的研究。
E-mail:raozhm@jiangnan.edu.cn
郭静,饶志明,杨套伟,等.理性设计定点突变提高Streptomyces kathirae SC-1酪氨酸酶热稳定性[J].食品与生物技术学报,2017,36(09):906-911.
