生物质色素的微生物合成研究进展
2017-11-01巩继贤王富邦任燕飞李秋瑾张健飞
巩继贤 , 王富邦 , 任燕飞 , 李 政 , 李秋瑾 , 张健飞
(1.天津工业大学 纺织学院,天津 300387;2.天津工业大学 先进纺织复合材料教育部重点实验室,天津300387)
生物质色素的微生物合成研究进展
巩继贤1,2, 王富邦1,2, 任燕飞1,2, 李 政1,2, 李秋瑾1,2, 张健飞1,2
(1.天津工业大学 纺织学院,天津 300387;2.天津工业大学 先进纺织复合材料教育部重点实验室,天津300387)
生物质色素在来源的可持续性方面、在制备过程的环保性方面和所染色纺织品的生态性方面都远优于目前正在使用的合成染料。生物质色素是由生物体合成的色素物质,相比较植物和动物中提取色素,微生物色素在工业化应用方面更具潜力。选择几种重要生物质色素,对其微生物合成制备进行了综述,分析了色素物质生物合成所用前体、介绍了能进行色素合成的微生物种类、阐述了色素的生物合成途径及所用的酶、分析了色素微生物合成的效率和应用现状,并对色素微生物合成的前景进行了展望。
生物质色素;生物合成;生物转化;微生物
微生物合成是利用微生物细胞工厂的作用,在细胞内外酶系的作用下,实现前体物质的转化或通过从头合成制备目标产物的过程。微生物合成从本质上看是一系列生物催化过程[1]。生物技术是21世纪三大核心技术之一,对于国民经济的发展具有巨大的推动作用。微生物转化技术是利用微生物产生的酶或酶系的催化作用,对微生物体内的某些物质进行结构修饰,最终建立在生物催化基础上的新物质加工体系的过程,对发展绿色制备和清洁生产有重要意义[2]。
生物质色素是由生物体合成的色素物质,可由动植物色素的提取和微生物发酵法获得[3]。生物质色素在来源的可持续性方面、在制备过程的环保性方面和所染色纺织品的生态性方面都远优于目前正在使用的合成染料。生物质色素在制备生态纺织品方面具有天然的、独到的优势,将生物质色素对有机棉染色[4],用于内衣等贴身衣物及要求更为严格的婴幼儿服装面料,将具有广阔的应用前景,同时为高端生态纺织品的制备提供了新的契机。在生物质色素的来源中,微生物色素比源于植物和动物中提取色素在工业化应用方面更具潜力[5]。
作者对几种重要生物质色素的微生物合成制备进行综述,阐述色素的生物合成途径及所用的酶、分析了色素微生物合成的效率和应用现状,并对色素微生物合成的前景进行展望。
1 靛蓝
靛蓝类色素是人类最早使用的色素之一。几千年来传统的靛蓝生产,一直是从被统称为“蓝草”的靛蓝植物或产靛蓝植物中提取,如菘蓝、蓼蓝、马蓝、木蓝等[6]。化学合成的靛蓝在1897年问世后,就迅速取代了植物靛蓝(天然靛蓝)的市场地位,现在印染加工中使用的几乎所有靛蓝都是化学合成的。合成靛蓝的生产过程会对劳动者健康带来损害,排放的废水对环境也造成严重的污染[7]。人们开始探索利用微生物生物合成靛蓝,以实现靛蓝合成的清洁生产。
早在1928年研究人员就发现假单胞菌(Pseudomonas indoloxidaes)能够氧化吲哚合成靛蓝[8]。1983年Ensley等发现,吲哚可被双加氧酶转化成3-羟基吲哚(吲哚酚),而3-羟基吲哚在接触空气后被氧化成靛蓝,见图1。由此,初步阐明了靛蓝生物转化的机制[9]。

图1 以吲哚为底物合成靛蓝Fig.1 Synthesis of indigo via indole as substrate
与靛蓝生物转化有关的酶主要是单加氧酶和双加氧酶。有的单加氧酶,通过参与甲苯和1-萘酚的代谢,形成靛蓝,有的单加氧酶,将吲哚催化为3-羟基吲哚,然后二聚化为靛蓝[10]。在靛蓝生物转化中,其催化机制为催化吲哚形成双羟基酚,然后脱水形成吲哚酚,最后在空气中氧化聚合形成靛蓝[11]。
目前已发现多种微生物能够合成靛蓝,如以萘为碳源的Pseudomonas putida菌株PpG7[12]、有能够降解甲苯-二甲苯或甲苯其它衍生物的P.putida菌株mt-2、降解甲苯的P.mendocina菌株KR1、降解苯乙烯的 P.putida 菌株 S12 和 CA-3、以 1,2,3,4-四氢化萘为碳源的Sphingomonas macrogolitabida[13]等。
当前,靛蓝生物转化的研究已经从筛选自然界中能够合成靛蓝的菌株,发展到进行工程菌的构建,并从实验室研究开始进入工业化生产[14]。但是在构建高效工程菌株、优化发酵参数、简化靛蓝提取过程等方面,仍然有待进一步的研究与开发。
植物靛蓝是合成染料问世之前常用的蓝色染料,色泽浓艳,牢度较好。靛蓝的染色机理与还原染料类似。靛蓝的染色是先将不溶于水的靛蓝在碱性溶液中还原成可溶于水的隐色体靛白,使隐色体上染纤维,然后将织物透风氧化,使隐色体变为靛蓝与织物牢固结合[15]。靛蓝的隐色体靛白对棉纤维的吸附等温线符合Freundlich型,即属于多分子层物理吸附模型。
微生物法制备的靛蓝与植物靛蓝及合成靛蓝具有相同的结构,因此染色性能也相同。在工业化生产中使用的靛蓝基本上都是合成靛蓝,植物靛蓝在部分地区的手工染色中仍有应用,尤其是在一些地区的特色旅游纪念品加工中。微生物法制备的靛蓝因为产量极低,目前还不能用于生产。相信随着育种技术和发酵技术的进步,微生物合成靛蓝有望取代植物靛蓝,进而代替合成靛蓝用于纺织品加工。
2 类胡萝卜素
类胡萝卜素(Carotenoid)是由共轭双键构成的一类40碳的碳氢化合物(胡萝卜素,Carotene)及其氧化衍生物(叶黄素,Xanthophyll)的总称。类胡萝卜素目前多被用作食用色素和保健品[16],某些色素,除了作为食品色素外,还是天然抗氧化剂[17],其中β-胡萝卜素、虾青素、番茄红素、玉米黄质、角黄质等是较为常见的类胡萝卜素[18],其化学结构式见图2、图3[19]。
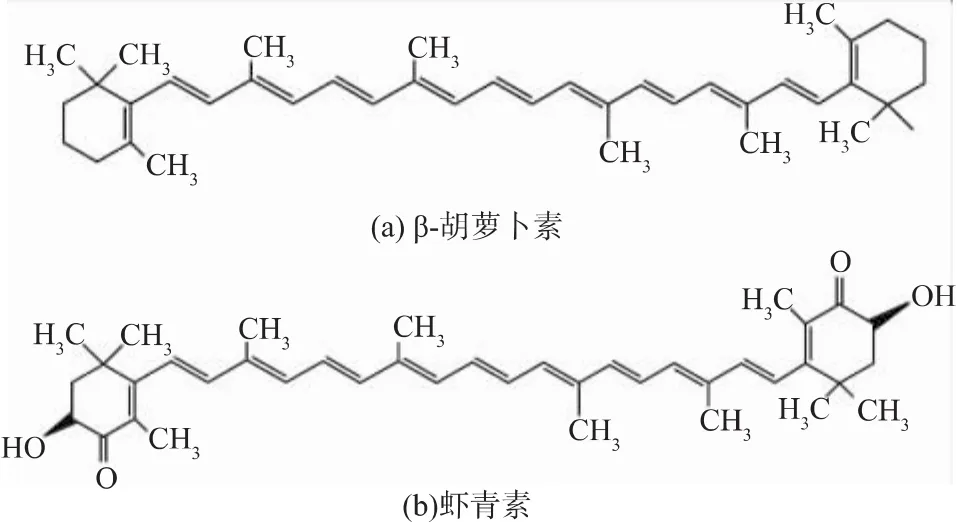
图2 β-胡萝卜素与虾青素的分子结构Fig.2 Molecular structures of β-carotene and axtaxanthin
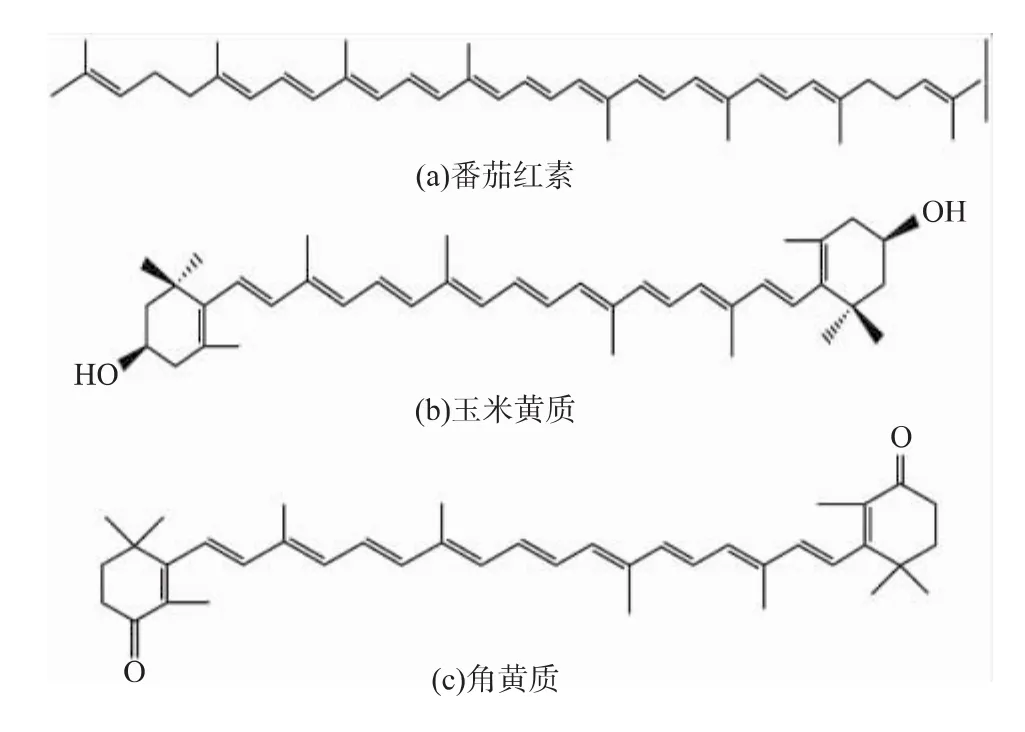
图3 番茄红素、玉米黄质和角黄质的分子结构Fig.3 Molecular structures of lycopene,zeaxanthin and canthaxanthin
利用生物转化技术制备合成类胡萝卜素是获得天然资源型类胡萝卜素的最重要的途径,用于生产类胡萝卜素的微生物主要有霉菌类(如三孢布拉氏霉)、酵母菌(如红酵母)、细菌(如光合细菌)以及微藻(如杜氏藻)[20]。

图4 类胡萝卜素的生物合成途径Fig.4 Biosynthetic pathway of carotenoid
目前,利用生物转化法生产类胡萝卜素基本上都是类异戊二烯途径,且生产过程都是有氧发酵。其生物合成途径见图4[21]。研究表明,不同微生物发酵生产产生的类胡萝卜素含量皆有所不同[22]。其中,单位培养液中三孢布拉氏霉产生的类胡萝卜素的含量最多,光合细菌产生的含量最少。三孢布拉氏霉和杜氏藻生产类胡萝卜素[23]已经实现了工业化生产,虽然红酵母的生产周期较短,但是其产量较低[19]。
由于β-胡萝卜素、虾青素、番茄红素等主要类胡萝卜素均为脂溶性物质,在水中溶解性较差,而且对热和光都不稳定,易氧化。这使得它们在纺织品染整加工中的应用有很大局限性。目前类胡萝卜素在纺织方面的应用还很少。有研究曾用番茄色素对羊毛和丝绸染色,番茄色素染色羊毛上在皂洗前后都是橙色,色牢度是4级;番茄色素染色的蚕丝为黄色,色牢度能达到5级[24]。
如何构建合适的染色加工体系,以实现类胡萝卜素与纺织纤维的牢固结合及类胡萝卜在纺织品上的稳定存在,是将类胡萝卜素成功用于纺织品染整加工的关键。相信随着工业微生物技术的进步和生物分离技术的发展,类胡萝卜素生产技术会更加成熟,成本也会下降,届时类胡萝卜素将会成为极具潜力的纺织品用生物质色素。
3 茶色素
茶色素是在茶的发酵过程中形成的水溶性酚类色素[25]。研究表明,茶色素的主要成分是茶褐素,约占其总量的85%以上。临床研究证实,茶色素亦有抗癌、降血脂等多种药物功效[26]。通常认为茶色素主要包括茶黄素(TFs)、茶红素(TRs)以及茶褐素(TB)等色素成分,其化学结构式见图5[27]。
茶多酚是一种天然的抗氧化剂[28],具有抗癌降血糖等多种药物功效[29-30]。一般认为,茶色素的前体茶多酚在多酚氧化酶(PPO)、过氧化物酶(POD)的催化作用下形成醌类物质[31],继而再经非酶促反应合成茶黄素,茶黄素和茶红素进一步氧化聚合会形成茶褐素[26]。茶色素的相对分子质量较大,结构相对不稳定。其转化途径见图6。

图5 茶黄素、茶红素和茶褐素的分子结构Fig.5 Molecular structures of theaflavin,thearubigins and theabrownin

图6 茶色素的生物合成途径Fig.6 Biosynthetic pathway of tea pigments
具有多酚生物转化能力的真菌有黑曲霉、酵母菌、根霉、产黄青霉以及冠突散囊菌等[32];细菌有枯草芽孢杆菌等。在微生物发酵过程中,茶多酚总量随着发酵时间的延长显著降低,这是由于微生物分泌代谢产生胞外酶,催化茶多酚氧化聚合形成茶色素。多酚的生物转化是在微生物产生的单宁酶的催化作用下完成的[33],单宁酶是一种具有水解催化能力的诱导酶。
在茶多酚与茶色素的生物转化过程中,不同种类的微生物对茶多酚的转化能力有所不同。有研究表明,在液体发酵时,用黑曲霉和酵母菌对普洱茶进行混菌发酵,只需6 d茶多酚的含量就从最初的31.16%减少到5.32%[34],减少的茶多酚转化成了茶色素,在这一转化过程中,黑曲霉起主要作用,酵母菌起次要作用。在黑曲霉、日本根霉和产黄青霉三种真菌对乌龙茶的混菌发酵过程中,经过25 d发酵后,多酚含量下降了45.4%,色素含量增加了34.8%[35],减少的多酚大部分都转化成了色素。
因为含色素较多的红茶和黑茶是经发酵制成的,因此作为色素应用的茶色素属微生物发酵色素。在微生物转化制备的生物质色素中,茶色素是被用于纺织品染色研究较多的色素[36-37]。研究表明,茶色素对蛋白质纤维的染色性能较好,而对纤维素纤维的染色性能较差。茶色素上染羊毛织物后,染色织物的摩擦和皂洗牢度较好,但日晒牢度较差[38]。此外,茶色素能赋予织物良好的防紫外性能和抗菌性能,其中,对大肠杆菌和金黄色葡萄球菌的抑菌效果较好。
为研究对纤维素纤维染整的问题,我们团队以铁观音茶梗为原料,提取天然功能物质作为整理剂,采用氧化缩合法及蛋白质络合法对纺织品进行仿生功能整理,整理后的织物不仅有一定的抗菌和防紫外线功能,而且实现了织物染色,其中氧化缩合法处理的棉织物,其耐水洗和耐摩擦牢度能达4-5级[39]。我们团队以乌龙茶提取液为染料对纯棉织物染色,以小檗碱、可可碱及咖啡碱3种生物碱和酒石酸及柠檬酸两种有机酸为固色剂,分别对染色后织物进行固色处理,染色后织物的摩擦牢度能到4-5级[40]。生物碱和有机酸在茶染色中不仅具有固色效果及一定的拼色效应,而且还可以增强织物的紫外线吸收功能。因此,将茶生物质色素应用于纺织品染色,能实现染色和功能整理的一体化加工,对简化工序和清洁生产具有重要意义。
4 黄酮
黄酮(flavone)是指2个具有酚羟基的芳香环通过中央三碳链连接而成的一系列酚类化合物[41]。类黄酮即黄酮类化合物(flavonoids)是一类广泛存在于植物体内的低分子多酚类物质,是黄酮的衍生物,在植物体内多以游离态或糖苷的形式存在[42]。
天然黄酮类化合物是难溶于水的黄色结晶体,且种类繁多,至少可分为15种,颜色各异,因而为生物质色素的种类增添了几分色彩[43]。由于黄酮具有抗氧化、抗菌、抗衰老等多种功效,因此在食品、医药、化妆品等行业有广泛的应用[44]。其基本骨架结构见图7。烷酮以及查耳酮等物质为原料[45]。在微生物合成黄酮化合物的代谢途径中,苯丙氨酸(Phe)或酪氨酸(Tyr)在苯丙氨酸解氨酶(PAL)或者酪氨酸解氨酶(TAL)的作用下转化为肉桂酸或者香豆酸,肉桂酸在P450羟化酶的作用下形成香豆酸[46]。其经典的生物合成途径见图8[47]。

图7 黄酮的基本骨架结构Fig.7 Basic skeleton structure of flavone
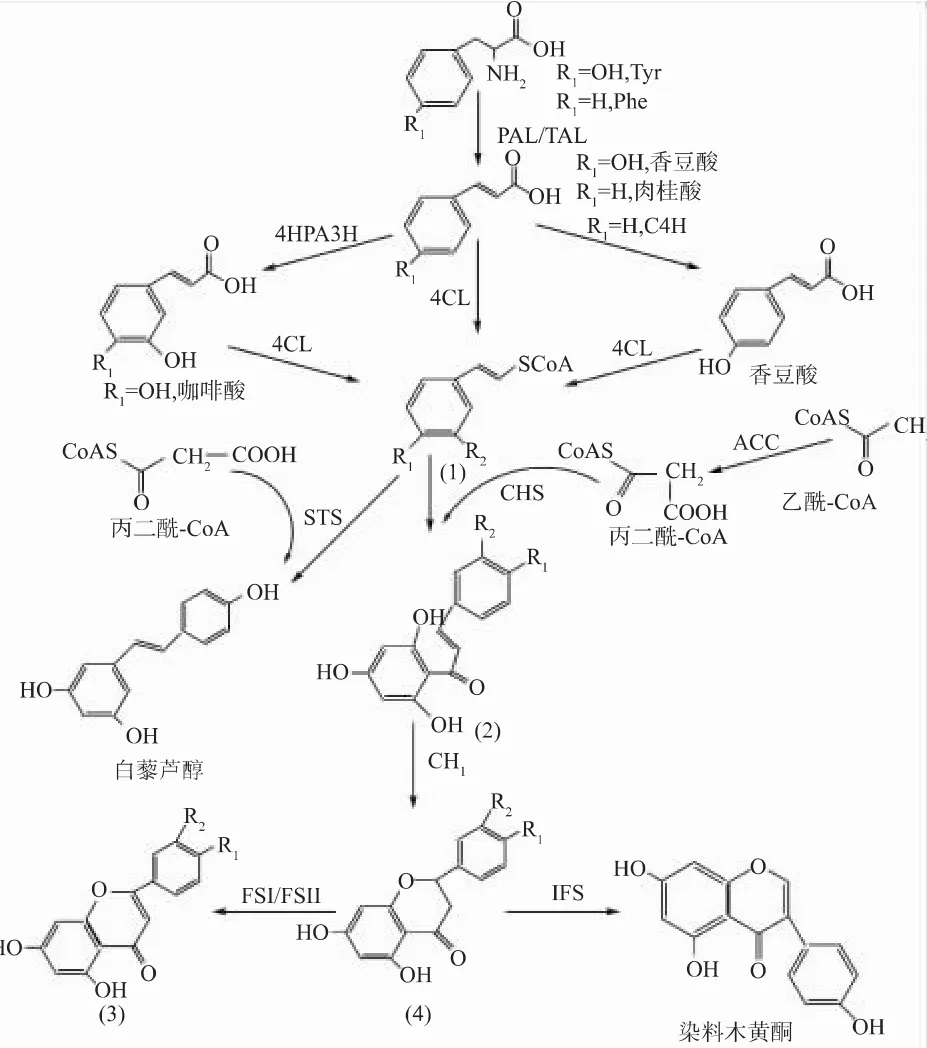
图8 黄酮类化合物的微生物合成途径Fig.8 Microbial synthetic pathway of flavonoids
目前,利用生物转化法合成黄酮类化合物的限制因素在于黄酮骨架结构的合成,黄酮骨架结构无法由可再生原料代谢合成得到,利用微生物法合成黄酮骨架结构需添加昂贵的前体[48],如芳香族氨基酸(苯丙氨酸/酪氨酸)或苯丙素(肉桂酸/香豆酸)。因此微生物法合成黄酮的骨架结构,成为当前研究的重点。如Miyahisa等将香豆酸CoA连接酶(4CL)与苯丙氨酸解氨酶(PAL)以及查尔酮合成酶(CHS)导入到大肠杆菌(E.coli)表达[41],实现了较高含量的黄酮骨架结构。
利用基因工程从某些生物中克隆得到某种基因[49],并分别转入大肠杆菌,从转基因大肠杆菌中提取的酶能催化黄酮前体的转化[46],且具有较高的区域选择性。除原核微生物外,一些真核微生物亦可合成黄酮类化合物,如酵母菌。微生物易于培养,利用发酵技术可进行大规模生产。对黄酮等生物质色素[50-51]以及天然产物的生产具有经济意义和实用价值。
黄酮类色素是一直较重要的生物质色素,以黄、红色调为主,可溶于水。黄酮类染料对纺织品染色的各项牢度都比较好。目前用黄酮类色素对纺织品的染色研究主要集中在植物黄酮和异黄酮方面,微生物黄酮染色研究则鲜有报道。黄酮类色素在植物细胞中以配糖体存在,像杨梅、芦亭、黄岑、红花等均含有这类色素,其基本骨架结构为2-苯基色酮。
有研究者从牡丹花花瓣中提取黄色色素物质用于纺织品染色研究[52],这类色素在结构上属于黄酮类物质。将牡丹花中提取的黄色色素用媒染法对羊毛织物染色,能够染得色泽纯正的黄色,耐洗牢度较好,但摩擦牢度色牢度比较差,日晒牢度更差,仅为1~2级。
桑椹中也含有丰富的黄酮类化合物,如花色素、芦丁、槲皮素等物质。反应型阴离子改性剂和丁二酸对棉织物进行改性处理后[53],用桑葚中提取的花色苷染料进行了染色,染色织物的水洗牢度、汗渍牢度和摩擦牢度能达到3.5级,日晒牢度能达4级。另外,染色后织物还有一点的抗氧化能力,其DPPH自由基清除率大于90%,经 5次标准洗涤后,仍保持着60.32%的DPPH自由基清除率。桑葚提取物染色的织物还具有抑菌性,对大肠杆菌和金黄色葡萄球菌的抑菌率均达到90%以上。
黄酮类物质目前更多的是作为一种天然的抗菌剂,被用于纺织品的整理。如有研究[54]采用乙醇浸提法从废弃洋葱皮中提取植物黄酮类物质,并将其作为抗菌剂用于棉织物整理。结果表明,经过黄酮整理的棉织物具有一定的抗菌性能,且对金黄色葡萄球菌的抗菌效果优于大肠杆菌。从罗布麻中提取天然黄酮并将其作为功能整理剂应用到棉织物的整理上,整理后织物具有良好的抗紫外线性能,并对金黄色葡萄球菌与大肠杆菌具有明显的抑制作用[55]。
5 展望
近年来,随着社会对绿色制备和清洁生产的重视,微生物法合成色素越来越受到关注。目前色素物质的微生物合成制备虽然取得了一定的研究成果,但仍存在一定的问题。比如微生物法合成色素产量低的问题[56],由于相关酶活低、合成路径长、前体物或产物的生物毒性或对酶活的抑制作用等原因,许多微生物合成色素产量低[57],与工业化生产距离还很大。成本问题也是制约微生物合成色素发展的关键问题,有的色素物质前体的价格高[58],比如生物合成靛蓝的前体吲哚及色氨酸价格昂贵,需要筛选更为廉价原材料以替代。另外,微生物合成色素的产物纯度低也是导致成本高昂的重要原因,产品纯度低将极大地增加下游加工过程纯化分离的成本。
微生物及其酶是色素生物合成的主体,因此,多尺度、深层次开发微生物及酶资源是实现色素制备的生物催化过程的前提及物质基础[59]。基因组重排技术、进化工程等新型育种技术为高效菌株的筛选提供了新的手段。对代谢网络的调控也是提高生物催化效率的重要手段[60],通过代谢工程方法可以进行代谢通量分析和代谢网络的调控。
相信在将来,随生物工程、化学工程等学科的发展,通过利用各种组学、生物信息学及系统生物学技术开发新型、稳定、高产的菌株资源[61],对代谢网络的调控进行发酵过程优化[62],及开发高效低成本的分离提取工艺[63],将有望使得色素物质的微生物合成制备进入工业化和量产化[64-65]。
[1]ZHAO Chunan,LI Haiyan,LIU Chenjian.Research progress concerning biosynthesis of microorganisms pigments and genetic engineering[J].Modern Chemical Engineering,2009(12):35-39.(in Chinese)
[2]WU Zhengyun,SHI Xianming,ZENG Juan.Research progress concerning biosynthesis of xanthophyll via employing microalgae[J].Food Science,2010,31(1):268-273.(in Chinese)
[3]TORRESFAE,ZACCARIMBR,deLencastreNovaesLC,etal.Naturalcolorantsfromfilamentousfungi[J].Applied Microbiology and Biotechnology,2016,100(6):2511-2521.
[4]RATNAPANDIAN S,FERGUSSON S M,WANG L.Application of acacia natural dyes on cotton by pad dyeing[J].Fibers and Polymers,2012,13(2):206-211.
[5]WANG Jun,ZHANG Baoshan.Research progress concerning production of natural pigment via employing microorganisms[J].Microbiology China,2007(3):580-583.(in Chinese)
[6]TEANGLUM A,TEANGLUM S,SAITHONG A.Selection of indigo plant varieties and other plants that yield indigo dye[J].Procedia Engineering,2012,32:184-190.
[7]WAMBUGUH D,CHIANELLI R R.Indigo dye waste recovery from blue denim textile effluent:a by-product synergy approach[J].New Journal of Chemistry,2008,32(12):2189-2194.
[8]DUA A,CHAUHAN K,PATHAK H.Biotransformation of indigo pigment by indigenously isolated Pseudomonas sp.HAV-1 and assessment of its antioxidant property[J].Biotechnology Research International,2014,2014:1-6.
[9]NICHOLSON S K,JOHN P.The mechanism of bacterial indigo reduction[J].Applied Microbiology and Biotechnology,2005,68(1):117-123.
[10]XIAO Qimin,XU Tianhong.Expression of flavin monooxygenase in Escherichia Coli and biosynthesis of indigo[J].Jiangsu Scientific and Technological Information,2016(3):78-80.(in Chinese)
[11]NIE Yao,FU Minjie,XU Yan.Research progress concerning oxygenase from different microorganisms and catalytic reaction feature[J].Chinese Journal of Bioprocess Engineering,2013(1):87-93.(in Chinese)
[12]MA Qiao,QU Yuanyuan,ZHANG Xuwang,et al.New research progress concerning microbial synthesis of indigo[J].Chinese Journal of Applied and Environmental Biology,2012(2):344-350.(in Chinese)
[13]ZHANG Xuwang,ZHANG Qiang,QU Yuanyuan,et al.Research concerning bioconversion of benzpyrole and methylindole via employing phenol hydroxylase[J].Journal of Dalian University of Technology,2013(3):346-353.(in Chinese)
[14]FURUYA T,TAKAHASHI S,ISHII Y,et al.Cloning of a gene encoding flavin reductase coupling with dibenzothiophene monooxygenase through coexpression screening using indigo production as selective indication[J].Biochemical and Biophysical Research Communications,2004,313(3):570-575.
[15]PARK S,RYU J,SEO J,et al.Isolation and characterization of alkaliphilic and thermotolerant bacteria that reduce insoluble indigo to soluble leuco-indigo from indigo dye vat[J].Journal of the Korean Society for Applied Biological Chemistry,2012,55(1):83-88.
[16]CAZZONELLIC I.Goldacre Review:Carotenoidsin nature:insightsfromplantsand beyond[J].Functional Plant Biology,2011,38(11):833-847.
[17]ZHANG Hui,JIA Jingdun,WANG Wenyue,et al.Current status and future trends of food additives research in China[J].Journal of Food Science and Biotechnology,2016(3):225-233.(in Chinese)
[18]GOMEZ G M,OCHOA A N.Biochemistry and molecular biology of carotenoid biosynthesis in chili peppers(Capsicum spp.)[J].International Journal of Molecular Sciences,2013,14(9):19025-19053.
[19]ZHAO Ting,LIN Kongliang,HUI Bodi.Research progress of carotenoids from microorganisms[J].Food Science,2010,31(23):461-467.(in Chinese)
[20]ZHANG L,SELAO T T,SELSTAM E,et al.Subcellular localization of carotenoid biosynthesis in Synechocystis sp.PCC 6803[J].Plos One,2015,10(6):e130904.
[21]FAN Yongxian,XU Yaoxing.Research progress concerning production of carotenoids of microorganisms[J].Food and Fermentation Industries,2003,29(7):69-74.(in Chinese)
[22]JUST B J,SANTOS C A F,FONSECA M E N,et al.Carotenoid biosynthesis structural genes in carrot (Daucus carota):isolation,sequence-characterization,single nucleotide polymorphism (SNP) markers and genome mapping[J].Theoretical and Applied Genetics,2007,114(4):693-704.
[23]YAN Hongxiao,SUN Qingrui,LI Dong,et al.Catalytic isomerization of β-carotene and preparation of 9-cis β-carotene[J].Journal of Food Science and Biotechnology,2016,35(7):739-746.(in Chinese)
[24]YU Bolin,LI Qingrong,MA Chunyu,et al.Research concerning dyeing wool and silk of ten kinds of natural dyestuffs[J].Textile Dyeing and Finishing Journal,2001(3):7-12.(in Chinese)
[25]TOMITA M,IRWIN K I,XIE Z,et al.Tea pigments inhibit the production of type 1 (TH1) and type 2 (TH2) helper T cell cytokines in CD4+T cells[J].Phytotherapy Research,2002,16(1):36-42.
[26]SANG S,LAMBERT J D,TIAN S,et al.Enzymatic synthesis of tea theaflavin derivatives and their anti-inflammatory and cytotoxic activities[J].Bioorganic&Medicinal Chemistry,2004,12(2):459-467.
[27]LIU Shihong,MIAO Xiaoguang.Research concerning dyeing technology of nanometer natural tea pigments to cashmere products[J].Knitting Industries,2011(1):25-28.(in Chinese)
[28]MACEDO J A,BATTESTIN V,RIBEIRO M L,et al.Increasing the antioxidant power of tea extracts by biotransformation of polyphenols[J].Food Chemistry,2011,126(2):491-497.
[29]LAMBERT J D,SANG S,YANG C S.Biotransformation of green tea polyphenols and the biological activities of those metabolites[J].Molecular Pharmaceutics,2007,4(6):819-825.
[30]LAMBERT J.Cancer chemopreventive activityand bioavailabilityoftea and tea polyphenols[J].Mutation Research/Fundamenta l and Molecular Mechanisms of Mutagenesis,2003,523-524:201-208.
[31]SHARMA K,BARI S S,SINGH H P.Biotransformation of tea catechins into theaflavins with immobilized polyphenol oxidase[J].Journal of Molecular Catalysis B:Enzymatic,2009,56(4):253-258.
[32]DONG Kun,XIONG Xinyu,LAN Zengquan.Analysis of microbial species during fermentation of Pu'er tea[J].Modern Agricultural Science and Technology,2009(1):164-165.(in Chinese)
[33]TAN Heping,ZHOU Lihua,QIAN Shanshan,et al.Research progress of enzyme in tea fermentation[J].China Measurement&Testing,2009,35(1):19-23.(in Chinese)
[34]ZHANG Tianying,ZHI Chunxiang,ZHANG Hao,et al.Study on variation features and antioxidant activity of polyphenol in tea fermentation process[J].Hubei Agricultural Sciences,2011(15):3144-3147.(in Chinese)
[35]LIPin,LIUTongxun.Effectofmicrobialfermentationoninternalqualityofoolongtea[J].Modern Food Science and Technology,2008,24(8):773-776.(in Chinese)
[36]CHEN Meiyun,YUAN Dehong,ZHANG Yuping.Alkaline extraction of natural dye from tea and its dyeing on silk fabric[J].Journal of Textile Research,2011(11):73-77.(in Chinese)
[37]YAO Dandan,YANG Guoli,WANG Chunxia,et al.Dyeing performance of natural tea dye to cationic cotton[J].Dyeing and Finishing,2011(12):5-8.(in Chinese)
[38]REN Y,GONG J,WANG F,et al.Effect of dye bath pH on dyeing and functional properties of wool fabric dyed with tea extract[J].Dyes and Pigments,2016,134:334-341.
[39]REN Yanfei,GONG Jixian,LI Qiujin,et al.Study on bionic finishing of textiles by tea stalk natural functional material[J].Knitting Industries,2014(7):77-80.(in Chinese)
[40]LOU Jiangfei,GONG Jixian,LI Zheng,et al.Study of dyeing application of biomass dyes[J].Knitting Industries,2016(3):39-43.(in Chinese)
[41]LEE H,KIM B G,KIM M,et al.Biosynthesis of two flavones,apigenin and genkwanin,in Escherichia coli[J].Journal of Microbiology and Biotechnology,2015,25(9):1442-1448.
[42]FANGCHUAN D,FANGKAI Z,FEIFEI C,et al.Advances in microbial heterologous production of flavonoids[J].African Journal of Microbiology Research,2011,5(18):2566-2574.
[43]WANG G.Role of temperature and soil moisture conditions on flavonoid production and biosynthesis-related genes in ginkgo(Ginkgo biloba L.) leaves[J].Natural Products Chemistry&Research,2015,3(1):1-6.
[44]FALCONE F M L,RIUS S P,CASATI P.Flavonoids:biosynthesis,biological functions,and biotechnological applications[J].Frontiers in Plant Science,2012,3:279-286.
[45]SHARMA M,CHAI C,MOROHASHI K,et al.Expression of flavonoid 3'-hydroxylase is controlled by P1,the regulator of 3-deoxyflavonoid biosynthesis in maize[J].BMC Plant Biol,2012,12(1):1-13.
[46]LEONARD E,CHEMLER J,LIM K H,et al.Expression of a soluble flavone synthase allows the biosynthesis of phytoestrogen derivatives in Escherichia coli[J].Applied Microbiology and Biotechnology,2006,70(1):85-91.
[47]CHEN Jian,ZHOU Shenghu,WU Junjun,et al.Research progress concerning synthesis of flavonoids compounds of microorganisms[J].Journal of Food Science and Technology,2015,33(1):1-5.(in Chinese)
[48]ZHAO Ying,LIU Jin,WANG Changsong,et al.Research progress concerning synthesis of flavonoids compounds of microorganisms[J].China Biotechnology,2014,34(4):110-117.(in Chinese)
[49]SAITO K,YONEKURA S K,NAKABAYASHI R,et al.The flavonoid biosynthetic pathway in Arabidopsis:structural and genetic diversity[J].Plant Physiology and Biochemistry,2013,72:21-34.
[50]WINKEL S B.Flavonoid biosynthesis-a colorful model for genetics,biochemistry,cell biology,and biotechnology[J].Plant Physiol,2001,126(2):485-493.
[51]ONO E,FUKUCHI M M,NAKAMURA N,et al.Yellow flowers generated by expression of the aurone biosynthetic pathway[J].Proc Natl Acad Sci U S A,2006,103(29):11075-11080.
[52]胡少刚.天然植物染料在蛋白质纤维织物上的染色性研究[D].上海:东华大学,2008:1-65.
[53]王华印.源于桑椹花色苷染料制备、分析及其棉织物染色研究[D].杭州:浙江理工大学,2016:1-157.
[54]CHENG Xiaoni,SONG Ruoyuan,QIAN Yongfang,et al.Extraction of natural flavonoids and antibacterial activity on cotton fabric[J].Shanghai Textile Science&Technology,2016(4):48-50.(in Chinese)
[55]XU Tianpi,GONG Jixian,LI Zheng,et al.Flavonoid extraction from apocynum venetum linn and its functional finishing on cotton fabrics[J].Knitting Industries,2013(1):29-32.(in Chinese)
[56]TULI H S,CHAUDHARY P,BENIWAL V,et al.Microbial pigments as natural color sources:current trends and future perspectives[J].Journal of Food Science and Technology,2015,52(8):4669-4678.
[57]VENDRUSCOLO F,BUHLER R M M,de Carvalho J C,et al.Monascus:a reality on the production and application of microbial pigments[J].Applied Biochemistry and Biotechnology,2016,178(2):211-223.
[58]POLAK J,AZKA A J.Whole-cell fungal transformation of precursors into dyes[J].Microbial Cell Factories,2010,9(1):1-12.
[59]POLAK J,JAROSZ W A.Fungal laccases as green catalysts for dye synthesis[J].Process Biochemistry,2012,47(9):1295-1307.
[60]VOLODKIN D V,BALL V,VOEGEL J,et al.Control of the interaction between membranes or vesicles:Adhesion,fusion and release of dyes[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2007,303(1-2):89-96.
[61]ZHOU Bo,WU Jilin,ZHU Mingjun,et al.Research progress of microbial yellow pigments[J].Microbiology,2010,37(9):1362-1368.(in Chinese)
[62]CHEN Yunzhong.Study on fermentation technology of functional monascus pigment[J].Food Science,2003(7):83-87.(in Chinese)
[63]HOU Jiaheng,YE Yan,XU Xiaobo,et al.Optimization of fermentation conditions and measurement of antibacterial activity of monascus pigment[J].Journal of Shanghai Jiaotong University(Agricultural Science),2009(4):363-367.(in Chinese)
[64]YANG Shuangchun,LI Chunyu,PAN Yi.Research progress of microorganisms pigments in food industry[J].Food Research and Developent,2014(1):114-117.(in Chinese)
[65]XU Chunming,WANG Xiaodan,JIAO Zhiliang.Research progress of edible pigments by microorganisms[J].China Food Additives,2015(2):162-168.(in Chinese)
Research Progress of Microbial Synthesis of Biomass Pigments
GONG Jixian1,2, WANG Fubang1,2, REN Yanfei1,2, LI Zheng1,2, LI Qiujin1,2, ZHANG Jianfei1,2
(1.School of Textiles,Tianjin Polytechnic University,Tianjin 300387,China; 2.Key Laboratory for Advanced Textile Composites of Ministry of Education,Tianjin Polytechnic University,Tianjin 300387,China)
Biomass pigments are better than synthetic dyestuffs which are applied currently,especially the aspects concerning sustainability of source,environmental conservation during manufacture as well as ecology dyed textiles.Biomass pigments are synthesized from organism,and microorganisms pigments are more potential than dyestuffs extracted from animals and plants in the aspect of industrialized application.The paper reviews the preparation of microbial synthesis with respect to some kinds of significant biomass pigments,analyzes the precursors of biosynthesis of dyestuffs,presents microorganism species that could synthesize pigments,elaborates the biosynthesis pathways of pigments as well as relevant enzymes,analyzes synthetic efficiency of biomass pigments as well as application condition currently,and looks into the perspective biomass dyestuffs via bioconversion.
biomass pigments,biosynthesis,bioconversion,microorganisms
Q 815
A
1673—1689(2017)09—0897—09
2016-07-21
国家自然科学基金项目(31200719,51403152,51473122);国家重点研发计划项目(2016YFC0400503-02);新疆自治区重大专项项目(2016A03006)。
巩继贤(1975—),男,河北临西人,工学博士,副教授,硕士研究生导师,主要从事纺织生物技术与清洁染整技术研究。
E-mail:gongjixian@126.com
巩继贤,王富邦,任燕飞,等.生物质色素的微生物合成研究进展[J].食品与生物技术学报,2017,36(09):897-905.
