超低剂量地西他滨治疗老年中、高危骨髓增生异常综合征的临床观察
2017-11-01刘卓刚张晓东马清君张桂敏
冷 青,刘卓刚,张晓东,马 瑀,宋 扬,季 征,马清君,吴 音,张桂敏
超低剂量地西他滨治疗老年中、高危骨髓增生异常综合征的临床观察
冷 青1,刘卓刚2,张晓东3*,马 瑀1,宋 扬1,季 征1,马清君1,吴 音1,张桂敏1
目的观察超低剂量地西他滨(Decitabine,DAC)治疗老年中、高危骨髓增生异常综合征(Myelody splastic syndromes,MDS)患者的近期临床疗效及安全性。方法选择2014-2016年符合纳入标准的IPSS(International Prognostic Scoring System)评分相对高危(中、高危)老年(≥60岁)MDS患者33例。观察组(24例)给予DAC 7 mg/m2,持续泵入1 h以上,连用10 d,28 d为1个治疗周期,入组患者至少完成4个周期治疗。9例采用最佳支持治疗患者作为对照组。结果33例MDS患者中位年龄73岁(60~91岁),29例MDS及3例慢性粒单细胞白血病(Chronic myelomonocytic leukemia,CMML)患者缓解状况可评价,两组患者临床特征差异无统计学意义(P>0.05)。观察组完全缓解(Complete response,CR)率为13.04%,部分缓解(Partial remission,PR)率为8.69%,5例获得骨髓完全缓解(mCR)中2例伴血液学改善(Hematologic improvement,HI);对照组仅1例获得HI。观察组总体反应率(Overall response rate,ORR)为52.17% (12/23),显著高于对照组11.11% (1/9),差异有统计学意义(P<0.05)。随访12个月,观察组中位总生存期(OS)为8.5个月,较对照组(4.3个月)差异有统计学意义(P<0.05)。观察组患者耐受性较好,主要不良反应为Ⅰ、Ⅱ级骨髓抑制。观察组患者感染率(56.52%)略低于对照组(77.78%),差异无统计学意义(P>0.05)。结论超低剂量DAC治疗老年中、高危MDS/CMML患者疗效显著,治疗相关不良反应发生率低,可实现显著的生存获益。
骨髓增生异常综合征;老年;地西他滨
0 引言
骨髓增生异常综合征(Myelodysplastic syndromes,MDS)是一组高度异质性、获得性造血干/祖细胞克隆性疾病,主要病理生理过程为正常造血活动的良性多克隆造血由于多次基因变化逐步被恶性克隆性造血替代。MDS好发于老年患者,每年的发病率大约为4/100 000,且与年龄呈直线相关性,70岁以上患者的发病率为40~50/100 000,80岁以上患者的发病率高达80~90/100 000[1]。在我国,每年约有30万例的新诊断患者,且随着我国人口老龄化的日益加剧,发病率亦逐年增加。由于MDS的临床转归差异性大,不同危险度分组的临床治疗策略不同。相对高危的MDS患者预后较差,易转化为急性髓系白血病(Acute myelocytic leukemia,AML),需要高强度治疗,包括化疗和造血干细胞移植,而高强度治疗的治疗相关并发症发生率和病死率较高,不适合老年患者。尽管地西他滨(Decitabine,DAC)可作为MDS患者有效的治疗选择,但完全缓解(Complete remission,CR)率仍较低,维持缓解的时间有限,且全血细胞缺乏的持续时间较长[2-4],而老年中、高危MDS患者大多存在脏器功能不全,代偿功能减退,同时合并多种慢性基础病,治疗相关死亡率高,耐受性差。如何提高DAC在老年MDS患者治疗上的疗效、其具体剂量及方案的优化仍是目前国际上亟待解决的问题。关于DAC治疗MDS的剂量方案,FDA推荐20~25 mg/m2×5 d[5];国内学者提出,低剂量方案10 mg/m2×10 d疗效更佳[6];最近的体内、外研究提示,DAC在更低浓度剂量3.5~7 mg/m2(相当于0.1~0.2 mg/kg)时,即可发挥去甲基化作用,且不良反应发生率最低[7]。该浓度较目前的低剂量进一步降低,即称为超低剂量。肖志坚[6]指出,超低剂量DAC在不影响疗效的基础上可显著降低其不良反应,特别是骨髓造血系统的细胞毒性。为进一步探索适合我国老年中、高危MDS的DAC治疗方案,本研究纳入33例MDS患者,观察并评估超低剂量DAC治疗老年中、高危MDS患者的近期临床疗效及安全性,初步探讨其临床适用性。
1 资料与方法
1.1 病例资料 2014年1月至2016年1月我院血液内科收治的符合入组条件的MDS患者33例。所有病例均进行骨髓细胞形态学分析、细胞化学染色、免疫分型、细胞遗传学及分子生物学检测,依据WHO 2008年MDS分型标准诊断分型并进行IPSS 窗体顶端(International Prognostic Scoring System,IPSS) 积分评估分层[8]。符合纳入标准的患者根据治疗方案分为对照组(Best supportive treatment,BST)和观察组(DAC)。
1.2 主要纳入标准 治疗前30 d内确诊符合法英美协作组(FAB)和世界卫生组织(WHO 2008年)分型诊断标准的MDS或CMML患者[9];年龄≥60岁;东部肿瘤学协作组体力状态评估(ECOG-PS)评分0~2分;肝肾功能健全;经心脏超声测定心脏射血分数在正常值范围内。主要排除标准:有严重心、肾或肝功能不全;血清胆红素、转氨酶、血清肌酐高于正常高限2倍;心功能Ⅱ级以上,有未控制的心脏疾病;合并其他恶性肿瘤需要治疗者;骨髓空抽;乙型或丙型肝炎活动期,HIV抗体阳性者;存在脑功能紊乱或严重精神性疾病不能理解或遵从研究方案者;处于严重的难以控制的局部或全身急、慢性感染期;30 d内参加过其他临床试验者;对研究药物成分过敏者。
1.3 治疗方案
1.3.1 观察组 应用DAC(商品名:昕美)7 mg/m2×10 d,每次给药持续泵入1 h以上,28 d为1个治疗周期。入组患者至少接受4个周期治疗,4个治疗周期内获得CR的患者可根据其个体情况进行巩固治疗;获得部分缓解(Partial remission,PR)或单纯血液学改善(Hematologic improvement,HI)的患者按原方案继续治疗2个周期后再行疗效评判。完成6个治疗周期仍未缓解者终止治疗。获益患者只要没有发生不可耐受的不良反应,可一直接受治疗。
1.3.2 对照组 给予最佳支持治疗:中性粒细胞减少(ANC<0.5×109/L)伴严重感染时,使用粒细胞集落刺激因子(G-CSF),Hb<60 g/L或存在明显贫血相关症状(如心功能不全)时,给予输注浓缩红细胞;PLT<10×109/L或在体温超过38.5 ℃时、PLT<20×109/L及存在明显出血状况时输注单采血小板悬液。对伴发感染者结合影像学、病原学等辅助检查予抗感染治疗。
1.4 疗效标准及不良反应监测 临床疗效评价依据国际工作组疗效标准的修订建议(International Working Group,IWG) 2006年标准。主要终点为总体反应率(Overall response rate,ORR),包括CR、PR、骨髓完全缓解(Marrow CR,mCR)及HI;次要终点包括总生存期(Overall survival,OS)、脱离红细胞输注依赖及安全性。OS定义为本研究治疗开始至死亡或者转变为急性白血病的时间。严重不良反应、进展为急性白血病及患者不愿执行治疗方案等情况出现时终止治疗。不良反应判定依照NCI CTCAE (National Cancer Institute Common Terminology Criteria for Adverse Events,CTCAE version 3.0)。对照组患者第1个治疗周期每周进行2次血液检测。观察组患者每次治疗前进行血常规、心电图及肝肾功能检查,治疗中每周检测2次血常规及进行肝肾功能检查。患者自开始治疗起进行随访,根据随访结果计算中位OS及评估安全性。
1.5 统计学分析 采用SPSS 15.0统计学软件,患者临床特征、疗效及不良反应比较采用χ2检验和t检验,并采用Fisher′s确切概率校正,P<0.05为差异有统计学意义。生存分析采用Kaplan-Meier法。
2 结果
2.1 临床资料 33例患者中,男23例(69.7%),女10例(30.3%),男∶女=2.51∶1,中位年龄73岁(60~91岁)。其中难治性贫血伴原始细胞增多-1 (RAEB-1) 18例(54.54%),难治性贫血伴原始细胞增多-2(RAEB-2)12例(36.36%),CMML 3例(9.1%)。IPSS危险度中危-1组6例(18.18%),中危-2组20例(60.61%),高危组7例(21.21%)。所有患者在治疗前无严重心、肝、肾功能受损和全身感染等并发症,两组患者临床资料方面差异无统计学意义(P>0.05),具有可比性。见表1。
2.2 治疗反应比较 观察组除1例患者于开始治疗1周内中断治疗外,其他32例入组患者缓解状况均可评价。第4个治疗周期结束后,观察组CR率13.04%,PR率8.69%,3例获得mCR患者中2例伴HI,1例患者单纯HI;对照组仅1例有血液学改善。第6个治疗周期完成后,观察组ORR为52.17%,高于对照组的11.11%,差异有统计学意义(P=0.05)。见表2。两组患者IPSS积分中危-1、中危-2和高危组间ORR差异无统计学意义(P>0.05)。见表3。

表1 骨髓增生异常综合征患者基本临床资料(例,%)
2.3 随访及生存分析 观察组12个月中位OS为8.5(2~12)个月、对照组为4.3(1~9)个月,两组比较差异有统计学意义(P<0.05)。见图1。
2.4 不良反应 多数患者就诊时均有不同程度血细胞减少,NCI分级判定标准为与就诊时比较。观察组患者主要不良反应是血液学不良反应,均出现Ⅰ、Ⅱ级骨髓抑制,2例患者仅出现血小板及红细胞一过性减少。17例患者于第1、2个治疗周期结束后血象开始恢复,3例于第3个治疗周期后血象开始恢复。对照组患者白细胞减少7例,红细胞减少4例,血小板减少6例。观察组患者感染率(56.52%)略低于对照组(77.78%),差异无统计学意义(P>0.05)。观察组患者非血液学不良反应主要为轻度消化道症状及丙氨酸氨基转移酶(ALT)升高,疗程结束或经保肝治疗后ALT均逐渐恢复正常。

表2 两组患者治疗反应比较(例,%)
注:*经Fisher′s确切概率校正

表3 不同IPSS分组总反应率比较(例,%)
注:*经Fisher′s确切概率校正
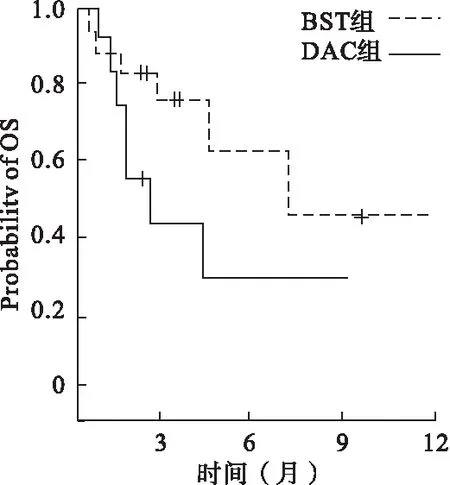
图1 两组OS生存曲线比较
3 讨论
MDS治疗主要解决两大问题:骨髓衰竭及并发症、AML转化。老年中、高危MDS患者具有体能状况较差及治疗相关风险高等临床特点,临床治疗目标和实际可接受毒性有其局限性[10]。国际血液和骨髓移植研究中心(CIBMTR)数据显示,近10年来,60岁以上FDA推荐的DAC剂量为20 mg/(m2·d)×5 d静脉输注(超过1 h),4周为1个疗程,诸多临床试验均采用此剂量单用或联合治疗MDS或AML[11-13]。然而,体外试验证实,DAC 3.5~7 mg/(m2·d),每周3次以上,足以达到表观遗传学效应,促进造血干细胞分化作用,但无细胞毒作用[14]。国外学者分析发现,阿扎胞苷(Azacitidine,AZA)是DAC磷酸盐的前体,而FDA推荐作用强于DAC的AZA常规剂量是50~75 mg/m2,约相当于DAC 7.5 mg/m2[15]。Saunthararajah等[16]于2013年美国血液学年会上提出超低剂量DAC治疗MDS的建议,并强调DAC的剂量只要能够达到去除DNMT1即可,可通过增加DAC应用的频率,使更多的S期肿瘤细胞暴露于DAC达到DNMT1的去除。
本研究应用超低剂量DAC 7 mg/m2连续10 d的方案治疗老年中、高危MDS患者。结果显示,DAC治疗组ORR为52.17% (12/23),高于BST治疗组(11.11%,1/9,P=0.05)。观察组中3例患者于第4~6个疗程期间获得mCR和HI,有效患者中位最佳治疗反应周期为第4个治疗周期,中位最早反应周期为第2个治疗周期。两组患者IPSS评分中危-1、中危-2和高危组间ORR无显著差异(P>0.05)。Mahfouz等[7]报道,超低剂量DAC治疗MDS 0.1~0.2 mg/kg (3.5~7 mg/m2),皮下注射1~3次/周,总反应率达44%,即使高危MDS也可以获得完全血液学反应和完全细胞遗传学反应。本研究中ORR较高,可能与前者给药方式及持续给药时间不足有关。有关DAC的临床试验和非随机对照研究显示,延长用药时间可带来更好的临床反应[17-20]。去甲基化药物(Hypomethylating agents,HMAs)治疗应持续到疾病进展或药物毒性不能耐受为止,去甲基化治疗的连续性及足够的疗程数是DAC治疗的关键。
本研究中,随访12个月,观察组、对照组中位OS分别为8.5(2~12)个月、4.3(1~9)个月,两组患者短期生存获益差异有统计学意义(P<0.05),提示接受DAC治疗有效的患者中位生存期明显长于治疗无效的患者。此外,mCR伴HI的患者较无改善者生存期更长。最近的研究表明,DAC在更低剂量 5 mg/m2时,即可实现DNMT抑制功能,且细胞毒性最低[21-23]。此外,DAC在超低剂量时可上调外周血T细胞受体,通过调节性T细胞(Regulatory T cells,Treg)改善免疫细胞功能[24],具有降低感染等优点。本研究中,观察组患者感染率(56.52%)低于对照组(77.78%),差异无统计学意义(P>0.05)。观察组最常见的不良反应为Ⅰ、Ⅱ级骨髓抑制,2例患者仅出现血小板及红细胞一过性减少。17例患者于第1、2个治疗周期结束后血象开始恢复,3例于第3个治疗周期后血象开始恢复。除1例患者退组外,观察组其他患者在基本治疗周期完成后,均能接受后续巩固治疗。
目前,临床治疗MDS主要基于西方医疗体系临床试验结果推荐的治疗方案,本研究基于我国国情,采用超低剂量DAC治疗老年中、高危MDS患者的治疗策略,在保证疗效的基础上明显减低DAC的不良反应,患者耐受性好,实现较满意的近期生存获益,为进一步摸索出真正基于“表观遗传学治疗”理念的联合给药方案奠定临床基础,具有应用推广价值。
[1] Nimer SD.Myelodysplastic syndromes[J].Blood,2008,111:4841-4851.
[2] Mihara K,Takihara Y,Kimura A.Genetic and epigenetic alterations in myelodysplastic syndrome[J].Cytogenet Genome Res,2007,118(2-4):297-303.
[3] Bacher U,Schnittger S,Kern W,et al.Distribution of cytogenetic abnormalities in myelodysplastic syndromes,Philadelphia negative myeloproliferative neoplasms,and the overlap MDS/MPN category[J].Ann Hematol,2009,88:1207-1213.
[4] Ebrahem Q,Mahfouz RZ,Ng KP,et al.High cytidine deaminase expression in the liver provides sanctuary for cancer cells from decitabine treatment effects[J].Oncotarget,2012,3(10):1137-1145.
[5] Hackanson B,Daskalakis M.Recent results in cancer research Fortschritte der Krebsforschung Progres dans les recherches sur le cancer[J].Decitabine,2014,201:269-297.
[6] 肖志坚.地西他滨治疗骨髓增生异常综合征——规范和探讨在我国的临床应用[J].中华血液学杂志,2014,35(3):185-186.
[7] Mahfouz RZ,Rickki E,Juersivich JA,et al.Non-cytotoxic differentiation therapy based on mechanism of disease produces complete remission in myelodysplastic syndromes (MDS) with high risk cytogenetics[A]:In:54th ASH Annual Meeting and Exposition[C].Atlanta,2012:1696.
[8] Jaffe ES,Harris NL,Stein H,et al.World Health Organization classification of tumours.Pathology & genetics.Tumours of haematopoietic and lymphoid tissues[M].Lyon:IARC Press,2001:62-73.
[9] Bennett JM,Catovsky D,Daniel MT,et al.Proposals for the classification of the acute leukaemias. French-American-British (FAB) co-operative group[J].Br J Haematol,1976,33(4):451-458.
[10]Malcovati L,Germing U,Kuendgen A,et al.Time-dependent prognostic scoring system for predicting survival and leukemic evolution in myelodysplastic syndromes[J].J Clin Oncol,2007,25(23):3503-3510.
[11]Steensma DP,Kantarjian H,Wijermans P.Clinical experience with different dosing schedules of decitabine in patients with myelodysplastic syndromes (MDS)[J].J Clin Oncol,2009,27.
[12]Santini V. Novel therapeutic strategies:hypomethylating agents and beyond[J].Hematology Am Soc Hematol Educ Program,2012,2012:65-73.
[13]Ishikawa T.Novel therapeutic strategies using hypomethylating agents in the treatment of myelodysplastic syndrome[J].Int J Clin Oncol,2014,19(1):10-15.
[14]Alcazar O,Achberger S,Aldrich W,et al.Epigenetic regulation by decitabine of melanoma differentiation in vitro and in vivo[J].Int J Cancer,2012,131(1):18-29.
[15]Ades L,Santin V.Hypomethylating agents and chemotherapy in MDS[J].Best Pract Res Clin Haematol,2013,26(4):411-419.
[16]Saunthararajah Y,Sekeres M,Advani A,et al.Evaluation of noncytotoxic DNMT1-depleting therapy in patients with myelodysplastic syndromes[J].J Clin Invest,2015,125(3):1043-1055.
[17]Mummaneni P,Shord SS.Epigenetics and oncology[J].Pharmacotherapy,2014,34(5):495-505.
[18]Garcia-Manero G,Jabbour E,Borthakur G,et al.Randomized open-label phase II study of decitabine in patients with low- or intermediate-risk myelodysplastic syndromes[J].J Clin Oncol,2013,31(20):2548-2253.
[19]Tsai HC,Li H,Van Neste L,et al.Transient low doses of DNA-demethylating agents exert durable antitumor effects on hematological and epithelial tumor cells[J].Cancer Cell,2012,21(3):430-446.
[20]Lubbert M,Suciu S,Baila L,et al.Low-dose decitabine versus best supportive care in elderly patients with intermediate- or high-risk myelodysplastic syndrome (MDS) ineligible for intensive chemotherapy:final results of the randomized phase III study of the European Organsation for Research and Treatment of Cancer Leukemia Group and the German MDS Study Group[J].J Clin Oncol,2011,29(15):1987-1996.
[21]Hackanson B,Decitabine DM.Decitabine[J].Recent Results Cancer Res,2014,201:269-297.
[22]Tsujioka T,Yokoi A,Uesugi M,et al.Effects of DNA methyltxansfexase inhibitors (DNMTIs) on MDS-derived cell lines[J].Exp Hematol,2013,41(2):189-197.
[23]Li X,Song Q,Chen Y,et al.Decitabine of reduced dosage in Chinese patients with myelodysplastic syndrome:a retrospective analysis[J].PLoS One,2014,9(4):e95473.
[24]Ghanem H,Cornelison AM,Garcia-Manero G,et al.Decitabine can be safely reduced after achievement of best objective response in patients with myelodysplastic syndrome[J].Clin Lymphoma Myeloma Leuk,2013,13(Suppl 2):S289-S294.
Clinicalobservationofultralow-dosedecitabineinthetreatmentofelderlypatientswithmoderate-highriskmyelodysplasticsyndrome
LENG Qing1,LIU Zhuo-gang2,ZHANG Xiao-dong3*,MA Yu1,SONG Yang1,JI Zheng1,MA Qing-jun1,WU Yin1,ZHANG Gui-min1
(1.Department of Hematology,Anshan Central Hospital,Anshan 114001,China;2.Department of Hematology,Shengjing Hospital of China Medical University,Shenyang 110004,China;3. Department of Hematology,the People′s Liberation Army NO.202 Hospital,Shenyang 110003,China)
ObjectiveTo evaluate the efficacy and safely of ultra low-dose decitabine (DAC) in the treatment of elderly patients with moderate-high risk myelodysplastic syndrome (MDS).MethodsTotally 33 elderly patients (≥60 years old)with moderate-high risk MDS according to IPSS (International Prognostic Scoring System) from 2014 to 2016 were divided into two groups.Patients in observation group (n=24) were given DAC 7 mg/m2by vein daily over 1 h on day 1~10.Cycles were scheduled every 28 d,and patients were treated for a minimum of 4 cycles;9 patients (control group)
best supportive treatment (BST).ResultsThe median age of 33 patients was 73 (60~91) years old,and the response data was evaluable for 29 patients with MDS and 3 patients with Chronic myelomonocytic leukemia(CMML).There was no significant difference in patients′ characteristics between the two groups (P>0.05).The rate of complete response (CR) in observation group was 13.04%,and the rate of partial remission (PR) was 8.69%.There were 5 cases with mCR in observation group,in which 2 case gained hematologic improvement (HI),while there was only 1 case with HI in control group.The overall response rate (ORR) in observation group was higher than that of control group:52.17% (12/23) vs.11.11% (1/9),P<0.05.The median OS in observation group was longer than that of control group (8.5 months vs.4.3 months,P<0.05).The most common adverse reaction was grade Ⅰ~Ⅱ myelosuppression.The infection rate in observation group was slightly lower than that of control group (56.52% vs.77.78%,P>0.05).ConclusionUltra low-dose decitabine has good clinical efficacy in elderly patients with moderate-high risk MDS,and can achieve significant survival benefits with low incidence of adverse reactions.
Myelodysplastic syndromes;Elderly;Decitabine
2017-01-25
1.鞍山市中心医院血液内科,辽宁 鞍山 114001;2.中国医科大学附属盛京医院血液内科,沈阳 110004;3.中国人民解放军第二〇二医院血液内科,沈阳 110003
*通信作者
10.14053/j.cnki.ppcr.201710009
