丙泊酚在脑缺血再灌注中对凋亡诱导因子核转位的影响
2017-11-01宋春雨
李 昊,宋春雨
·论著·
丙泊酚在脑缺血再灌注中对凋亡诱导因子核转位的影响
李 昊,宋春雨*
目的研究丙泊酚是否能降低凋亡诱导因子(AIF)线粒体核转位,阻止Caspase非依赖性神经元凋亡,从而起到脑保护作用。方法Wistar大鼠60只随机分为假手术组(S组)、缺血再灌注组(I/R组)、抑制剂组(I组)、丙泊酚组(P组)。S组大鼠仅接受手术而不遭受全脑缺血再灌注损伤打击;I/R组大鼠采用二血管夹闭法制造缺血模型10 min,然后再灌注;I组大鼠在缺血前2 min经静脉注入Caspase抑制剂;P组大鼠在全脑缺血再灌注前1 h,经股静脉持续泵注丙泊酚持续1 h,之后注入抑制剂,2 min后建立全脑缺血再灌注损伤模型。缺血再灌注后6、24、48 h,取海马组织用流式细胞仪测细胞凋亡率、Western blot法分析AIF线粒体核转位、凋亡相关基因Bax、Bcl-2的表达情况。结果与I/R、S、I组相比,P组神经元凋亡率显著降低,Bax/Bcl-2比值显著降低,AIF蛋白表达水平明显减少。结论丙泊酚对脑缺血再灌注损伤的脑保护作用可能与抑制海马神经元中AIF线粒体核转位有关。
丙泊酚;脑缺血再灌注;Bax/Bcl-2;AIF
0 引言
脑缺血再灌注损伤(Ischemia reperfusion injury,IRI)是指脑组织发生缺血后在一定时间内重新得到血液灌注,其功能不仅不能恢复,且结构损伤和功能障碍反而加重的一种表现。脑缺血发生后,缺血中心发生缺血性坏死,而缺血周围发生大量的细胞凋亡[1],其中神经元大量死亡是导致神经功能丧失的主要原因。丙泊酚是一种静脉麻醉药,具有起效快、诱导平稳、苏醒快等优点,广泛应用于外科患者的麻醉和重症监护室患者的镇静。研究表明,丙泊酚具有潜在的神经保护作用及脑保护作用[2-5]。多项研究表明,丙泊酚对脑缺血损伤有一定的防治作用,但丙泊酚脑保护作用的机制目前尚未阐明[6-8]。研究表明,丙泊酚可以通过抑制凋亡相关途径起到脑保护作用[9]。但相关研究大多集中在丙泊酚对Caspase依赖途径神经元凋亡的影响[10-11]。一个新的线粒体蛋白-凋亡诱导因子(AIF)参与了非依赖Caspase细胞凋亡途径。本研究采用二血管夹闭法建立全脑缺血再灌注损伤大鼠模型,并使用Caspase途径抑制剂Z-VAD-FMK,阻断Caspase依赖途径的神经元凋亡,观察Caspase非依赖凋亡途径中,AIF在丙泊酚脑保护过程中的作用。
1 材料
成年雄性Wistar大鼠6只,体重200~250 g,清洁级,由哈尔滨医科大学附属第二医院动物中心提供,动物使用许可证号SCXK(黑)2013-001。丙泊酚注射液(规格:20 mL∶200 mg,批号:XLH057,四川国瑞药业有限责任公司),Caspase抑制剂Z-VAD-FMK(规格:5 mg,批号:HY-16658,上海碧云天生物技术有限公司),氟烷由哈尔滨医科大学附属第二医院实验室提供。
2 实验方法
2.1 全脑缺血再灌注损伤模型的制备和分组 Wistar 大鼠60只,随机分为假手术组(S组)、全脑缺血再灌注组(I/R)、全脑缺血再灌注+Z-VAD-FMK组(I组)、丙泊酚+Z-VAD-FMK组(P组),每组15只。所有大鼠禁食 8~12 h,采用双侧颈总动脉夹闭和放血全身低血压法建立大鼠全脑缺血再灌注损伤动物模型。大鼠用4%氟烷麻醉(与其他麻醉药物相比,氟烷的脑保护作用较小,可基本排除干扰),之后明视下行气管插管,机械通气用30% O2/70% N2O,维持大鼠动脉血气各项指标正常。当大鼠达到一定麻醉深度后,消毒颈部和右下肢皮肤。沿颈部正中线剪一切口,钝性分离颈部肌肉,分离双侧颈总动脉,穿线备用。在大鼠的右下肢沿腹股沟剪一切口,钝性分离肌肉,游离股动静脉。选用24号静脉穿刺针,进行股动静脉插管,以备动脉压监测、放血、采血样、静脉给药及血液回输用。建立动静脉通路后,缓慢放血,使平均动脉压达到40 mmHg,夹闭双侧颈总动脉10 min。当脑电波成一条直线时,模型成立。S组大鼠仅接受手术而不遭受全脑缺血再灌注损伤打击;I/R组大鼠二血管夹闭法制造全脑缺血模型10 min,之后再灌注;I组大鼠在缺血前2 min经静脉注入0.5 mg的Caspase抑制剂300 μL;P组大鼠在全脑缺血再灌注前1 h,经股静脉持续泵注丙泊酚1.0 mg/(kg·min),持续1 h,之后经静脉注入0.5 mg的Z-VAD-FMK 300 μL,2 min后建立全脑缺血再灌注损伤模型。分别在缺血6、24、48 h后对大鼠进行断头取脑,在-20 ℃冰盘上迅速分离海马组织,置于液氮中保存待测。
2.2 流式细胞术(FCM)测定全脑缺血再灌注损伤后海马CA1区神经元凋亡率 取全脑缺血再灌注后24 h大鼠,腹腔注射戊巴比妥钠麻醉,之后经静脉进行全身肝素化。肝素化之后开胸,经主动脉应用冰盐水进行脑组织灌洗。灌洗完毕断头取脑。将脑组织用磷酸盐缓冲液(PBS)漂洗,眼科剪剪碎,加入5 mL PBS液振荡混匀后,以200目尼龙网过滤,将细胞悬液以500 r/min低温离心5 min。收集细胞加入2 mL PBS液振荡混匀后,以300目尼龙网过滤,再次将细胞悬液以500 r/min低温离心5 min。收集细胞后加入Buffer液以备染色上机。
2.3 Western blot法分析Bcl-2、Bax的表达 大鼠在全脑缺血再灌注后 6、24、48 h,麻醉状态下断头取海马组织,将海马组织切碎后,立即放入冰预冷的 0.5 mL缓冲液中5 s。在 4 ℃溶解的组织下,以12 000 r/min离心5 min,取上清液用于免疫印迹分析。总蛋白等量的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)10%聚丙烯酰胺凝胶,然后转移到PVDF膜。膜经5%脱脂奶粉封闭,然后用一抗将膜稀释在2%的BSA中,在PBST孵育,4 ℃过夜。然后用PBST洗涤3次(每次间隔10 min),在室温下用适当的辣根过氧化物酶共轭二次体孵育45 min,然后用 PBST 洗涤3次。显色充分后用增强化学发光试剂使印迹显影,并在X射线胶片曝光。
2.4 Western blot分析AIF线粒体核转位 大鼠在全脑缺血再灌注后6、24、48 h,腹腔注射10%水合氯醛(350 mg/kg),麻醉状态下断头取脑组织。将脑组织切碎后,立即放入10 mL用冰预冷的缓冲液(250 mmol/L蔗糖,10 mmol/L Hepes,pH 7.4,1 mg/mL牛血清白蛋白,0.5 mol/L medta,0.5 mol/L megta)中,在0 ℃冰槽中用玻璃匀浆器手动匀浆,匀浆液备用。经过在一系列梯度浓度的蔗糖溶液中超速离心,获取细胞核浓缩部分。将悬浮于250 mmol/L蔗糖溶液中的线粒体部分取出,于-80 ℃保存,备用。取20 μg 蛋白质进行12%SDS-PAGE电泳,分离后的蛋白质转移至 PVDF膜;膜经5%脱脂奶粉封闭;分别加入1∶500稀释的兔抗人AIF多抗、1∶100稀释的兔抗人a-actin多抗、1∶200稀释的小鼠抗人HSP60单抗,4 ℃过夜。加人HRP标记的羊抗兔或羊抗小鼠IgG,室温孵育1 h,用DAB显色。显色充分后用增强化学发光试剂使印迹显影,并在X线胶片曝光。对凝胶剂进行扫描和定量分析。图片上每组样本的显影条带代表不同分子量的蛋白,对照蛋白分子量标记图,判断条带的蛋白分子量,用图像定量程序来测定AIF和actin的含量水平。用相同条带上actin值为标准来计算各个条带上的 AIF 相对含量。
3 结果
3.1 大鼠生理参数 三组大鼠在体重、平均动脉血压(MAP)或动脉血气张力分析方面差异无统计学意义(P>0.05)。PaO2、PaCO2及血液pH值保持在正常范围内。在I/R组和P组的缺血期间,MAP 保持在预定限度内[(40±5) mmHg]。见表1。
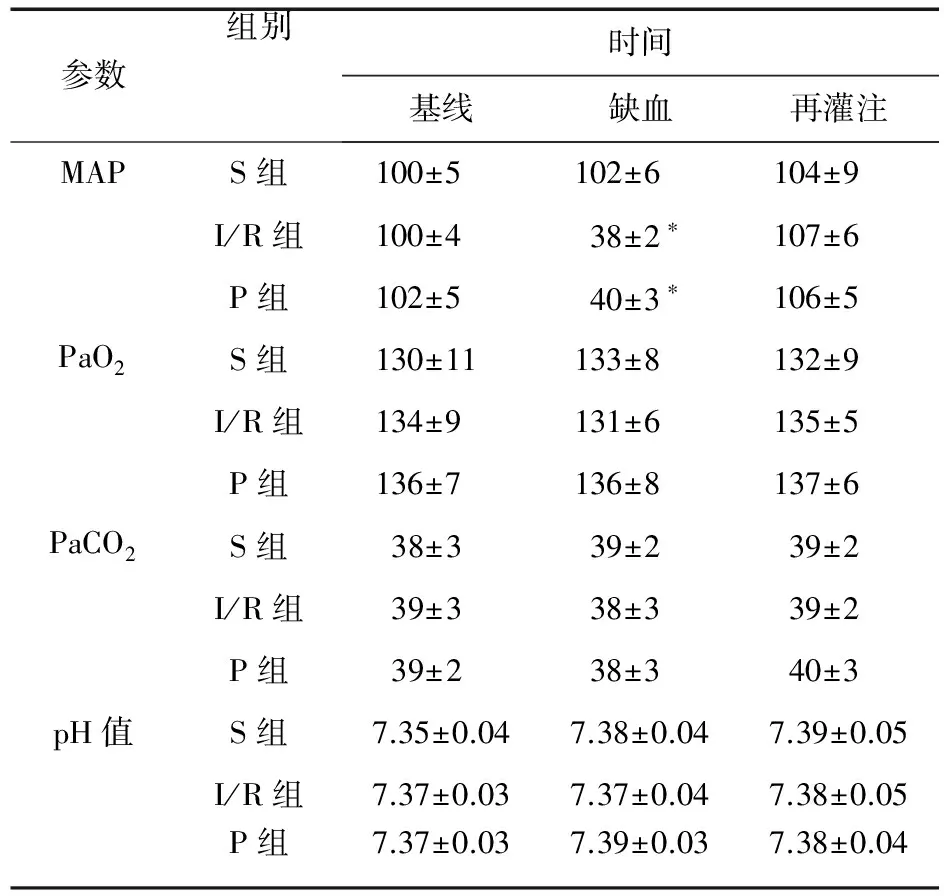
表1 三组大鼠生理参数比较(mmHg)
3.2 流式细胞仪测定神经元细胞死亡率 流式细胞仪检测不同组在再灌注24 h后海马神经元的凋亡情况,观察各组凋亡神经元的分布。S组未见凋亡细胞;在I/R组有大量神经元细胞凋亡;与I/R组相比,P组细胞凋亡水平显著降低(P<0.05)。与S组(6.4%±0.8%)相比,I/R组神经元凋亡率(50.9%±3.2%)明显升高(P<0.05),P组的凋亡率(24.7%±1.2%)低于抑制剂组(P<0.05)。见图1。

图1 流式细胞术检测三组大鼠缺血再灌注后海马神经元凋亡水平
3.3 丙泊酚对凋亡因子Bax、Bcl-2表达情况的影响 免疫组化结果显示,缺血再灌注后24 h,与C组相比,I组Bax/Bcl-2比值较高(P<0.05),而且显著高于 P组(P<0.05)。见图 2。

图2 三组Bax和Bcl-2蛋白表达比较
3.4 AIF 线粒体核转位的表达情况 Western blot结果显示,P组AIF蛋白的表达水平低于I组(P<0.05)。缺血后AIF蛋白水平无明显变化,再灌注6、24、48 h后,AIF从线粒体向细胞核移位明显。I/R组和P组的线粒体AIF相对水平低于S组(P<0.05)。I/R组线粒体组AIF相对水平低于P组(P<0.05)。I/R组和P组核因子的AIF相对水平高于S组(P<0.05)。I/R组核因子AIF相对水平高于P组。见图3、图4。
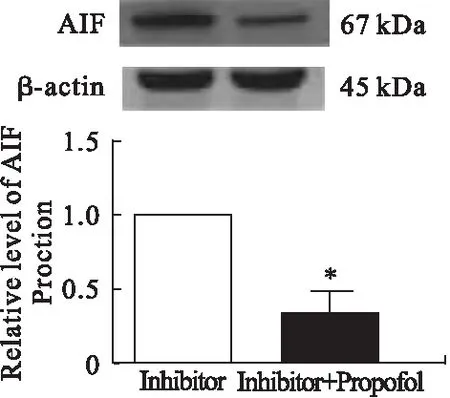
图3 脑缺血再灌注后AIF蛋白表达的相对水平

图4 缺血再灌注损伤后海马组织中AIF转位表达情况
注:A.Western blot显示,再灌注后24 h,三组细胞核和线粒体中AIF的表达;B.再灌注6、24、48 h后,三组线粒体中AIF含量的相对变化;C.再灌注6、24、48 h后,三组核因子含量相对变化。*与S组比较,P<0.05;#与I/R组比较,P<0.05
4 讨论
缺血再灌注损伤不仅影响缺血组织和器官的结构,而且功能损伤和代谢障碍的严重程度明显高于单纯由缺血引起的损伤[12]。因此,减轻或避免缺血再灌注损伤的发生与发展已成为基础研究和临床研究的热点。随着医疗技术的飞速发展,有很多降低脑缺血再灌注损伤风险的方法,如:缩短操作时间,改进操作方式,增加脑血供等,但是对生化因素诱导的脑缺血再灌注损伤没有明显改变[13]。有研究表明,缺血再灌注前预处理,可以增加器官或组织对缺血再灌注的耐受[14-17]。
脑缺血后神经元的凋亡过程主要是通过Caspase依赖途径和Caspase非依赖途径实现的。这两种途径最后都集中到线粒体来执行凋亡过程。线粒体是动植物能量代谢的主要场所,其在调控细胞凋亡和基因表达等方面发挥重要作用[18]。大量研究表明,线粒体在细胞凋亡中起着最基本的执行者的作用,同时线粒体也是缺血再灌注损伤攻击的主要对象[19]。一些凋亡相关的基因产物都欸位于细胞线粒体内,在脑缺血缺氧损伤等凋亡刺激因素作用下,线粒体崩解,线粒体通透性转换孔(MPTP)开放,呼吸链断裂,线粒体膜间隙的凋亡诱导因子释放到胞质或转位到胞核,启动凋亡的级联反应。Caspase依赖途径:MPTP开放,细胞色素C等释放到胞质后,与dATP、凋亡蛋白酶激活因子结合成复合物,激活Caspase-9,之后激活Caspase-3,Caspase-3水解细胞的蛋白质结构,导致细胞解体,形成凋亡小体。Caspase非依赖途径:线粒体中存在一些凋亡蛋白,如AIF等,从线粒体进入胞质后能直接作用于细胞核,引发细胞凋亡。AIF是一种膜间蛋白,具有DNA内切酶活性,由线粒体释放并转位进入核内促凋亡作用,独立地将DNA裂解为60 KB左右的DNA片段,直接引起DNA断裂。当细胞受到特定凋亡诱导信号的刺激后,线粒体膜上的通透性孔道MPTP打开,允许AIF从线粒体释放到胞浆,并转位到核内,进而引起DNA大片段裂解,即AIF线粒体核转位[20-22]。在脑缺血缺氧性损伤后,Bcl-2家族各成员的表达发生不同的变化,可直接或间接调节MPTP,决定神经元能否成活。MPTP是细胞死亡的开关,在缺血的过程中是关闭的,但再灌注开始时,自由基大量释放,钙离子内流增加,诱导MPTP开放,MPTP开放导致膜电位下降,呼吸链解耦联,细胞色素C及其他坏死因子外流,促进细胞凋亡和坏死[23]。丙泊酚可抑制MPTP的开放,降低钙离子浓度,调节细胞凋亡蛋白Bcl-2和Bax的表达,从而对脑缺血再灌注起到积极作用[24]。
有报道,丙泊酚可以增加凋亡相关基因Bcl-2的表达,减少Bax的表达[25-27],而且丙泊酚预处理可以上调Bcl-2/Bax比值,抑制全脑缺血再灌注损伤大鼠海马CA1区神经元的凋亡[28]。本研究表明,丙泊酚可以下调Bax/Bcl-2比值,抑制神经元凋亡,与之前的研究[28]一致。Bcl-2家族成员可以调节AIF释放,以及随后的Caspase非依赖性细胞死亡。Bcl-2家族具有调控线粒体膜通透性的功能,在多种物质诱导的凋亡中过度表达Bcl-2,可以抑制AIF从线粒体的释放和细胞死亡。Bcl-2过度表达时,可阻止AIF从线粒体释放,并且能调节AIF从线粒体到核的转位[29]。Bax对AIF的释放也有作用,过表达Bax可以引起AIF从线粒体释放增多。因此,AIF的促凋亡功能及Bcl-2家族成员对其释放的调控可能代表了一条降解DNA和导致细胞死亡的全新的信号通路。本研究表明,丙泊酚能够显著降低神经元细胞凋亡水平,使凋亡相关基因Bcl-2的表达增加、Bax表达降低,抑制全脑缺血再灌注后AIF线粒体的核转位。
本研究选择临床剂量1 mg/(kg·min)作为试验剂量,该剂量可以提供更好的脑保护作用和更少的循环抑制。本实验采用夹闭双侧颈总动脉合并低血压方法建立全脑缺血再灌注模型,此模型模拟了临床上的休克、心功能不全等低灌注引起的不同程度的脑组织缺血损伤,更接近临床脑损伤患者的病理生理,对探讨脑缺血损伤规律及评价药物疗效等有价值。本课题深入探讨丙泊酚脑保护作用的线粒体机制,为临床脑保护策略提供新的方法和理论基础。此外,抑制AIF介导的细胞凋亡信号通路可能是治疗脑损伤患者的较好选择。
[1] 崔芳芹,杨卫东,陈前芬,等.不同时间脑缺血/再灌注损伤小鼠大脑Bcl-2和Caspase-3表达的变化[J].中国老年学杂志,2014,34(10):2765-2767.
[2] Nakajima A,Tsuji M,Inagaki M,et al.Neuroprotective effects of propofol on ER stress-mediated apoptosis in neuroblastoma SH-SY5Y cells[J].Eur J Pharmacol,2014,725:47-54.
[3] Wang H,Luo M,Li C,et al.Propofol post-conditioning induced long-term neuroprotection and reduced internalization of AMPAR GluR 2 subunit in a rat model of focal cerebral ischemia/reperfusion[J].J Neurochem,2011,119(1):210-219.
[4] Zhang H,Mei X,Wang W,et al.Blocking conversion of GABAergic inhibition as a potential mechanism of propofol-mediated brain protection following resuscitation[J].Drug News Perspect,2009,22(9):525-529.
[5] 解立杰,黄锦秀,胡霁.丙泊酚对兔脊髓缺血再灌注损伤血脊髓屏障的保护作用[J].实用医学杂志,2016,32(20):3364-3368.
[6] Li C,Xu M,Wu Y,et al.Limb remote ischemic preconditioning attenuates lung injury after pulmonary resection under propofol-remifentanil anesthesia:a randomized controlled study[J].Anesthesiology,2014,121(2):249-259.
[7] Kottenberg E,Musiolik J,Thielmann M,et al.Interference of propofol with signal transducer and activator of transcription 5 activation and cardioprotection by remote ischemic preconditioning during coronary artery bypass grafting[J].J Thorac Cardiovasc Surg,2014,147(1):376-382.
[8] Zhou R,Yang Z,Tang X,et al.Propofol protects against focal cerebral ischemia via inhibition of microglia-mediated proinflammatory cytokines in a rat model of experimental stroke[J].PLoS One,2013,8(12):e82729.
[9] 乔霖,赵薇,王新生,等.丙泊酚对大鼠脑缺血再灌注损伤的保护作用及其Caspase-3表达干预机制的研究[J].现代药物与临床,2015,30(6):629-632.
[10]Wu GJ,Chen WF,Hung HC,et al.Effects of propofol on proliferation and anti-apoptosis of neuroblastoma SH-SY5Y cell line:new insights into neuroprotection[J].Brain Res,2011,12(1384):42-50.
[11]Li J,Han B,Ma X,et al.The effects of propofol on hippocampal caspase-3 and Bcl-2 expression following forbrain ischeima-reperfusion in rats[J].Brain Res,2010,14(1356):11-23.
[12]刘朝华,刘炎芳,杨晓霞.硫辛酸与周围神经缺血再灌注损伤[J].沈阳医学院学报,20115,17(4):245-247.
[13]申新,赵鸽,王瑞,等.异丙酚和白藜芦醇预处理对大鼠肝脏缺血再灌注损伤细胞凋亡的影响及机制[J].南方医科大学学报,2013,33(1):80-85.
[14]Gharanei M,Hussain A,Janneh O,et al.Doxorubicin induced myocardial injury is exacerbated following ischaemic stress via opening of the mitochondrial permeability transition pore[J].Toxicol Appl Pharmacol,2013,268(2):149-156.
[15]Cui J,Li Z,Qian LB,et al.Reducing the oxidative stress mediates the cardioprotection of bicyclol against ischemia-reperfusion injury in rats[J].J Zhejiang Univ Sci B,2013,14(6):487-495.
[16]Tu Q,Wang R,Ding B,et al.Protective and antioxidant effect of Danshen polysaccharides on cerebral ischemia/reperfusion injury in rats[J].Int J Biol Macromol,2013,60:268-271.
[17]Sun L,Zhao M,Yu XJ,et al.Cardioprotection by acetylcholine:a novel mechanism via mitochondrial biogenesis and function involving the PGC-1α pathway[J].J Cell Physiol,2013,228(6):1238-1248.
[18]Hernández-Reséndiz S,Buelna-Chontal M,Correa F,et al.Targeting mitochondria for cardiac protection[J].Curr Drug Targets,2013,14(5):586-600.
[19]Ten VS,Starkov A.Hypoxic-ischemic injury in the developing brain:the role of reactive oxygen species originating in mitochondria[J].Neurol Res Int,2012,2012:542976.
[20]Otera H,Ohsakava S,Nagaura Z,et al.Export of mitochondrial AIF in response to proapoptotic stimuli depends of processing at the intermembrane space[J].EMBO J,2005,24(7):1375-1386.
[21]Panka DJ,Wang W,Atkinsn B.The Raf inhibitor BAY 43-9006(Sorafenib) induces Caspase-independent apoptosis in melanorma cells[J].Cancer Res,2006,66(3):1611-1619.
[22]Tanaka S,Takehashi M,Iida S.Mitochondrial impairment induced by poly(ADP-ribose) polymerase-1 activation in cortical neurous after oxygen and glucose deprivation[J].Neurochem,2005,95(1):179-190.
[23]Penna C,Perrelli MG,Pagliaro P.Mitochondrial pathways,permeability transition pore,and redox signaling in cardioprotection:therapeutic implications[J].Antioxid Redox Signal,2013,18(5):556-599.
[24]Yin C,Zhang GF,Chen HL,et al.Role of AMPK signal pathway in propofol against transient cerebral ischemia/reperfusion injury of aged rats[J].Chin J Clinicians,2014,10:1879-1884.
[25]Xu Z,Yu J,Wu J,et al.The effects of two anesthetics,propofol and sevoflurane,on liver ischemia/ reperfusion injury[J].Cell Physiol Biochem,2016,38(4):1631-1642.
[26]Li Y,Zhong D,Lei L,et al.Propofol prevents renal Ischemia-reperfusion injury via inhibiting the oxidative stress pathways[J].cell physiol biochem,2015,37(1):14-26.
[27]庞鹏,宋春雨.丙泊酚对缺血性脑损伤的抗凋亡作用[J].中国医药,2015,10(11):1710-1712.
[28]Xi HJ,Zhang TH,Tao T,et al.Propofol improved neurobehavioral outcome of cerebral ischemia-reperfusion rats by regulating Bcl-2 and Bax expression[J].Brain Res,2011,1410:24-32.
[29]Cregan SP,Dawson VL,Slack RS.Role of AIF in caspase-dependent and Caspase-independent cell death[J].Oncogene,2004,23(16):2785-2796.
Effectsofpropofolonnucleartranslocationofapoptosisinducingfactorduringcerebralischemiareperfusion
LI Hao,SONG Chun-yu*
(the Second Affiliated Hospital of Harbin Medical University,Harbin 150006,China)
ObjectiveTo investigate whether propofol can reduce the apoptosis inducing factor (AIF),inhibit the nuclear translocation of mitochondria and prevent the apoptosis of Caspase independent neurons.MethodsTotally 60 Wistar rats were randomly divided into sham operation group (group S),ischemia reperfusion group (group I/R),inhibitor group (group I) and propofol group (group P).Rats in group S only underwent surgery without suffering from cerebral ischemia-reperfusion injury blow;rats in group I/R were established as blood deficiency model by two vessel clip preparation for 10 min,and then were given reperfusion;rats in group I were given intravenous injection of Caspase inhibitor at 2 min before ischemia;rats in group P were given intravenous continuous infusion of propofol via femoral vein for 1 h at 1 h before cerebral ischemia reperfusion,and then they were given intravenous injection of inhibitors,and the cerebral ischemia reperfusion injury model was established after 2 min.The hippocampus was taken,and the apoptosis rate was measured by flow cytometry respectively at 6 h,24 h and 48 h after ischemia reperfusion;meanwhile,the expression of AIF nuclear translocation,Bax and Bcl-2 were analyzed by Western blot.ResultsCompared with group I/R,group S and group I,the apoptosis rate,ratio of Bax/Bcl-2 and the expression of AIF protein in group P decreased significantly (P<0.05).ConclusionThe neuro-protective effect of propofol on cerebral ischemia reperfusion injury may be related to the inhibition of AIF nuclear translocation in hippocampus neurons.
Propofol;Cerebral ischemia reperfusion;Bax/Bcl-2;AIF
2017-06-28
哈尔滨医科大学附属第二医院,哈尔滨 150006
国家自然基金课题(304000393)
*
10.14053/j.cnki.ppcr.201710001
