上调microRNA- 214表达对肺癌细胞凋亡及耐药性的影响
2017-11-01常芬肖贵华李琪
常芬,肖贵华,李琪
(武汉市普仁医院 呼吸内科,湖北 武汉 430081)
·论著·
上调microRNA-214表达对肺癌细胞凋亡及耐药性的影响
常芬,肖贵华,李琪
(武汉市普仁医院 呼吸内科,湖北 武汉 430081)
目的探究microRNA- 214过表达是否可以通过调节凋亡过程影响肺癌细胞的多药耐药性。方法选择2种不同的人小细胞肺癌细胞株和人非小细胞肺癌细胞株作为实验组,分别是H69细胞实验组和H446细胞实验组;A549细胞实验组和H1299细胞组;选择正常人肺上皮细胞(BEAs- 2B)作为对照组。Real- time PCR法进行检测肺癌细胞株内miR- 214的表达量。上调miR- 214表达后给予不同的抗肿瘤药物刺激,并MTT比色法检测肺癌细胞株对药物的敏感性;CCK- 8法检测细胞存活率和TUNEL法流式细胞仪检测细胞凋亡;Western blot法检测肺癌细胞株中Bcl- 2和p53的蛋白表达水平。结果Real- time PCR法检测结果发现,实验组细胞中miR- 214表达量明显低于对照组BEAs- 2B,差异有统计学意义(P<0.05);CCK- 8结果显示,上调miR- 214表达后肺癌细胞的存活率显著降低,差异有统计学意义(P<0.05);MTT法结果显示,上调miR- 214表达后肺癌细胞对抗肿瘤药物的敏感性显著降低(P<0.05);Western blot结果表明,上调miR- 214基因表达后肺癌细胞Bcl- 2和p53蛋白的异常表达,与对照组相比差异有统计学意义(P<0.05);结论上调miR- 214表达能够显著降低肺癌细胞的存活率并加速凋亡的发生;同时miR- 214过表达可以调控凋亡蛋白并降低肺癌细胞对药物的敏感性。
小分子核糖核酸- 214; 肺癌; 凋亡; 多药耐药性
肺癌是对人类健康和生命危害最大的恶性肿瘤之一[1]。肺癌一般可分为两大类:小细胞肺癌(small cell lung cancer,SCLC)和非小细胞肺癌(non- small cell lung cancer,NSCLC)[2]。肺癌具有高侵袭性、高复发性及生长迅速的生物学特点,预后极差[2],如何提高肺癌的治疗效果已成为当今的重要课题。近年来microRNAs已经成为肿瘤生物治疗领域的一个新亮点[3],研究表明,miR- 214可参与多种途径调节肿瘤的发生和发展过程,miR- 214可以调控细胞的凋亡通路,影响肿瘤细胞增殖,同时调控miR- 214也可以作为肿瘤抑制剂对细胞的对药耐药性产生影响[4]。多药耐药性的产生是由多种基因共同调控的复杂过程,其中细胞凋亡相关蛋白Bcl- 2、p53在此过程中起重要作用[5]。但miR- 214是否可以通过调节凋亡过程影响肺癌细胞的多药耐药性仍在探索阶段。在本研究中,我们通过上调几种肺癌细胞中miR- 214的表达,观察miR- 214对肺癌细胞增殖和凋亡的影响,阐明miR- 214在肺癌发生发展中的作用及miR- 214对凋亡蛋白的调节作用治疗肿瘤细胞的多药耐药性的机制。
1 材料与方法
1.1 细胞
BEAs- 2B细胞、H69细胞、H446细胞、A549细胞和H1299细胞,购自美国培养物保藏中心(ATCC,Manassas,VA),为本实验室保存。
1.2 药品与试剂
阿霉素(ADM)、长春新碱(VCR)、吉西他滨(GEM)、依托泊苷(VP- 16)和顺铂(DDP),均购于美国Sigma公司;miR- 214质粒及RealTime- PCR配套引物,均购自广州RiboBio公司;一抗Bcl- 2、p53单克隆抗体,购于美国Abcam公司;二抗,购自北京中杉金桥公司;CCK- 8试剂盒,购自日本同仁化学研究所;Real- Time PCR试剂盒购自日本TaKaRa公司;荧光素酶报告实验试剂盒,购自美国Promega公司。
1.3 方法
1.3.1 细胞培养 选择正常人肺上皮细胞(BEAs- 2B),作为对照组;分别选择2种不同的人小细胞肺癌细胞株和人非小细胞肺癌细胞株作为实验组,分别是H69细胞实验组和H446细胞实验组;A549细胞实验组和H1299细胞组。细胞在含10%胎牛血清的RPMI培养液中培养,37 ℃、5% CO2条件下培养。
1.3.2 Real- time PCR法检测不同肺癌内miR- 214的表达水平 Trizol法提取细胞内总RNA。用含有gDNA Eraser的PrimeScriptRT试剂盒逆转录合成cDNA,用SYBR Premix Ex TaqII试剂盒进行实时荧光定量Real- time PCR分析。每个实验至少重复3次。分析:通过计算循环阈值CT值来确定基因的表达量。公式:ΔΔCT=(CT.实验组的基因- CT.实验组管家基因)- (CT.对照组目的基因- CT.对照组管家基因)。目的mRNA的量=2-ΔΔCT。其引物序列为:
miR- 214 Forward 5′- GGACAGCAGGCGCAGACA- 3′,
Reverse:5′- CAGTGCAGGGTCCGAGGT- 3′,
β- actin Reverse:5′- TGTTGGCATAGAGGTCTTTACGG- 3′,
Reverse: 5′- TGGGTATGGAATCCTGTGGCA- 3′
1.3.3 细胞miR- 214 mimics质粒转染 将细胞接种到六孔板中,当细胞融合达40%左右时进行转染。将10 μl的LipofectaminTM2000和250 μl Opti- MEM混合,同时将5 μl的miR- 214 mimics与250 μl Opti- MEM混合孵育,静置5 min后将两者混合。细胞用PBS清洗一次并加入1.5 ml的Opti- MEM培养基。将转染混合物静置20 min后加滴加到六孔板中,置于上述条件培养。6 h后换含10%胎牛血清的RPMI培养液中继续培养,确保各组细胞转染效率高于80%,48 h后收集细胞。miR- 214 mimics质粒序列为:
miR- 214 mimics Forward:5′- ACAGCAGGCACAGACAGGCAGU- 3′,
Reverse:5′- UGCCUGUCUGUGCCUGCUGUUU- 3′,
mimics control Forward:5′- UUCUCCGAACGUGUCACGUTT- 3′,
Reverse:5′- ACGUGACACGUUCGGAGAATT- 3′,
1.3.4 CCK- 8法检测细胞存活率 将miR- 214 mimics质粒转染进入细胞后制备成细胞悬液,接种到96孔板中(100 μl/孔),37 ℃、5% CO2条件下过夜培养。更换培养基后加入10 μl CCK8,37 ℃、5% CO2条件下培养2 h,使用酶标仪在450 nm波长处测定OD值,计算细胞存活率。
1.3.5 TUNEL流式细胞术检测细胞凋亡率 将miR- 214 mimics质粒转染进入细胞后制备成细胞悬液,调整细胞浓度为1×106接种于6孔板中培养,收集不同肺癌细胞用PBS洗涤2次,按试剂盒说明书说明分别加入FITc标记的AnnexinV和PI,用流式细胞仪激发波长488 nm,收集波长630 nm检测各组细胞的荧光强度,检测各组细胞的凋亡百分比。
1.3.6 MTT比色法检测细胞对药物的敏感性 用MTT法检测不同肺癌细胞对药物的敏感性。阿霉素(ADM)、长春新碱(VCR)、依托泊苷(VP- 16)和顺铂(DDP)分别处理细胞48 h。PBS清洗细胞一次并加入MTT试剂37 ℃、5% CO2条件下继续培养4 h。弃去培养基并加入DMSO,用酶标仪在540 nm波长处测定OD值,测定细胞对不同药物的敏感程度(即细胞IC50),每个实验至少重复3次。
1.3.7 免疫印迹法检测细胞中凋亡蛋白表达水平 收集对数生长期细胞,加入裂解液冰上裂解2 h。用BCA试剂盒进行蛋白浓度检测,将各组蛋白浓度总量调整为30 μg·μl-1。将各组蛋白样品加入到10% SDS聚丙烯酰胺凝胶中进行电泳,转膜至PVDF膜后按1∶1000 的稀释比例加入一抗和二抗。用ECL显色剂显色,并对各泳道条带进行灰度扫描,计算蛋白的表达量。
1.4 统计学处理
2 结 果
2.1 肺癌细胞内miR- 214的表达量
Real- time PCR法检测发现,miR- 214在小细胞肺癌细胞株H69细胞、H446细胞及在非小细胞肺癌细胞株A549细胞和H1299细胞的表达量明显低于对照组BEAs- 2B细胞,差异有统计学意义(P<0.01),见图1。
2.2 肺癌细胞miR- 214过表达检测细胞的存活率
CCK- 8法检测细胞存活率显示,与对照组的细胞

注:**与对照组相比,差异有统计学意义(P<0.01)
图1不同肺癌细胞株中miR-214的表达量
Fig1ExpressionofmiR-214indifferentlungcancercells
存活率相比,上调miR- 214表达后小细胞肺癌细胞株和非小细胞肺癌细胞株细胞存活率明显降低,差异有统计学意义(P<0.01),见图2。
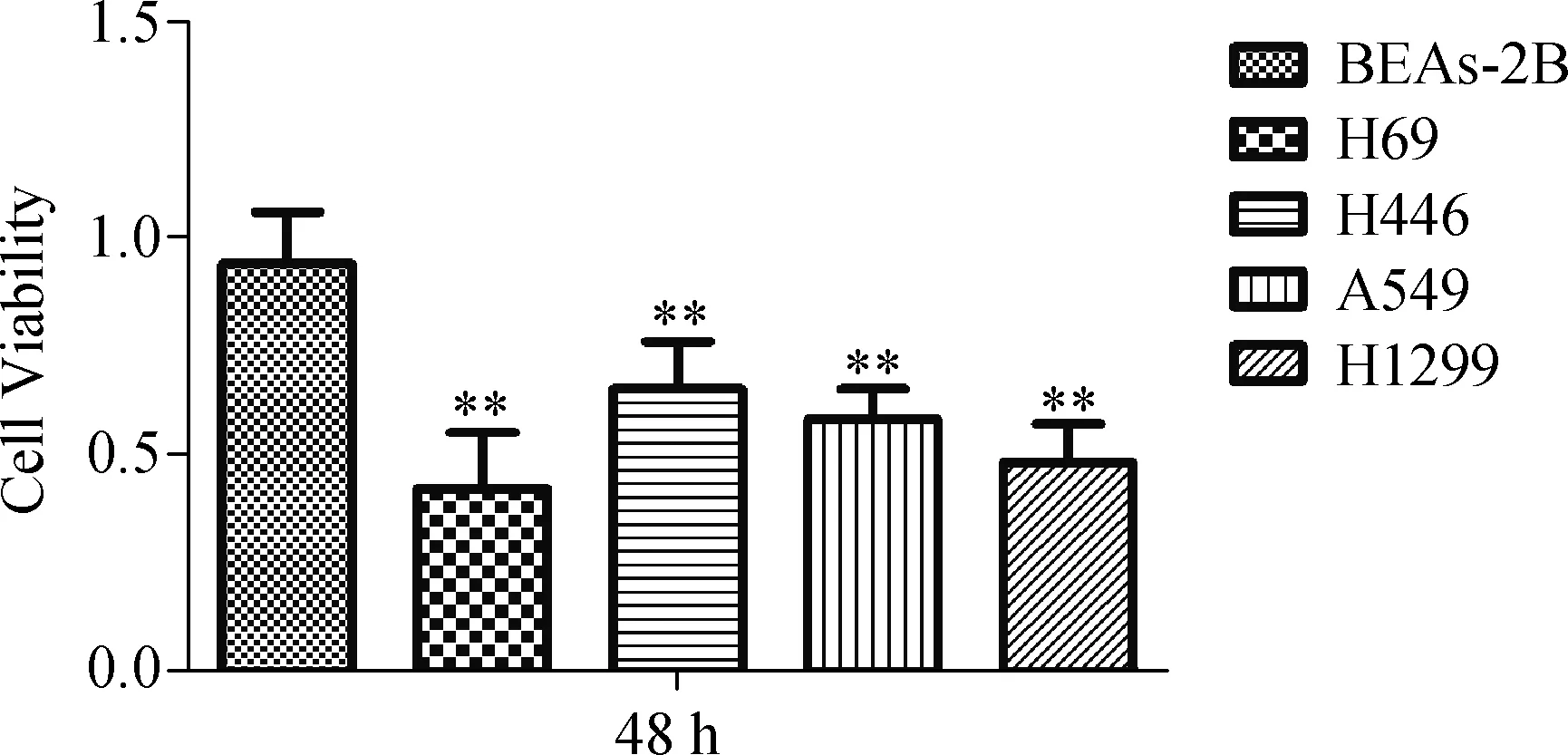
注:**与对照组相比,差异有统计学意义(P<0.01)
图2miR-214过表达降低肺癌细胞的细胞存活率
Fig2miR-214overexpressiondecreasescellviabilityoflungcancercells
2.3 肺癌细胞miR- 214过表达检测细胞的凋亡率
细胞凋亡率结果显示,与对照组相比,上调miR- 214表达后小细胞肺癌细胞株和非小细胞肺癌细胞株细胞凋亡率明显上升,差异有统计学意义(P<0.01),见图3。

注:**与对照组相比,差异有统计学意义(P<0.01)
图3miR-214过表达上调肺癌细胞的细胞凋亡率
Fig3miR-214overexpressionincreasescellapoptosisoflungcancercells
2.4 肺癌细胞miR- 214过表达后对药物的敏感性降低
MTT比色法检测上调miR- 214表达后肺癌细胞对药物的敏感性。结果显示miR- 214过表达后,与对照组相比,小细胞肺癌细胞株H69细胞、H446细胞及在非小细胞肺癌细胞株A549细胞和H1299细胞对阿霉素(ADM)、长春新碱(VCR)、吉西他滨(GEM)、依托泊苷(VP- 16)和顺铂(DDP)药物的敏感性降低,差异有统计学意义(P<0.05),见表1。
表1miR-214过表达会降低肺癌细胞对药物的敏感性
Tab1miR-214overexpressiondecreasesthedrugsensitivityinlungcancercells
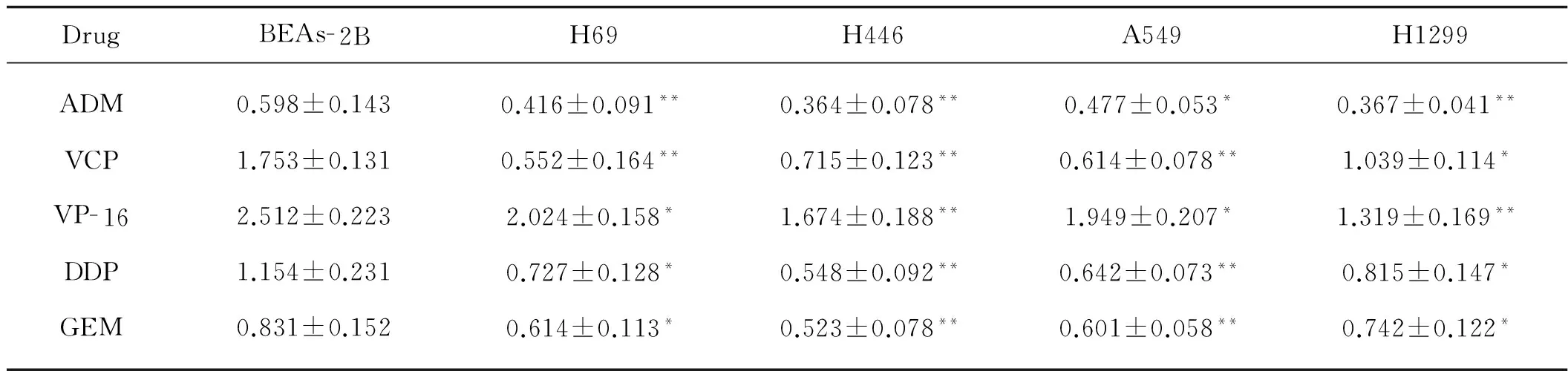
DrugBEAs-2BH69H446A549H1299ADM0.598±0.1430.416±0.091**0.364±0.078**0.477±0.053*0.367±0.041**VCP1.753±0.1310.552±0.164**0.715±0.123**0.614±0.078**1.039±0.114*VP-162.512±0.2232.024±0.158*1.674±0.188**1.949±0.207*1.319±0.169**DDP1.154±0.2310.727±0.128*0.548±0.092**0.642±0.073**0.815±0.147*GEM0.831±0.1520.614±0.113*0.523±0.078**0.601±0.058**0.742±0.122*
注:*与对照组相比,差异有统计学意义(P<0.05);**与对照组相比,差异有统计学意义(P<0.01)
2.5 肺癌细胞miR- 214过表达后细胞中凋亡蛋白表达水平
Western blot技术检测上调miR- 214表达后肺癌细胞中Bcl- 2、p53蛋白表达情况。结果表明miR- 214过表达后,小细胞肺癌细胞株H69细胞、H446细胞及在非小细胞肺癌细胞株A549细胞和H1299细胞中的Bcl- 2表达水平明显降低,差异有统计学意义(P<0.05);miR- 214过表达后,小细胞肺癌细胞株H69细胞、H446细胞及在非小细胞肺癌细胞株A549细胞和H1299细胞中的p53表达水平明显升高,差异有统计学意义(P<0.05)。
注:*与对照组control相比,差异有统计学意义(P<0.05);**与对照组control相比,差异有统计学意义(P<0.01)
图4miR-214过表达会降低肺癌细胞中CPD的表达
Fig4miR-214overexpressiondecreasestheexpressionofBcl-2andincreasedtheexpressionofp53inlungcancercells
3 讨 论
肺癌是对人类健康和生命危害最大的恶性肿瘤之一[1]。目前对于肺癌的治疗方法为三种:手术切除、化学药物治疗(化疗)和放射性治疗(放疗),主要治疗手段主要为药物治疗[2,6]。由于其极易发生肿瘤多药耐药性(multidrug resistance,MDR),且肺癌具有高侵袭性、高复发性及生长迅速的生物学特点,容易导致化疗失败,临床预后极差[2,7]。因此如何提高肺癌的治疗效果及降低化疗药物的耐药性是函待解决的重要问题。miR- 214已被发现可在多种肿瘤细胞种异常表达并调节细胞凋亡过程,包括胰腺癌、乳腺癌、胃癌和卵巢癌等[8- 11]。miR- 214作为肿瘤抑制因子其表达与恶性癌症呈负相关性[12],可对细胞的多药耐药性产生影响[6,13]。研究表明,miR- 214位于1号染色体的长臂上,它能调节抑癌基因 PTEN 并能调控肿瘤细胞的增殖和凋亡。PTEN的抑制可以激活 PI3K/AKT通路,从而增加使用药物化疗的肿瘤细胞的生存,而下调miR- 214 的表达可以减少肿瘤细胞的生存和诱导凋亡,但miR- 214是否可以通过调节凋亡过程影响肺癌细胞的多药耐药性仍在探索阶段[6,13]。
本实验中,我们对肺癌细胞进行miR- 214的过表达转染实验,我们通过上调BEAs- 2B细胞、H69细胞、H446细胞、A549细胞和H1299细胞中miR- 214的含量发现,过表达miR- 214可以显著降低肺癌细胞的细胞存活率,并促进H69细胞、H446细胞、A549细胞和H1299细胞的细胞凋亡发生。miR- 214基因过表达对肺癌增殖起到明显的抑制作用,并可以显著加速细胞凋亡的发生,说明miR- 214在肺癌细胞的存活和凋亡的调控过程中起到重要的作用,其表达水平的高低与小细胞肺癌和非小细胞肺癌的增殖状态密切相关,细胞内miR- 214的异常表达可以作为临床上诊断和判断肺癌发生的指标之一。同时,MTT比色法结果可知,miR- 214过表达可对细胞的多药耐药性能力起到明显的抑制作用,说明肺癌细胞的多药耐药性受miR- 214基因的显著调控。
现已证实 ,Bcl- 2蛋白主要通过线粒体介导途径引起细胞凋亡[14],p53作为Bcl- 2的基因转录的负调控因子也参与了细胞凋亡的过程[15]。我们发现miR- 214基因过表达后,肺癌细胞内凋亡相关蛋白Bcl- 2和p53的表达具有显著的差异性。结果表明,Bcl- 2的蛋白含量明显降低,p53的蛋白含量显著上升,这说明了miR- 214过表达可以激活细胞的凋亡途径,引起肺癌细胞的凋亡和坏死,对肺癌细胞的多药耐药性产生影响,起到主要的调控作用。
综上所述,上调miR- 214基因的表达可对肺癌细胞的增殖及凋亡能力产生显著的调控作用;并可以诱导凋亡蛋白发挥作用启动细胞凋亡过程,调节肺癌细胞的多药耐药能力。但是miR- 214是否可以作为临床治疗肺癌的靶点,其具体参与机体调节肺癌的机制还需进一步研究和探讨。
[1] SIEGEL R,NAISHADHAM D,JEMAL A.CA:a cancer journal for clinicians[J].Cancer statistics,2013,63(1):11- 30.
[2] 李彦楠 ,朱晓莉.SSTR2在小细胞肺癌中的表达及其意义[J].东南大学学报:医学版 ,2016,35(2):269- 271.
[3] XUE J,YANG J,LUO M,et al.MicroRNA- targeted therapeutics for lung cancer treatment[J].Expert Opin Drug Discov,2016,12(2):141.
[4] LIU B,TIAN Y,LI F,et al.Tumor- suppressing roles of miR- 214 and miR- 218 in breast cancer[J].Oncol Rep,2016,35(6):3178- 3184.
[5] 刘超,邓智勇.肺癌多药耐药机制及其逆转方法的研究进展[J].标记免疫分析与临床,2016,23(9):1086- 1090.
[6] 刘云,周晓玉,微小RNA与肺发育及肺相关疾病的研究进展[J].中华实用儿科临床杂志2015,30(22):1748- 1750.
[7] ULAHANNAN S V,BRHMERA J R.Antiangiogenic agents in combination with chemotherapy in patients with advanced non- small cell lung cancer[J].Cancer Invest,2011,29(4):325- 337.
[8] XIN R,BAI F,FENG Y,et al.MicroRNA- 214 promotes peritoneal metastasis through regulating PTEN negatively in gastric cancer[J].Clin Res Hepatol Gastroenterol,2016,40(6):748- 754.
[9] WANG F,LV P,LIU X,et al.microRNA- 214 enhances the invasion ability of breast cancer cells by targeting p53[J].Int J Mol Med ,2015,35(5):1395- 1402.
[10] TIAN X,ZENG G,LI X,et al.Cantharidin inhibits cell proliferation and promotes apoptosis in tongue squamous cell carcinoma through suppression of miR- 214 and regulation of p53 and Bcl- 2/Bax[J].Oncol Rep ,2015,33(6):3061- 3068.
[11] 薛红芳; 吴维光; 赵容.下调microRNA- 214表达对人卵巢癌SKOV- 3细胞增殖及凋亡的影响[J].新乡医学院学报,2016,33(3):193- 197.
[12] ZHANG X J,YE H,ZENG C W,et al.Dysregulation of miR- 15a and miR- 214 in human pancreatic cancer[J].J Hematol Oncol,2010,3(1):46.
[13] DERFOUL A,JUAN AH,DIFILIPPANTONIO MJ,et al.Decreased microRNA- 214 levels in breast cancer cells coincides with increased cell proliferation,invasion and accumulation of the Polycomb Ezh2 methyltransferase[J].Carcinogenesis,2011,32(11):1607- 1614.
[14] 刘桂荣,康亚辉,马建新,等.热疗和热疗联合放疗对人食管癌ECA109细胞凋亡的影响[J].检验医学与临床2015,12(5):646- 648.
[15] 眭怡群,冯一中.自噬相关基因LC3、Beclin- 1与凋亡相关基因p53、BCL- 2在大肠癌中的表达及意义[J].临床与实验病理学杂志,2012,28(3):282- 286.
EffectsofmicroRNA-214up-regulationonapoptosisanddrugresistanceoflungcancercells
CHANGFen,XIAOGui-hua,LIQi
(DepartmentofRespiratoryMedicine,WuhanPurenHospital,Wuhan430081,China)
Objective: To investigate whether microRNA- 214 overexpression could affect multidrug resistance of lung cancer cells by regulating the process of apoptosis.MethodsHuman small cell lung cancer cell lines and human non- small cell lung cancer cell lines were selected for H69 cell group, H446 cell group, A549 cell group and H1299 cell group; Lung epithelial cells (BEAs- 2B) were served as control group. Real- time PCR was used to detect the expression of miR- 214. After up- regulated microRNA- 214 expression, MTT colorimetry was used to detect the sensitivity of lung cancer cells; CCK- 8 assay was used to detect cell viability; TUNEL assay was used to detect the levels of apoptosis by flow cytometry; the protein expression of Bcl- 2 and p53 were detected by Western blot.ResultsReal- time PCR showed that the expression of miR- 214 was significantly decreased in the lung cancer cell groups(P<0.05); CCK- 8 results showed that miR- 214 overexpression was significantly down- regulated the cell viability (P<0.05); miR- 214 overexpression was significantly decreased the drug sensitivity in lung cancer cells by MTT assay(P<0.05); compared with the control group, the protein expression of Bcl- 2 and p53 in lung cancer cells were significantly abnormally expressed (P<0.05).ConclusionUp- regulation of miR- 214 could decrease cell viability of the lung cancer and increase cell apoptosis, which may also regulate the apoptosis - related proteins and decrease the drug sensitivity in lung cancer cells.
MicroRNA- 214; lung cancer; apoptosis; multidrug resistance
2017- 05- 02
2017- 09- 12
常芬(1988-),女,湖北武汉人,主治医师, 主要研究方向:慢性阻塞性肺病、支气管哮喘、肺癌等方面。E- mail:changfen1428@163.com
常芬,肖贵华,李琪.上调microRNA- 214表达对肺癌细胞凋亡及耐药性的影响分析[J].东南大学学报:医学版,2017,36(5):811- 815.
R734.2
A
1671- 6264(2017)05- 0811- 05
10.3969/j.issn.1671- 6264.2017.05.026
(本文编辑:孙茂民)
