不同隔盐方式对菠菜光合特性和抗氧化酶活性的影响
2017-11-01孙凯宁王克安杨宁
孙凯宁,王克安,杨宁
(山东省农业科学院蔬菜花卉研究所/国家蔬菜改良中心山东分中心/山东省设施蔬菜生物学重点实验室,山东 济南 250100)
不同隔盐方式对菠菜光合特性和抗氧化酶活性的影响
孙凯宁,王克安,杨宁
(山东省农业科学院蔬菜花卉研究所/国家蔬菜改良中心山东分中心/山东省设施蔬菜生物学重点实验室,山东 济南 250100)
针对设施土壤盐渍化状况日趋严重的现状,以无隔盐层为对照,设置三种隔盐层类型:砂砾层(T1)、复合有机物料层(T2)、砂砾+复合有机物料层(T3),研究不同隔盐措施的抑盐效果。结果表明:T3隔盐效果最佳,电导率(EC)较对照降低13.2%,其次为T2。隔盐处理可显著提高菠菜植株的净光合速率,T1、T2、T3分别较CK增加55.8%、83.5%、110.8%,差异达显著水平(P<0.05);蒸腾速率和气孔导度的变化趋势与净光合速率相近,T1、T2、T3的蒸腾速率较CK分别增加42.0%、141.6%、220.5%;气孔导度较CK分别增加18.9%、145.7%、263.9%,差异达显著水平(P<0.05)。MDA含量、POD活性、CAT活性与土层EC值的变化趋势相同;T2处理的SOD活性达17.0 U·g-1FW,高于其它处理,T3最低,仅为11.8 U·g-1FW。
设施土壤;盐渍化;隔盐层;光合速率;抗氧化酶
设施土壤是指玻璃温室、日光温室、塑料大棚等园艺设施栽培土壤的总称[1]。目前我国已形成了黄淮地区、东北南部、华北、西北等多块规模较大的设施农业生产区域[2]。然而,设施生产高投入、高产出、高复种指数的生产模式,随着年限的延长,其土壤次生盐渍化现象不断出现并日益加重,部分种植年限长(一般5~8 年以上)的设施菜地已不能再继续生产,严重影响蔬菜的产量和品质,阻碍蔬菜生产的可持续发展[3-5]。为此,前人尝试多种途径进行修复改良,如王金龙等[6]用填闲作物改良温室次生盐渍化土壤;施毅超等[7]采用轮作模式研究其对土壤电导率和离子组成的影响;张生田[8]通过增施生物有机肥和改良剂以降低设施蔬菜土壤次生盐渍化危害。实践中,隔盐层在露天盐碱地改良中有较多应用[9-12],并取得了一定效果,但在设施盐渍化土壤中的应用却少有报道,它对作物生长状况的影响则更为鲜见。本试验在前人成果基础上,设置无机介质隔层、有机介质隔层以及复合隔层,研究隔盐层在设施盐渍化土壤中的抑盐效果,分析不同隔盐方式对作物光合特性以及抗氧化活性的影响,以期为设施土壤改良提供技术支撑。
1 材料与方法
1.1试验概况
供试土壤为人工均匀调配的中度盐碱土(含盐量0.3%),理化性状见表1。供试菠菜品种为日本大叶菠菜,由天津市津科力丰种苗有限公司生产。试验于2016年11月8日到2017年2 月22日在山东省农业科学院蔬菜花卉研究所核心试验区进行。

表1 供试土壤基本理化性状
1.2试验设计与管理
采用土柱模拟试验(图1)。土柱高80 cm,内径为25 cm,柱中的填充物分隔盐层和土壤。隔盐层设无隔层(对照,CK)、砂砾层(厚10 cm,T1)、复合有机物料层(含生物炭、菌渣,厚10 cm,T2)、砂砾+复合有机物料层(厚20 cm,T3),共4个处理,重复3次。各处理隔层均在土柱上部30 cm土层以下。每个土柱定植菠菜3株。各处理管理方式保持一致。植株光合特性在收获当天测定,并随机采集植株样品和0~10、10~20、20~30 cm土样,每个区内重复取样3次。植株采用液氮保存,土样则风干保存。
图1土柱排列图
1.3测定项目与方法
1.3.1 土壤电导率(EC) 风干土样按照土水比为1∶5的比例浸提,采用电导率仪对浸提液进行测定。
1.3.2 光合指标 于晴朗无风天气9∶00—11∶00用Li-6400光合仪测定光合参数。每个微区选取长势一致的菠菜3株,在每株相同部位选取完全伸张的向阳叶片,每片叶读数5次,取15次平均结果。测定参数为:净光合速率(Pn,μmol CO2·m-2·s-1)、气孔导度(Gs,mmol·m-2·s-1)、胞间CO2浓度(Ci,mmol CO2·mol-1)和蒸腾速率(Tr,mmolH2O·m-2·s-1)。
1.3.3 抗氧化活性测定 丙二醛(MDA)含量、过氧化氢酶(CAT)和过氧化物酶(POD)活性采用Cakmak等[13]的方法测定;超氧化物歧化酶(SOD)活性采用Prochazkovar等[14]的方法测定。
1.4数据处理
用Microsoft Excel做图,用SPSS 22.0软件进行统计分析,单因素方差分析采用LSD法。
2 结果与分析
2.1不同隔盐层对0~30 cm土层电导率的影响
图2显示,不同隔盐层处理(T1~T3)上部30 cm土层EC值呈逐渐降低趋势,其中T1为1.49 mS·cm-1,高于CK的1.36 mS·cm-1,T2、T3分别为1.30 mS·cm-1和1.18 mS·cm-1,两者较CK分别降低4.4%和13.2%,其中T3与CK差异达显著水平(P<0.05),隔盐效果较好。
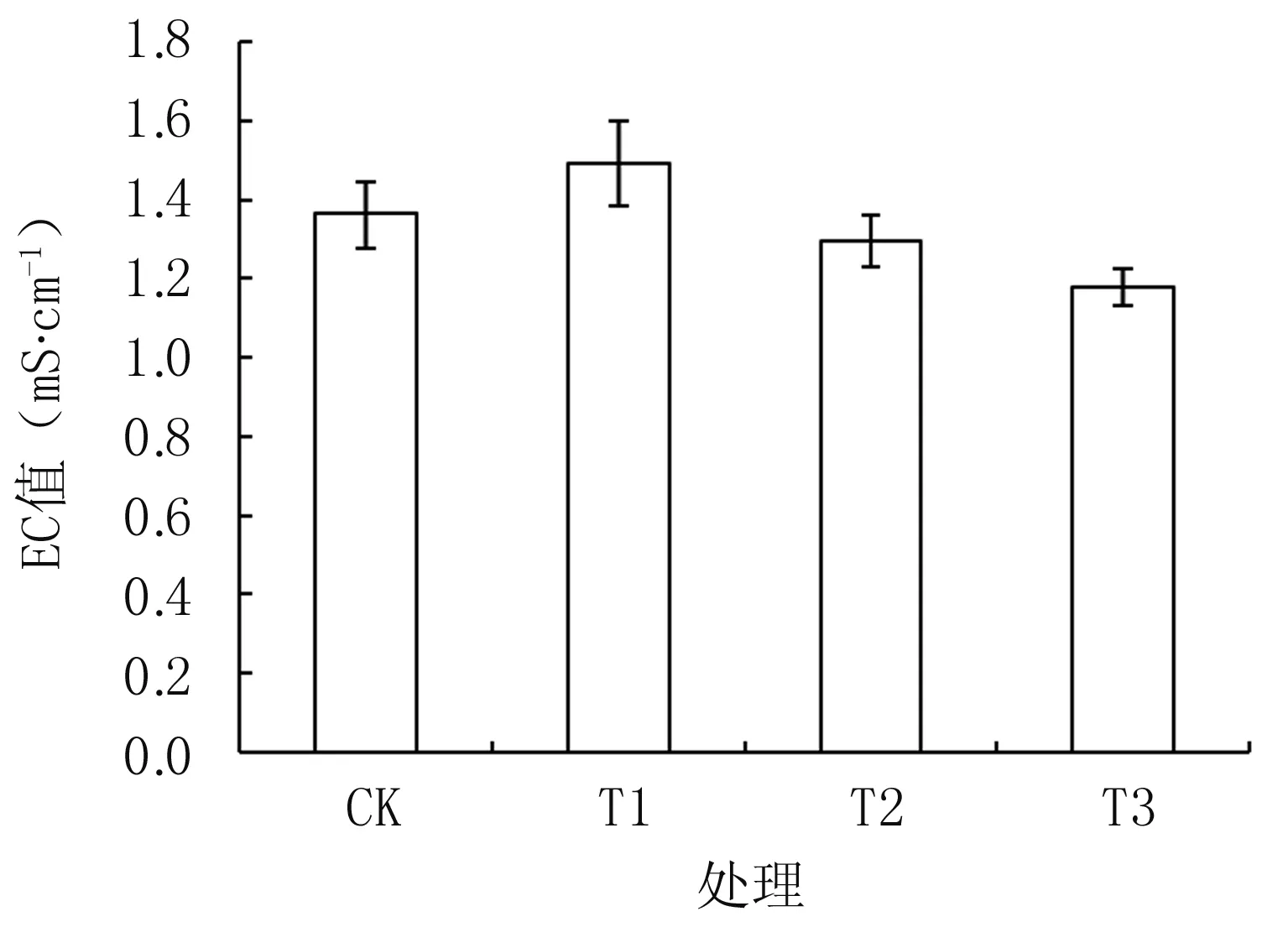
图2不同隔盐层处理0~30 cm土层EC值
2.2不同隔盐层对菠菜光合特性的影响
由图3可知,隔盐处理可显著提高植株净光合速率,CK仅为6.62 μmol CO2·m-2·s-1,T1、T2、T3分别较CK增加55.8%、83.5%、110.8%,差异达显著水平(P﹤0.05)。植株蒸腾速率和气孔导度(图4和图5)的变化趋势与净光合速率的相近,T1、T2、T3的蒸腾速率较CK分别增加42.0%、141.6%、220.5%,气孔导度较CK分别增加18.9%、145.7%、263.9%,差异达显著水平(P﹤0.05)。胞间CO2浓度表现出不同的趋势(图6),T1与T2分别达109.7 μmol CO2mol-1和 166.9 μmol CO2·mol-1,均显著低于CK,T3达181.68 μmol CO2· mol-1,与CK相近。
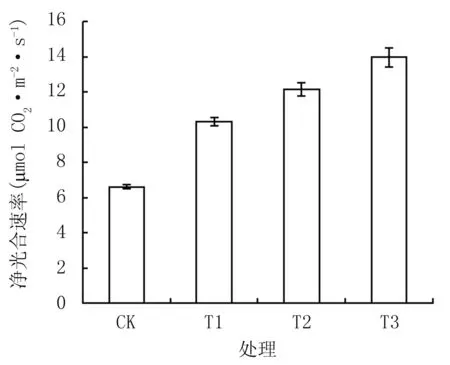
图3不同隔盐层处理的净光合速率
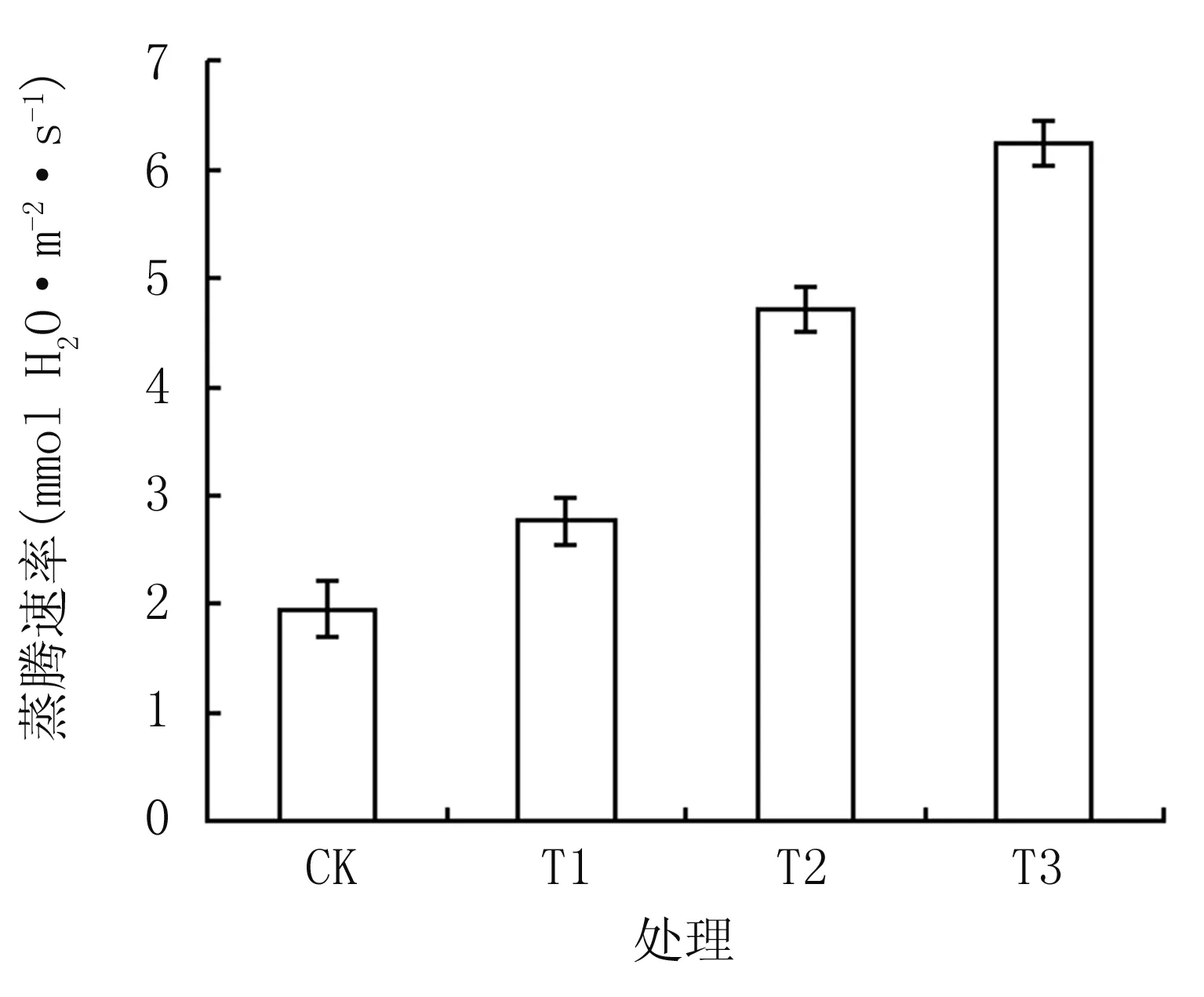
图4不同隔盐层处理的蒸腾速率
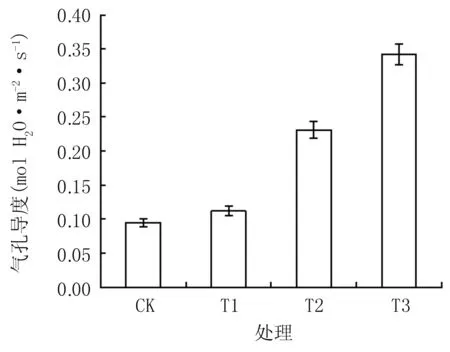
图5不同隔盐层处理的气孔导度
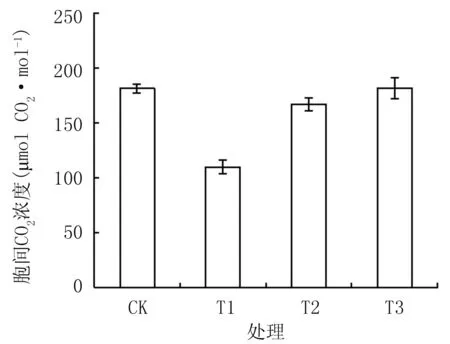
图6不同隔盐层处理的胞间CO2浓度
2.3不同隔盐层对菠菜抗氧化活性的影响
从图7可知,丙二醛(MDA)含量表现为T1>CK>T2>T3,与0~30 cm土层EC值变化趋势相同,表明在本试验条件下,植株的MDA含量与EC具有一定相关性,较高的土壤盐分可以促进MDA的生成。由图8A可知,T2处理的SOD活性达17.0U·g-1FW,高于其它处理,CK为12.5 U·g-1FW,T3低于CK,仅为11.8 U·g-1FW。POD和CAT活性与MDA趋势相近(图8B和图8C),T1的POD和CAT活性分别为27.6 △OD470·min-1·g-1FW和15.6 △OD240·min-1·g-1FW,均高于其它处理,而T3为各处理最低,分别为19.1 △OD470·min-1·g-1FW和11.8 △OD240·min-1·g-1FW,与CK差异达显著水平(P<0.05)。
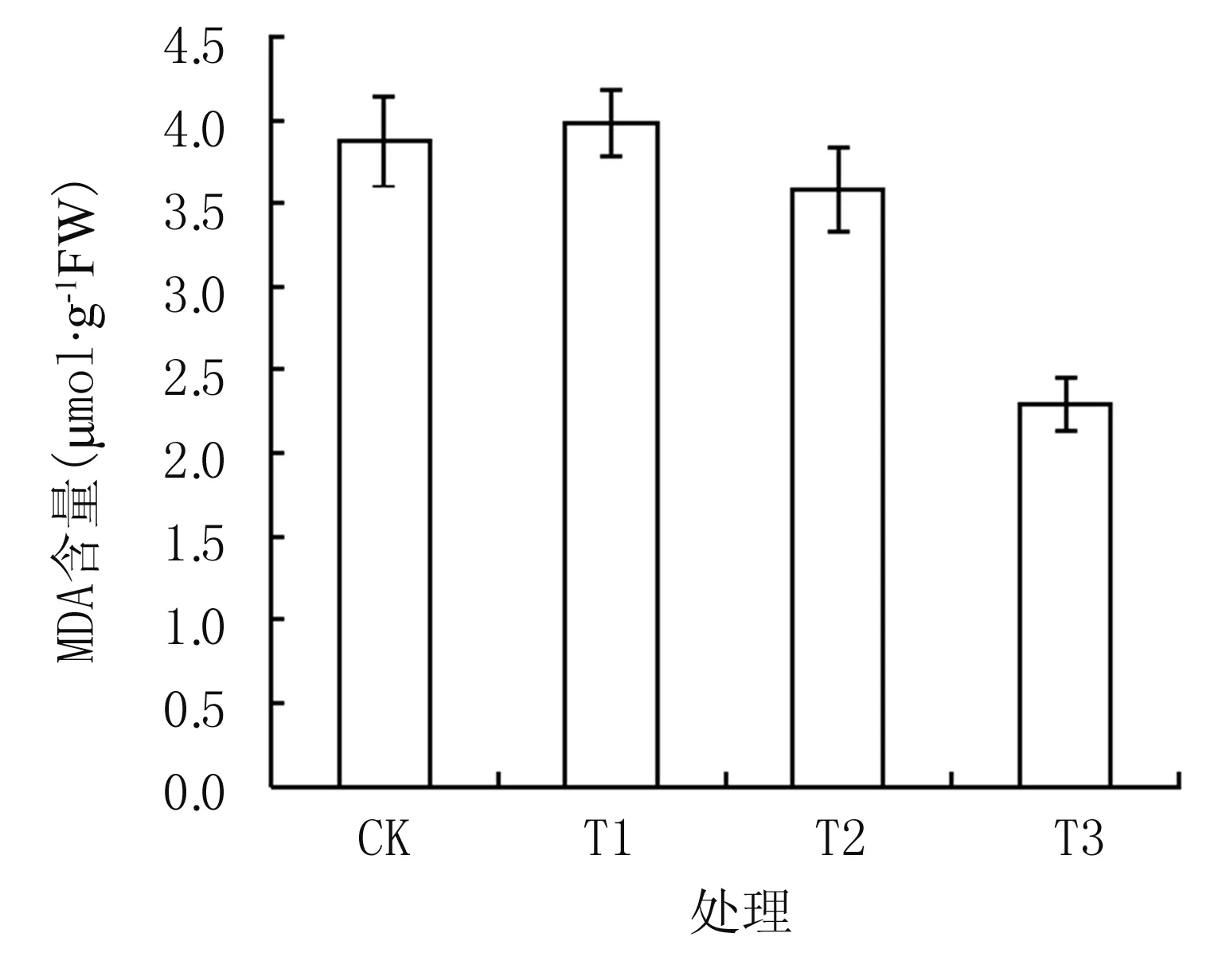
图7不同处理植株MDA含量

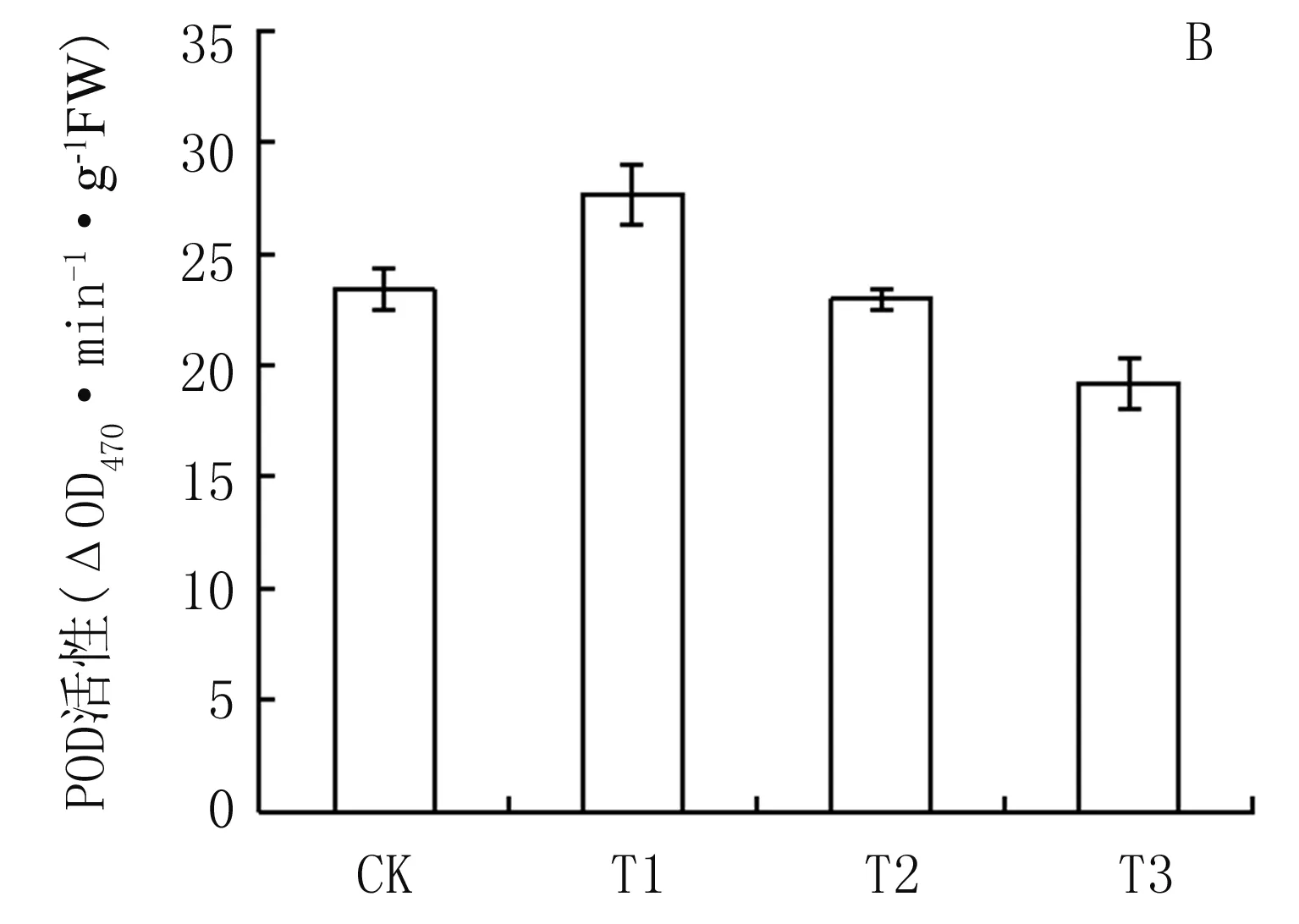

图8不同处理植株SOD、POD、CAT活性
3 讨论与结论
3.1不同隔盐层对土壤电导率的影响
研究表明,砂层可以阻止水的入渗锋面向土砂界面以下渗入,直至水流在界面以上土体迅速聚积至所具有的能量大于砂层中水分的能量后,入渗水才能渗入砂层,可见砂层在一定程度上增大了上层土体的储水能力,起到了阻水减渗作用[9]。砂砾层(T1)在试验中的效果不明显,可能与砂砾的粒度、设施小环境等有关,需进一步试验探究。生物炭的孔隙结构丰富,使其拥有巨大的比表面积,是一种良好的保水材料[15],将其作为隔盐层后,由于隔盐材料和土壤毛管孔隙度的不同,使得隔层以上的土壤水分运行到土壤-隔层界面时发生停滞,隔层以下的土壤水分迁移盐离子也在隔层下界面积累,盐分在上层土壤的积累减少。本试验中T2可降低土壤电导率,T3较CK降低13.2%,降幅更为明显,这与复合有机物料层的特殊结构有关。
3.2不同隔盐层对菠菜光合特性的影响
有研究表明,在盐胁迫条件下,植物幼苗的叶绿体结构受到破坏,可直接影响光合作用的正常进行[16],所导致的降低叶片气孔导度是一种主动的适应行为,能够减少蒸腾作用引起的水分散失,提高水分利用效率[17]。本试验中,CK和T1气孔导度明显低于T2和T3,这是因为CK和T1受到较高浓度的盐胁迫刺激引起渗透胁迫,导致气孔相对关闭较多,同时二者的蒸腾速率也低于T2和T3,该结果与前人的研究相一致[18]。盐胁迫既可以直接影响植物的生长,也可以通过抑制光合作用而间接地影响植物生长,且浓度越高、时间越长、其影响越明显[19]。EC值也间接反映了土壤可溶性盐离子含量[20]。本试验条件下,T1盐分含量高于CK,而净光合速率也高于CK,说明盐胁迫不是造成净光合速率下降的唯一因素。
3.3不同隔盐层对菠菜抗氧化活性的影响
植物在盐胁迫状态下,细胞内活性氧逐渐积累,最终引发膜脂过氧化反应,膜的完整性被破坏,差别性渗透丧失,细胞物质交换失衡,进而导致一系列生理生化代谢紊乱。MDA 是膜脂过氧化作用的主要产物之一,其含量的高低可反映膜脂过氧化反应的程度[21]。本试验表明,菠菜叶片MDA 含量与盐浓度呈正相关,表现为T1>CK>T2>T3,这与前人的观点一致[22,23]。
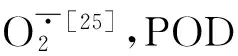
综上所述,砂砾+复合有机物料层(T3)隔盐效果最佳,电导率(EC)较对照降低13.2%,同时可提高菠菜植株的净光合速率、蒸腾速率、气孔导度分别达110.8%、220.5%、263.9%,SOD活性低于其它处理。
[1] 张俊侠,孙德平,司友斌. 设施土壤蔬菜栽培的障碍因子研究[J]. 安徽农学通报, 2001,7(4):52-54.
[2] 张金锦,段增强. 设施菜地土壤次生盐渍化的成因、危害及其分类与分级标准的研究进展[J]. 土壤,2011,43(3):361-366.
[3] 夏立忠,李忠佩,杨林章. 大棚栽培番茄不同施肥条件下土壤养分和盐分组成与含量的变化[J]. 土壤,2005,37(6):620-625.
[4] 孙凯宁,王克安,杨宁,等. 轮作模式下设施菜地主要重金属元素空间分布特征[J]. 山东农业科学,2016,48(11):81-84.
[5] 杜新民,吴忠红,张永清,等. 不同种植年限日光温室土壤盐分和养分变化研究[J]. 水土保持学报,2007,21(2):78-80.
[6] 王金龙,阮维斌. 4种填闲作物对天津黄瓜温室土壤次生盐渍化改良作用的初步研究[J]. 农业环境科学学报,2009,28(9):1849-1854.
[7] 施毅超,胡正义,龙为国,等. 轮作对设施蔬菜大棚中次生盐渍化土壤盐分离子累积的影响[J]. 中国生态农业学报,2011,19(3):548-553.
[8] 张生田. 增施生物有机肥和改良剂对设施蔬菜土壤次生盐渍化的改良效果研究[J]. 北方园艺,2011(12):52-54.
[9] 张莉,丁国栋,王翔宇,等. 隔沙层对盐碱地土壤水盐运动的影响[J]. 干旱地区农业研究,2010,28(2):197-200,207.
[10] 郭相平,杨泊,王振昌,等. 秸秆隔层对滨海盐渍土水盐运移影响[J]. 灌溉排水学报, 2016,35(5):22-27.
[11] 翟鹏辉,李素艳,孙向阳,等. 隔盐层对滨海地区盐分动态及国槐生长的影响[J]. 中国水土保持科学,2012,10(4):80-83.
[12] 王婧,逄焕成,任天志,等. 地膜覆盖与秸秆深埋对河套灌区盐渍土水盐运动的影响[J]. 农业工程学报,2012,18(15):52-59.
[13] Cakmak I,Marschner H. Magnesium deficiency and high light intensity enhance activities of superoxide dismutase, ascorbate peroxidase,and glutathione reductase in bea leaves[J]. Plant Physiology,1992,98(4):1222-1227.
[14] Prochazkovar K D,Sairam G C,Srivastava D V. Single oxidative stress and antioxidant activity as the basis of senescence in maize leaves[J]. Plant Science,2001,161(4):765-771.
[15] 姚俊卿,侯建伟,索全义,等. 不同炭化条件对黑沙蒿生物炭保水性能的影响[J]. 北方园艺,2017(6):171-176.
[16] 王邦锡,何军贤,黄久常. 水分胁迫导致小麦叶片光合作用下降的非气孔因素[J]. 植物生理学报,1992(1):77-84.
[17] Chaves M M,Flexas J,Pinheiro C. Photosynthesis under drought and salt stress: regulation mechanisms from whole plant to cell[J]. Annals of Botany,2009, 103(4):551-560.
[18] Lu C,Qiu N,Wang B,et al. Salinity treatment shows no effects on photosystem Ⅱ photochemistry,but increases the resistance of photosystemⅡ to heat stress in halophyteSuaedasalsa[J]. Journal of Experimental Botany,2003,54(383):851-860.
[19] Sultana N,Ikeda T,Itoh R. Effect of NaCl salinity on photosynthesis and dry matter accumulation in developing rice grains[J]. Environmental and Experimental Botany,1999,42(3):211-220.
[20] 刘广明,杨劲松. 土壤含盐量与土壤电导率及水分含量关系的试验研究[J]. 土壤通报,2001,32(S1):85-87.
[21] Katsuhara M,Otsuka T,Ezaki B. Salt stress-induced lipid peroxidation is reduced by glutathione S-transferase,but this reduction of lipid peroxides is not enough for a recovery of root growth inArabidopsis[J]. Plant Sci., 2005,169(2):369-373.
[22] Sreenivasulu N,Ramanjulu S,Ramaehandra K K.Total peroxidase activity and peroxidase isoforms as modified by salt stress in two cultivars of fox-tail millet with differential salt tolerance[J]. Plant Sci.,1999,141(1):1-9.
[23] Giridarakumar S,Madhusudhan K V,Sreenivasulu N,et al.Stress responses in two genotypes of mulberry (MorusalbaL.) under NaCl salinity[J]. Indian J. Exp. Biol.,2000,38(2):192-195.
[24] Noctor G,Foyer C H. Ascorbate and glutathione:keeping active oxygen under control[J]. Annu. Rev. Plant Physiol.and Plant Mol. Boil.,1998,49:249-279.
[25] Pan Y,Jun W L,Liang Y Z. Effect of salt and drought stress on antioxidant enzyme activities and SOD isoenzymes of liquorice (GlycyrrbizauralensisFiscb) [J]. Plant Growth Regul.,2006,49(2/3):157-165.
[26] Parida A K,Das A B. Salt tolerance and salinity effects on plants:a review[J]. Ecotoxicol. Environ. Saf.,2005,60(3):324-349.
[27] Tsang E W T,Bowler C,Herouart D,et al. Differential regulation of superoxide dismutases in plants exposed to environmental stress[J]. The Plant Cell,1991,3(8):783-792.
EffectsofDifferentSaltIsolatingMethodsonPhotosyntheticCharacteristicsandAntioxidantEnzymeActivitiesofSpinach
Sun Kaining,Wang Ke’an,Yang Ning
(InstituteofVegetablesandFlowers,ShandongAcademyofAgriculturalSciences/ShandongBranchofNationalImprovementCenterforVegetables/ShandongProvincialKeyLaboratoryforBiologyofGreenhouseVegetables,Jinan250100,China)
According to the serious present situation of soil salinization in greenhouse soil,3 salt isolating layer types, gravel layer (T1),compound organic material layer (T2) and gravel and compound organic material layer (T3), were set up to explore the effects of different salt isolating measures. The results showed that the salt isolating effect of T3 was the best,the conductivity (EC) reduced by 13.2% than the control,followed by T2. The salt isolating measure could significantly increase the photosynthetic rate of spinach plants(P<0.05),and T1,T2 and T3 increased by 55.8%,83.5% and 110.8% compared with CK,respectively. The trends of transpiration rate and stomatal conductance were similar to that of photosynthetic rate. Compared with CK,the transpiration rate of T1,T2 and T3 increased by 42.0%,141.6% and 220.5%, respectively. The stomatal conductance significantly increased by 18.9%,145.7%,263.9%,respectively (P<0.05). The trends of MDA content,POD activity and CAT activity were the same as that of soil EC. The SOD activity of T2 reached 17.0 U·g-1FW,which was higher than other treatments,and T3 was the lowest with only 11.8 U·g-1FW.
Greenhouse soil;Salinization;Salt isolating layer; Photosynthetic rate;Antioxidant enzyme
S636.101
A
1001-4942(2017)10-0036-05
10.14083/j.issn.1001-4942.2017.10.008
2017-05-22
国家大宗蔬菜产业技术体系项目(CARS-25-G-24);山东省农业科学院青年科研基金项目(2014QNM35);山东省现代农业产业技术体系蔬菜创新团队项目(SDAIT-05-07);山东省农业科学院农业科技创新工程项目(CXGC2016B06,CXGC2016A06)
孙凯宁(1985—),男,博士,助理研究员,研究方向为蔬菜营养、土壤改良及重金属污染。E-mail:sunkaining-123@163.com
王克安(1963—),男,硕士,研究员,主要从事蔬菜栽培、设施工程与环境调控技术方面研究。E-mail: wka6302@126.com
