CFDA2017新《医疗器械分类目录》浅析*
2017-11-01黄军斌崔泽实
麻 良 黄军斌 王 菲 崔泽实
CFDA2017新《医疗器械分类目录》浅析*
麻 良①②黄军斌③△王 菲④*崔泽实①*
目的:解读国家食品药品监督管理总局2017年8月31日发布的新《医疗器械分类目录》(新《分类目录》)。方法:借鉴美国食品药品管理局(FDA)和欧盟医疗器械分类方法,对分类原则、层级结构等方面进行比较研究;对医疗器械分类研究报道进行文献计量分析,揭示此项研究的聚焦度与发展特点。结果:新《分类目录》基于临床医学学科分类结合功能需求的分类方法,将医疗器械分类聚焦在临床使用上,无疑将有利于企业、医疗、监管等领域的应用;在2002年版43类的基础上凝集为22类,另较美国FDA增加了医用成像、放射治疗、医用软件等6个子目录,符合技术进展实际;检索中国知网(2002-2017年)获得673篇文献,发文量基本上呈逐年增加趋势,表明研究一直处于较活跃势态。结论:新《分类目录》体现以技术专业和临床使用特点为分类原则,层级结构便于多方使用及与国际接轨,是医疗器械监管科学发展的结果。
医疗器械;分类目录;监管;风险管理
由表1可见,在新《分类目录》的22个子目录中有19个与一个或以上临床医学二级学科或三级学科相关,而子目录12、13两项植入器械及子目录15患者承载器械与多学科的临床应用及其诊疗流程即“临床使用特点”相关。因此,可以认为新《分类目录》是基于临床医学学科分类结合功能需求的分类方法。把医疗器械分类聚焦在临床使用上,无疑将有利于企业、医疗、监管等领域的应用。
1.2 采用层级结构加风险管理类别标注
对新《分类目录》可以理解为整体上有子目录、一级产品类别(205个)、二级产品类别(1094个;标注产品描述、预期用途)、产品品名(举例)4层级分层结构,并将管理类别标注到品名(举例),以有源手术器械为例,层级结构如图1所示。
美国食品药品管理局(Foodand Drug Administration,FDA)分类结构是在16个专业子类的基础上,在每个子类中除总则外(Subpart A General Provisions)把此类医疗器械按产品功能及用途细分到“诊断、治疗、监测、其他”4个亚类,相应的产品可在Subpart下累列[2]。以麻醉类为例分层结构如图2所示。
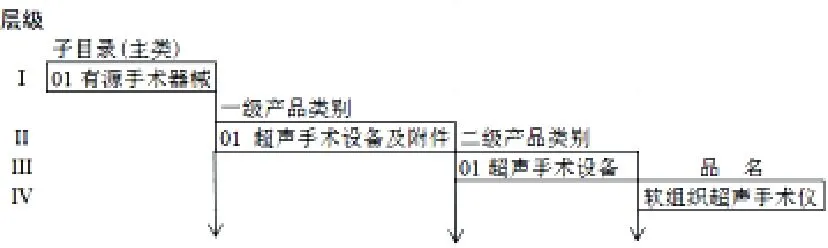
图1 新《分类目录》有源手术器械的层级结构图

图2 美国FDA医疗器械分类中麻醉设备类的分层结构图
1.3 体现机制创新
目前,有关报道讨论较集中在美国FDA和欧盟等分类方法[3-5]。FDA在《联邦法规汇编》(Code of Federal Regulations)第21卷(21 CFR862-892)中列出了16大类医疗器械,欧盟委托欧洲标准化组织在参考多个国家的医疗器械分类基础上编制了“全球医疗器械命名系统”(global medical device nomenclature,GMDN),两者比较见表2。

表1 医疗器械分类目录(CFDA2017年第143号)
新《分类目录》在2002年版43类的基础上凝集为22类,与美国FDA及GMDN分类进行比较,总体与两者兼容,更便于与国际接轨,较美国FDA多6个类别。
(1)医用成像器械:集合了放射学成像、磁共振成像、核医学成像、超声成像及窥镜5个子类(一级产品类别),与目前国际惯用及市场研究数据归类基本一致。
(2)放射治疗器械:美国FDA与GMDN是把“诊断与治疗放射设备”归为一类,新《分类目录》单列出此项。
(3)医疗器械消毒灭菌器械:随着对院内感染控制的日趋重视,消毒灭菌器械渗透在医疗机构外科、口腔等诸技术环节,消毒供应中心(central sterile supply department,CSSD)已逐步成为一个重要的专业领域,制定此分类顺应了医院管理需求[6]。
(4)有源介入器械与无源介入器械:区分于低值耗材,两类器材属于目前惯用的“高值医用材料”范畴[7]。由于介入放射学技术的进展及老龄化、疾病谱改变等因素驱动,市场份额逐年增长,如果统含在医用耗材中显然不甚合适。
(5)医用软件:分列此项符合对医疗器械定义的描述,应用软件已成为医疗器械的特定产品类别;此外,医疗器械软件带来的医疗风险越来越引发人们注意,美国医疗技术评估机构ECRI在所发表的“Top 10 Health Technology Hazards for 2017”一文中将软件管理列为第6位,认为“软件管理问题将把患者和患者数据置于风险之中”[8]。
(6)医用诊察和监护器械及注输、护理和防护器械两个子类,也反映出此类产品临床应用与技术发展的趋同性。
CFDA新《分类目录》与美国FDA在二级及以下结构的分类原则上有所不同(正如图1、图2所示),大致可以认为CFDA是沿着医疗器械的工程学属性向下细分,并将主设备与配套装置、附件分别列出,便于管理;而美国FDA是在二级结构开设了4个功能区向下衔接相关产品。
综上所述,新《分类目录》的制定是建立在对我国前期经验的总结优化及对国外分类方法深入分析研究的基础上,体现机制创新。
2 新《分类目录》彰显医疗器械监管的科学发展
2002年版《医疗器械分类目录》发布至今不乏有关医疗器械分类研究的报道。以“医疗器械”为主题词并含“分类”检索中国知网2002-2017年文献数据,共检索到文献747篇,剔除报刊为673篇;其中期刊文献472篇、会议文献51篇、学位论文150篇。年代分布呈波折式增加,在2012年达到69篇,期刊文献在2014年最多为53篇,之后显见进入平台期,如图3所示。
由图3可见,医疗器械分类是较为热点的研究领域,也是学术会议交流较活跃的专题,特别是学位论文达到了150篇。诸多学者在指出2002年版《医疗器械分类目录》存在着目录划分原则相互交叉、缺乏产品类别的描述与定义等需要改进之处的同时,对美国FDA、欧盟等分类方法进行了较为广泛的比较研究[4-5,9-10]。实际上1997年CFDA就发布了《医疗器械分类目录》,在2002年版《医疗器械分类目录》发表后,CFDA也在不断充实内容,如2012年CFDA发布食药监办械[2012]108号文件对《6823医用超声仪器及有关设备》、《6830医用X射线设备》、《6831医用X射线附属设备及部件》、6834医用射线防护用品、装置》4个子目录进行了修订[11]。
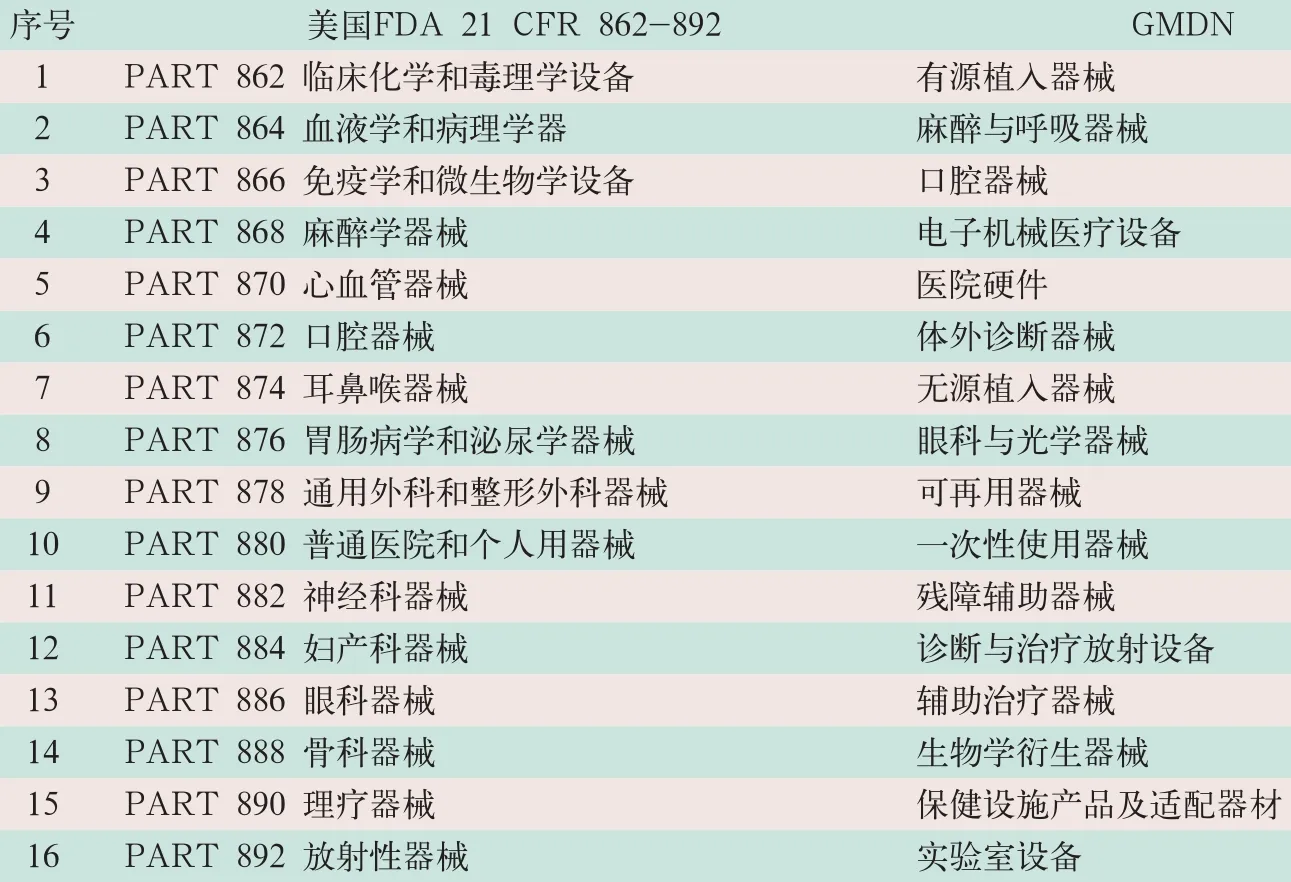
表2 美国FDA与全球医疗器械命名系统
正是在这些研究工作的基础上,2015年CFDA发布《医疗器械分类规则》(国家食品药品监督管理总局令第15号),随之《医疗器械分类目录》的修订工作正式启动。表明国家医疗器械监管部门高度重视医疗器械分类研究工作,新《分类目录》彰显出医疗器械分类目录制定的科学发展进程。

图3 2002-2017年医疗器械分类研究文献分布图
3 有关思考
推行《医疗器械分类目录》的主要目的是用于指导监管部门和企业识别产品管理类别,并作为划分不同层级监管职能、实施不同层级注册审批制度的重要依据[11]。但鉴于医疗器械监管是围绕医疗器械的全生命周期进行,涉及生产、市场前管理、市场中管理、在用管理等诸环节,因此分类目录的应用将渗透到企业、医疗卫生机构、高校及科研院所、评估机构、行业协会等领域。为全面实施新《分类目录》,联动相关领域工作,需要考虑以下方面。
3.1 建立分类数据的转换机制
为有效实施新《分类目录》,有必要在2002年版与2017年版之间开展词目转换研究,建立分类数据的转换机制,为基层单位的数据库管理提供便利条件。尝试与美国FDA、欧盟等分类目录的转换研究,对开展市场数据分析等国际接轨工作会有一定帮助。
3.2 加强医疗器械代码研究
代码是信息管理的重要标签,目前我国采用的医疗器械代码不甚一致,在医学装备信息的收集与各渠道信息转换上存在诸多不便[12]。早在1990年,原卫生部和国家中医药管理局联合发布了《全国卫生系统医疗器械仪器设备(商品、物资)分类与代码》(标识代号:WZB 01-90),WZB01-90是在国家标准GB7635-1987基础上编制,作为全国卫生系统物资管理的专业标准;1999年修订再版为《全国卫生行业医疗器械仪器设备(商品、物资)分类与代码:WS/T118-1999》。在贯彻新《分类目录》的同时,应同步加强医疗器械代码研究,渴望达到全国统一使用。
3.3 尽快与医疗器械大数据研究接轨
开展大数据分析与分析工具研究、建立大数据平台是近年我国医学装备行业的聚焦专题,新《分类目录》也为医疗器械大数据研究创造了基础条件,建议应尽快接轨,发挥大数据在我国深化医药卫生改革中的作用,有效服务于健康事业。
[1]马艳红,安慧娟.创新机制 精准分类 稳妥实施[N].中国医药报,2017-09-05(003).
[2]https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfPCD/classification.cfm[DB/OL].
[3]周良彬,伍倚明,李伟松,等.国内外医疗器械分类管理思路和规则的对比分析[J].中国医疗器械信息,2016,22(7):26-31,35.
[4]曹青,李文,廖晓曼,等.国内外医疗器械分类管理现状和思路简介[J].医疗装备,2016,29(1):56-58.
[5]张兆丰.医疗器械分类系统及方法剖析[J].中国医疗器械杂志,2010,34(6):452-454.
[6]沈逸君.医院消毒灭菌设备概论[J].中国医学装备,2005,2(10):46-48.
[7]麻良,王菲,崔泽实,等.我国医用耗材管理研究热点的文献计量学社会网络分析[J].中国医学装备,2016,13(1):35-40.
[8]EXECUTIVE BRIEF Top 10 Health Technology Hazards for 2017[J/OL],ECRI Institute.Excerpted from:Health Devices 2016 November,www.ecri.org/2017hazards.
[9]杨昕,卓越.完善医疗器械分类方法的建议[J].中国医疗器械杂志,2015,39(06):449-450,459.
[10]付晓阳,孙利华.国外医疗器械分类管理经验对我国的启示[J].中国医药导刊,2012,14(12):2207-2208,2206.
[11]李静莉,郑佳,张春青,等.中国医疗器械分类目录全面修订的设计与思考[J].中国医疗器械杂志,2017,41(4):283-285,305.
[12]杨骁婷,陈小玲,周奕,等.医疗器械分类及编码分析[J].中国处方药,2013,11(6):20-22.
Brief analysis of CFDA 2017 new edition classification and catalogue of medical devices/
MA Liang, HUNAG Jun-bin, WANG Fei, et al//
China Medical Equipment,2017,14(10):130-133.
Objective: to interpret the new edition and catalogue of medical devices issued by the China Food and Drug Administration(CFDA)in August 31, 2017(new catalogue).Methods: Based on the United States FDA, EU medical device classification methods, a comparative study of the classification principle, hierarchy structure; bibliometric analysis of medical device classification research reports, focusing degree and development characteristics of the study. Results:the classification of new categories in clinical medicine was classified according to the functional requirements.The classification of medical devices focused in clinical applications, it will facilitate the applications of enterprise,medical and health institutions, regulators and other fields; on the basis of the 43 categories of the 2002 edition,aggregated into 22 categories, other than the United States FDA increase in medical imaging and radiation therapy and medical software etc 6 categories, in accordance with the recent technical progress. CNKI(2002~2017) acquired the 673 articles, articles basically increase year by year, that has been in a state of active research. Conclusion: The new catalogue of medical devices embodies the features of technical specialty and clinical applications, which is classified principle, hierarchical structure, convenient for multi-field use and acting on international standards. It is the result of scientific development of medical device supervision and administration.
Medical device; Classified catalogue; Supervision and administration; Risk management
1.College of Pharmacy, China Medical University, Shenyang, 110122,China. 2.Department of Human resource, The First Hospital of China Medical University ,Shenyang 110001, China.
10.3969/J.ISSN.1672-8270.2017.10.038
麻良,男,(1988- ),硕士,助教。中国医科大学药学院、中国医科大学附属第一医院人力资源部,从事卫生(装备)技术评估与社会医学研究。
1 对新《分类目录》的初步认知
,新《分类目录》更贴近临床医学学科分类与医学技术流程,体现以需求为导向,正如2017年第143号文件所述“新《分类目录》按技术专业和临床使用特点分为22个子目录”,见表1。
2017-08-16
1672-8270(2017)10-0130-04
R197.39
A
△共同第一作者:黄军斌
辽宁省教育厅项目(辽教发[2014]108)“生命科学(医药工)综合实验实训平台”;沈阳市科学技术项目(F12-264-4-01)“分子细胞计量学实验技术数字资源共享服务平台”
①中国医科大学药学院 辽宁 沈阳 110122
②中国医科大学附属第一医院人力资源部 辽宁 沈阳 110001
③吉林大学公共卫生学院 吉林 长春 130021
④中国医科大学财务处 辽宁 沈阳 110122
*通讯作者:wangfei@cmu.edu.cn;zscui@cmu.edu.cn
在国家食品药品监督管理总局(China Food and Drug Administration, CFDA)发布2002年版《医疗器械分类与代码》后时隔15年,于2017年8月31日又发布新版《医疗器械分类目录》(根据CFDA2017年第143号文件以下简称“新《分类目录》”),自2018年8月1日起施行。9月5日《中国医药导报》以“创新机制 精准分类 稳妥实施”为题报道[1]。因此,认知2017年新《分类目录》的分类原则、基本结构以及基本要素,对贯彻实施甚为重要。
1.1 以技术专业和临床使用特点为分类原则