美沙拉嗪联合康复新液保留灌肠治疗活动期溃疡性结肠炎的临床观察
2017-11-01何元清何子彬王玉琼广元市第三人民医院消化内科四川广元628000
何元清,何子彬,张 晗,何 丽,杨 涛,赵 娟,王玉琼,周 骥(广元市第三人民医院消化内科,四川广元628000)
美沙拉嗪联合康复新液保留灌肠治疗活动期溃疡性结肠炎的临床观察
何元清*,何子彬,张 晗,何 丽,杨 涛,赵 娟,王玉琼,周 骥(广元市第三人民医院消化内科,四川广元628000)
目的:观察美沙拉嗪联合康复新液保留灌肠治疗活动期溃疡性结肠炎(UC)的临床疗效及安全性。方法:选取2012年3月-2014年8月在我院消化内科治疗的活动期UC患者120例,按照随机数字表法分为观察组和对照组,各60例。两组患者均给予活动期UC常规治疗,对照组患者在此基础上口服美沙拉嗪肠溶片1 g,tid;观察组患者在对照组的基础上加用康复新液30 mL加入生理盐水150 mL稀释后灌肠,qd。两组患者均治疗30 d。观察两组患者治疗前后血清肿瘤坏死因子(TNF)-α、白细胞介素1(IL-1)、IL-8、IL-10、超氧化物歧化酶(SOD)、一氧化氮(NO)、过氧化脂质(LPO)水平,比较两组患者临床疗效、复发率、肠镜疗效及不良反应发生情况。结果:治疗前,两组患者血清TNF-α、IL-1、IL-8、IL-10、SOD、NO、LPO水平比较,差异均无统计学意义(P>0.05)。治疗后,两组患者血清TNF-α、IL-1、IL-8、NO、LPO水平均明显降低,血清IL-10、SOD水平明显升高;且观察组患者血清TNF-α、IL-1、IL-8、NO、LPO水平明显低于对照组,IL-10、SOD水平明显高于对照组,差异均有统计学意义(P<0.05)。观察组患者临床有效率为83.3%,复发率为11.7%,肠镜有效率为88.3%,显著优于对照组的66.7%、30.0%、70.0%,差异均有统计学意义(P<0.05)。两组患者总不良反应发生率比较,差异无统计学意义(P>0.05)。结论:美沙拉嗪联合康复新液保留灌肠可有效减轻活动期UC患者炎症反应及氧自由基损伤,且安全性较高。
美沙拉嗪;康复新液;活动期;溃疡性结肠炎;炎症反应
溃疡性结肠炎(UC)是一种病因及发病机制尚未阐明的累及结肠或直肠黏膜及黏膜下层的慢性非特异性炎症,研究显示UC的发病与遗传、感染、免疫、环境等因素密切相关,其中肿瘤坏死因子α(TNF-α)、白细胞介素1(IL-1)、IL-10等炎症因子失衡、免疫反应异常、氧自由基损伤在UC的病情进展中起重要作用[1-2]。近10年,UC的病例报道数量增长了约10倍,其病程长、病情反复、治愈难度大、并发症较多、可致癌变,已经成为消化科医师面临的较为棘手的疾病[3-4]。目前,临床上治疗UC的主要手段包括氨基水杨酸、免疫抑制剂、糖皮质激素、益生菌、神经免疫调控剂、中药灌肠等[5-6]。柳汝明等[7]通过荟萃分析发现,美沙拉嗪总有效率及不良反应发生率明显优于柳氮磺吡啶,已经逐渐成为UC治疗的首选药物。康复新液保留灌肠可直达结肠或直肠病变部位,药物吸收率高,不良反应较少,已逐渐成为控制活动期UC的辅助治疗手段[8]。因此,本研究通过美沙拉嗪联合康复新液保留灌肠治疗活动期UC患者,观察其临床疗效及安全性,现报道如下。
1 资料与方法
1.1 纳入与排除标准
纳入标准:(1)符合2012年中华医学会消化病学分会炎症性肠病学组制订的活动期UC诊断标准[9];(2)年龄18~70岁;(3)存在腹泻、黏液脓血便等UC临床症状,肠镜提示活动期UC;(4)近1月未服用糖皮质激素、免疫抑制剂或其他类型氨基水杨酸制剂。
排除标准:(1)妊娠或哺乳期妇女;(2)心、肝、肾功能不全、血液系统疾病者;(3)合并肠道良恶性肿瘤或系统性红斑狼疮、类风湿性关节炎等自身免疫疾病者;(4)存在胃肠道切除手术史者;(5)存在美沙拉嗪及康复新液使用禁忌证者。
1.2 研究对象
本研究收集2012年3月-2014年8月在我院消化内科治疗的活动期UC患者120例,采用随机数字表法分为对照组和观察组,各60例。两组患者的年龄、性别、病程、病变部位、病情严重程度等一般资料比较,差异均无统计学意义(P>0.05),具有可比性,详见表1。本研究方案经医院医学伦理委员会批准,患者知情同意并签署知情同意书。

表1 两组患者一般资料比较Tab 1Comparison of general information of patients between 2 groups
1.3 治疗方法
两组患者均给予常规治疗,包括营养支持、补液、纠正水、电解质、酸碱平衡紊乱,同时口服双歧杆菌四联活菌片(杭州远大生物制药有限公司,批准文号:国药准字S20060010,规格:每片0.5 g)1.5 g,tid。对照组患者在常规治疗基础上口服美沙拉嗪肠溶片(葵花药业集团佳木斯鹿灵制药有限公司,批准文号:国药准字H19980148,规格:0.25 g)1 g,tid;观察组在对照组基础上加用康复新液(昆明赛诺制药有限公司,批准文号:国药准字Z53020054,规格:50 mL∶100 mL)30 mL加入生理盐水150 mL中稀释,并加温至37,患者取膝胸位,垫高臀部,灌肠管置入肛门10 cm~15 cm处,每次灌肠时间约20~30 min,qd。两组患者均治疗30 d。
1.4 观察指标
(1)检测两组患者治疗前后的炎症因子(TNF-α、IL-1、IL-8、IL-10)及氧化应激[超氧化物歧化酶(SOD)、过氧化脂质(LPO)、一氧化氮(NO)]水平。清晨抽取患者空腹静脉血10 mL,经离心后,取上层血清置于-80冰箱保存,待检。TNF-α、IL-1、IL-8、IL-10检测试剂盒由军事医学科学院邦定生物公司提供,SOD、LPO检测试剂盒由上海沪峰生物科技有限公司提供,采用酶联免疫吸附测定(ELISA)法检测;NO检测试剂盒由上海继锦化学科技有限公司提供,采用硝酸还原酶法测定。上述指标均使用680型酶标仪(美国Bio-Rad公司),严格按照相关仪器及试剂盒说明书操作。(2)观察两组患者临床疗效。疗效评价标准[10]——显效:症状、体征基本消失,结肠镜检糜烂消失、溃疡愈合、黏膜恢复正常,大便常规检查阴性;有效:症状、体征显著改善,结肠镜检黏膜轻度炎症、假息肉形成,大便常规检查阴性;无效:症状、体征无改善或恶化,结肠镜检无改善或加重。总有效=显效+有效。肠镜效果评价依据Barons分级标准[11]进行评估——显效:治疗后进步2级或明显缓解;有效:治疗后进步1级;无效:治疗后无进步或加重。总有效=显效+有效。同时对两组患者随访1年,统计复发率。(3)观察两组患者不良反应发生情况。
1.5 统计学方法
采用SPSS 20.0软件对数据进行统计分析。计量资料以±s表示,采用t检验;计数资料或等级资料以例数或率表示,前者采用χ2检验,后者采用秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者治疗前后炎症因子水平比较
治疗前,两组患者血清TNF-α、IL-1、IL-8、IL-10水平比较,差异均无统计学意义(P>0.05);治疗后,两组患者血清TNF-α、IL-1、IL-8水平均较治疗前显著降低,血清IL-10水平较治疗前显著升高,且观察组患者上述指标均显著优于对照组,差异均有统计学意义(P<0.05),详见表2。
2.2 两组患者治疗前后氧化应激水平比较
治疗前,两组患者血清SOD、LPO、NO水平比较,差异均无统计学意义(P>0.05);治疗后,两组患者血清LPO、NO水平均较治疗前显著降低,血清SOD水平较治疗前明显著高,且观察组患者上述指标均显著优于对照组,差异均有统计学意义(P<0.05),详见表3。
表2 两组患者治疗前后炎症因子水平比较(±s,ng/mL)Tab 2Comparison of inflammatory factor levels between 2 groups before and after treatment(±s,ng/mL)

表2 两组患者治疗前后炎症因子水平比较(±s,ng/mL)Tab 2Comparison of inflammatory factor levels between 2 groups before and after treatment(±s,ng/mL)
注:与治疗前比较,*P<0.05Note:vs.before treatment,*P<0.05
组别对照组观察组IL-1 n IL-8IL-10 t P治疗后1.1±0.3*1.3±0.3*3.65<0.01 60 60 TNF-α治疗前254.2±25.8 256.8±26.5 0.54 0.59治疗后187.8±15.5*153.6±16.3*11.78<0.01治疗前0.8±0.3 0.9±0.3 1.82 0.07治疗后0.6±0.2*0.4±0.3*4.30<0.01治疗前1.3±0.5 1.2±0.4 1.21 0.23治疗后0.9±0.4*0.7±0.4*2.74<0.01治疗前0.9±0.4 0.8±0.3 1.55 0.12
表3 两组患者治疗前后氧化应激水平比较(±s)Tab 3Comparison of oxidant stress levels between 2 groups before and after treatment(±s)
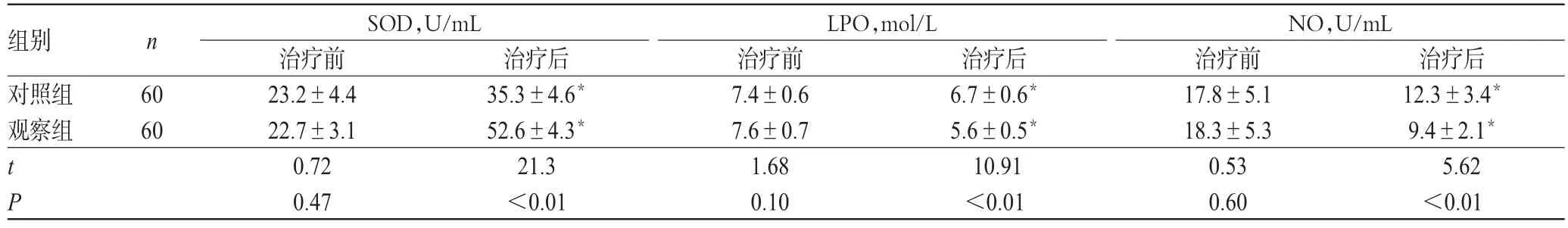
表3 两组患者治疗前后氧化应激水平比较(±s)Tab 3Comparison of oxidant stress levels between 2 groups before and after treatment(±s)
注:与治疗前比较,*P<0.05Note:vs.before treatment,*P<0.05
组别对照组观察组LPO,mol/L n NO,U/mL 60 60 t P治疗后12.3±3.4*9.4±2.1*5.62<0.01 SOD,U/mL治疗前23.2±4.4 22.7±3.1 0.72 0.47治疗后35.3±4.6*52.6±4.3*21.3<0.01治疗前7.4±0.6 7.6±0.7 1.68 0.10治疗后6.7±0.6*5.6±0.5*10.91<0.01治疗前17.8±5.1 18.3±5.3 0.53 0.60
2.3 两组患者临床疗效比较
观察组患者的临床总有效率为83.3%,显著高于对照组的66.7%;复发率为11.7%,显著低于对照组的30.0%,差异均有统计学意义(P<0.05),详见表4。
2.4 两组患者肠镜疗效比较
观察组患者的肠镜总有效率为88.3%,显著高于对照组的70.0%,差异有统计学意义(P<0.05),详见表5。
2.5 不良反应
两组患者治疗过程中均未出现严重的药物相关的不良反应;治疗过程定期复查肝肾功能、血尿常规及凝血功能,均未发现明显异常。观察组患者有2例出现轻度恶心,1例出现轻度反酸,3例出现肛门刺激症状;对照组患者有2例出现轻度恶心呕吐,1例出现轻度头晕,1例出现皮疹。上述患者给予对症处理后均恢复正常。观察组和对照组总不良反应发生率分别为10.0%和6.7%,差异无统计学意义(P>0.05)。
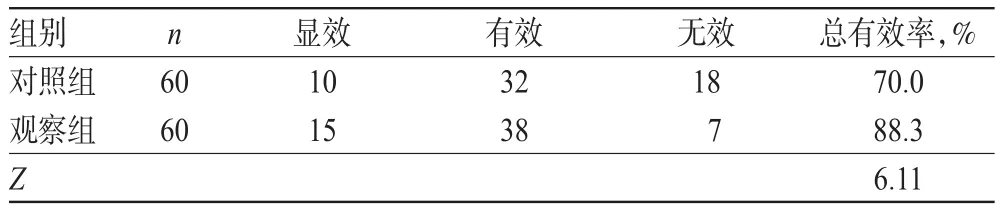
表5 两组患者肠镜疗效比较Tab 5Comparison of colonoscopy efficacies between 2 groups
3 讨论
UC发病机制复杂,免疫反应异常、炎症因子失衡是其发病的重要因素。细菌感染等作用于UC遗传易感人群,激活患者体内异常的免疫反应,黏附分子、炎性细胞等释放大量炎症介质,同时抑炎因子水平下降,从而诱发结肠或直肠黏膜弥散性炎症及溃疡[12]。UC肠道病理显示,黏膜固有层伴有大量中性粒细胞、单核细胞、淋巴细胞、嗜酸性粒细胞、浆细胞等的浸润;患者常表现为长期反复发作的腹泻、黏液脓血便、里急后重、腹痛、营养不良等[13]。
美沙拉嗪作为治疗UC的一线药物,可诱导核因子κB(NF-κB)的活化和过氧化物增殖活化受体γ(PPAR-γ)基因的表达,进而抑制前列腺素E2(PGE2)的合成,而PGE2是参与UC患者肠道炎症反应的重要介质,降低肠道PGE2的含量可有效控制肠道炎症[14]。经研究证实,美沙拉嗪可有效抑制肠道炎症细胞功能,降低白三烯的含量,有效清除羟基等多种氧自由基以发挥控制肠道炎症、减轻肠黏膜损伤、改善患者症状等效果[15]。本研究结果显示,治疗后对照组患者TNF-α、IL-1、IL-8明显低于治疗前,而IL-10明显高于治疗前,血清SOD、NO、LPO水平较治疗前明显改善,说明美沙拉嗪对活动期UC具有控制炎症、减轻肠道氧化应激损伤的作用。
康复新液是由从美洲大蠊干燥虫体中提取的有效成分所制成的富含多种肽类和多元醇的新型中成药,具有通利血脉、去腐生肌的功效,可有效促进毛细血管增生及肉芽组织生长,改善结肠及直肠黏膜血流灌注,促进肠道坏死组织脱落,加速溃疡及创面修复再生;同时可有效提高患者免疫功能,抑制肠道炎症,减轻炎性水肿,提高单核巨噬细胞、淋巴细胞、血清溶菌酶的活性,升高SOD水平,降低NO、LPO水平,促进机体抗炎与抑炎反应的平衡[8,16]。本研究结果显示,美沙拉嗪口服联合康复新液保留灌肠可明显降低患者血清TNF-α、IL-1、IL-8水平,提高IL-10水平,效果优于单纯口服美沙拉嗪;同时,观察组患者治疗后血清SOD水平明显高于对照组,而LPO、NO水平明显低于对照组,这主要由于美沙拉嗪和康复新液通过不同作用机制发挥抗炎作用,共同增强机体清除氧自由基的能力,减轻肠道氧自由基损伤。两药协同作用的效果较单一用药更好。同时本研究结果还显示,观察组患者临床疗效及肠镜改善情况均明显优于对照组,这进一步证实了美沙拉嗪联合康复新液的临床效果。两组患者治疗过程中均未出现严重的药物相关不良反应,部分患者出现的轻度不良反应在给予对症处理后均恢复正常,不良反应发生率亦无统计学差异,这充分说明了美沙拉嗪与康复新液联用并未增加治疗的风险,安全性较高。
综上所述,美沙拉嗪联合康复新液保留灌肠治疗活动期UC疗效较好,可有效减轻患者炎症反应,增强清除氧自由基能力,减轻氧自由基损伤,同时不良反应较少,安全性较高。但由于本研究样本量较小、随访时间较短、证据等级较低,结果仍有待于高质量随机对照研究证实。
[1]Nirei T,Kazama S,Hiyoshi M,et al.Successful treatment of rectovaginal fistula complicating ulcerative colitis with infliximab:a case report and review of the literature[J].J Clin Med Res,2015,7(1):59-61.
[2]Taghvaei T,Maleki I,Nagshvar F,et al.Fecal calprotectin and ulcerative colitis endoscopic activity index as indicators of mucosal healing in ulcerative colitis[J].Intern Emerg Med,2015,10(3):321-328.
[3]Stallmach A,Nickel L,Lehmann T,et al.Parameters of a severe disease course in ulcerative colitis[J].World J Gastroenterol,2014,20(35):12574-12580.
[4]孙菁,袁耀宗.美沙拉秦缓释片治疗缓解期溃疡性结肠炎的多中心、单盲、随机对照研究[J].中华消化杂志,2015,35(4):256-259.
[5]门路,朱良如,付妤,等.美沙拉秦缓释颗粒剂顿服与分次服用治疗轻中度溃疡性结肠炎的临床随机对照研究[J].中华消化杂志,2015,35(8):549-553.
[6]Koido S,Ohkusa T,Takakura K,et al.Clinical significance of serum procalcitonin in patients with ulcerative colitis[J].World J Gastroenterol,2013,19(45):8335-8341.
[7]柳汝明,吴斌,赵雨晋,等.美沙拉嗪与柳氮磺吡啶比较治疗溃疡性结肠炎疗效与安全性的系统评价[J].中国循证医学杂志,2011,11(2):181-186.
[8]韩柯,胡丽庆.益生菌联合康复新液治疗活动期轻中度溃疡性结肠炎的疗效及安全性分析[J].中国生化药物杂志,2014,34(4):98-100.
[9]中国消化系疾病学术大会中华医学会消化病学分会炎症性肠病协作组.炎症性肠病诊断与治疗的共识意见(2012年:广州)[J].中华内科杂志,2012,51(10):818-831.
[10]刘宝珍,郭芳,金世禄,等.小剂量短疗程糖皮质激素初始治疗轻-中度溃疡性结肠炎的疗效观察[J].中华消化内镜杂志,2014,31(3):164-165.
[11]Farrukh A,Mayberry JF.Inflammatory bowel disease in Hispanic communities:a concerted South American approach could identify the aetiology of Crohn’s disease and ulcerative colitis[J].Arq Gastroenterol,2014,51(4):271-275.
[12]Nirmal SA,Dhikale RS,Girme AS,et al.Potential of the plant Thespesia populnea in the treatment of ulcerative colitis[J].Pharm Biol,2015,53(9):1379-1385.
[13]Pellino G,Selvaggi F.Slaughtering sacred cows:longterm surveillance after ileal pouch-anal anastomosis for ulcerative colitis and choice of anastomosis[J].Dis Colon Rectum,2015,58(5):e73-e74.
[14]Losurdo G,Iannone A,Contaldo A,et al.Escherichia coli Nissle 1917 in ulcerative colitis treatment:systematic review and meta-analysis[J].J Gastrointestin Liver Dis,2015,24(4):499-505.
[15]Ye B,van Langenberg DR.Mesalazine preparations for the treatment of ulcerative colitis:are all created equal?[J].World J Gastrointest Pharmacol Ther,2015,6(4):137-144.
[16]董青.康复新液灌肠联合美沙拉嗪治疗溃疡性结肠炎疗效观察[J].中国中西医结合消化杂志,2011,19(4):252-253.
Clinical Observation of Mesalazine Combined with Kangfuxin Solution Retention Enema in the Treatment of Active Ulcerative Colitis
HE Yuanqing,HE Zibin,ZHANG Han,HE Li,YANG Tao,ZHAO Juan,WANG Yuqiong,ZHOU Ji(Dept.of Gastroenterology,Guangyuan Third People’s Hospital,Sichuan Guangyuan 628000,China)
OBJECTIVE:To observe clinical efficacy and safety of mesalazine combined with Kangfuxin solution retention enema in the treatment of active ulcerative colitis(UC).METHODS:A total of 120 patients diagnosed as active UC selected from gastroenterology department of our hospital during Mar.2012 to Aug.2014 were divided into observation group and control group according to random number table,with 60 cases in each group.Both groups
conventional treatment of active UC.Control group was additionally given Mesalazine enteric coated tablets 1 g,tid,on the basis of routine treatment.Observation group was additionally given Kangfuxin solution 30 mL diluted with normal saline 150 mL for enema,qd,on the basis of control group.Both groups were treated for 30 d.The serum levels of TNF-α,IL-1,IL-8,IL-10,SOD,NO and LPO were observed in 2 groups before and after treatment;clinical efficacies,recurrence rates,colonoscopy efficacies and the occurrence of ADR were compared between 2 groups.RESULTS:Before treatment,there was no statistical significance in the serum levels of TNF-α,IL-1,IL-8,IL-10,SOD,NO or LPO between 2 groups(P>0.05).After treatment,the serum levels of TNF-α,IL-1,IL-8,NO and LPO in 2 groups were decreased significantly,while the serum levels of IL-10 and SOD were increased significantly;the serum levels ofTNF-α,IL-1,IL-8,NO and LPO in observation group were significantly lower than control group,while the serum levels of IL-10 and SOD were significantly higher than control group,with statistical significance(P<0.05).Clinical response rate,recurrence rate and colonoscopy response rate of observation group were 83.3%,11.7%and 88.3%,which were significantly better than 66.7%,30.0%,70.0%of control group,with statistical significance(P<0.05).There was no statistical significance in the incidence of ADR between 2 groups(P>0.05).CONCLUSIONS:Mesalazine combined with Kangfuxin solution can effectively alleviate inflammatory reaction in patients with active UC,and reduce oxygen free radical damage with good safety.
Mesalazine;Kangfuxin solution;Active stage;Ulcerative colitis;Inflammatory reaction
R574.62
A
1001-0408(2017)29-4133-04
DOI10.6039/j.issn.1001-0408.2017.29.28
*副主任医师。研究方向:功能性胃肠病。电话:0839-5501168。E-mail:478428296@qq.com
2016-12-16
2017-06-24)
(编辑:黄 欢)
