HPLC-荧光法测定人血浆中伊立替康及其活性代谢产物的浓度Δ
2017-11-01张晓霈刘晓明徐今宁王爱萍姜爱雯河北北方学院药学系河北张家口075000河北北方学院附属第一医院药剂科河北张家口075000
张晓霈,刘晓明,徐今宁,王爱萍,姜爱雯(1.河北北方学院药学系,河北张家口075000;.河北北方学院附属第一医院药剂科,河北张家口075000)
·临床药学与研究·
HPLC-荧光法测定人血浆中伊立替康及其活性代谢产物的浓度Δ
张晓霈1*,刘晓明2#,徐今宁2,王爱萍2,姜爱雯2(1.河北北方学院药学系,河北张家口075000;2.河北北方学院附属第一医院药剂科,河北张家口075000)
目的:建立同时测定人血浆中伊立替康(CPT-11)及其活性代谢产物7-乙基-10-羟基喜树碱(SN-38)浓度的方法。方法:血浆样品经乙腈沉淀蛋白及盐酸酸化后,以喜树碱为内标,采用高效液相色谱-荧光法测定。色谱柱为Waters Luna C18,流动相为0.05 mol/L磷酸二氢钠溶液-乙腈(70∶30,V/V,用磷酸调节pH至4.0),流速为1 mL/min,激发波长为380 nm,发射波长为480 nm(CPT-11)、535 nm(SN-38),柱温为25,进样量为20 μL。结果:CPT-11和SN-38血药浓度分别在200~1 000、5~45 ng/mL范围内线性关系良好(r分别为0.999 4、0.999 2,n=5),定量下限分别为200、5 ng/mL;日内、日间RSD为1.68%~5.57%;CPT-11和SN-38的相对回收率分别为90.12%~106.93%(RSD<8%,n=5)、92.07%~102.56%(RSD<6%,n=5),提取回收率分别为72.23%~86.56%(RSD<6%,n=5)、71.98%~83.44%(RSD<7%,n=5)。采用该方法测得5例结肠癌患者体内CPT-11和SN-38的血药浓度分别为431.13~617.19、13.97~31.89 ng/mL(静脉滴注结束后1 h),398.14~584.43、11.61~29.94 ng/mL(静脉滴注结束后2 h)。结论:该方法样品处理简单、快速,且灵敏度高、重复性好,适用于临床常规监测CPT-11及其代谢物SN-38的血药浓度及药动学研究。
高效液相色谱-荧光法;伊立替康;7-乙基-10-羟基喜树碱;血药浓度
伊立替康(Irinotecan,CPT-11)属于水溶性半合成喜树碱类衍生物,是DNA拓扑异构酶抑制剂,作用于细胞周期S期,阻止拓扑异构酶对DNA断链的修复,从而抑制细胞分裂[1]。CPT-11作为前体药物进入人体后,一部分经过羧酸酯酶(Carboxylesterase,CES)转化为活性代谢物7-乙基-10-羟基喜树碱(7-ethyl-10-hydroxycamptothecin,SN-38),其活性比CPT-11强100~1 000倍,细胞毒性约为CPT-11的200~2 000倍[2]。
CPT-11现已广泛应用于结直肠癌、非小细胞肺癌和宫颈癌等实体瘤的临床治疗,在肿瘤化疗领域具有广泛的应用前景[3]。但随着临床研究的不断深入,CPT-11给患者带来的骨髓抑制、严重腹泻等毒副反应也成为限制其临床应用的重要因素[4]。相关研究表明,CPT-11及SN-38的血药浓度与临床疗效、化疗所致严重不良反应密切相关[5]。因此,建议对使用CPT-11的患者进行血药浓度监测。目前,测定CPT-11血药浓度的方法主要包括高效液相色谱(HPLC)法和液-质联用(LC-MS)法[6-10]。本研究在已有文献的基础上,建立了同时测定人血浆中CPT-11及其活性代谢产物SN-38的HPLC-荧光法,并将该方法应用于临床,为进一步探讨CPT-11血药浓度与其所致不良反应的相关性提供参考。
1 材料
1.1 仪器
100型HPLC仪,包括手动进样器、G1312A型二元泵、G1316A型柱温箱、G1321A型荧光检测器、Chemstation色谱工作站(美国Agilent公司);H1650-W型台式低温高速离心机(湖南湘仪实验室仪器开发有限公司);MX-S型涡旋混合器(美国Scilogex公司);BSZ10型电子分析天平(德国赛多利斯公司);PHS-3C型酸度计(上海雷磁公司)。
1.2 药品与试剂
伊立替康对照品(批号:141228,纯度:≥99%)、SN-38对照品(批号:150102,纯度:98.86%)均购自北京世纪奥科生物技术有限公司;喜树碱对照品(内标,北京恒元启天化工研究院,批号:14090401,纯度:98.82%);注射用盐酸伊立替康[江苏恒瑞医药股份有限公司,批准文号:国药准字H20040711,批号:16221AF,规格:100 mg(按C33H38N4O6·HCl计)];乙腈为色谱纯,磷酸二氢钠、二甲基亚砜、盐酸、磷酸等均为分析纯,水为纯净水。
1.3 空白血浆
健康人空白血浆由河北北方学院附属第一医院(以下简称“我院”)血库提供。
2 方法与结果
2.1 色谱条件
色谱柱:Waters Luna C1(8250 mm×4.6 mm,5 μm);流动相:0.05 mol/L磷酸二氢钠溶液-乙腈(70∶30,V/V,用磷酸调节pH至4.0);流速:1 mL/min;荧光激发波长:380 nm;发射波长:480 nm(CPT-11)、535 nm(SN-38);柱温:25;进样量:20 μL。
2.2 溶液的制备
精密称取CPT-11、SN-38对照品各适量,用二甲基亚砜溶解并分别定容至10 mL棕色量瓶中,配制成质量浓度均为1.0 mg/mL的标准贮备液。量取上述标准贮备液适量,用0.01 mol/L盐酸-乙腈混合溶液(2∶3,V/V)作为稀释剂,分别配制成CPT-11质量浓度为4、6、10、12、14、18、20 μg/mL,SN-38质量浓度为0.1、0.2、0.4、0.5、0.6、0.8、0.9 μg/mL的标准工作液。精密称取内标对照品适量,用二甲基亚砜溶解并定容,配制成质量浓度为2 μg/mL的内标溶液。以上所有溶液均置于-20冰箱中避光保存,备用。
2.3 血浆样品的处理
精密吸取空白血浆适量,置于1.5 mL EP管中,加入内标溶液20 μL,涡旋混匀30 s;再加入乙腈200 μL,涡旋混匀1 min;以离心半径9 cm、转速13 000 r/min离心3 min。精密吸取上清液200 μL,加入1.0 mol/L盐酸50 μL酸化,涡旋混匀30 s,精密吸取20 μL,进样分析。
2.4 方法学考察
2.4.1 专属性考察 分别取不同来源的空白血浆、空白血浆+CPT-11+SN-38、患者用药后的血浆样品各适量,按“2.3”项下方法处理(空白血浆样品不加内标)后,于“2.1”项色谱条件下进样分析,记录色谱图(见图1)。结果表明,CPT-11、内标、SN-38的色谱峰峰形对称,保留时间分别为3.6、4.7、7.1 min,血浆中的内源性物质均不干扰待测物的测定,表明该方法专属性良好。

图1 高效液相色谱图Fig 1HPLC chromatograms
2.4.2 标准曲线的绘制与定量下限的考察 精密量取空白血浆适量,置于1.5 mL EP管中,加入不同质量浓度的CPT-11和SN-38标准工作液各10 μL,混合摇匀,分别配制成CPT-11质量浓度为200、300、500、600、700、900、1 000 ng/mL,SN-38质量浓度为5、10、20、25、30、40、45 ng/mL的血浆样品,按“2.3”项下方法处理后,进样测定,记录色谱图。以待测物质量浓度(x)为横坐标、待测物与内标的峰面积比值(y)为纵坐标,采用加权最小二乘法(加权系数w=1/x2)进行线性回归,得CPT-11的回归方程为:y=0.003x+0.186(r=0.999 4,n=5),SN-38的回归方程为:y=0.026x+1.122(r=0.999 2,n=5)。结果表明,CPT-11、SN-38血药浓度分别在200~1 000、5~45 ng/mL范围内线性关系良好。
配制CPT-11、SN-38质量浓度分别为200、5 ng/mL的血浆样品,按“2.3”项下方法处理后,平行测定5次,连续测定5 d。结果显示,日内、日间RSD均小于15%;实测质量浓度在理论质量浓度的80%~120%内,表明CPT-11、SN-38的定量下限分别为200、5 ng/mL。
2.4.3 精密度试验 取空白血浆、相应质量浓度的CPT-11和SN-38标准工作液各适量,分别配制成CPT-11低、中、高质量浓度(300、500、800 ng/mL)和SN-38低、中、高质量浓度(10、20、35 ng/mL)的质控样品,按“2.3”项下方法处理后,进样分析。各样品平行测定5次,连续测定5 d,考察方法的精密度[精密度以RSD(RSD=实测质量浓度标准偏差/实测质量浓度平均值×100%)表示]。结果显示,CPT-11的日内RSD为1.68%~3.22%,日间RSD为3.12%~5.57%;SN-38的日内RSD为2.06%~3.48%,日间RSD为1.98%~4.51%,表明精密度良好,详见表1。
表1 精密度试验结果(±s,n=5)Tab 1Results of precision tests(±s,n=5)
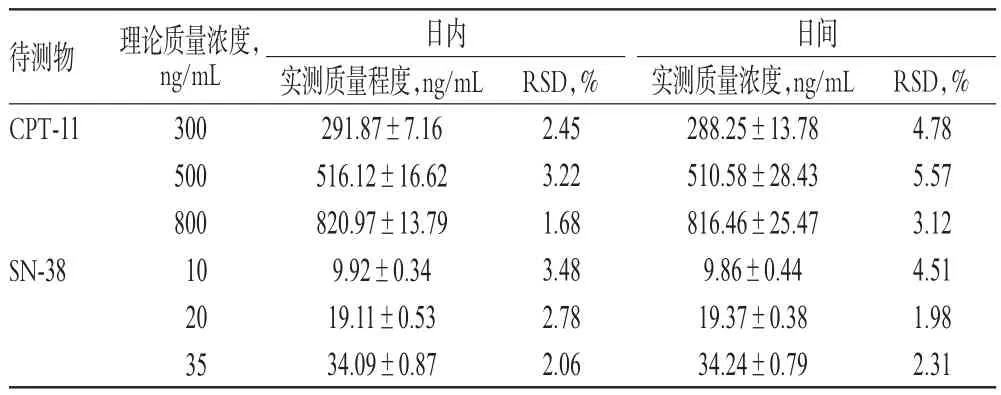
表1 精密度试验结果(±s,n=5)Tab 1Results of precision tests(±s,n=5)
待测物CPT-11 SN-38理论质量浓度,ng/mL 300 500 800 10 20 35日内实测质量程度,ng/mL 291.87±7.16 516.12±16.62 820.97±13.79 9.92±0.34 19.11±0.53 34.09±0.87 RSD,%2.45 3.22 1.68 3.48 2.78 2.06日间实测质量浓度,ng/mL 288.25±13.78 510.58±28.43 816.46±25.47 9.86±0.44 19.37±0.38 34.24±0.79 RSD,%4.78 5.57 3.12 4.51 1.98 2.31
2.4.4 回收率试验 取空白血浆、相应质量浓度的CPT-11和SN-38标准工作液各适量,分别配制成CPT-11低、中、高质量浓度(300、500、800 ng/mL)和SN-38低、中、高质量浓度(10、20、35 ng/mL)的质控样品,按“2.3”项下方法处理后,进样分析。每个样品平行测定5次,根据当日标准曲线计算实测质量浓度与理论质量浓度的比值,考察相对回收率;以经提取所得血浆样品的色谱峰面积与未经提取血浆样品的色谱峰面积进行比较,考察提取回收率。结果显示,CPT-11的相对回收率为90.12%~106.93%(RSD<8%,n=5),提取回收率为72.23%~86.56%(RSD<6%,n=5);SN-38的相对回收率为92.07%~102.56%(RSD<6%,n=5),提取回收率为71.98%~83.44%(RSD<7%,n=5),详见表2。
表2 回收率试验结果(±s,n=5)Tab 2Results of recovery tests(±s,n=5)
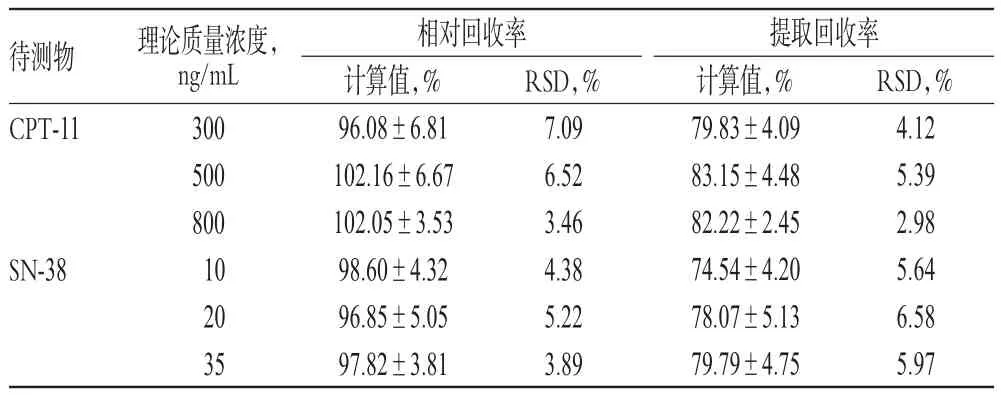
表2 回收率试验结果(±s,n=5)Tab 2Results of recovery tests(±s,n=5)
待测物CPT-11 SN-38理论质量浓度,ng/mL 300 500 800 10 20 35相对回收率计算值,%96.08±6.81 102.16±6.67 102.05±3.53 98.60±4.32 96.85±5.05 97.82±3.81 RSD,%7.09 6.52 3.46 4.38 5.22 3.89提取回收率计算值,%79.83±4.09 83.15±4.48 82.22±2.45 74.54±4.20 78.07±5.13 79.79±4.75 RSD,%4.12 5.39 2.98 5.64 6.58 5.97
2.4.5 稳定性试验 分别配制CPT-11低、中、高质量浓度(300、500、800 ng/mL)和SN-38低、中、高质量浓度(10、20、35 ng/mL)的质控样品各5份,按“2.3”项下方法处理后,进样分析,考察各样品在光照室温条件下放置8 h、经历3次冻融(-20~室温)、-80保存1个月、手动进样器中存放6 h的稳定性。结果显示,各样品在上述条件下稳定性良好,RSD<10%(n=5)。
2.5 临床应用
采用上述HPLC-荧光法测定5例结肠癌患者血浆中CPT-11和SN-38的浓度。其中,男性2例,女性3例;年龄45~53岁;3例患者联用5-氟尿嘧啶(5-fluorouracil,5-FU)、亚叶酸钙(Leucovorin,LV)等药物,2例患者为单药治疗。
所有患者均于90 min内静脉滴注注射用盐酸伊立替康,分别于静脉滴注结束后1、2 h抽取其外周血各2 mL,置于乙二胺四乙酸(EDTA)抗凝管中,以离心半径9 cm、转速3 000 r/min离心10 min,取上层血浆按“2.3”项下方法处理后,进样分析。结果显示,静脉滴注结束后1 h,5例患者体内CPT-11、SN-38的血药浓度分别为431.13~617.19 ng/mL、13.97~31.89 ng/mL;静脉滴注结束后2 h,其体内CPT-11、SN-38的血药浓度分别为398.14~584.43 ng/mL、11.61~29.94 ng/mL,详见表3。

表3 血药浓度测定结果Tab 3Determination results of plasma concentration
3 讨论
3.1 方法学评价
目前,临床并尚普及CPT-11及其活性代谢产物SN-38血药浓度的监测。现有的浓度测定方法主要包括HPLC-紫外法、HPLC-荧光法和LC-MS法[6-10]。其中,质谱分析方法的样本前处理过程较为复杂,且受仪器成本较高的影响,不利于在临床上大规模推广。CPT-11及SN-38的结构式中含有π-π共轭体系,为刚性平面结构,同时含有给电子基(羟基),可以增加荧光效率,满足荧光物质检测的要求,选择性较紫外检测更好[2,7-9]。故笔者参考上述文献,在370~430 nm激发波长范围内每隔5 nm扫描其激发光谱,发现CPT-11、SN-38在380 nm处的荧光激发强度最大,故将两者的激发波长设定为380 nm;在470~540 nm发射波长范围内每隔5 nm扫描其发射光谱,发现CPT-11在480 nm、SN-38在535 nm处的荧光发射强度最大,故将其两者的发射波长依次设定为480、535 nm。
CPT-11具有一个不稳定的内酯环,有pH依赖性,在体内保持内酯与羧酸盐2种形式的动态平衡:当pH为3.0~5.0时,CPT-11主要以具有活性的内酯形式存在;当pH为7.0时,则CPT-11主要以羧酸盐形式存在[11]。因此,笔者考察了不同pH流动相对分离度的影响,结果发现,当流动相pH=3.0时,出现前延峰;当pH=4.5时,峰形存在拖尾现象;而当用磷酸调节pH至4.0时,在保证完全分离的前提下,各待测物峰形良好,故最终确定流动相的pH为4.0。
前期试验曾使用甲醇作为蛋白沉淀剂,经处理后,血浆样品呈浑浊状,沉淀不完全。使用相同体积的10%高氯酸处理后,空白血浆进样后响应值变大,干扰明显,检测限升高。而使用乙腈作为蛋白沉淀剂不仅回收率较高,而且内源性物质的干扰较小。离心后的血浆样品经盐酸酸化后,可保证CPT-11的内酯-羧酸盐平衡向内酯移动,使测定结果更为准确。
笔者通过优化色谱条件,调节流动相比例和pH,并采用蛋白沉淀法处理血浆样品,操作简单、迅速,同时又可消除血浆中内源性物质的干扰,可满足生物样本快速批量检测的需求。临床上与CPT-11可能合用的药物包括5-FU、LV等,在临床应用中并未发现上述两种药物对CPT-11、SN-38和内标的检测有所干扰。该方法在10 min之内即可完成CPT-11和SN-38血药浓度的检测,且成本较低,可用于临床治疗药物监测。值得注意的是,空白血浆在3~4 min处出现色谱峰(见图1A),虽然响应值很低,但也有可能对测定结果造成一定影响,故该方法仍有待进一步完善。
3.2 临床应用
目前,临床上主要依靠尿苷二磷酸葡糖醛酸转移酶(UGT)1A1基因多态性检测来指导CPT-11的个体化用药,从而降低限制性毒副反应的发生。当患者服用高剂量(>300 mg/m2)的CPT-11时,其不良反应与基因型存在相关性;而服用中、低剂量(<300 mg/m2)的CPT-11时,其不良反应则与基因型无关[12]。然而,我国人群UGT1A1基因突变的比例仅占10%~12%,且CPT-11的给药剂量一直处于较低水平,因此仅依靠基因检测来指导其个体化用药存在明显的局限性[13]。相关研究发现,CPT-11所造成的严重骨髓抑制与SN-38的峰浓度密切相关,腹泻的发生率也与SN-38的谷浓度存在相关性[14-15]。但上述研究仍处于初始阶段,尚无一致结论。
本研究所建立的血药浓度监测方法已成功应用于患者。由表3可见,若CPT-11剂量为100~300 mg,CPT-11、SN-38的血药浓度分别维持在398.14~617.19、11.61~31.89 ng/mL。其中,4号患者的用药剂量高于3号,但活性代谢产物SN-38的血药浓度却明显低于3号,提示CPT-11的体内代谢可能存在明显的个体差异。但由于本研究检测的患者例数较少,监测的样本量也较小,且均为结肠癌患者,具有一定的局限性,故有待后续研究收集更多的样本,进一步探讨CPT-11血药浓度与不良反应的相关性,以指导临床个体化用药。
综上所述,该方法样品处理简单、快速,方法灵敏度高、重复性好,适用于临床常规监测CPT-11及其代谢物SN-38的血药浓度及药动学研究。
[1]Yu QQ,Qiu H,Zhang MS,et al.Predictive effects of bilirubin on response of colorectal cancer to irinotecan-based chemotherapy[J].World J Gastroenterol,2016,22(16):4250-4258.
[2]汪皖青,黄晨蓉.HPLC法测定血浆中伊立替康及其代谢产物SN-38、SN-38G浓度及方法学研究[J].药学与临床研究,2015,23(6):565-568.
[3]王喆,李萌,朱小明.伊立替康的用药风险与合理用药[J].实用药物与临床,2015,18(4):451-453.
[4]游云红,王颂平,朱超,等.伊立替康不良反应与UGT1A1基因多态性关系的研究[J].中国药房,2016,27(5):638-641.
[5]周琰,庄荣源,陈朴,等.UGT1A1基因多态性与伊立替康治疗结直肠癌不良反应的关系[J].中国癌症杂志,2014,24(7):493-500.
[6]鞠晓宇,罗雪梅,葛卫红,等.高效液相色谱法测定血中伊立替康及活性代谢物SN-38浓度[J].药学与临床研究,2015,23(3):267-270.
[7]尹小丽,吴海龙,张晓华,等.三维荧光二阶校正同时测定人体液中伊立替康及其代谢物7-乙基-10-羟基喜树碱的含量[J].化学学报,2013,71(4):560-566.
[8]王宇,黄巧巧,谢升谷,等.高效液相色谱法测定盐酸伊立替康注射液的含量[J].中国药业,2014,23(11):38-39.
[9]党宏万,杨付英,张文萍,等.LC-MS/MS测定大鼠全血纳米粒中伊立替康及其代谢物SN-38的浓度[J].中国药学杂志,2014,49(5):396-400.
[10]余春梅,杨秀丽,郑小锋,等.HPLC法测定盐酸伊立替康注射液的含量和有关物质[J].中国药房,2013,24(17):1600-1602.
[11]张程亮,徐艳娇,李喜平,等.高效液相色谱法测定大鼠肝微粒体酶孵育体系中伊立替康及其代谢产物的浓度
[J].中国药学杂志,2013,48(6):485-488.
[12]张燕燕,何炜,扬子长,等.UTG1A1*28基因型指导伊立替康用药剂量选择的回顾性分析[J].中华肿瘤防治杂志,2015,22(9):709-712.
[13]鞠晓宇,罗雪梅,王友群,等.UGT1A1基因多态性联合血药浓度监测在伊立替康个体化治疗中的应用[J].中南药学,2015,(11):1178-1182.
[14]蔡讯,曹卫国,丁红华,等.UGT1A1*28基因多态性联合SN-38药代动力学检测在进展期结直肠癌以伊立替康为基础的二线治疗中的应用[J].肿瘤,2013,33(2):181-189.
[15]Panczyk M.Pharmacogenetics research on chemotherapy resistance in colorectal cancer over the last 20 years[J].World J Gastroenterol,2014,20(29):9775-9827.
Concentration Determination of Irinotecan and Its Active Metabolite in Human Plasma by HPLC-FLD
ZHANG Xiaopei1,LIU Xiaoming2,XU Jinning2,WANG Aiping2,JIANG Aiwen2(1.Dept.of Pharmacy,Hebei North University,Hebei Zhangjiakou 075000,China;2.Dept.of Pharmacy,the First Affiliated Hospital of Hebei North University,Hebei Zhangjiakou 075000,China)
OBJECTIVE:To develop a method for simultaneous determination of irinotecan(CPT-11)and its active metabolite 7-ethyl-10-hydroxycamptothecin(SN-38)in human plasma.METHODS:After precipitated by acetonitrile and acidified with hydrochloric acid,using camptothecin as internal standard,the plasma sample was determined by HPLC-FLD.The determination was performed on Waters Luna C18column with mobile phase consisted of 0.05 mol/L sodium dihydrogen phosphate-acetonitrile(70∶30,V/V,adjusted pH to 4.0 by phosphoric acid)at flow rate of 1 mL/min.The excitation wavelength was set at 380 nm;the emission wavelengths of CPT-11 and SN-38 were set at 480 nm and 535 nm,respectively.The column temperature was 25and the sample size was 20 μL.RESULTS:The linear ranges were 200-1 000 ng/mL for CPT-11(r=0.999 4,n=5)and 5-45 ng/mL for SN-38(r=0.999 2,n=5).RSDs of inter-day and intra-day were 1.68%-5.57%.The relative recoveries of CPT-11 and SN-38 were 90.12%-106.93%(RSD<8%,n=5)and 92.07%-102.56%(RSD<6%,n=5);the extraction recoveries of CPT-11 and SN-38 were 72.23%-86.56%(RSD<6%,n=5)and 71.98%-83.44%(RSD<7%,n=5),respectively.The plasma concentrations of CPT-11 and SN-38 in 5 patients with colon cancer were 431.13-617.19,13.97-31.89 ng/mL(1 h after intravenous dripping)and 398.14-584.43,11.61-29.94 ng/mL(2 h after intravenous dripping).CONCLUSIONS:The method is simple,rapid,sensitive,reproducible and suitable for the determination of plasma concentration and pharmacokinetic study of CPT-11 and its metabolite SN-38.
HPLC-FLD;Irinotecan;7-ethyl-10-hydroxycamptothecin;Plasma concentration
R969.1
A
1001-0408(2017)29-4072-04
DOI10.6039/j.issn.1001-0408.2017.29.11
河北省医学科学研究重点课题计划(No.20120157)
*硕士研究生。研究方向:临床药学。电话:0313-8043563。E-mail:2605520609@qq.com
#通信作者:主任药师,硕士生导师。研究方向:药理学。电话:0313-8043563。E-mail:lxmyf@hotmail.com
2016-11-23
2017-03-15)
(编辑:张元媛)
