副干酪乳杆菌直投式菌种中霉菌和酵母菌检测方法的建立
2017-11-01董雪凤杨子彪任发政刘松玲段瑞华宋伟志王远
董雪凤,杨子彪,任发政,刘松玲,段瑞华,宋伟志,王远
(1.云南皇氏来思尔乳业有限责任公司,大理 671000;2.中国农业大学食品科学与营养工程学院教育部功能乳品重点实验室,北京 100083;3.大理市农业技术推广中心,大理 671000)
★乳与乳制品
副干酪乳杆菌直投式菌种中霉菌和酵母菌检测方法的建立
董雪凤1,杨子彪1,任发政2,刘松玲2,段瑞华1,宋伟志3,王远1
(1.云南皇氏来思尔乳业有限责任公司,大理 671000;2.中国农业大学食品科学与营养工程学院教育部功能乳品重点实验室,北京 100083;3.大理市农业技术推广中心,大理 671000)
霉菌和酵母菌是直投式菌种中常见的污染菌,严重影响直投菌种的安全使用。在副干酪乳杆菌直投式菌种的霉菌、酵母菌检测中,由于菌种本身对霉菌、酵母菌的抑制作用以及高浓度菌种对污染菌检测的干扰作用,经常造成检测结果的假阴性。本研究根据副干酪乳杆菌菌体比霉菌、酵母菌小的特点,采用抽滤的方法将副干酪乳杆菌和霉菌、酵母菌分开,通过定性和定量两步检验,结合国标检测方法,成功鉴定到副干酪乳杆菌直投式菌种污染的低丰度霉菌和酵母菌。为有效地控制副干酪乳杆菌直投式菌种的产品质量,菌种发酵产品在生产过程中的稳定性提供了有效的保证。
副干酪乳杆菌;直投式菌种;霉菌;酵母菌
直投式酸奶发酵剂(directed vat set,DVS)是指通过对发酵菌种进行高密度培养、浓缩、洗涤、添加保护剂、冷冻干燥等工艺制成的发酵剂菌种,可直接加入到热处理的原料乳中进行发酵,而无需对其进行活化、扩培等其他预处理工作。直投式发酵剂具有活力强、种类多、使用方便及性能稳定等多种优点,成为目前众多大型乳品企业的首选。
副干酪乳杆菌作为一种有效的益生菌[1],具有良好的加工性能,成为乳品生产中常用的菌种[2,3]。在副干酪乳杆菌直投发酵剂的使用过程中,霉菌、酵母菌的污染严重影响着使用的安全性[4,5]。在霉菌、酵母菌检测中,高浓度的发酵剂菌种易对检测结果造成严重干扰,同时研究还发现,干酪乳杆菌本身对霉菌、酵母菌具有一定的抑制作用[6],这些都严重影响了检测的准确性。
本研究通过超滤分离手段结合国家标准检测方法[7]探讨了副干酪乳杆菌直投式菌种中霉菌、酵母菌的检测方法[8],改善了国标法的不足,期望新方法能够帮助相关乳企提高发酵成功率,减少生产损失,为市场提供更优质的产品。同时可以进一步研究探讨用此方法纯化霉菌、酵母菌超标的副干酪乳杆菌直投式菌种稀释液,作为生产应急时使用,以保证副干酪乳杆菌直投式菌种发酵产品的稳定性,有效控制产品质量,提高发酵成功率,避免和减少生产中的损失。
1 材料与方法
1.1 材料
菌种:国外进口的副干酪乳杆菌直投式菌种。
孟加拉红培养基:蛋白胨5g、葡萄糖10g、磷酸二氢钾1g、七水合硫酸镁0.5g、琼脂20g、孟加拉红0.033g、氯霉素0.1g、蒸馏水1 000mL,121℃灭菌20min。
1μm过滤膜。
1.2 仪器和设备
恒温培养箱(28±1℃)、QL-901混合器、抽滤瓶、真空泵、XS-212-201显微镜(10×~100×)、电子天平(感量0.1g)。
1.3 原理
根据副干酪乳杆菌与霉菌孢子、酵母细胞的大小差异,选用选择性透过滤膜,稀释副干酪乳杆菌直投式菌种样品,通过抽滤分离出霉菌、酵母菌再进行检测。酵母细胞的大小是1~5μm×5~30μm[9],霉菌孢子为2~10μm,副干酪乳杆菌通常宽度小于1.5μm[10]。副干酪乳杆菌直投式菌种由于采用冷冻真空干燥工艺,菌株宽度更小,不超过1μm。依据不同菌株分子大小不同的特性,通过1μm微膜抽滤将副干酪乳杆菌和霉菌、酵母菌分离开,即基本上霉菌、酵母菌留在滤膜上,副干酪乳杆菌在滤液中[11]。
1.4 方法
1.4.1 样品处理
样品制备:称取5g副干酪乳杆菌直投式菌种至盛有95g灭菌生理盐水的锥形瓶中,振荡2min后静置30min,制得1:20的样品匀液。
1.4.2 定性检测方法
1.4.2.1 制备培养基:加热溶解商用孟加拉红培养基,高压蒸汽121℃灭菌15min,灭菌后,待培养基冷却至45~50℃时,倾注到灭菌平板上,培养基厚度在5mm以上,凝固待用。
1.4.2.2 第一次抽滤:固定好滤器,取10g制得的样品匀液通过孔径1 μm的滤膜过滤,然后将过滤后的滤膜贴在已制备好的孟加拉红琼脂平板上。
1.4.2.3 第二次抽滤:取10g上述步骤1.4.1制得的样品匀液通过孔径1μm的滤膜过滤,然后将过滤后的滤膜放入20~30g无菌生理盐水中,用拍击式振荡器振荡2min,制得二次稀释液,取10g二次稀释液通过孔径1μm的滤膜过滤,然后将过滤好的滤膜贴在已制备好的孟加拉红琼脂平板上。
1.4.2.4 第三次抽滤:取10g上述步骤1.4.2.3制得的二次稀释液,通过孔径1 μm的滤膜过滤,将过滤后的滤膜放入20~30g无菌生理盐水中,用拍击式振荡器振荡2min,制得三次稀释液,取10g三次稀释液通过孔径1μm的滤膜过滤,然后将过滤好的滤膜贴在已制备好的孟加拉红琼脂平板上。
1.4.2.5 结果观察:将上述平板置于28±1℃培养5d,观察滤膜上菌落的生长情况,看有无霉菌和酵母菌典型菌落。
1.4.3 定量检测方法
1.4.3.1 第一次抽滤:固定好滤器,将10g上述步骤
1.4.1 制得的样品匀液通过孔径1μm的滤膜过滤,然后将过滤后的滤膜放入30g灭菌生理盐水的锥形瓶中,充分振摇,制得第一次抽滤后的样品匀液。
1.4.3.2 第二次抽滤:固定好滤器,将上述步骤1.4.3.1制得的第一次抽滤后的样品匀液全部通过新的孔径1μm滤膜过滤,然后将过滤后的滤膜放入30g灭菌生理盐水的锥形瓶中,充分振摇,制得第二次抽滤后的样品匀液。
1.4.3.3 第三次抽滤:固定好滤器,将上述步骤1.4.3.2制得的第二次抽滤后的样品匀液全部通过新的孔径1μm滤膜过滤,然后将过滤后的滤膜放入50g灭菌生理盐水的锥形瓶中,充分振摇,制成稀释度为1×10-2的样品匀液。
1.4.3.4 制备培养皿:取1g上述步骤1.4.3.3制得的稀释度为1×10-2的样品匀液,注入9g灭菌生理盐水的试管中,充分振摇,制得稀释度为1×10-3的样品匀液,按此操作程序,制备10倍系列稀释样品匀液,每递增稀释1次,换用一次无菌吸管;在进行10倍递增稀释的同时,每个稀释度分别吸取1g样品匀液注入2个无菌平皿作平行实验,及时将15~20g冷却至46~50℃的孟加拉红培养基倾注至平皿,转动平皿使其混合均匀。
1.4.3.5 培养:待琼脂凝固后,将平皿倒置,28±1℃培养5d,观察并记录。
1.4.3.6 菌落计数及报告:选取菌落数在10~150CFU之间的平板进行计数,一个稀释度使用两个平板,取两个平板菌落数的平均值,乘以稀释倍数后出报告。
1.4.4 国标法对比检测
1.4.4.1 在100级的洁净工作台进行过滤操作。称取10g副干酪乳杆菌直投式菌种至盛有90mL灭菌生理盐水的锥形瓶中,用拍击式振荡器振荡2min后静置30min,制成1:10的样品匀液。
1.4.4.2 取1mL上述制成的1:10样品匀液,注入9mL灭菌生理盐水的试管中,充分振摇,即为1:100的稀释液。按此操作程序,制备10倍系列稀释样品匀液。每递增稀释1次,换用一次无菌吸管。
1.4.4.3 根据对样品污染状况的估计,选择2~3个适宜稀释度的样品匀液(本试验选择10-1、10-2、10-3、10-4),在进行10倍递增稀释的同时,每个稀释度分别吸取1mL样品匀液于2个无菌平皿。同时分别取1mL样品稀释液加入2个无菌平皿作空白对照。及时将15~20mL冷却至46℃左右的孟加拉红培养基倾注至平皿,并转动平皿使其混合均匀。
1.4.4.4 培养、菌落计数,出具结果报告。
2 结果与讨论
2.1 定性检测结果
按照GB 6914-86规定的取样方法,选取从3个国家进口的15个副干酪乳杆菌直投式菌种样品为样本。按上述定性检测方法检测,结果13个样品未检出霉菌和酵母菌,两个样品检出霉菌、酵母菌,试验结果如下:
第一次抽滤后滤膜上菌落的培养结果见图1。从图1可见滤膜一片白色,未检测到霉菌、酵母。原因可能是第一次抽滤后滤膜上副干酪乳杆菌数量较多,抑制了霉菌、酵母菌的生长。
第二次抽滤后滤膜上菌落的培养结果见图2。从图2可见滤膜出现淡粉色,有少量霉菌、酵母菌。这是因为第二次抽滤后滤膜上副干酪乳杆菌数量相对减少,对霉菌、酵母菌生长的抑制作用相对减弱。
图1 第一次滤液定性检测结果

图2 第二次滤液定性检测结果
第三次抽滤后滤膜上菌落的培养结果见图3。从图3可见滤膜出现粉色的典型酵母菌落和霉菌菌落,可确定此副干酪乳杆菌直投式菌种样品中有霉菌、酵母菌存在。这是因为第三次抽滤后滤膜上副干酪乳杆菌数量较少,对霉菌、酵母菌生长基本没有抑制作用。
总之,一次抽滤后由于副干酪乳杆菌抽滤下去的少,留在滤膜上的副干酪乳杆菌较多,阻碍了酵母菌和霉菌的生长;二次抽滤后滤膜上酵母菌和霉菌的生长情况受副干酪乳杆菌抑制作用弱,滤膜微红;三次抽滤后留在滤膜上的副干酪乳杆菌数量基本很少了,抑制霉菌、酵母菌的能力基本没有,滤膜上有霉菌、酵母菌的典型菌落,证明副干酪乳杆菌直投式菌种样品中有霉菌和酵母菌存在。

图3 第三次滤液定性检测结果
2.2 定量检测结果
相同样品除进行定性检测外,同时做定量检测和国标方法检测。用国标法检测的15个国外进口副干酪乳杆菌菌种中霉菌、酵母菌都为0,而用抽滤的方法检测相同的样品,结果见表1。
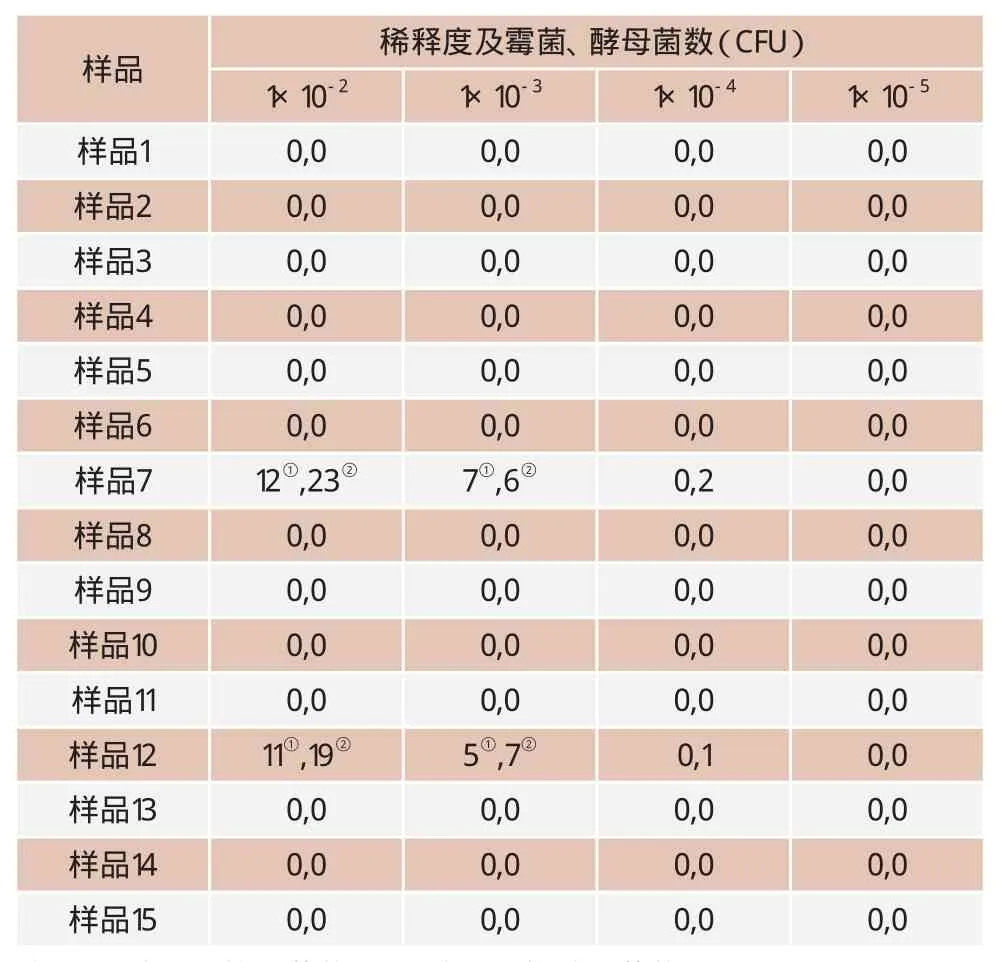
表1 滤液定量检测结果
从表1可以看出,13个样品与用国标法检测的结果相同,即1×10-2、1×10-3、1×10-4、1×10-5稀释度的霉菌和酵母菌落检测结果都为0。 而样品7、样品12与国标法的检测结果不同,由于样品经1μm滤膜抽滤处理后,除去了副干酪乳杆菌对霉菌、酵母菌的抑制作用,排除了检测过程的干扰因素,均检出了霉菌和酵母菌。样品7的检测结果是:稀释度为1×10-2的两个平皿的霉菌和酵母菌落数平均为18个,其中酵母菌落数12个、霉菌菌落数6个;稀释度为1×10-3两个平皿霉菌和酵母菌落数平均为7,不在10~150CFU计数范围以内,因此选1×10-2稀释度中的菌落数来计数,即该样品中霉菌和酵母菌数为1 800CFU/g。样品12的检测结果是:稀释度为1×10-2的两个平皿中霉菌和酵母菌落数平均为15个,其中酵母菌落数9个、霉菌菌落数6个;稀释度为1×10-3两个平皿霉菌和酵母菌落数平均为6,不在10~150CFU计数范围以内,因此选1×10-2稀释度中的菌落数来计数,即该样品中霉菌和酵母菌数为1 500CFU/g。
3 结论
3.1 针对现有技术存在的不足,提供了一种副干酪乳杆菌直投式菌种中霉菌和酵母菌的定量检测方法,主要解决直接用国标法检测会受稀释倍数、抑制作用等因素的干扰而造成的漏检。
3.2 本试验通过过滤分离手段避免了副干酪乳杆菌对检测过程的干扰,成功定量检验到直投式菌种中污染的低丰度的霉菌和酵母。
3.3 本试验的实施可有效地控制国外进口直投式菌种的产品质量,保证乳酸菌发酵产品在生产过程中的稳定性,同时可有利于避免产品保质期发生鼓盖的质量问题。
[1]Tsai,Yueh-Ting,Cheng,Po-Ching,et al.The immunomodulatory effects of lactic acid bacteria for improving immune functions and benefits[J].Applied Microbiology and Biotechnolo gy,2012,96(4):853-862.
[2]乔发东,吴秀芳,南庆贤,等.浓缩乳酸菌发酵剂的现状[J]. 中国乳品工业,1989,17(1):15-16.
[3]杨洁彬,凌代文,郭兴华,等. 乳酸菌—生物学基础及应用[M]. 北京:中国轻工业出版社,1996,139-176.
[4]奚震,刘然,万守朋.直投式乳酸菌发酵剂的制备[J].食品研究与开发,2003,24(6):25-26.
[5]刘衍芬,高学军. DVS乳酸菌菌株传代过程中遗传稳定性分析[J]. 生物技术,2005,48-50.
[6]Atanassovhoiset Y, et al. Isolation and partial biochemical characterization of a proteinaceous antibacteria and anti-yeast compound produced by lactobacillus paracasei ssp paracasei strain M3[J].International Journal of food Microbiology,2003,87(1-2):63-72.
[7]霉菌和酵母计数. 食品微生物学检验[S].GB4789.15--2010.
[8]乳与乳制品国家标准. 食品工业[S]. 北京:中国标准出版社,2000
[9]何国庆,贾英民,丁立孝,等.食品微生物学[M].第2版.北京:中国轻工业出版社,2001.
[10]RE希坎南.伯杰细菌鉴定手册[M].第9版.北京:北京科学出版社,1997.
[11]饮用天然矿泉水检测方法[S].食品安全国家标准,GB8538--2008.
Improvement of Detection Technology for Molds and Yeats in Directed Vat Set of Lactobacillus paracasei
DONG Xue-feng1, YANG Zi-biao1, REN Fa-zheng2, LIU Song-ling2, SONG Wei-zhi3
(1.Yunan Huangshi Lesson Dairy Industry Co., Ltd., Dali 671000; 2. Key Laboratory of Functional Dairy, College of Food Science & Nutritional Engineering, China Agricultural University, Beijing 100083; 3. Agricultural Technology Promotion Center of Dali, Dali 671000)
Dairy products are particularly susceptible to fugal contaminations leading to important economic losses. The commonly used assaying for molds and yeasts in directed vat set of Lactobacillus paracasei was often interferred by the high density of starter strains and by the fact that some strains can inhibit the growth of molds and yeasts during assaying. It was known that the cell of L. paracasei was smaller than both molds and yeasts. In this study, we separated the bigger molds and yeasts cells from the smaller L.paracasei cells by extraction fi ltration and by doing so we managed to detect the low abundant of contamination of molds and yeasts quantitatively and qualitatively. The detecting techonology developed in this study will help avoid the economic losses resulted from contaminations of molds and yeasts during fermentation using Directed Vat Set.
Lactobacillus paracasei; Directed vat set; Mold; Yeast
TS252.1
A
1004-4264(2017)10-0039-04
10.19305/j.cnki.11-3009/s.2017.10.010
2017-06-08
云南省科技计划生物重大专项(奶业专项)(2014ZA001)。
董雪凤(1975-),高级工程师,研究方向为乳制品与乳酸菌的开发应用。
